引言

妊娠对于女性而言是一个重要且具有挑战的过程。在此期间,为支持胚胎/胎儿的生长发育,母体多种组织器官都会发生显著的适应性改变。正常妊娠适应的微小偏差都可能导致严重妊娠相关疾病,包括子痫前期(Preeclampsia, PE)、妊娠期糖尿病(Gestational diabetes mellitus, GDM)、妊娠代谢综合征(Pregnancy metabolic syndrome, PregMS)等。据全球分析估计,每10万名活产婴儿中,约有216名母亲和1800名新生儿死于妊娠相关疾病1,2。因此,研究妊娠期间母体多组织器官的正常适应性改变,是揭示异常妊娠适应导致疾病发生机制、提升妊娠相关疾病诊疗效率、从根源上改善母婴健康水平的重要前提。
随着妊娠进展,母体多种组织器官都会发生适应性改变。成功妊娠需要母体免疫系统精确的适应,以耐受和支持同种-半异体胎盘和胎儿。免疫系统的妊娠适应包括胸腺部分退化、髓质与皮质比例增加3,以及母体循环和母胎界面中不同免疫细胞的动态功能和组成变化4。妊娠也会导致母体心血管系统发生变化,包括心输出量、血容量、心率和每搏输出量的增加5,以及为支持胎儿发育母体心脏长期高负荷引起母体心脏发生重塑,出现类似于通过运动训练获得的生理性心脏肥大,左心室重量显著增加等6。此外,母体骨骼肌祖细胞的激活、分化和再生在妊娠期也明显增强7,8。母体胰腺β细胞质量显著增加9;母体肝脏的体积从妊娠早期到晚期增加了15%10。尽管多种母体组织器官在妊娠期的生理性适应改变已有一些研究,但妊娠期母体多数组织器官在分子层面的具体改变以及组织器官之间的互作如何维持妊娠(妊娠适应)仍不清楚。
代谢是维持组织器官中细胞生长和功能的核心,也是生命系统能量供给的主要来源。代谢组直接与表型相关联,可反映机体的生理或病理状态。妊娠期间的代谢适应维持着母体和胎儿之间的物质交换和营养需求,对人类妊娠母体血液的代谢组研究揭示了妊娠期母体循环中的一些代谢变化11,12。通过比较妊娠相关疾病患者与正常妊娠孕妇的血液代谢组,筛选出多种对妊娠相关疾病(例如:PE和GDM)具有预测潜力的代谢生物标志物13,14。未来如能系统了解妊娠期母体多种组织器官的代谢变化以及组织器官之间的代谢互作,对于深入理解妊娠过程具有重要理论意义,对预防与治疗妊娠相关疾病具有重要应用价值。由于伦理限制,我们不可能使用孕妇的组织器官来进行这项研究。非人灵长类猴在生理、生殖特征和妊娠周期方面与人类高度相似,在严格的伦理规范下,是研究灵长类母体多组织器官妊娠适应的最理想动物模型。
2024年2月1日,中国科学院动物研究所黄仕强团队、王红梅团队、李伟团队和重庆医科大学附属妇女儿童医院漆洪波团队在Cell期刊在线发表了题为“A multi-tissue metabolome atlas of primate pregnancy”的文章。该项研究构建了食蟹猴23种组织器官共273个样本在非妊娠期以及妊娠不同时期的代谢组图谱,揭示了食蟹猴妊娠期多种组织器官代谢网络的动态演变、代谢通路适应和关键的适应性代谢物。
正文

为系统了解灵长类妊娠期间母体多种组织器官的代谢适应,研究团队利用液相色谱-质谱(Liquid chromatography-mass spectrometry, LC-MS)技术分析了非妊娠期(Non-pregnancy, NP)、妊娠早期(Early-pregnancy, EP)、妊娠中期(Mid-pregnancy, MP)和妊娠晚期(Late-pregnancy, LP)食蟹猴23种组织器官共273个样本的非靶向代谢组,发现每种组织器官代谢组在非妊娠期和妊娠不同时期拥有独特的变化模式(图1)。代谢组数据相关性分析显示不同妊娠时期多种组织器官之间代谢组相关性呈现动态演变,且与非妊娠期相比,23种组织器官之间的代谢组相关性随妊娠进展而降低,到妊娠晚期达到高度解耦的状态(图1)。接下来,研究团队利用代谢集富集分析(Metabolite set enrichment analysis, MSEA)鉴定了8个在妊娠期多种组织器官都发生显著改变的核心代谢通路,包括类固醇生成、谷氨酸代谢、酪氨酸代谢、嘌呤代谢、卟啉代谢、胆汁酸生物合成、嘧啶代谢和花生四烯酸代谢。进一步利用差异倍数(Fold change,FC)分析发现与EP相比,每种组织器官在MP和LP时都有超过3000种以上的差异代谢物(FC≥1.5)被检测到,而23种组织器官共享的差异代谢物有91种。以上结果表明妊娠期间灵长类母体经历了巨大的代谢扰乱和挑战,多种组织器官都发生了代谢重编程。

图1. 食蟹猴非妊娠期(NP)、妊娠早期(EP)、妊娠中期(MP)和妊娠晚期(LP)23种组织器官代谢组分析
为探究重要差异代谢物在组织器官的细胞生长或分化中的潜在功能,研究团队利用多种人类细胞对23种组织器官妊娠期共享的关键差异代谢物进行了初步功能验证。鉴于皮质酮对应激状态的重要性以及妊娠期其水平在胎盘里持续上调,研究团队利用人类胎盘滋养层细胞模型探究了皮质酮对胎盘细胞分化和功能的潜在影响。结果发现皮质酮能够诱导人胎盘滋养层干细胞(Human trophoblast stem cells, hTSCs)向绒毛外滋养层细胞(Extravillous trophoblasts, EVTs)分化和促进合体滋养层(Syncytiotrophoblasts, STBs)分泌人绒毛膜促性腺激素(Human chorionic gonadotropin, hCG),表明妊娠期胎盘中持续上调的皮质酮可能对胎盘生长、发育和功能有重要调控作用(图2)。鉴于棕榈酰肉碱在免疫调节中的作用及其在妊娠早中期胰腺、肝脏、心脏和骨骼肌中水平增加,研究团队通过诱导人类胚胎干细胞(Human embryonic stem cells, hESCs)分化获得的胰腺祖细胞(Pancreatic progenitor cells, PPCs)、肝脏祖细胞(Liver progenitor cells, LPCs)、心肌细胞(Cardiomyocytes, CMs)和肌肉细胞(Myocyte cells, MCs)模型探究了棕榈酰肉碱对上述细胞命运决定的作用。结果发现,棕榈酰肉碱促进上述细胞的分化或成熟,表明妊娠期间母体胰腺、肝脏、心脏和腓肠肌中棕榈酰肉碱水平的增加可能在调节组织器官的细胞分化、成熟与再生方面发挥重要功能(图2)。以上发现为深入探究差异代谢物对人类妊娠期间母体重要组织器官的适应性变化及其调控机制提供了重要实验证据。
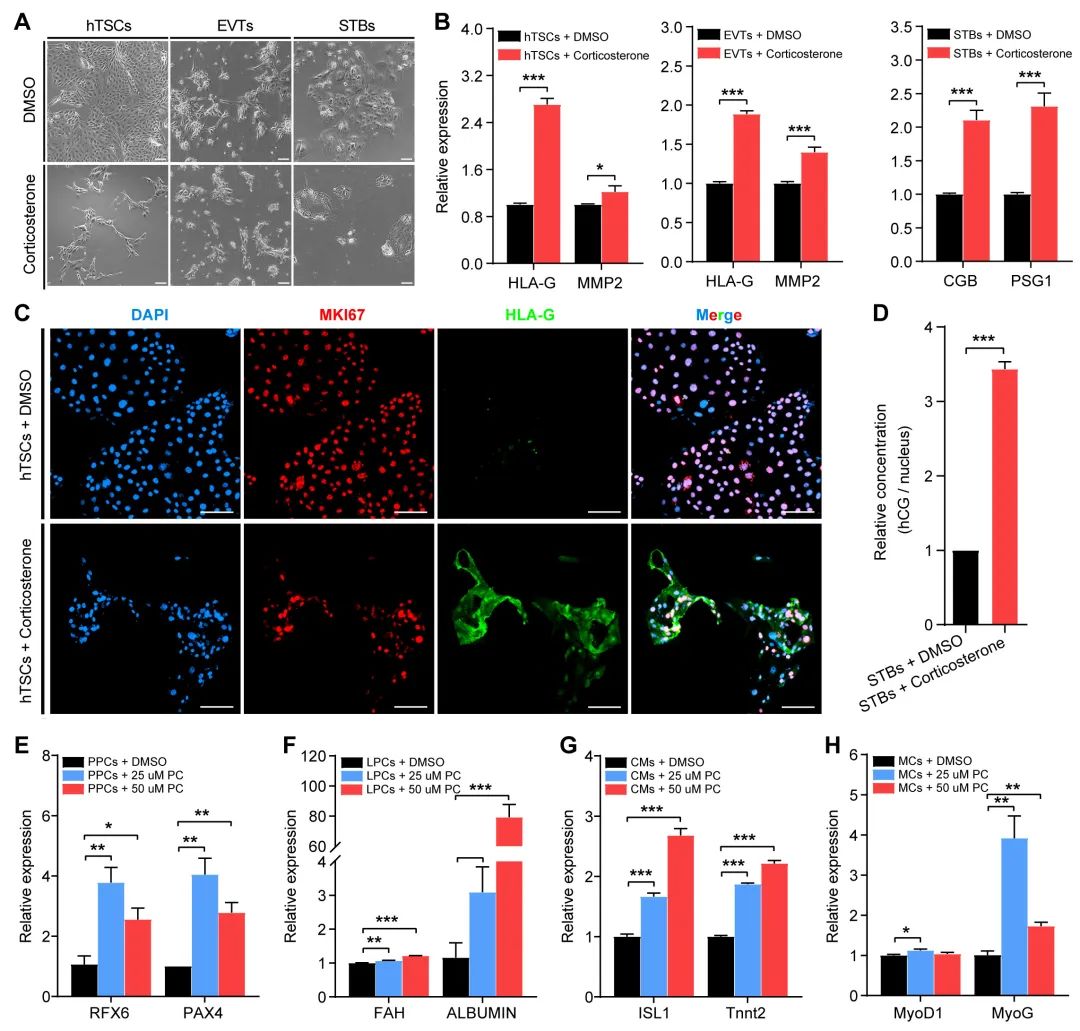
图2. 皮质酮和棕榈酰肉碱对人类细胞功能的影响
为验证食蟹猴代谢组数据对人类的潜在可译性,研究团队将妊娠食蟹猴血液代谢组数据与公开的人类孕妇血液代谢组数据进行了比较,结果发现,妊娠期间人类孕妇血液上调或下调的大多数代谢物在妊娠食蟹猴血液数据里呈现类似的变化趋势。研究团队进一步收集了正常妊娠孕妇和子痫前期患者血液样本,通过LC-MS定量检测了其血清皮质酮水平,发现与正常妊娠孕妇相比,子痫前期患者血清皮质酮水平显著降低。此外,研究团队利用皮质酮抑制剂处理人类胎盘滋养层细胞,发现皮质酮的抑制显著增加了hTSCs、EVTs和STBs中TNF-α和IL-8的表达,表明妊娠期皮质酮缺乏可能引起子痫前期患者胎盘出现滋养层炎症反应。以上发现初步证实了本研究所获得的食蟹猴代谢组数据具有重要临床应用价值。
结语

综上所述,本研究以食蟹猴非妊娠期和妊娠早期、中期、晚期23种组织器官为研究对象,利用代谢组学技术揭示了灵长类妊娠期间多种组织器官的代谢网络动态演变,及共享的关键差异代谢通路和代谢物(图3)。利用人类胎盘滋养层细胞、胰腺祖细胞、肝脏祖细胞、心肌细胞和肌肉细胞验证了关键差异代谢物的潜在重要功能,并在人类正常妊娠孕妇与子痫前期患者血液中初步验证了食蟹猴代谢组数据的潜在临床应用价值(图3),为全面了解灵长类母体如何适应妊娠带来的代谢挑战奠定了重要基础。

图3. 本研究整体思路概括图
中国科学院动物研究所博士后余带男、助理研究员万海峰、重庆医科大学附属第一医院童超研究员、中国科学院动物研究所博士研究生广璐、博士后陈岗、博士研究生苏佳丽为本文共同第一作者。
参考文献
1. Alkema, L., Chou, D., Hogan, D., Zhang, S., Moller, A.B., Gemmill, A., Fat, D.M., Boerma, T., Temmerman, M., Mathers, C., and Say, L. (2016). Global, regional, and national levels and trends in maternal mortality between 1990 and 2015, with scenario-based projections to 2030: a systematic analysis by the UN Maternal Mortality Estimation Inter-Agency Group. Lancet 387, 462-474. 10.1016/s0140-6736(15)00838-7.
2.Hug, L., Alexander, M., You, D., and Alkema, L. (2019). National, regional, and global levels and trends in neonatal mortality between 1990 and 2017, with scenario-based projections to 2030: a systematic analysis. Lancet Glob Health 7, e710-e720. 10.1016/s2214-109x(19)30163-9.
3.Paolino, M., Koglgruber, R., Cronin, S.J.F., Uribesalgo, I., Rauscher, E., Harreiter, J., Schuster, M., Bancher-Todesca, D., Pranjic, B., Novatchkova, M., et al. (2021). RANK links thymic regulatory T cells to fetal loss and gestational diabetes in pregnancy. Nature 589, 442-447. 10.1038/s41586-020-03071-0.
4.True, H., Blanton, M., Sureshchandra, S., and Messaoudi, I. (2022). Monocytes and macrophages in pregnancy: The good, the bad, and the ugly. Immunol Rev 308, 77-92. 10.1111/imr.13080.
5.Liu, L.X., and Arany, Z. (2014). Maternal cardiac metabolism in pregnancy. Cardiovasc Res 101, 545-553. 10.1093/cvr/cvu009.
6.Savu, O., Jurcuţ, R., Giuşcă, S., van Mieghem, T., Gussi, I., Popescu, B.A., Ginghină, C., Rademakers, F., Deprest, J., and Voigt, J.U. (2012). Morphological and functional adaptation of the maternal heart during pregnancy. Circ Cardiovasc Imaging 5, 289-297. 10.1161/circimaging.111.970012.
7.Falick Michaeli, T., Laufer, N., Sagiv, J.Y., Dreazen, A., Granot, Z., Pikarsky, E., Bergman, Y., and Gielchinsky, Y. (2015). The rejuvenating effect of pregnancy on muscle regeneration. Aging Cell 14, 698-700. 10.1111/acel.12286.
8.Lu, A., Guo, P., Pan, H., Tseng, C., Sinha, K.M., Yang, F., Scibetta, A., Cui, Y., Huard, M., Zhong, L., et al. (2021). Enhancement of myogenic potential of muscle progenitor cells and muscle healing during pregnancy. Faseb j 35, e21378. 10.1096/fj.202001914R.
9.Rieck, S., and Kaestner, K.H. (2010). Expansion of beta-cell mass in response to pregnancy. Trends Endocrinol Metab 21, 151-158. 10.1016/j.tem.2009.11.001.
10. A, Q.B., Vesco, K.K., Purnell, J.Q., Francisco, M., Goddard, E., Guan, X., DeBarber, A., Leo, M.C., Baetscher, E., Rooney, W., et al. (2021). Pregnancy and weaning regulate human maternal liver size and function. Proc Natl Acad Sci U S A 118. 10.1073/pnas.2107269118.
11.Wang, Q., Würtz, P., Auro, K., Mäkinen, V.P., Kangas, A.J., Soininen, P., Tiainen, M., Tynkkynen, T., Jokelainen, J., Santalahti, K., et al. (2016). Metabolic profiling of pregnancy: cross-sectional and longitudinal evidence. BMC Med 14, 205. 10.1186/s12916-016-0733-0.
12.Liang, L., Rasmussen, M.H., Piening, B., Shen, X., Chen, S., Röst, H., Snyder, J.K., Tibshirani, R., Skotte, L., Lee, N.C., et al. (2020). Metabolic Dynamics and Prediction of Gestational Age and Time to Delivery in Pregnant Women. Cell 181, 1680-1692.e1615. 10.1016/j.cell.2020.05.002.
13. Alesi, S., Ghelani, D., Rassie, K., and Mousa, A. (2021). Metabolomic Biomarkers in Gestational Diabetes Mellitus: A Review of the Evidence. Int J Mol Sci 22. 10.3390/ijms22115512.
14.Nobakht, M.G.B.F. (2018). Application of metabolomics to preeclampsia diagnosis. Syst Biol Reprod Med 64, 324-339. 10.1080/19396368.2018.1482968.
高颜值免费 SCI 在线绘图(点击图片直达)
往期精品(点击图片直达文字对应教程)





















































 413
413











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








