细胞凋亡是哺乳动物细胞中发现的第一种可被调节的细胞死亡形式,由caspase-3和caspase-7执行。活细胞中caspase-3和caspase-7处于休眠状态,当细胞外细胞因子或细胞内应激信号刺激后,caspase-3和caspase-7由上游caspase-8和caspase-9激活,引发凋亡。当caspase-8被抑制时,相同的细胞死亡诱导因子也可以引发RIPK3介导的坏死性凋亡。炎症性caspases,caspase-1/4/5/11通过切割Gasdermin D诱导细胞焦亡。此外,膜磷脂的多不饱和脂肪酸尾的过氧化紊乱会引发铁死亡,这是一种铁依赖性和caspase非依赖性的细胞死亡方式。
研究报道,癌症中细胞凋亡、坏死性凋亡、铁死亡等细胞死亡途径的失调都可能与表观遗传密切相关[1]。了解这些细胞死亡途径的典型特征有利于明晰后续的研究方向(尤其是研究涉及相关表型特征或者富集分析涉及相关通路),也有利于发掘可能的调控机制,突显价值(与表观遗传相联系,可以参考IF:11.4 | 机制研究没思路?不妨看看这篇m5C+铁死亡![]() http://mp.weixin.qq.com/s?__biz=MzIzMzE1OTYyOQ==&mid=2247494831&idx=1&sn=c347d5ba0a82b6ea19c4e744d7c8fab4&chksm=e88b420ddffccb1b2457f10e88dbadc6498ed1eb8a9b26ac35d568b4bc4f4a6aa6874a1cc239&scene=21#wechat_redirect
http://mp.weixin.qq.com/s?__biz=MzIzMzE1OTYyOQ==&mid=2247494831&idx=1&sn=c347d5ba0a82b6ea19c4e744d7c8fab4&chksm=e88b420ddffccb1b2457f10e88dbadc6498ed1eb8a9b26ac35d568b4bc4f4a6aa6874a1cc239&scene=21#wechat_redirect

2024年1月,北京生命科学研究所王晓东院士团队在Molecular Cell上发表了题为“The biochemical pathways of apoptotic, necroptotic, pyroptotic, and ferroptotic cell death”的综述文章,详细介绍了可被调节的细胞死亡方式(细胞凋亡、坏死性凋亡、细胞焦亡以及铁死亡)如何在特定细胞类型中单独或相互串扰发挥重要的生理和病理功能。
一、细胞凋亡
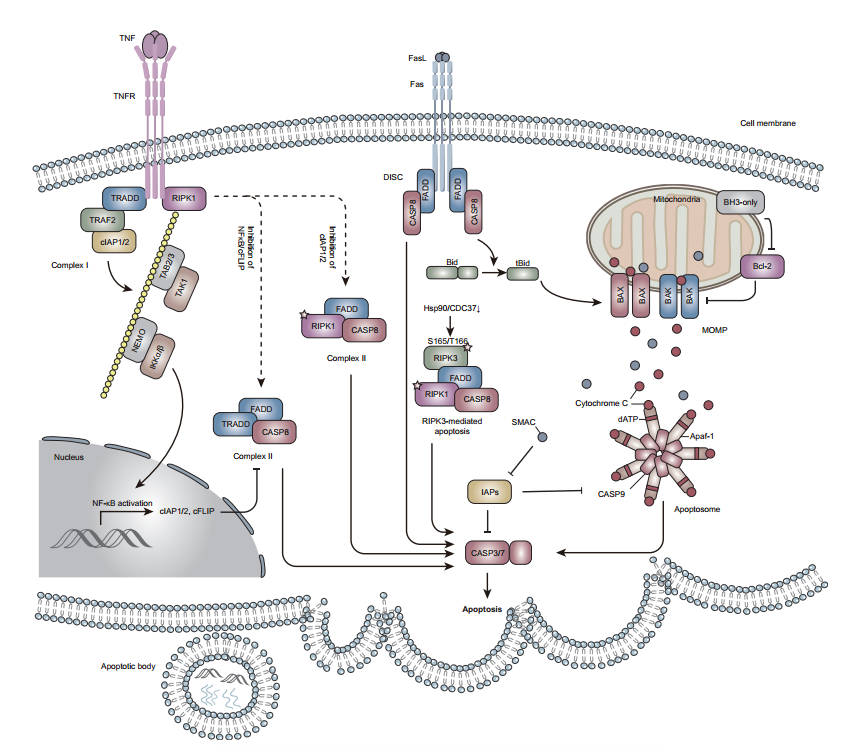
细胞凋亡是一种程序性细胞死亡方式,由细胞内caspase-3和caspase-7执行。它们切割不同的细胞内底物,导致细胞收缩、染色质碎裂、膜起泡并分解成膜包裹的囊泡(凋亡小体)。例如,caspase-3和caspase-7切割DNA片段化因子(DFF或ICAD),触发DFF40的释放和激活,将染色质DNA切割成核小体片段。Caspase-3通过切割凝溶胶蛋白和ROCKI蛋白引起细胞骨架重组和凋亡泡形成。它还通过切割XKR8促进磷脂酰丝氨酸(PS)暴露,并通过切割ATP11A、ATP11C和CDC50a使得磷脂翻转酶复合因子失活。因此,含有细胞内容物和片段化DNA的垂死细胞的凋亡小体会将PS暴露于外叶,并允许巨噬细胞和邻近细胞对其进行非炎症性吞噬识别。
Caspase-8,响应细胞外细胞死亡诱导因子。Caspase-9,响应线粒体外膜透化(MOMP)。Caspase-3和caspase-7由caspase-8或caspase-9激活(Figure 1)。当细胞外凋亡信号(如TNF-α)与对应的细胞膜受体结合,会在质膜的胞质侧形成多组分蛋白质复合物,如complex I。Complex I通常激活NF-kB信号通路,介导各种细胞因子和抗凋亡基因的转录,包括cIAP和cFLIP。而当CHX存在时,抗凋亡蛋白(如cFLIP)的翻译受到抑制,进一步缓解cFLIP介导的对caspase-8激活的抑制。随后,complex I组分从质膜上解离并招募FADD和caspase-8形成complex II,触发细胞凋亡(Figure 1)。
除CHX外,Smac/Diablo也会导致complex I向complex II转变。Smac是一种核编码的线粒体蛋白,当从线粒体释放到细胞质时,Smac可以与cIAP-1、cIAP-2和XIAP相互作用,从而解除它们对caspases的抑制。此外,Smac也会引发cIAP自动降解,导致RIPK1从complex I中释放并与细胞质中的FADD和caspase-8相互作用,形成complex II,触发细胞凋亡。
Caspase-9介导的细胞凋亡响应各种微环境干扰,包括DNA损伤、内质网(ER)应激、活性氧(ROS)积累和生长因子戒断。这些变化会导致线粒体外膜(MOM)的完整性遭到破坏,某些线粒体蛋白(如细胞色素c和Smac)泄漏。而细胞色素c可以结合Apaf-1,随后Apaf-1招募procaspase-9到凋亡小体,吸引 caspase-9接近并激活。
BCL-2家族蛋白参与caspase-9介导的细胞凋亡。根据在细胞凋亡中功能的差异,BCL-2家族蛋白可分为三类。第一类包括引起MOMP的BAX和BAK。第二类包括各种抗凋亡因子,如BCL-2、BCL-XL、BCL-W和MCL-1,它们直接结合BAX和BAK。第三类包括各种促凋亡因子,如BIM、BID、BAD、PUMA和NOXA。
Caspase-8介导的细胞凋亡也能触发MOM的激活,通过 caspase-8切割BID可以触发线粒体凋亡。此外,构象变化导致RIPK3能够招募RIPK1、FADD和caspase-8,从而形成胞质caspase-8激活复合物,启动细胞凋亡。当caspase-8活性被抑制或者量不足时,RIPK1也可以招募RIPK3,启动坏死性凋亡。
二、坏死性凋亡
坏死性凋亡是另一种可被调节的细胞死亡形式,通常表现为细胞膜破裂,RIPK3是坏死性凋亡的关键调节因子。在细胞死亡诱导因子作用下,RIPK1与RIPK3相互作用,介导RIPK3的磷酸化和激活(Figure 2),并随后磷酸化MLKL。紧接着,磷酸化的MLKL经历寡聚化和易位,最终以某种未知机制导致膜破裂。
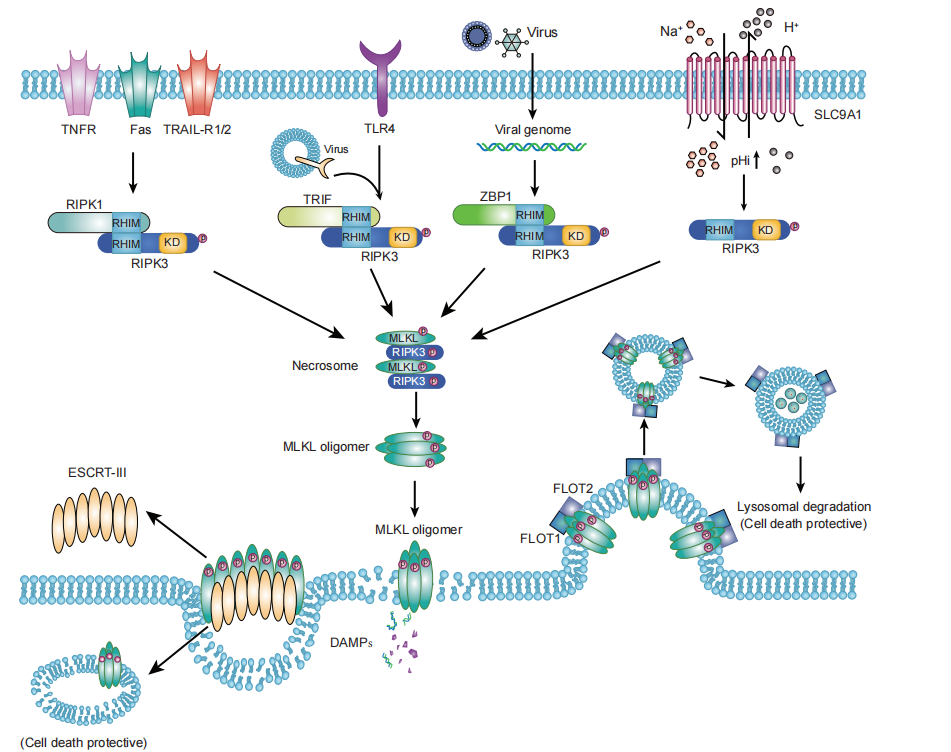
RHIM是关键的坏死性凋亡蛋白结构域。RIPK1、TRIF (TICAM1)和ZBP1 (DAI或DLM-1)蛋白均含有RHIM结构域,可以与RIPK3相互作用,激活坏死性凋亡。例如,病毒或细菌核苷酸、脂蛋白、脂多糖或肽聚糖结合PRR(如TLR),激活RIPK3-TRIF介导的坏死性凋亡。MCMV感染期间,RIPK3-ZBP1介导独立于RIPK1的坏死性凋亡。除了坏死性凋亡外,细胞还存在另一种受caspase调节的死亡形式,称作细胞焦亡。
三、细胞焦亡
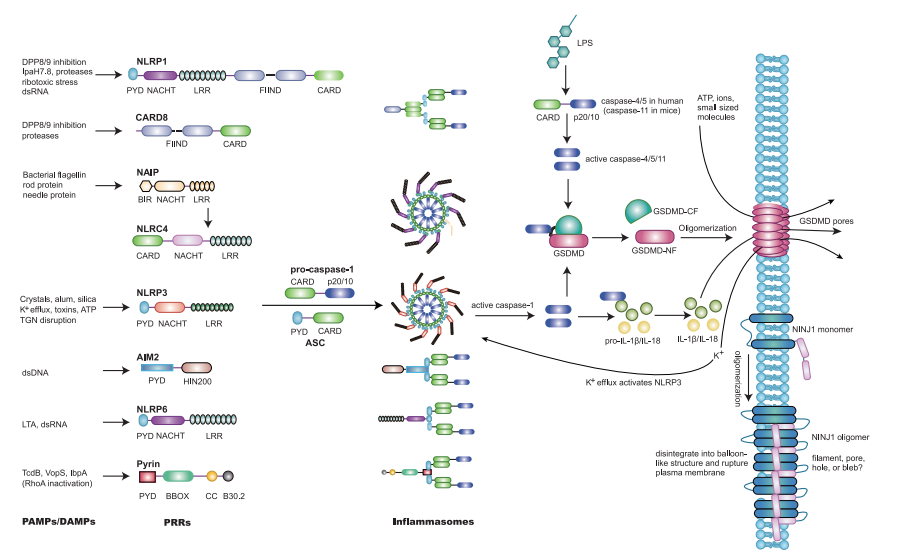
细胞焦亡是由caspase-1/4/5/11介导的细胞死亡形式,表现为细胞膜破裂,细胞内容物释放进而引发强烈的炎症反应。细胞焦亡最早描述于感染鼠伤寒沙门氏菌的巨噬细胞,在激活caspase-1后,炎症细胞因子(IL-1β和IL-18)被释放并介导细胞死亡。细胞焦亡由PAMP或DAMP所诱导,这些PAMP和DAMP可以被PRR识别并产生炎症小体(Figure 3)。目前已知的PRR有7种,包括NLRP1、CARD8、NLRP3、NLRC4/NAIP、AIM2、Pyrin和NLRP6。其中,NLRP1和CARD8含有CARD结构域,通过CARD-CARD相互作用招募 caspase-1。而含有PYD结构域的NLRP3、AIM2、NLRP6和Pyrin,通过招募含有CARD和PYD的接头蛋白ASC,随后再利用CARD-CARD相互作用招募caspase-1。
除了PRR—caspase-1轴介导的细胞焦亡外,人中caspase-4/5以及小鼠中caspase-11可以直接结合细胞内LPS,形成“非典型炎症小体”,激活细胞焦亡。
激活的caspase-1/4/5/11会切割GSDMD,GSDMD属于GSDM蛋白家族,成员还包括GSDMA、GSDMB、GSDMC、GSDME(DFNA5)和DFNB59(pejvakin)。许多GSDM家族蛋白(DFNB59除外)含有GSDM-NF和GSDM-CF。正常情况下,GSDM-NF的成孔活性被抑制。在诱导细胞焦亡后,caspase-1/4/5/11破坏了GSDMD-NF和GSDMD-CF之间的结构,将抑制解除。同时,受切割的GSDMD易位到质膜内叶,结合酸性磷脂(磷脂酰肌醇、磷脂酸和PS)或心磷脂。GSDMD产生的孔会造成质膜破损,并快速释放细胞内DAMP以及促炎细胞因子IL-1β和IL-18。所以,caspase-1/4/5/11对GSDMD(以及其他类似的GSDM蛋白)结构域的切割会导致伴随炎症反应的细胞死亡。
此外,存在TAK1抑制剂(YopJ)时,假结核耶尔森菌可以激活caspase-8直接切割GSDMD。而在细胞凋亡过程中,GSDME会被caspase-3切割。当GSDME表达水平较低时,caspase-3切割GSDME,引起继发性坏死。而当GSDME的表达水平较高时,caspase-3切割GSDME,在细胞凋亡开始前引起强烈的焦亡。此外,来自细胞毒性淋巴细胞的颗粒酶B也能切割GSDME,以caspase非依赖性方式激活细胞焦亡。类似地,来自自然杀伤细胞和细胞毒性T淋巴细胞的颗粒酶A 可以切割GSDMB,导致细胞焦亡。
四、铁死亡
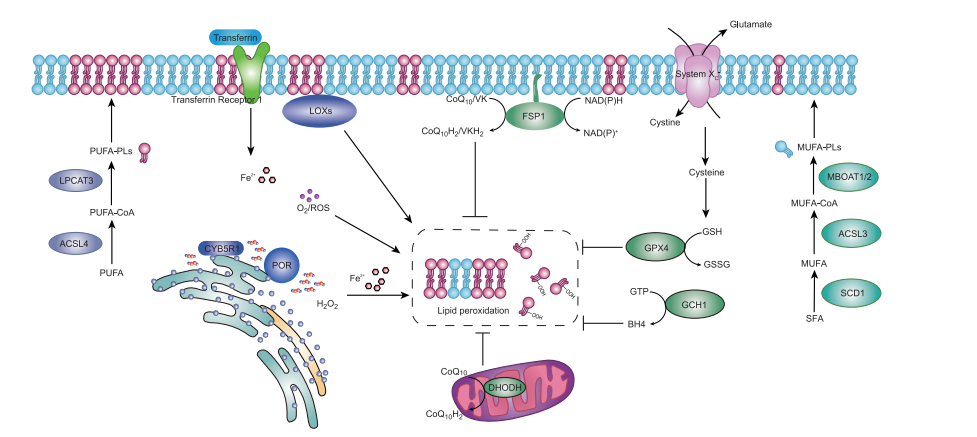
铁死亡是一种氧化和铁依赖性的调节性细胞死亡形式,由细胞膜磷脂的多不饱和脂肪酸(PUFA)尾的脂质过氧化引起 (Figure 4)。铁死亡受代谢调节,与氨基酸和铁的吸收、储存、利用、外排以及磷脂合成有关。
含有PUFA的脂质是脂质过氧化的底物,其水平决定了细胞对铁死亡的敏感性。含有PUFA的脂质生物合成的关键酶,如ACSL4和LPCAT3,是铁死亡所必需的。而介导含有单不饱和脂肪酸(MUFA)的脂质生物合成的酶,如SCD1、ACSL3和MBOAT1/2会与含有PUFA 的脂质竞争膜的组成,从而降低细胞对铁死亡的敏感性。铁死亡中第一个鉴定到的抗氧化机制是system xc--谷胱甘肽-GPX4轴。System xc-包含两个蛋白质亚基,SLC7A11和SLC3A2,是将胱氨酸转运进细胞并释放谷氨酸所必需的。胱氨酸被还原为半胱氨酸,用于后续谷胱甘肽的合成。GPX4利用谷胱甘肽催化磷脂氢过氧化物的还原,从而防止膜脂质过氧化。此外,CoQ10-FSP1/DHODH轴与GPX4并行作用,防止脂质过氧化。机制上,FSP1和DHODH催化泛醌还原为泛醇。FSP1还催化维生素K还原为VKH2。泛醇和VKH2作为天然亲脂性抗氧化剂,可以清除磷脂过氧化物,防止铁死亡。此外,参与BH4合成的酶,包括GCH1、PTS和SPR,也有助于抵抗铁死亡(Figure 4)。
脂氧合酶(LOX)、线粒体电子传递链(ETC)和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶,都可以产生导致脂质过氧化的ROS。ER驻留酶,POR和CYB5R1,也是脂质过氧化和铁死亡所必需的。这些酶利用电子转移能力,将电子传递到游离氧中,形成过氧化氢。随后被亚铁氧化产生羟基自由基,从而引发脂质过氧化。
ER既是负责掺入PUFA的主要细胞器,又是POR/CYB5R1的定位位点,因此可能是脂质过氧化的初始位点。线粒体是脂质过氧化物的来源之一,并在半胱氨酸剥夺-诱导的铁死亡过程中放大脂质过氧化,但对于GPX4抑制-诱导的铁死亡则可有可无。与在特定的生理刺激下引发的细胞凋亡、坏死性凋亡和焦亡不同,铁死亡是细胞抗氧化系统崩溃的结果。铁死亡可能在促进不同器官的退行性疾病方面发挥重要作用,并伴有氧化损伤,而在肿瘤发生和癌症进展中受到抑制。
五、细胞死亡途径之间的串扰
由于分子功能的多效性,激活细胞死亡途径的信号分子通常是相互关联的。例如,RIPK1既可以以激酶依赖性方式激活细胞凋亡和坏死性凋亡,也可以作为接头蛋白参与由RIPK3构象变化介导的细胞凋亡。线粒体中细胞色素c的释放激活细胞凋亡。此外,也会导致线粒体ETC分解产生ROS,从而引发铁死亡。常见的化疗药物可诱导caspase-9介导的细胞凋亡并激活GSDME,引发焦亡。TNF-α和IFNγ或PAMP的组合可以同时激活焦亡、细胞凋亡和坏死性凋亡。此外,IFNγ通过降低SCL7A11和SLC3A2的表达促进铁死亡。
参考文献
1.R Damiescu, T Efferth, M Dawood. Dysregulation of different modes of programmed cell death by epigenetic modifications and their role in cancer[J]. Cancer Letters, 2024
2.Youwei Ai, Yutong Meng, Bo Yan, et al. The biochemical pathways of apoptotic, necroptotic, pyroptotic, and ferroptotic cell death[J]. Molecular Cell, 2024





















 3394
3394

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








