
引言
RNA修饰,包括N6-甲基腺苷(m6A)、N1-甲基腺苷(m1A)、5-甲基胞嘧啶(m5C)、N4-乙酰胞嘧啶(ac4C)、N7-甲基鸟苷(m7G)等,是重要的转录后水平基因表达调控方式(Box 1)。

目前,在各类RNA分子上共鉴定到170多种不同类型的转录后修饰,涵盖mRNA、tRNA、rRNA、miRNA和lncRNA等。这些RNA修饰通过影响RNA剪接、加工、出核、转录、翻译和稳定性等,决定RNA分子命运。此外,RNA修饰也与多种疾病的发生和发展密切相关,是国自然长盛不衰的热点。作为最早研究表观转录组学的公司之一,康测科技提供全面的RNA修饰研究工具,包括m6A修饰(m6A meRIP-seq)、m5C修饰(m5C meRIP-seq/bsRNA-seq)、m7G修饰(m7G meRIP-seq)、ac4C修饰(ac4C acRIP-seq/ac4C-seq/RedaC:T-seq)等。
2024年1月,中山大学附属第一医院林水宾和匡铭教授在Nature Reviews Gastroenterology & Hepatology上发表了题为“RNA modification-mediated mRNA translation regulation in liver cancer: mechanisms and clinical perspectives”的综述文章,详细介绍了各类RNA修饰在调节mRNA翻译中的重要作用,总结了肝癌中异常RNA修饰介导的mRNA翻译调节对肿瘤发生、转移、代谢、免疫微环境、耐药性的影响,揭示了靶向RNA修饰和mRNA翻译策略在肝癌诊断和治疗中的巨大潜力!
研究结果
一、RNA修饰在mRNA翻译调控中的作用
mRNA翻译是通过解码mRNA中的遗传信息来合成蛋白质的过程。mRNA、tRNA和rRNA是翻译过程关键的RNA成分,它们会经历动态修饰并在调控RNA功能和mRNA翻译效率方面发挥重要作用。mRNA上各类修饰可以促进阅读蛋白和翻译因子的结合,从而调节mRNA的加工和翻译。tRNA上T和D环内的修饰与tRNA折叠和稳定性相关,而反密码子环内的修饰则影响密码子识别、解码效率和准确性。rRNA上的修饰通常发生在核糖体功能中心,包括肽基转移酶中心和解码位点,并通过调节核糖体生物发生、结构或活性影响mRNA翻译。此外,circRNA和miRNA上也会发生各种修饰并调控mRNA的翻译效率。
1)mRNA修饰介导的mRNA翻译调控
mRNA上动态、可逆的修饰在mRNA加工和翻译中发挥重要作用(Fig. 1a; Table 1)。m6A是mRNA上最丰富的化学修饰。甲基转移酶(writer)METTL3与辅因子METTL14、WTAP等形成稳定的蛋白质复合体,催化“RRACH”(R:鸟嘌呤或腺嘌呤,H:腺嘌呤或尿嘧啶或胞嘧啶)上的m6A修饰。去甲基化酶(eraser)FTO和ALKBH5,负责去除mRNA上的m6A修饰。m6A修饰主要位于stop codon附近,但也有一些mRNA在5'UTR和CDS区存在m6A修饰。m6A修饰的位点特异性由多种因素调控,包括motif序列、相邻RNA序列、酶及辅因子。YTHDF1–3、YTHDC1–2、IGFBP1–3和eIF3是已知的阅读蛋白(reader),它们具有不同的结合特异性,通过识别m6A行使不同的功能,从而决定RNA分子命运。stop codon附近的m6A修饰可以通过YTHDF1-eIF3和METTL3-eIF3h相互作用介导的mRNA环促进核糖体循环,从而提高翻译效率。细胞应激时,5′UTR上m6A修饰增加,招募eIF3促进帽非依赖性翻译。此外,在缺乏足够的eIF4F复合物情况下,METTL3介导的m6A修饰通过ABCF1招募翻译因子实现eIF4F非依赖性翻译。CDS区的m6A修饰相对较低,被认为可以阻断tRNA调节和翻译延伸。另一项研究揭示CDS区的m6A修饰可以通过YTHDC2解析mRNA二级结构,在翻译中发挥积极作用。
m1A修饰在start codon附近富集,可以通过改变二级或三级结构或介导reader识别翻译起始位点来促进翻译起始。而人线粒体mRNA CDS区的m1A修饰可以通过诱导核糖体停滞来抑制翻译。
NSUN2介导的m5C修饰,若发生在mRNA 3′UTR则可以与m6A修饰协调作用以促进mRNA翻译。若发生在mRNA 5′UTR或CDS区则会抑制mRNA翻译。另外,m5C可以被Tet家族蛋白氧化为hm5C,而mRNA上hm5C修饰与翻译激活相关。
ac4C是另一种具有位置特异性的RNA修饰。CDS区的ac4C修饰通过调节mRNA-tRNA相互作用促进翻译,而5′UTR中的ac4C修饰阻碍翻译起始。此外,其他类型的RNA修饰,包括内部m7G、假尿苷(ψ)、N1-甲基假尿苷(m1ψ)也被报道在调节mRNA翻译方面具有重要作用。总而言之,与DNA和组蛋白类似,mRNA也经历多种修饰,这对mRNA加工和翻译至关重要。通过mRNA修饰可以调控基因表达。


2)tRNA修饰对tRNA稳定性、功能和mRNA翻译的调节
tRNA是翻译重要的调节分子,介导密码子的识别和氨基酸的递送。tRNA上的修饰调节tRNA成熟、tRNA稳定性和密码子识别,在mRNA翻译中发挥重要作用 (Fig. 1b)。tRNA修饰的功能与发生位置紧密相关。tRNA反密码子环内的修饰可以微调解码过程,调控翻译稳态。摆动位置U34上的修饰扩展了解码能力,增加了碱基配对的灵活性和翻译复杂性。而37位上的修饰,包括1-甲基鸟苷(m1G)、苏氨酰氨基甲酰腺苷(t6A)等修饰,可以通过防止翻译过程中的移码和错放来提高翻译保真度和效率。此外,位于可变环46位上的m7G修饰以密码子依赖方式维持tRNA稳定性和mRNA翻译效率。T环58位上的m1A修饰在翻译起始和延伸过程促进蛋白质合成。茎区的其他修饰在调节tRNA成熟和稳定性方面也具有重要作用,并随后影响mRNA翻译。

3)rRNA修饰及在mRNA翻译中的作用
作为翻译机器核糖体的关键RNA组分,rRNA也被广泛修饰(Fig. 1c)。rRNA修饰由小核仁RNA引导酶或传统的蛋白酶引入。它们并非随机分布,而是倾向于聚集在核糖体功能中心周围,包括解码位点和肽基序,因而在核糖体组装和功能调节中具有重要功能。rRNA上最丰富的两类修饰是2’-O-甲基化修饰(Nm)和假尿苷修饰(ψ),分别由box C/D和box H/ACA小核仁核糖核蛋白引入。rRNA上2’-O-甲基化修饰通过影响核糖体功能、保真度以及调节核糖体动力学来增强mRNA翻译。而rRNA上假尿苷修饰介导核糖体组装和核糖体配体的结合,从而提高翻译保真度和效率。
翻译蛋白酶催化的rRNA修饰在调节核糖体动力学和mRNA翻译方面也发挥重要作用。METTL5–TRMT112和ZCCHC4分别催化18S rRNA和28S rRNA 上m6A修饰。rRNA上m6A修饰可以促进核糖体在5′末端寡核苷酸嘧啶RNA基序(5′TOP motif)上的结合和加工,从而选择性地促进含有5′TOP motif的mRNA的翻译。此外,NSUN家族酶催化的m5C修饰和WBSCR22催化的m7G修饰对于核糖体的高效组装和mRNA翻译至关重要。总而言之,rRNA上的各类修饰调节核糖体动力学并促进mRNA翻译的保真度和效率。

二、肝癌中RNA修饰介导的mRNA翻译调控
肝癌是一种高度恶性和致命的疾病,致癌转录本的翻译过度活跃以促进癌症进展。研究表明,各类RNA修饰和编辑在调节肝癌致病方面发挥关键作用。
1、促进肝癌肿瘤发生
A)mRNA上的修饰
m6A甲基转移酶METTL3在人HCC中显著上调,并通过诱导肿瘤抑制因子SOCS2 mRNA的降解,促进HCC的发展。有趣的是,METTL14作为一种肿瘤抑制因子,通过调节DGCR8和MACF1来抑制人肝癌的发生。METTL3和METTL14之间的差异作用仍在争论中,反映了m6A修饰在不同情况下的功能复杂性。此外,METTL16可以通过m6A依赖性和非依赖性方式促进人HCC的肿瘤发生。m6A甲基转移酶复合体的其他组分,包括WTAP、KIAA1429和RBM15以及m5C甲基转移酶NSUN7,也可以通过调节各种下游靶标在体外和体内加速人HCC的肿瘤发生(Table 2)。
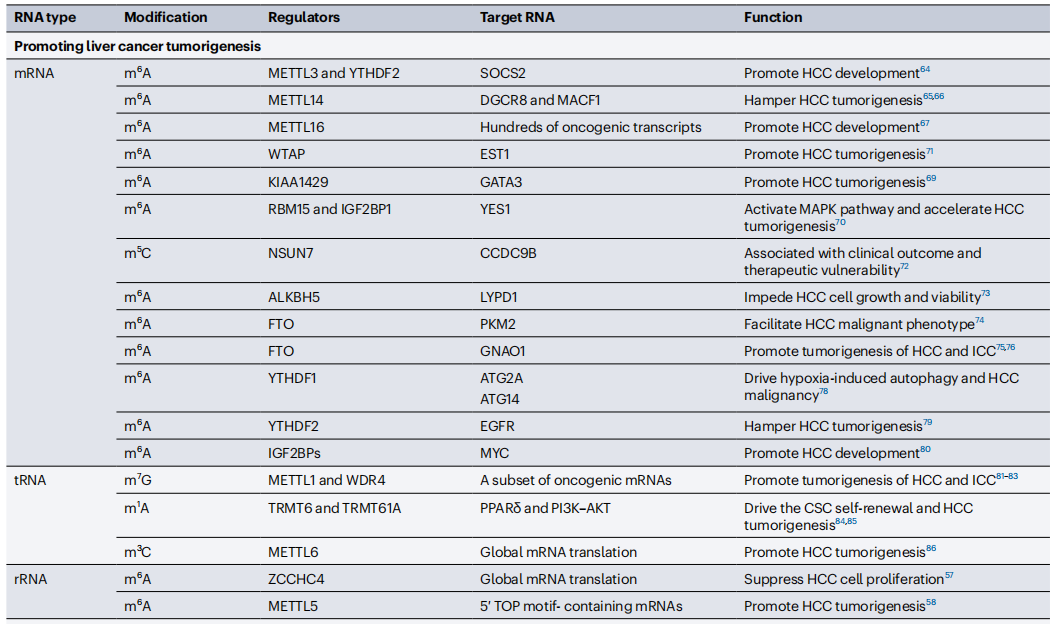
m6A eraser ALKBH5和FTO在肝癌的肿瘤发生中扮演重要“角色”。ALKBH5作为一种肿瘤抑制因子,介导LYPD1 mRNA的m6A去甲基化以促进其降解,从而抑制人HCC的肿瘤发生。令人惊讶的是,肝癌中FTO同时具有致癌和肿瘤抑制功能。一方面,FTO诱导PKM2 mRNA的m6A去甲基化,提高其翻译效率并促进体外HCC恶性表型。另一方面,FTO的缺失通过影响肿瘤抑制基因(包括 GNAO1)的稳定性,促进体外和体内HCC和ICC的肿瘤发生。肝癌中FTO的功能差异可能是由于不同的HCC细胞系或组织中不同的m6A靶标所导致。
大多数m6A reader在HCC中异常表达并与HCC的肿瘤发生相关。例如,HIF1α诱导的YTHDF1促进ATG2A和ATG14的翻译,从而在体外和体内驱动缺氧诱导的自噬和HCC恶性表型。另一方面,YTHDF2在缺氧的人肝癌细胞中表达下调,并通过破坏EGFR mRNA的稳定性发挥肿瘤抑制因子的功能。IGF2BP通过调节MYC mRNA的稳定性和翻译,促进体外HCC进展。
B)tRNA上的修饰
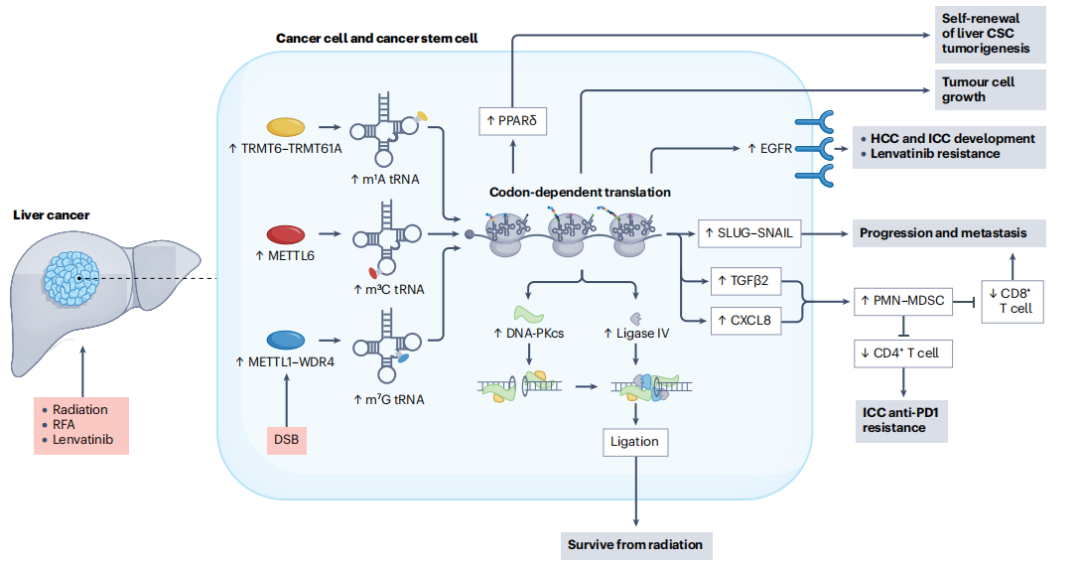
tRNA修饰失调会导致mRNA翻译异常,促进HCC的肿瘤发生。m7G修饰是tRNA上常见的修饰之一,m7G甲基转移酶复合体组分METTL1和WDR4在HCC和ICC中表达上调,并与患者预后不良有关。敲除METTL1或WDR4显著抑制肝癌的肿瘤发生。从机制上讲,m7G修饰的tRNA中密码子的解码频率高。m7G修饰使tRNA稳定并选择性促进致癌mRNA的翻译。TRMT6-TRMT61A介导的tRNA m1A修饰促进PPAR通路相关mRNA(包括PPARD)的翻译,最终驱动肝癌干细胞(CSCs)的自我更新和HCC的肿瘤发生。此外,tRNA m3C甲基转移酶METTL6通过调节mRNA的翻译促进人和小鼠中HCC的肿瘤发生。
C)rRNA上的修饰
28S和18S rRNA m6A甲基转移酶ZCCHC4和METTL5–TRMT112在HCC中显著上调,与HCC预后不良相关。人肝癌细胞系中ZCCHC4的敲除扰乱了mRNA的整体翻译,抑制了体外和体内HCC细胞的增殖。METTL5介导的18S rRNA上m6A修饰促进体外和体内HCC的肿瘤发生。从机制上讲,18S rRNA上m6A修饰促进80S核糖体组装,并选择性增强含有5′ TOP motif的致癌mRNA的翻译,从而促进HCC的肿瘤发生。SNORA23抑制28S rRNA上2’-O-甲基化修饰和核糖体生物发生,从而抑制体外和体内HCC的肿瘤发生。

2、促进肝癌侵袭和转移
异常的RNA修饰调节关键上皮-间质转化(EMT)因子的表达,从而促进肝癌的侵袭和转移。例如,METTL3介导的m6A修饰通过调节关键EMT因子SNAIL和CTNNB1的表达,在体外和体内增强HCC的侵袭和转移。不完全消融,暴露于亚致死的热应激时,METTL3刺激 CD47的表达和EMT的形成,促进人肝癌细胞的迁移。METTL1-WDR4介导的tRNA上m7G修饰提高了SNAIL-SLUG的翻译效率,介导HCC的复发和人肝癌细胞的转移。
此外,其他肿瘤转移相关的RNA分子也会受到动态RNA修饰的影响。KIAA1429介导的m6A修饰破坏肿瘤抑制因子GATA3 pre-mRNA的稳定性,增强裸鼠中人肝癌细胞的转移。METTL14作为一种肿瘤抑制因子,通过调节miR126的加工来抑制小鼠模型中人肝癌细胞的转移。YTHDF1和YTHDF2可以通过激活PI3K-AKT-mTOR信号传导和OCT4 mRNA翻译来诱导EMT和人肝癌细胞的转移。FTO和ALKBH5可以通过各种靶标(包括circRNA和lncRNA)调节HCC的复发和人肝癌细胞的转移。

3、重编程肝癌代谢
动态RNA修饰调节关键代谢基因的表达,并有助于HCC的代谢重排。METTL3通过调节糖酵解相关基因(包括 PDK4、mTORC1 和 NFAT5),促进体外肝癌细胞的糖酵解和糖酵解应激敏感性。METTL14介导的USP48上m6A修饰通过调节SIRT6泛素化和糖酵解,抑制体外和体内HCC的进展。ALKBH5表达抑制导致连接酶E3组分N-识别素7 mRNA降解,通过KEAP1-NRF2-BACH1-HK2轴促进糖酵解和HCC的肿瘤发生。YTHDF3通过促进磷酸果糖激酶PFKL的表达,调节体外HCC中的有氧糖酵解。



除糖酵解外,脂质代谢也受到RNA修饰和mRNA翻译的异常调控。例如,METTL3和m6A修饰上调脂肪生成相关因子SCD1、ACLY和LNC00958的表达,促进脂肪积累和HCC发展。FTO通过对FABP2和FABP5 mRNA上m6Am修饰去甲基化,调控肥胖相关mRNA的翻译。METTL5–TRMT112介导的18S rRNA上m6A修饰增强ACSL4的核糖体组装和mRNA翻译,促进脂肪酸代谢和HCC进展。TRMT6-TRMT61A介导tRNA上m1A修饰,增强PPARδ mRNA翻译,触发胆固醇合成并促进CSC自我更新 (Fig. 2)。
4、塑造肝癌肿瘤免疫微环境
HCC中肿瘤免疫微环境(TIME)受到TIME相关因子上RNA修饰的动态调节。例如,HBV病毒通过诱导宿主PTEN mRNA上m6A修饰引发免疫逃逸和HCC肿瘤发生。ALKBH5去除PDL1 mRNA 3′UTR上m6A修饰,维持PDL1的表达,促进了T细胞扩增和细胞毒性。此外,ALKBH5以m6A依赖性方式调节MAP3K8—IL-8轴以招募PDL1+ 肿瘤相关巨噬细胞,促进体外和体内HCC进展。YTHDF2介导含有m6A修饰的Il11和Serpine mRNA的降解,导致正常血管结构被破坏和炎症介导的HCC恶性表型。IGF2BP1的敲低激活了免疫细胞浸润并降低了TIME中PDL1的表达,最终抑制异种移植小鼠模型中HCC的进展。
tRNA m7G甲基转移酶METTL1水平的升高与晚期ICC中PMN-MDSC的富集显著相关。功能上,METTL1介导的tRNA m7G修饰促进Cxcl8 mRNA的翻译,加快ICC进展并促进体内TIME中PMN-MDSC的积累。消融不足,暴露于热应激时,METTL1上调tRNA m7G 修饰,增强Tgfb2 mRNA的翻译,导致TIME中PMN-MDSC的积累增加和CD8+ T细胞浸润减少。此外,其他类型RNA修饰,如m5C、m1A和ψ,也与HCC中TIME的建立显著相关。

5、调节肝癌治疗抗性
异常RNA修饰介导的mRNA翻译调控与肝癌治疗抗性密切相关。RFA是早期HCC患者推荐的局部治疗方法,通过高温杀死HCC细胞来诱导不可逆的凝固性坏死。RNA修饰可以动态快速地响应热应激,快速促进应激响应基因的翻译,提高细胞存活。亚致死热处理下,METTL3–YTHDF1增强EGFR mRNA上m6A修饰和翻译,促进体外和体内HCC的复发和转移。YTHDF1沉默和EGFR抑制联合作用协同抑制HCC恶性表型。亚致死热应激下,METTL1-WDR4介导的tRNA m7G修饰通过增强SLUG-SNAIL翻译,促进HCC转移和复发。另外,iRFA处理后,METTL1可以通过诱导PMN-MDSCs促进TGFB2的翻译,形成免疫抑制环境,从而增强HCC的存活和转移。
放疗是不可切除的肝癌患者采取的局部治疗方法,通过高能电离辐射消除肿瘤细胞。放疗过程中,动态调节的RNA修饰能够诱导治疗抗性。辐射诱导ALKBH5蛋白表达,催化Tirap mRNA上m6A去甲基化,随后激活下游通路,促进放疗抗性。放疗后METTL1蛋白水平显著上调,并与患者不良预后相关。从机制上讲,METTL1激活DNA依赖性蛋白激酶催化亚基和DNA连接酶IV mRNA的翻译,促进双链断裂的修复,诱导放疗抗性。

6、调节肝癌的耐药性
药物靶向治疗是晚期HCC患者的治疗方法之一。研究表明,m6A修饰在肝癌的耐药性中发挥重要作用。例如,METTL3在索拉非尼耐药的HCC患者中表达显著下调。METTL3耗竭的人肝癌细胞通过 YTHDF1依赖性方式调节FOXO3的稳定性以增强索拉非尼耐药。METTL14介导的m6A修饰导致HNF3γ减少,引发人肝癌细胞去分化和索拉非尼耐药。此外,m6A修饰的circRNA-SORE隔离 miR-103a-2-5p和miR-660-3p,竞争性激活WNT-β-catenin通路并诱导索拉非尼耐药。
METTL3在仑伐替尼耐药的HCC患者中表达显著上调,并通过调节EGFR mRNA的翻译,促进仑伐替尼耐药。METTL1-WDR4介导的tRNA m7G修饰,促进EGFR mRNA翻译,诱导仑伐替尼耐药。此外,METTL3表达下调导致p53 m6A修饰减少,促进了p53的表达,诱导 p53依赖性细胞凋亡,并使人肝癌细胞对阿帕替尼治疗敏感。

三、异常RNA修饰介导的mRNA翻译与肝癌预后
异常RNA修饰介导的mRNA翻译与肝癌预后密切相关,凸显了RNA修饰相关标志物在肝癌中的潜在诊断和预后价值。此外,靶向失调的RNA修饰酶和翻译机制被证明可以有效抑制HCC的生长和转移,并增加体外和体内治疗和药物的敏感性。
1、肝癌中与RNA修饰和mRNA翻译相关的诊断和预后标志物
生物体液中的RNA修饰水平与HCC进展有关,可作为肝癌的诊断标志物。肝癌患者血清、尿液和腹水中假尿苷的浓度明显高于健康人,表明生物体液中假尿苷的浓度水平可作为肝癌诊断的生化标志物。此外,研究揭示m6A miRNA特征在鉴定癌症(包括HCC)方面具有敏感性。重要的是,在区分HCC与慢性肝炎/肝硬化方面,这种诊断特征比传统的生物标志物AFP更准确。因此,探索有效的RNA修饰相关的预后特征并开发实用的检测试剂盒将为肝癌的准确诊断开辟出一条新途径。
RNA修饰(包括m7G、m5C和m1A等)和mRNA翻译相关的关键调节因子在肝癌中广泛失调,可以作为有效的HCC诊断和预后生物标志物。体外和体内研究表明,这些调节因子表达水平的升高以及活跃的RNA修饰状态与更晚的HCC阶段、较差的总生存期相关。此外,RNA修饰及调节因子还可以预测HCC患者放化疗、靶向治疗和免疫治疗的结局。
2、靶向异常RNA修饰和mRNA翻译的肝癌治疗策略
靶向异常的RNA修饰可显著减轻肿瘤负荷,提高局部和全身治疗的疗效,这凸显了靶向RNA修饰治疗肝癌的潜在临床益处。目前,已经研发出一系列有效的、靶向RNA修饰的小分子抑制剂 (Table 3)。STM2457是一种高效、选择性的METTL3催化抑制剂,可显著减缓髓系白血病的进展,延长荷瘤小鼠的存活时间。利用STM2457抑制METTL3可以明显延缓ICC的生长和进展。FB23-2在抑制FTO m6A去甲基化酶活性方面表现出高选择性,并抑制体外和体内急性髓系白血病的进展。Dac51由FB23-2优化而来,是一种更有效的FTO抑制剂,可与抗PDL1阻断协同作用,抑制黑色素瘤和结肠腺癌进展。此外,IGF2BP2抑制剂JX5能显著抑制体外和体内白血病细胞的增殖。
tRNA m1A甲基转移酶TRMT6和TRMT61A在肝癌中表达上调,并与人HCC进展相关。Thiram,可阻断TRMT6和TRMT61A之间的相互作用,显著抑制HCC细胞生长并降低HCC小鼠模型中的肿瘤负荷。NSC107512,PUS7抑制剂,可显著抑制胶质母细胞瘤干细胞的发生。考虑到ψ修饰writer在HCC组织中表达上调,并且表达水平与HCC患者的生存率呈负相关,这意味着NSC107512在治疗HCC患者方面可能具有重要的治疗潜力。

研究总结&展望
肝癌中RNA修饰和mRNA翻译的广泛变化为有效的肝癌诊断和治疗提供了新的机会。然而,各种挑战仍有待解决。例如,许多RNA修饰的催化酶和调节蛋白仍然未知。确定这些RNA修饰的writers、erasers和readers以及探索它们在调节mRNA翻译和肝癌进展中的生理功能是十分有必要的。此外,许多翻译相关的RNA具有复杂的结构和被大量修饰,这为测序效率和准确性带来挑战。因此,迫切需要研发出效率、精准度和灵敏度都更高的新型测序技术。总体而言,RNA修饰调节因子的综合研究和新型测序技术的发展将有利于肝癌新诊断标志物和治疗靶点的鉴定。
RNA修饰writer/eraser/reader的失调可能导致成百上千个靶标的翻译发生改变,同时诱导多种致癌表型。writer/eraser/reader在特定癌症类型或个体中的功能(致癌或肿瘤抑制)由下游靶标决定。因此,鉴定关键的下游靶标,并揭示特定靶标优势调控的背后机制。此外,需要明确对特定writer/eraser/reader抑制敏感的癌症类型或患者群体,并开发出能够有效杀死癌细胞且对正常组织不利影响最小的治疗策略。
肝癌中,各种RNA修饰酶受到异常调控,并发挥促癌作用。因此,高通量筛选靶向这些RNA修饰酶的有效且特异的小分子抑制剂,可能有助于开发用于肝癌治疗的新型药物。
RNA修饰调控肝癌转移、肿瘤微环境、耐药等各个方面。因而,特异性的RNA修饰抑制剂与其他治疗策略联合使用可能对肝癌患者产生较好的协同治疗效果。例如,抑制RNA修饰酶可以有效提高肝癌对抗PD1治疗的敏感性,证明靶向RNA表观遗传治疗和免疫治疗相结合可以有效规避单独治疗策略的局限。总而言之,进一步探索RNA表观遗传疗法与其他肝癌疗法的协同作用,对于提高肝癌患者的临床治疗效果至关重要。
参考文献
Shuibin Lin, Ming Kuang. RNA modification-mediated mRNA translation regulation in liver cancer: mechanisms and clinical perspectives[J]. Nature Reviews Gastroenterology & Hepatology, 2024























 260
260

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








