导读
要了解大脑的认知功能,就必须了解神经元是如何在局部、不同脑区以及整个大脑的大规模范围内相互连接的。局部处理和全局整合之间的平衡为复杂的处理模式提供了支持,这些模式是高阶认知功能的基础,同时确保了大脑的灵活性、稳健性和功能多样化。在这种情况下,网络范式为研究脑区之间的相互作用以及使用强大的计算工具解释功能网络的复杂拓扑结构提供了理论框架。本文回顾了研究大脑功能网络的当前技术水平,并总结了用于量化网络特征的方法进展。同时概述了主要的神经成像技术,探讨了目前有关认知功能和功能障碍的核心大规模网络的知识。
前言
大脑主要通过多个相互作用单元系统的运作来实现其各种功能。这些单元的规模可以从神经元集群到不同的皮层和皮层下区域。神经科学的主要挑战之一是,如何理解大脑丰富的功能是从这样一个虽然跨越多个尺度,但相对固定的解剖结构中产生的。此外,在庞大的功能库中,由于所涉及的大脑系统数量和复杂性,给高级认知过程的研究带来了特殊的挑战。越来越多的证据表明,答案可能在于大脑相互联系的组织,它促进了局部运作和局部功能的全局整合。这种类型的组织构建了内在复原力,并确保了适应性,稳健性和功能多样化。
为了对相互关联的大脑组织进行建模,神经科学家越来越多地转向源自网络科学的工具和概念,这些工具和概念允许对复杂的大脑拓扑结构以及网络的多个神经系统之间的相互作用进行一致的描述和解释,这种方法已被证明在系统生物学和社交网络分析中是成功的。除了能够分析大脑网络之外,网络科学还为研究大脑功能提供了坚实的理论框架,并为解开多对一功能结构悖论提供了概念基础。同样,网络的形式使得长期以来关于大脑功能的局部中心观点和全局分布观点之间的争论得以协调。这是通过将局部特化视为模式化分布式交互的结果来实现的,这导致特定网络元素具有不同的功能属性。
各种神经成像技术,如功能性磁共振成像(fMRI),正电子发射断层扫描(PET),脑磁图(MEG),功能性近红外光谱(fNIRS)和脑电图(EEG)(图1),提供了测量功能连接的方法。在过去的十年中,神经成像在技术成本和可用性方面的发展导致了实验数据量的显著增加,以及临床、实验室和实验室外实验设计和应用的复杂性。传感技术的进步得到了计算方法学等类似发展的补充,这在一定程度上是由可用计算能力的激增以及计算神经科学、网络科学和机器学习等领域的理论进步所驱动。一方面,在脑功能网络的发现中,研究借鉴了图论的概念和神经系统中已经发现的各种广为人知的组织模式,如小世界网络和无标度网络。另一方面,基于神经活动的相关、相干、锁相和相位幅值协同调制的特定神经科学工具已经开发出来。与此同时,这些导致了一些大脑系统的发现,也称为大规模脑网络,包括默认模式(DMN),突显网络(SN),执行和注意网络。这些核心的大规模网络,以及它们组成的子网络之间的相互作用,都与认知功能有关,强调了认知加工中神经活动无处不在的联合性质。
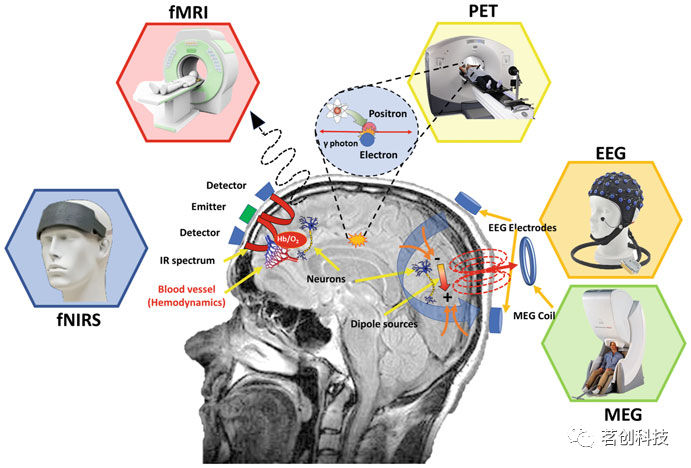
图1.电生理技术(EEG和MEG)捕获神经元的电活动,分别反映突触后电位和细胞内电流。fMRI和fNIRS都捕获与局部神经活动相关的血流动力学活动变化,尽管它们使用的方法不同:即分别通过评估磁性的变化与测量含氧和脱氧血红蛋白对近红外光吸收的差异。PET通过检测发射的正负电子湮灭产生的伽马射线对来测量与葡萄糖摄取相关的神经代谢活动的升高。
对脑功能网络的全面表征不仅产生了对正常认知过程的大量描述,而且还产生了对不同网络功能障碍在异常和神经障碍(如抑郁症、癫痫、精神分裂症、自闭症和脑震荡后综合征)中所起作用的新见解。本文根据脑功能网络科学的最新发展,探讨了理解认知的神经基础的技术现状,脑功能网络已成为揭示分布式大脑系统内部和之间相互作用如何产生认知的主要范式。这是因为涉及认知处理不同方面的大规模脑网络之间的相互作用对于更深入地了解认知的神经基础至关重要。
功能神经成像技术在网络发现中的应用
早期的功能连通性概念考虑了从不同解剖位置记录的时间序列信号对之间的统计依赖性。这种方法最初是为分析尖峰列形式的单个单元神经记录而开发的。这使得研究人员能够通过简单地估计相关系数来证明脑区表现出相关的活动模式,从而产生了功能连接的概念。功能连接的概念已经扩展到不同类型的统计关联和测量技术,并越来越多地从网络理论框架内延伸到全脑网络。来自不同测量技术的数据反映了信号系统的各种生理功能:血流动力学活动引起氧合血红蛋白和脱氧血红蛋白水平的差异(fMRI),由于局部代谢和血管活动引起的血红蛋白浓度变化(连续波fNIRS),与葡萄糖摄取相关的代谢升高(PET),部分同步的突触后电位(EEG),以及由细胞内电流产生的磁场振荡(MEG)。
神经成像技术的优缺点
用于发现大脑网络的各种神经成像技术的主要区别在于其测量背后的物理原理(图1)。通常,它们根据分辨率(空间和时间)和大脑活动感知的位置(侵入性和非侵入性)进行分类。由于这里主要是关注非侵入性技术,因此排除了诸如局部场电位(LFP),皮层脑电图(ECoG)以及单神经元和多神经元活动(SUA/MUA)等信号。
在图1中列出的非侵入性技术中,fMRI和PET具有高空间分辨率,但其时间分辨率有限(图2)。它们在解释潜在的神经元活动方面具有一定的局限性。例如,基于血氧水平依赖性(BOLD)fMRI信号,很难区分功能相关的处理和神经调节,而基于fMRI的功能连接可能由于对固有的动态功能耦合变化的了解不足而受阻,因为BOLD fMRI信号较慢(<1Hz)。另一方面,PET除了具有比fMRI更低的时间和空间分辨率外,还被认为不适合广泛使用,因为它使被试暴露于电离辐射中。此外,PET社区正在进行的一个讨论是关于葡萄糖摄取是否实际上反映了神经元或周围细胞(例如星形胶质细胞)能量消耗的问题。然而,PET对轻微运动伪影的敏感度低于fMRI,在单个试次中具有更好的信噪比,同时不太容易受到信号失真的影响,如fMRI中由于邻近组织的磁性不同而产生的信号失真。

图2.非侵入性神经成像技术的相对空间和时间分辨率示意图。
非侵入性电生理模式,如EEG和MEG,具有优越的时间分辨率,并且对于研究认知功能和评估大脑状态很有吸引力,因为它们直接记录了大脑的电活动,尽管是通过位于头骨上的传感器。但也因此,EEG和MEG在空间分辨率方面受到了一定的限制,因为容积传导效应存在,它们无法明确地重建大脑中产生电信号的来源。因此,EEG和MEG通常在传感器空间进行分析,涉及到时域和频域技术。在这种情况下,神经电磁源成像(NSI)被用于解决EEG/EMG逆问题,希望能够定位大脑活动源并提高空间分辨率。根据神经解剖学和容积传导效应,目前已经开发了各种稳健的源定位技术。
连续波fNIRS是一种相对较新的技术,它结合了功能磁共振成像在空间分辨率方面的优势,但依赖于生物发色团的不同吸收特性,而不是血红蛋白的顺磁性。通过在光源和探测器对之间传递近红外光(700-900nm)来实现这一点,这些探测器对通常位于头皮上,距离范围为2cm到5cm。虽然fNIRS具有便携性和易用性特点,以及对头部运动伪影的敏感性相对较低,但它仅限于对皮层的表层进行采样,这与提供全脑测量的fMRI不同。
多模态方法
每种神经成像技术在空间和时间分辨率、对特定伪影的敏感性和实际实施方面都具有相对的优势和局限性。这强调了多模态方法在弥补神经活动全面表征差距方面的效用,特别是在功能网络整合和动力学方面。多模态脑网络映射方法整合了来自不同神经成像方式的信息,可以弥补彼此的不足。接下来将介绍一些最常用的多模态组合:
EEG/MEG和fMRI。目前,已有研究人员提出了一些将EEG/MEG与fMRI记录相结合的方法,以进一步提高电生理学技术的空间分辨率或fMRI的时间分辨率。这种集成主要有三个方向:时间信息融合(EEG-informed fMRI)、空间信息融合(fMRI-informed EEG)和时空信息的对称融合(EEG-fMRI fusion)。在时间信息融合中,目标是从EEG时间序列数据中对BOLD活动进行时间预测。这涉及到使用EEG数据作为线性模型的回归量来预测体素方面的BOLD激活,并且通常只能与同时收集的数据一起使用,因为它依赖于时间相关性。随后,在功能连接方面,可以测试与EEG动力学相关的BOLD活动是否与已知的fMRI衍生网络一致,并将时间动力学与已知的fMRI衍生网络相关联。在空间信息融合中,fMRI通常用于改善EEG的源定位。这种方法可以随后识别模式之间不同和共享的功能网络,并仔细检查这些网络之间的相互作用。在EEG-fMRI融合中,这两种技术都不能用于预测另一种技术的特征。融合方法可以进一步分为模型驱动和数据驱动。后者通常使用偏最小二乘法(PLS)、典型相关分析(CCA)和独立成分分析(ICA)将多模态数据同时分解为有意义的成分。
EEG和fNIRS。EEG和fNIRS的整合旨在弥补EEG在空间分辨率上的不足,同时使fNIRS在皮层水平上对神经活动的定位不那么模糊。此外,fNIRS对电干扰和肌电图(EMG)以及眨眼伪影不太敏感。EEG和fNIRS的整合提供了基于神经血管耦合(NVC)的不同类型的信息,神经活动调节局部血流和氧合的级联过程,这是仅通过单模态EEG无法解决的。虽然许多研究通过集成EEG和fNIRS特征来利用这些丰富的信息内容(包括功能连接),但也有研究使用基于fNIRS的约束条件作为EEG源定位的空间先验信息,然后在动态网络框架内的EEG源水平进行功能连接网络估计。
PET和fMRI。最近有研究强调,在一体化PET/MRI扫描仪中集成PET和fMRI凸显了这两种模式的重要性。在PET中,分子探针特异性方面的进步是由于选择性放射性配体的发展而引起的,但在fMRI中,通过改进仪器和分析方法,分辨率得到了增强,扫描速度也加快了。因此,越来越多地提出了将PET不断提高的分子成像能力与更好的fMRI空间分辨率相结合的多模态方案。最近,三模态神经成像(PET-fMRI-EEG)已被用于通过同步测量的方式来研究大规模脑网络之间的差异。为此,使用fMRI来估计默认模式网络(DMN)和感觉运动网络的功能连通性,并使用EEG全局场功率来识别EEG微状态,然后将其与fMRI连接网络和FDG-PET摄取的图论测量值相关联。这些研究的首要目标是确定神经精神障碍的诊断、疾病分期和治疗反应监测的综合(神经血管、神经代谢和神经电)生物标志物。
网络建模和分析方法
脑网络是认知功能的基础
几个世纪以来,大脑功能的局部与整合一直是激烈争论的主题,后者在过去几十年里终于占据了主导地位。使问题更加复杂的是神经功能固有的多尺度特性,从单个细胞的突触连接到局部解剖区域内有组织的细胞组合,再到通过神经通路以分层方式相互连接的大脑区域的大规模结构。
突触和通路的解剖结构不可避免地制约着脑网络的功能;然而,已有研究表明,大脑区域不需要以直接的物理/结构方式连接来发挥其功能属性。此外,功能网络动态变化可以通过可塑性重塑大脑网络的物理结构。同时,网络科学提供了理论基础和分析工具,不仅可以对大脑功能进行数据驱动的定量评估,而不需要假设各个大脑区域如何参与不同的认知过程,还可以从实验数据对网络进行基于模型的推断,以及建模大脑系统之间的耦合及其受任务、感觉刺激或时间的调节。
功能连接通常是通过时间序列观察来估计的,它描述了神经实体之间的统计依赖模式(其性质不同,取决于所使用的神经成像方式)。功能连接会随时间的变化而变化,通常在数十或数百毫秒的时间尺度内发生变化,因为功能耦合不断受到感官刺激,任务环境以及内源性因素的调节。
脑网络:节点和边缘
从实验数据中估计大脑功能网络通常遵循如图3所示的方法。该方法(a)通常根据潜在的大脑解剖结构和所使用的传感技术定义网络节点,以及(b)随后估计由节点对产生的信号的时间序列之间的统计依赖性。根据所使用的测量类型,功能连接网络可以是有向的或无向的,反映线性或非线性功能耦合,双变量或多变量效应,以及在时域或频域中。接下来,(c)将这些估计值组织成一个邻接矩阵,用于进一步的分析。邻接矩阵在其行和列上包含网络节点,而其记录对应于使用统计依赖度量估计的值。随后,(d)邻接矩阵通常通过去除弱连接的阈值过程而变得稀疏。阈值可以在一定范围内变化,以观察其对结果的影响。然而,最近的研究指出,这种方法可能会过度地去除弱连接,而这些弱连接实际上具有功能相关性,并提出了基于最大化信息流而不是布线成本的生物相关性阈值标准。在最后一步中,(e)处理后的邻接矩阵用于计算图论度量,这些度量表征了嵌入在所检查数据中的连通性网络。此步骤通常伴随着统计分析,旨在确定观测值与随机网络总体比较的显著性。

图3.用不同的传感技术测量脑功能网络的典型步骤。
节点定义
节点的定义很大程度上取决于感知模态。从广义上讲,节点可以以三种不同的方式分类:(i)在图像重建后的测量空间中,在基于体素模式的情况下,如fMRI或PET;(ii)在电生理模式(EEG和MEG),以及fNIRS的传感器空间中;(iii)基于定位技术(EEG和MEG)的源重建。
对于基于体素模式的情况,要考虑的主要因素是与后续分析最相关的空间尺度,转化为是否要考虑单个体素或体素组(ROI)。早期的脑网络分析方法使用单个体素来描述节点。虽然这种方法可能比基于ROI的方法提供了更高的分辨率,并且自然地支持无模型分析,但与基于ROI的分析相比,它的信噪比较低,并且产生了高维数的网络。当使用基于ROI的方法时,需要根据用于聚合体素的方法做出进一步的选择:基于图谱解剖知识的大脑分割、数据驱动的分割或混合方法。
不仅由于大脑解剖学知识越来越详细,而且由于神经成像技术的分辨率不断提高,这导致网络规模不可持续(从计算的角度来看),所以也不奇怪为什么目前的大多数方法都是基于ROI的。有研究者使用来自图谱的先验解剖知识,如自动解剖标记(AAL2)图谱,基于大脑的解剖标记(多达120个ROI),基于细胞结构信息的Brodmann区域,或神经成像实验室(LONI)概率图谱。其他最近的方法使用连接信息来进行分割,其背后的原因是每个功能特化的脑区都具有与其他区域连接的特定模式,从而定义了其功能。分割方法的选择、用于体素配准的图谱,以及网络节点的数量,对所得到的图测量值和跨研究结果比较的能力都有显著影响。因此,在比较脑网络的拓扑测量时,建议使用相似的空间尺度(就节点数量而言)。
将节点表示为体素组的另一种常用方法是使用ICA。该方法将每个独立成分(IC)映射到一个分布式区域,并根据IC时间序列构建反映功能连接的邻接矩阵。IC的数量取决于所研究的功能过程的性质,范围从少于10个到50个或更多。
在基于传感器的模式中,脑网络的节点通常由传感器或电极直接表示。这大大简化了网络构建过程;然而,由于容积传导现象和传感器网格的布局,每个传感器/电极记录的信号并不直接代表神经区域的电活动,而是代表来自多个皮层源的同时活动。虽然目前的大多数EEG和MEG研究都忽略了这些因素,但有几种方法可以解决这些问题。首先是使用空间滤波器,主要基于拉普拉斯算法,用于去除由一组相邻电极共享的记录信号的公共成分。第二种方法包括使用功能连接估计的方法,该方法考虑了容积传导效应,例如相位滞后指数或虚部相干性。EEG和MEG衍生网络中使用的另一种方法是将网络节点定义为假定生成头皮记录信号的皮层源。利用复杂的源定位技术,通过求解一个逆问题来估计这些源。这些技术可以基于正则化最小二乘算法、贝叶斯方法、基于张量的方法或扩展的源扫描方法,例如波束成形。
此外,对于EEG和MEG,信号可以通过带通滤波技术分解成典型的频段。一旦与皮层源对应的信号被重建,这既可以在传感器水平也可以在源水平上完成。EEG/MEG频段分为delta(1-4 Hz)、theta(4-8 Hz)、alpha(8-13 Hz)和beta(>13 Hz),而更高频的活动(通常高于30 Hz)称为gamma活动。在这些类型的分析中,在每个频段内都构建了不同的功能连通性网络,从而实现多层网络分析,如图4所示。

图4.通过对测量数据(最常见的是EEG和MEG)进行频域分解,多层网络形式可用于研究大脑活动。不同的层代表不同频段的脑功能网络,或者不同的层可能表示不同的数据形式。
边缘定义
定义节点后,下一步是评估与节点对应的神经信号的统计依赖性。此时需要考虑许多因素,因为最近有研究综述确定了40多种用于估计功能连接的方法。
在选择最合适的连通性测量时,必须考虑研究的基本假设。例如,考虑到唤起对疼痛刺激的反应情况,已知疼痛是一种综合现象,它基于感觉、运动、注意力和其他情境之间的相互作用。因此,当科学目标是研究在对疼痛刺激的注意和运动反应中激活的机制时,使用定向连接测量将是一个合适的选择,该测量在理论上更有助于描述躯体感觉区域对内侧额叶皮层施加的影响(从而反映它们的因果关系),该区域已知参与注意加工,或者如果目标是研究工作记忆任务的记忆保持过程中远处大脑区域之间的同步,则无向功能连接测量(如相关性)方法将适用于脑网络分析。
一些测量(如格兰杰因果关系和转移熵)的原因在时间上先于其结果的事实提供了有向指标。创造性思维等复杂认知过程中的跨频耦合,可以通过频域连通性测量更好地反映出来,例如相位-振幅耦合(PAC)。与EEG/MEG的宽频段相比,较低的频率范围在一定程度上限制了频域连接测量在BOLD信号中的适用性。因此,时域测量似乎在fMRI和fNIRS中具有更广泛的适用性。表1给出了常用测量值和相关属性的概述列表。
表1.常用功能连接测量的列表。

脑网络的统计意义
统计分析可以通过根据模拟模型生成的参考网格进行比较,或者通过在不同组之间进行比较,例如健康组与控制组或任务执行组与休息组。在第一种情况下,使用零模型进行比较,通常通过随机化网络连接获得,同时保留经验网络的某些属性,但所研究的指标除外。通常需要在生成零模型时保留度分布。不同的方法可以大致分为以下几类:(i)生成零模型,其中参考网络是通过向经验网络中的原始节点集添加连接而生成的,同时保留所需的约束;(ii)随机化方法,其工作原理是根据一组规则重新连接经验网络。在生成零模型的情况下,例如Watts-Strogatz零模型,实验者从经验网络的一组节点和所需的平均节点度开始,同时添加后续连接以生成一个小世界结构。最后一步是根据特定概率随机重新连接每个连接。在随机化方法的情况下,如HirschbergerQi-Steuer,重新布线是通过生成随机协方差矩阵来完成的,同时保留经验脑网络的分布特性。
在连接水平执行组间比较时,常用的初始步骤是在邻接矩阵上应用阈值以去除虚假连接。可以根据连接强度或网络密度设置阈值,并且仅保留高于阈值的连接,其他连接则设置为零。然而,当目标是比较依赖于网络密度的图指标时,阈值化可能会导致组间的网络密度不同,这通常会引发问题。同样,在执行基于密度的阈值化时,生成的网络可能仍包含较低值的虚假连接。例如,当目标是将对照组的脑网络与一组精神分裂症患者(已知其网络中表现出更多的随机拓扑结构)的脑网络进行比较时,这可能会导致假阳性。此外,基于强度和密度的阈值都可能导致网络碎片化,因为一些节点连接将保持断开状态,这违反了神经系统的基本连接框架。在这种情况下,一个潜在的解决方案是使用基于拓扑的阈值化,它可以确保在网络的所有节点之间找到一条路径。基于拓扑阈值化的一个例子是正交最小生成树(OMST)。
另一种有助于最小化由网络指标对密度的依赖性所引起的问题的方法是将所考察的指标与参考网络进行归一化。这种方法适用于小世界网络,它由相对于给定密度值的归一化指标组成,即随机网络和规则网络中的指标为其范围提供了合适的值。可以创建常规和随机网络,以匹配原始网络的大小和度分布。然后,网络指标G的归一化值将计算为Gnorm=(G-Grand)/(Greg-Grand),其中Greg和Grand分别为该指标在相应的格状网格和随机网络中的值。
选择合适的阈值通常具有挑战性。为了避免选择任意的阈值,可以考虑一个阈值范围,并在结果中重复所需的统计分析。这通常会产生多次统计检验,因此需要进行多个检验的校正。或者将所研究的网络测量值在阈值范围内进行整合,得到曲线下面积(AUC),然后对AUC进行统计检验。
大规模功能网络与认知
大脑区域作为大规模功能网络的一部分发挥着特定的作用。研究最多的网络包括默认模式网络(DMN),突显网络(SN),中央执行网络(CEN)和注意网络(背侧(DAN)和腹侧(VAN))(图5)。有证据支持这样一种观点,即结构/解剖网络只对功能连接起约束作用,而不完全决定功能连接。

图5.在认知中起主要作用的大规模网络。
这些网络可以通过几种不同的分析方法观察到:(i)ICA分析,它将多变量脑信号分离成加性子成分(ICs),假设这些成分是由独立源产生的;然后将大脑区域中的神经活动与ICs相关联,以识别大规模网络的节点;对于与任务相关的设置,应用多元回归和时间排序来识别与任务活动相关的ICs;(ii)基于种子的分析,选择特定大脑区域(已知参与特定功能)对应的神经信号作为种子,随后分析该种子到其他脑区的连接模式,以检索该网络;(iii)社区检测方法,对全脑功能网络进行分析,以识别群体结构(功能模块),其特征是群体之间的联系比其他群体之间的联系更紧密。
然而,现有的模型尚可以阐明认知出现的静态和动态网络机制。根据最近的观察,SN动态地影响DMN和CEN,以实现内部(自我导向)和外部(目标导向)导向行动之间的切换,并对显著刺激进行适当的反应(图6)。然而,其子系统之间跨多个时间尺度的交互模式,特别是那些在任务域中保持相当稳定的交互模式与那些表现出更多灵活性的交互模式在很大程度上仍然是未知的。

图6.三重网络模型广泛用于描述默认模式网络、突显网络和中央执行网络之间的动态相互作用。
默认模式网络(DMN)
DMN是最早也是最突出的大规模功能网络之一。Shulman等人使用PET成像观察到,当被试从事各种视觉任务时,与静息态相比,许多大脑区域的活动有所下降。这一初步观察结果后来在一系列非自我参照的目标导向任务中得到了证实,后续研究表明,这种下降不是由于不受控制的实验因素导致的静息态下各自区域的激活,而是由于大脑的内在活动。目前关于DMN的知识还指出,该网络在塑造需要自我参照处理(如未来计划,记忆加工和社会规划)的任务相关大脑活动方面具有突出作用,从而创建了心理理论和道德决策。此外,自从它在静息态实验中被发现以来,就与自发的认知功能有关,例如走神,自我反思和其他与刺激无关的想法。这些功能中的每一个都与子系统和DMN中离散脑区的神经活动有关。
DMN分为三个子系统:腹内侧前额叶皮层(vmPFC)、背内侧前额叶皮层(DMPFC);以及后扣带皮层(PCC)、内侧楔前叶(MPC);和外侧顶叶皮层(LPC)组成的子系统(图5和6)。另一个通常与DMN相关的区域是内侧颞叶(MTL)的内嗅皮层。由vmPFC组成的子系统说明了DMN所起的动态平衡作用,因为它已被证明连接负责外源性感觉信息处理的区域(如OFC),并将信息传递到与社会行为和情绪控制相关的结构,如下丘脑和杏仁核。总而言之,该子系统的功能反映了DMN在集中注意力和情绪状态之间的连接作用。DMPFC子系统主要与自我参照活动有关,例如喜欢/不喜欢情绪效价刺激。DMPFC和vMPFC中的活动呈负相关,DMPFC的增加与vMPFC的减少有关,这似乎证实了情绪处理会因涉及任务的注意力而减弱的事实。PCC+MPC+LPC子系统一直与记忆相关的加工相关联,特别吸引人的是该子系统与海马形成(包括MTL中的内嗅皮层)之间的连接在记忆巩固中的作用。在这种情况下,研究假设它们之间连接强度的昼夜变化可能是日常记忆检索和巩固的基础。
总结现有的证据,DMN在认知过程(包括情绪处理,自我参照活动,和检索之前的经验)中的广泛作用,强调了该网络在认知健康和疾病中的至关重要性。虽然DMN的功能子系统可能会根据任务相关的因素而被显著地激活,比如情绪元素或自我参照成分的存在或缺失,但是该网络从未关闭。它的活动在基线时是高水平的,根据特定的任务,它会减弱或放大。
大量的脑部疾病与DMN的功能障碍有关。这些疾病包括AD、自闭症、注意缺陷多动障碍、双相情感障碍、抑郁症、癫痫、情绪障碍、帕金森病和创伤后应激障碍。然而,关于DMN的临床意义,需要指出的是,很少有研究报告DMN内的连通性中断(主要是神经退行性疾病,如AD),而大多数研究将疾病与DMN与其他大规模网络(如CEN和SN)之间的不平衡联系起来。然而,DMN在清醒镇静下似乎持续存在,其后扣带皮层成分的活动有局灶性降低。最后,虽然上述大多数观察结果都是基于人类研究,但应该注意的是,关于DMN一般特征的确凿性证据也在非人类哺乳动物中存在。
突显网络(SN)
SN由一组大脑区域组成,这些区域协同工作,以便人们选择需要重点关注的刺激。因此,它在对突显的内部或外部信息的反应中被激活,或在情绪处理过程中被激活。突显概念本身就是一个广泛的概念,从视觉刺激到疼痛、共情和错误检测。SN在Seeley等人的开创性工作中首次被独立描述,此前作为一个任务正向网络,被认为是CEN的一部分。其关键节点位于前岛叶皮层(AIC)和背前扣带皮层(dACC)中,其功能连接已被证明可延伸至丘脑、下丘脑、杏仁核、黑质(SuN)/腹侧被盖区(VTA)和颞极(图5和6)。皮层下区域(杏仁核、SuN和VTA)的激活能够检测情绪和奖赏显著性。SN和腹侧注意网络(VAN)共享位于AIC的节点;然而,虽然SN是双侧的,但VAN被证明具有右半球偏侧化。由于与VAN的重叠以及与CEN共同的几个区域中的共激活,因此对于SN及其所包含区域的明确定义没有普遍的共识。一些研究人员将SN概念化为注意网络的一部分,而另一些研究人员则认为这两个系统是不同的。
根据上述三重网络模型(图6),SN被认为在DMN(需要内部注意时)和CEN(需要目标导向注意时)之间切换,并在调节大规模功能网络之间的相互作用中起着重要作用。它已被证明是由背侧AIC(dAIC)实现的(背侧AIC已被证明参与协调大脑动力学),并且由于其与CEN和DMN的密集传出连接,因此可能充当因果影响(输出)中枢。此外,越来越多的证据表明,dAIC可能在多模态刺激的多模态整合和突显检测中发挥重要作用。dAIC的这一特征已通过结构MRI、fMRI的因果连通性建模以及经颅磁刺激得到了证实。
由于其在其他大规模网络之间的中介作用,以及在SN中发生的刺激加工的多模态性质,突显加工功能障碍会导致许多疾病,包括神经退行性疾病,神经精神病和其他类型的脑部疾病。特别是,岛叶皮层的功能障碍受到越来越多的关注,该区域的非典型功能连接模式与自闭症、精神分裂症和痴呆的异常突显加工有关。总体而言,这种发生在SN中的内外突显刺激的检测和映射的改变对自我监测和认知都有显著的影响。
SN也被认为是疼痛整合的重要系统,AI和前扣带皮层(ACC)位于子网络的中心,该子网络整合了关于即将发生刺激的重要性和显著性信息。因此,关于有害/无害刺激的感知决策受到SN加工的影响,导致疼痛知觉依赖于情境。此外,在成瘾中观察到SN和DMN之间的连通性显著降低以及SN内连通性降低。SN中的多个节点,包括AI,也包括已知参与多巴胺能通路的区域,如SuN和VTA,一方面似乎在将内感受性身体状态信息整合到连贯的情绪感知中发挥着重要作用,另一方面,也在增加归因于线索的突显性方面发挥着重要作用。
大量的研究也强调了SN在健康大脑认知过程中的作用。举几个例子,最近一项涉及图论指标的研究显示,随着认知负荷的增加,SN和CEN中的功能连接显著增加,而DMN中的功能连接显著减少。此外,由于错误往往在正常的认知行为中很突出,最近的研究调查了大脑的错误监测系统与SN之间的联系。研究结果发现,源于AI的加工可以检测错误信号并将其传递给ACC,然后以前馈方式传递给感觉运动区域。
中央执行网络(CEN)
CEN由一组额顶区域组成,主要包括背外侧前额叶皮层(dlPFC),外侧后顶叶皮层(lPPC)和顶内沟(IPS)。其他最常被报告为CEN一部分的脑区域包括dACC、额盖/AI(fO/AI)、腹外侧和喙外侧前额叶皮层(vlPFC和rlPFC)、前下顶叶(aiPL)和后下侧颞叶(图5和6)。CEN与目标导向行为有关,并被证明参与高阶认知过程,如外部导向的注意力,维持和操纵工作记忆信息,基于规则的问题解决和决策。CEN对来自SN的显著输入施加控制,在上述三重网络模型中,有人认为CEN通过直接的因果神经机制对DMN进行负调节。由于激活区域有很大的重叠,它最初被认为与SN一起形成一个单一的网络。然而,CEN的独特功能通过其与执行控制任务表现的相关性所证实。此外,CEN中的节点在各种认知要求较高的任务中表现出强大的内部功能连接。
CEN的缺陷与一系列疾病有关,特别是与工作记忆有关。这些缺陷主要由三个因素造成:(i)CEN内部的连通性降低,(ii)在非CEN节点相关的任务上错误地激活,或(iii)来自SN的关于任务相关的突显刺激的通信受损。CEN受损与精神分裂症中观察到的紊乱有关,主要集中在与SN重叠的dlPFC和PPC区域。从这个意义上说,大量的研究调查了这两个区域在其他神经和精神疾病中的作用。然而,基于网络表征方面的证据表明主要集中在SN和DMN上。
在涉及健康认知功能方面,一些研究指出,健康成年人的CEN和DMN的活动呈负相关。此外,在一项观察儿童、青少年和成人的纵向研究中,CEN网络中功能连接强度的增加和DMN分离程度的增加(就PCC和CEN之间的联系而言)与更高的智力有关。
注意网络
在大规模功能网络的背景下,引起广泛兴趣的另一个领域是注意过程和潜在的神经机制。目前用于研究注意网络的两个最有影响力的模型是Posner和Petersen在90年代初提出的三个子系统模型以及Corbetta和Shulman提出的双网络模型。
三个子系统模型已被证明对应于不同脑区的协同功能活动:(i)警报子系统,负责获得和维持警觉状态和警惕性,它位于脑干蓝斑部位,通过去甲肾上腺素通路投射到额叶和顶叶皮层区域;(ii)定向子系统,将显性和隐形注意力引导到刺激上,位于腹内侧额叶皮层(vFC)、颞顶交界处(TPJ)、额叶视区(FEF)和顶内沟/顶叶上叶(IPS/SPL);(iii)执行控制子系统,它涉及对目标的检测,以及为意识加工检测和选择刺激。该子系统涉及大量区域,包括ACC、AI和纹状体(图7)。

图7.典型的大脑注意网络。
双网络模型定义了两个不同的网络:(i)背侧注意网络(DAN),它涉及自上而下或目标导向的注意(主要是视觉空间),主要在FEF和IPS中,并存在于大脑双侧组织,以及(ii)腹侧注意网络(VAN),它涉及自下而上的刺激驱动的注意,当刺激意外出现时被激活。VAN位于TPJ和vFC中。
两个模型之间存在一定程度的重叠,特别是在三个子系统模型的定向子系统方面,该模型结合了来自双网络模型的背侧和腹侧注意网络(图7)。此外,Posner的三个子系统模型与上述其他大规模功能网络存在很大程度的重叠。具体而言,从它的定义中可以明显看出,执行控制子系统包含了可归因于SN和CEN的特征。从这个意义上说,Posner提出的模型概念化范围更广泛,但仍然关注注意的来源,而不是受注意影响的加工功能。
Posner模型中的警报子系统与注意的持续警觉有关,在行为和生理上都被描述为一个独特的注意网络。在生理学上,警报子系统依赖于脑干唤醒通路。该系统被证明是右侧偏侧化的,投射到右侧额叶和顶叶皮层。注意力缺陷多动(ADHD)等障碍包括早期的警觉功能障碍和随后的执行注意力缺陷。
与注意力的相位成分相对应的定向子系统依赖于神经递质乙酰胆碱。该系统的主要功能是通过选择方式或位置来确定感官输入的优先级,它由两个部分分离的网络组成。自上而下的背侧网络,包括FEF和IPS/SPL中的节点,与双注意网络模型中的DAN有明显重叠,主要负责视觉空间注意。背侧注意网络通常由需要特别注意集中的任务激活,这涉及到刺激发生之前的视觉空间线索。该网络在外部目标导向认知过程中被CEN激活,通常被观察到与DMN反相关。另一个腹侧注意网络(VAN)是一个自下而上的定向系统,由TPJ和VFC中的节点组成(图7a)。当与行为相关的事件意外发生时,此网络将被激活,从而打破当前的处理重点。VAN主要活跃在右半球,其两个核心区域通常是共激活且存在功能连接的。
Posner模型中的第三个子系统是执行控制子系统,它对各种任务中目标检测和选择过程中的自发响应提供自上而下的控制。该系统进一步分为两个独立的执行控制网络:(i)额顶网络,与上述定向子网络不同,由背侧额叶皮层(dFC),IPS,IPL,楔前叶和内侧扣带皮层(mCC)内的节点组成;(ii)扣带回-盖部网络,由前额叶皮层(aPFC)、dACC、AI和fO中的节点组成(图7b)。这两个系统相对独立地在任务执行期间实现自上而下的控制。扣带回-盖部网络和SN在解剖拓扑结构方面有很大程度的重叠,一些研究表明它们实际上是同一个神经网络的一部分。许多功能障碍都与执行控制系统有关,包括焦虑、抑郁、精神分裂症和强迫症。
总结
本文回顾了用于描述脑功能网络的主要概念和技术,介绍了有关大规模功能网络在认知中的作用。可以看到,基于网络的脑科学为在多个尺度上研究神经活动提供了一个框架,它不仅被应用于基础神经科学,而且越来越多地应用于临床和转化研究。网络结构存在于大脑的所有组织层面,从细胞(单个神经元和突触)到全脑区域和系统水平。本文将重点放在分析全脑水平及其各个解剖区域和功能系统的相互作用的方法上,目的是提供有关建模步骤的系统观点,同时也描述大规模网络组织,这在基于模型的认知功能和功能障碍研究中越来越流行。
此外,随着多模态神经成像方法的日益普及,预计多层网络方法的使用将成为常态。例如,同时获取的fMRI-EEG提供了有关不同神经生物学机制以及高时空分辨率,多层网络是用来解释这种多模态、多尺度数据的数学模型。多层网络已在EEG研究中得到了应用,它们被用于优化描述同时发生在不同频段上的功能相互作用,从而有可能揭示不同神经机制的功能耦合。
另一个最近的研究趋势是整合来自多个生物尺度的信息,以提供有关认知功能的神经生物学机制的丰富功能背景。这些方法是由大脑网络作为分子系统水平和认知/行为水平之间的中间表型观点所驱动的。因此,同时对脑功能网络和潜在分子底物的研究有望揭示与基因型-大脑表型相互作用相关的高级机制。
参考文献(上下滑动查看):
1. Park, H.J., Friston, K.: Structural and functional brain networks: from connections to cognition. Science. 342, 73–89 (2013)
2. Sporns, O., Betzel, R.F.: Modular brain networks. Annu. Rev. Psychol. 67, 613–640 (2016)
3. Bezerianos, A., Dragomir, A., Balomenos, P.: Networks and pathways in systems pharmacology. In: Computational Methods for Processing and Analysis of Biological Pathways, pp.11–46. Springer, Cham (2017)
4. Akay, A., Dragomir, A., Erlandsson, B.E.: Network-based modeling and intelligent data mining of social media for improving care. IEEE J. Biomed. Health Inform. 19, 210–218 (2014)
5. He, B., Yang, L., Wilke, C., Yuan, H.: Electrophysiological imaging of brain activity and connectivity – challenges and opportunities. IEEE Trans. Biomed. Eng. 58, 1918–1931 (2011)
6. Mier, W., Mier, D.: Advantages in functional imaging of the brain. Front. Human Neurosci. 9, 249 (2015)
7. Bassett, D.S., Sporns, O.: Network neuroscience. Nat. Neurosci. 20, 353 (2017)
8. Vu, M.A.T., Adalı, T., Ba, D., Buzsáki, G., Carlson, D., Heller, K., Mayberg, H.S.: A shared vision for machine learning in neuroscience. J. Neurosci. 38, 1601–1607 (2018)
9. Fornito, A., Zalesky, A., Bullmore, E.: Fundamentals of brain network analysis. Academic, Amsterdam (2016)
10. Bressler, S.L., Menon, V., Menon, V.: Large-scale brain networks in cognition: emerging methods and principles. Trends Cogn. Sci. 14, 277–290 (2010)
11. Petersen, S.E., Sporns, O.: Brain networks and cognitive architectures. Neuron. 88, 207–219 (2015)
12. Menon, V.: Large-scale brain networks and psychopathology: a unifying triple network model. Trends Cogn. Sci. 15, 483–506 (2011)
13. Gerstein, G.L., Perkel, D.H.: Simultaneously recorded trains of action potentials: analysis and functional interpretation. Science. 164, 828–830 (1969)
14. Friston, K.J.: Functional and effective connectivity in neuroimaging: a synthesis. Hum. Brain Mapp. 2, 56–78 (1994)
15. Logothetis, N.K.: What we can do and what we cannot do with fMRI. Nature. 453, 869 (2008)
16. Riedl, V., Utz, L., Castrillón, G., Grimmer, T., Rauschecker, J.P., Ploner, M., Sorg, C.: Metabolic connectivity mapping reveals effective connectivity in the resting human brain. Proc. Natl. Acad. Sci. 113, 428–433 (2016)
17. Kameyama, M., Murakami, K., Jinzaki, M.: Comparison of [15O] H2O positron emission tomography and functional magnetic resonance imaging in activation studies. World J. Nucl.Med. 15, 3 (2016)
18. Bradley, A., Yao, J., Dewald, J., Richter, C.P.: Evaluation of electroencephalography source localization algorithms with multiple cortical sources. PLoS One. 11, 0147266 (2016)
19. Ferrari, M., Quaresima, V.: A brief review on the history of human functional near-infrared spectroscopy (fNIRS) development and fields of application. NeuroImage. 63, 921–935 (2012)
20. Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J.R.: Functional magnetic resonance imaging and functional near-infrared spectroscopy: insights from combined recording studies. Front. Hum. Neurosci. 11, 419 (2017)
21. Mash, L.E., Reiter, M.A., Linke, A.C., Townsend, J., Müller, R.A.: Multimodal approaches to functional connectivity in autism spectrum disorders: an integrative perspective. Dev. Neurobiol. 78, 456–473 (2018)
22. Lei, X., Xu, P., Luo, C., Zhao, J., Zhou, D., Yao, D.: fMRI functional networks for EEG source imaging. Hum. Brain Mapp. 32, 1141–1160 (2011)
23. Lei, X., Ostwald, D., Hu, J.: Multimodal functional network connectivity: an EEG-fMRI fusion in network space. PLoS One. 6, e24642 (2011)
24. Calhoun, V.D., Sui, J.: Multimodal fusion of brain imaging data: a key to finding the missing link (s) in complex mental illness. In: Biological Psychiatry: Cognitive Neuroscience and Neuroimaging, pp. 230–244 (2016)
25. Moosmann, M., Eichele, T., Nordby, H., Hugdahl, K., Calhoun, V.D.: Joint independent component analysis for simultaneous EEG-fMRI: principle and simulation. Int. J. Psychophysiol. 67, 212–221 (2008)
26. Keles, H.O., Barbour, R.L., Aghajani, H., Omurtag, A.: Multimodality mapping approach for evolving functional brain connectivity patterns: A fNIRS-EEG study. In: Biomedical Optics, pp. 5–2. Optical Society of America (2014)
27. Buccino, A.P., Keles, H.O., Omurtag, A.: Hybrid EEG-fNIRS asynchronous brain-computer interface for multiple motor tasks. PLoS One. 11, 0146610 (2016)
28. Omurtag, A., Aghajani, H., Keles, H.O.: Decoding human mental states by whole-head EEG+ FNIRS during category fluency task performance. J. Neural Eng. 14, 066003 (2017)
29. Aghajani, H., Garbey, M., Omurtag, A.: Measuring mental workload with EEG+ fNIRS.
Front. Hum. Neurosci. 11, 359 (2017)
30. Li, R., Nguyen, T., Potter, T., Zhang, Y.: Dynamic cortical connectivity alterations associated with Alzheimer’s disease: an EEG and fNIRS integration study. NeuroImage: Clin. 21, 101622 (2019)
31. Cavaliere, C., Kandeepan, S., Aiello, M., Ribeiro de Paula, D., Marchitelli, R., Fiorenza, S., Loreto, V.: Multimodal neuroimaging approach to variability of functional connectivity in disorders of consciousness: a PET/MRI pilot study. Front. Neurol. 9, 861 (2018)
32. Shah, N., Arrubla, J., Rajkumar, R., Farrher, E., Mauler, J., Kops, E.R., Sripad, P.: Multimodal fingerprints of resting state networks as assessed by simultaneous trimodal MR-PET-EEG imaging. Sci. Rep. 7, 6452 (2017)
33. Rajkumar, R., Farrher, E., Mauler, J., Sripad, P., Régio Brambilla, C., Rota Kops, E., Herzog, H.: Comparison of EEG microstates with resting state fMRI and FDG-PET measures in the default mode network via simultaneously recorded trimodal (PET/MR/EEG) data. Hum. Brain Mapp. 1–12 (2018)
34. Majewska, A.K., Sur, M.: Plasticity and specificity of cortical processing networks. Trends Neurosci. 29, 323–329 (2006)
35. Power, J.D., Fair, D.A., Schlaggar, B.L., Petersen, S.E.: The development of human brain functional networks. Neuron. 67, 735–748 (2010)
36. Dimitriadis, S.I., Salis, C., Tarnanas, I., Linden, D.E.: Topological filtering of dynamic brain functional networks unfolds informative chronnectomics: a novel data-driven thresholding scheme based on orthogonal minimal spanning trees (OMSTs). Front. Neuroinform. 11, 28 (2017)
37. Dodel, S., Herrmann, J.M., Geisel, T.: Functional connectivity by cross-correlation clustering. Neurocomputing. 44, 1065–1070 (2002)
38. de Reus, M.A., van den Heuvel, M.P.: The parcellation-based connectome: limitations and extensions. NeuroImage. 80, 397–404 (2013)
39. Stanley, M.L., Moussa, M.N., Paolini, B.M., Lyday, R.G., Burdette, J.H., Laurienti, P.J.: Defining nodes in complex brain networks. Front. Comput. Neurosci. 7, 169 (2013)
40. De Vico Fallani, F., Richiardi, J., Chavez, M., Achard, S.: Graph analysis of brain functional networks: practical issues in translational neuroscience. Philos. Trans. R. Soc. B Biol. Sci. 369, 20130521 (2014)
41. Bullmore, E., Sporns, O.: Complex brain networks: graph theoretical analysis of structural and functional systems. Nat. Rev. Neurosci. 10, 186 (2009)
42. Engel, A.K., Gerloff, C., Hilgetag, C.C., Nolte, G.: Intrinsic coupling modes: multiscale interactions in ongoing brain activity. Neuron. 80, 867–886 (2013)
43. Rolls, E.T., Joliot, M., Tzourio-Mazoyer, N.: Implementation of a new parcellation of the orbitofrontal cortex in the automated anatomical labeling atlas. NeuroImage. 122, 1–5 (2015)
44. Rorden, C., Brett, M.: Stereotaxic display of brain lesions. Behav. Neurol. 12, 191–200 (2000)
45. Shattuck, D.W.: Construction of a 3D probabilistic atlas of human cortical structures. NeuroImage. 39, 1064–1080 (2008)
46. Arslan, S., Ktena, S.I., Makropoulos, A., Robinson, E.C., Rueckert, D., Parisot, S.: Human brain mapping: a systematic comparison of parcellation methods for the human cerebral cortex. NeuroImage. 170, 5–30 (2018)
47. Menon, V.: Large-scale brain networks in cognition: emerging principles. Anal. Funct. Largescale Brain Netw. 14, 43–54 (2010)
48. Duff, E.P., Trachtenberg, A.J., Mackay, C.E., Howard, M.A., Wilson, F., Smith, S.M., Woolrich, M.W.: Task-driven ICA feature generation for accurate and interpretable prediction using fMRI. NeuroImage. 60, 189–203 (2012)
49. Bassett, D.: Human brain networks in health and disease. Curr. Opin. Neurol. 22, 340 (2009)
50. Carvalhaes, C., de Barros, J.A.: The surface Laplacian technique in EEG: theory and methods. Int. J. Psychophysiol. 97, 174–188 (2015)
51. Stam, C.J., Nolte, G., Daffertshofer, A.: Phase lag index: assessment of functional connectivity from multi channel EEG and MEG with diminished bias from common sources. Hum. Brain Mapp. 28, 1178–1193 (2007)
52. Nolte, G., Bai, O., Wheaton, L., Mari, Z., Vorbach, S., Hallett, M.: Identifying true brain interaction from EEG data using the imaginary part of coherency. Clin. Neurophysiol. 115, 2292–2307 (2004)
53. Becker, H., Albera, L., Comon, P., Gribonval, R., Wendling, F., Merlet, I.: Brain-source imaging: from sparse to tensor models. IEEE Signal Process. Mag. 32, 100–112 (2015)
54. De Domenico, M.: Multilayer modeling and analysis of human brain networks. Giga Sci. 6, 004 (2017)
55. Bose, R., Ashutosh, K., Li, J., Dragomir, A., Thakor, N., Bezerianos, A.: A multilayer network approach for studying creative ideation from EEG. In: Lecture notes in artificial intelligence, pp. 294–303. Springer, Cham (2018)
56. Wang, H.E., Bénar, C.G., Quilichini, P.P., Friston, K.J., Jirsa, V.K., Bernard, C.: A systematic framework for functional connectivity measures. Front. Neurosci. 8, 405 (2014)
57. Bastos, A.M., Schoffelen, J.M.: A tutorial review of functional connectivity analysis methods and their interpretational pitfalls. Front. Syst. Neurosci. 9, 175 (2016)
58. Ploner, M., Sorg, C., Gross, J.: Brain rhythms of pain. Trends Cogn. Sci. 21, 100–110 (2017)
59. Liu, C.C., Ohara, S., Franaszczuk, P.J., Crone, N.E., Lenz, F.A.: Attention to painful cutaneous laser stimuli evokes directed functional interactions between human sensory and modulatory pain-related cortical areas. Pain. 152, 2781–2791 (2011)
60. Palva, J.M., Monto, S., Kulashekhar, S., Palva, S.: Neuronal synchrony reveals working memory networks and predicts individual memory capacity. Proc. Natl. Acad. Sci. 107, 7580–7585 (2010)
61. Seth, A.K., Barrett, A.B., Barnett, L.: Granger causality analysis in neuroscience and neuroimaging. J. Neurosci. 35, 3293–3297 (2015)
62. Vicente, R., Wibral, M., Lindner, M., Pipa, G.: Transfer entropy – a model-free measure of effective connectivity for the neurosciences. J. Comput. Neurosci. 30, 45–67 (2011)
63. Srinivasan, R., Winter, W.R., Ding, J., Nunez, P.L.: EEG and MEG coherence: measures of functional connectivity at distinct spatial scales of neocortical dynamics. J. Neurosci. Methods. 166, 41–52 (2007)
64. Lachaux, J.P., Rodriguez, E., Martinerie, J., Varela, F.J.: Measuring phase synchrony in brain signals. Hum. Brain Mapp. 8, 194–208 (1999)
65. Vinck, M., Oostenveld, R., Van Wingerden, M., Battaglia, F., Pennartz, C.M.: An improved index of phase-synchronization for electrophysiological data in the presence of volumeconduction, noise and sample-size bias. NeuroImage. 55, 1548–1565 (2011)
66. Canolty, R.T., Knight, R.T.: The functional role of cross-frequency coupling. Trends Cogn. Sci. 14, 506–515 (2010) 84
67. Bose, R., Dragomir, A., Taya, F., Thakor, N., Bezerianos, A.: Role of cross-frequency coupling in the frontal and parieto-occipital subnetwork during creative ideation. In: 9thInternational IEEE/EMBS Conference Neural Engineering, pp. 294–303. Springer, Cham (2019)
68. Blinowska, K.J.: Review of the methods of determination of directed connectivity from multichannel data. Med. Biol. Eng. Comput. 49, 521–529 (2011)
69. Baccalá, L.A., Sameshima, K.: Partial directed coherence: a new concept in neural structure determination. Biol. Cybern. 84, 463–474 (2001)
70. Hirschberger, M., Qi, Y., Steuer, R.E.: Randomly generating portfolio-selection covariance matrices with specified distributional characteristics. Eur. J. Oper. Res. 177, 1610–1625 (2007)
71. Van Wijk, B.C., Stam, C.J., Daffertshofer, A.: Comparing brain networks of different size and connectivity density using graph theory. PLoS One. 5, 13701 (2010)
72. Kleckner, I.R., Zhang, J., Touroutoglou, A., Chanes, L., Xia, C., Simmons, W.K., Barrett, L.F.: Evidence for a large-scale brain system supporting allostasis and interoception in humans. Nat. Hum. Behav. 1, 0069 (2017)
73. Miller, E.K., Cohen, J.D.: An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167–202 (2001)
74. Greicius, M.D., Krasnow, B., Reiss, A.L., Menon, V.: Functional connectivity in the resting brain: a network analysis of the default mode hypothesis. Proc. Natl. Acad. Sci. 100, 253–258 (2003)
75. Uddin, L.Q.: Salience processing and insular cortical function and dysfunction. Nat. Rev. Neurosci. 16, 55 (2015)
76. Raichle, M.E.: Two views of brain function. Trends Cogn. Sci. 14, 180–190 (2010)
77. Shulman, G.L., Fiez, J.A., Corbetta, M., Buckner, R.L., Miezin, F.M., Raichle, M.E., Petersen, S.E.: Common blood flow changes across visual tasks: II. Decreases in cerebral cortex. J. Cogn. Neurosci. 9, 648–663 (1997)
78. Andrews-Hanna, J.R.: The brain’s default network and its adaptive role in internal mentation. Neuroscientist. 18, 251–270 (2012)
79. Shannon, B.J., Dosenbach, R.A., Su, Y., Vlassenko, A.G., Larson-Prior, L.J., Nolan, T.S., Raichle, M.E.: Morning-evening variation in human brain metabolism and memory circuits. J. Neurophysiol. 109, 1444–1456 (2012)
80. Broyd, S.J., Demanuele, C., Debener, S., Helps, S.K., James, C.J., Sonuga-Barke, E.J.: Default-mode brain dysfunction in mental disorders: a systematic review. Neurosci. Biobehav. Rev. 33, 279–296 (2009)
81. Mohan, A., Roberto, A.J., Mohan, A., Lorenzo, A., Jones, K., Carney, M.J., Lapidus, K.A.: Focus: the aging brain: the significance of the default mode network (DMN) in neurological and neuropsychiatric disorders: a review. Yale J. Biol. Med. 89, 49 (2016)
82. Uddin, L.Q.: Salience network of the human brain. Academic, Amsterdam (2016)
83. Seeley, W.W., Menon, V., Schatzberg, A.F., Keller, J., Glover, G.H., Kenna, H.: Dissociable intrinsic connectivity networks for salience processing and executive control. J. Neurosci. 27, 2349–2356 (2007)
84. Sridharan, D., Levitin, D.J., Menon, V.: A critical role for the right fronto-insular cortex in switching between central-executive and default-mode networks. Proc. Natl. Acad. Sci. 105, 12569–12574 (2008)
85. Stein, M.B.: Increased amygdala and insula activation during emotion processing in anxietyprone subjects. Am. J. Psychiatr. 164, 318–327 (2007)
86. Manoliu, A., Riedl, V., Zherdin, A., Mühlau, M., Schwerthöffer, D., Scherr, M., Wohlschläger, A.M.: Aberrant dependence of default mode/central executive network interactions on anterior insular salience network activity in schizophrenia. Schizophr. Bull. 40, 428–437 (2013)
87. Wiech, K., Lin, C.S., Brodersen, K.H., Bingel, U., Ploner, M., Tracey, I.: Anterior insula integrates information about salience into perceptual decisions about pain. J. Neurosci. 30, 16324–16331 (2010)
88. Liang, X., He, Y., Salmeron, B.J., Gu, H., Stein, E.A., Yang, Y.: Interactions between the salience and default-mode networks are disrupted in cocaine addiction. J. Neurosci. 35, 8081–8090 (2015)
89. Scott, D., Hiroi, N.: Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biol. Psychiatry. 69, 1052–1059 (2011)
90. Liang, X., Zou, Q., He, Y., Yang, Y.: Topologically reorganized connectivity architecture of default-mode, executive-control, and salience networks across working memory task loads. Cereb. Cortex. 26, 1501–1511 (2015)
91. Ham, T., Leff, A., de Boissezon, X., Joffe, A., Sharp, D.J.: Cognitive control and the salience network: an investigation of error processing and effective connectivity. J. Neurosci. 33, 7091–7098 (2013)
92. Andrews-Hanna, J.R., Smallwood, J., Spreng, R.N.: The default network and self-generated thought: component processes, dynamic control, and clinical relevance. Ann. N. Y. Acad. Sci. 1316, 29–52 (2014)
93. Sherman, L.E., Rudie, J.D., Pfeifer, J.H., Masten, C.L., McNealy, K., Dapretto, M.: Development of the default mode and central executive networks across early adolescence: a longitudinal study. Dev. Cogn. Neurosci. 10, 148–159 (2014)
94. Posner, M.I., Petersen, S.E.: The attention system of the human brain. Annu. Rev. Neurosci. 13, 25–42 (1990)
95. Corbetta, M., Shulman, G.L.: Control of goal-directed and stimulus-driven attention in the brain. Nat. Rev. Neurosci. 3, 201–215 (2002)
96. Petersen, S.E., Posner, M.I.: The attention system of the human brain: 20 years after. Annu. Rev. Neurosci. 35, 73–89 (2012)
97. Posner, M.I., Rothbart, M.K., Ghassemzadeh, H.: Focus: attention science: restoring attention networks. Yale J. Biol. Med. 92, 139 (2019)
98. Spreng, R.N., Sepulcre, J., Turner, G.R., Stevens, W.D., Schacter, D.L.: Intrinsic architecture underlying the relations among the default, dorsal attention, and frontoparietal control networks of the human brain. J. Cogn. Neurosci. 25, 74–86 (2012)
99. Farrant, K., Uddin, L.Q.: Asymmetric development of dorsal and ventral attention networks in the human brain. Dev. Cogn. Neurosci. 12, 165–174 (2015)
100. Posner, M.I.: Imaging attention networks. NeuroImage. 61, 450–456 (2012)
101. Deslauriers, J., Ansado, J., Marrelec, G., Provost, J.S., Joanette, Y.: Increase of posterior connectivity in aging within the ventral attention network: a functional connectivity analysis using independent component analysis. Brain Res. 1657, 288–296 (2017)
102. Block, S.R., King, A.P., Sripada, R.K., Weissman, D.H., Welsh, R., Liberzon, I.: Behavioral and neural correlates of disrupted orienting attention in posttraumatic stress disorder. Cogn. Affect. Behav. Neurosci. 17, 422–436 (2017)
103. Lin, P., Yang, Y., Gao, J., De Pisapia, N., Ge, S., Wang, X., Niu, C.: Dynamic default mode network across different brain states. Sci. Rep. 7, 46088 (2017)
104. Bola, M., Sabel, B.A.: Dynamic reorganization of brain functional networks during cognition. NeuroImage. 114, 398–413 (2015)
105. Dragomir, A., Vrahatis, A.G., Bezerianos, A.: A network-based perspective in Alzheimer’s disease: current state and an integrative framework. IEEE J. Biomed. Health Inform. 23, 14–25 (2019)
106. Jonas, E., Kording, K.P.: Could a neuroscientist understand a microprocessor? PLoS Comput. Biol. 13, 1005268 (2017)
小伙伴们点个“在看”,加
(星标)关注茗创科技,将第一时间收到精彩内容推送哦~




























 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








