注:表观遗传内容聚合。
1957 年至今跨越 60 年的表观遗传学简史(重点关注 DNA 甲基化和组蛋白修饰)
原创 市场部 - SLZ 联川表观 2024

摘要
由于过去几十年,特别是最近几年,聚焦于表观遗传学的研究数量之多,因此提供一个表观遗传学的时间线显得至关重要。实际上,本篇综述将表观遗传事件和主要的表观遗传学中的转移酶(Writers)、阅读蛋白(Readers)和去修饰酶(Erasers)从事表观遗传学几十年的历史维度上进行审视。这篇综述有助于我们在分子生物学和细胞生物学中日渐爆炸的知识体系中重新进行系统性理解,例如近些年新出现的生物化学检测技术的发展以及表观遗传学的进步。更重要的是,我们需要理解表观遗传学在许多生理和病理情况下所扮演着极其重要的角色。
1. 从遗传学到表观遗传学
直到 18 世纪,预成论(preformation theory)认为,能力和生物差异由上帝决定,个体特征在受精时开始并被固定。这一理论被达尔文的理论和康德的观点所反驳,他们认为环境在表型修饰中起着严格的作用。这导致了进化概念的定义。
孟德尔在 1865 年提出的原则,1869 年 DNA 分子的分离,以及大约一个世纪后,即 1959 年,DNA 双螺旋结构的解析,确立了遗传学和遗传的全球学术界通用型共识原则。
发育生物学家康拉德・H・瓦丁顿(1905-1975)创造了 “表观遗传学” 这个词来概括一个新的生物学分支,它专注于基因和蛋白质表达之间的联系 [1]。1930 年,在果蝇中报道了基因 white 的位置在异染色质或常染色质中是其激活或抑制的原因。这些观察表明,局部核环境调节基因表达 [2]。1957 年,瓦丁顿提出了著名的表观遗传景观,在其中,一个球体(象征一个细胞)由于表面的粗糙(这意味着细胞内和细胞外环境的影响)可以沿着不同的路径移动 [3]。
在 20 世纪 70 年代中期到 80 年代,高迁移率族(HMG)蛋白的识别使我们理解到,除了自 1884 年以来已知的组蛋白之外,特定蛋白可能在染色质中具有架构作用,并可能影响表型表达。在 1980 年代,几个独立的课题组确定了雄性配子基因组和雌性配子的融合对于产生可行的受精卵和胚胎发生是必需的。这揭示了 “印记基因” 的存在,这些基因根据母系或父系遗传被特别调控 [4-6]。这个过程解释了在将成年体细胞核转移到去核卵子后获得克隆的高难度,这一概念在 1997 年 Wilmut 等人发表并创造羊多莉之前被认为是不可能的 [7]。随后,在许多不同物种中产生了数千个克隆动物,并在 2018 年产生了双母性和双父性小鼠,尽管这些动物表现出严重缺陷 [8]。
实际上,即使在 20 世纪中叶早期就大致理解了 DNA 的总体组织,表观遗传学的繁荣在 1990 年代和 2000 年代随着克隆和生化技术的全面展开而到来,这些技术允许识别特定的酶,表观遗传标记的 Writer 蛋白和 Eraser 蛋白。最研究和已知的表观遗传标记,DNA 甲基化(5mC)和翻译后组蛋白修饰,很快在 DNA 双螺旋结构解析后被识别。
DNA 甲基化最早在 1965 年就有相关的论文报道,而组蛋白甲基化、乙酰化、磷酸化、泛素化、苏氨化和 ADP 核糖化从 1962 年到 1977 年期间也被相继报道 [9,10]。尽管诸多课题组发现了这些核酸及蛋白层面上的修饰,但是这些修饰究竟发挥什么作用一直难以理解。事实上,这些表观标记的催化或擦除酶的晚期识别使得在酵母模型中进行遗传和生化实验成为可能,这些实验逐渐阐明了这些修饰的生物学意义。所有这些表观遗传事件和表观遗传学中涉及的主要蛋白质在时间线图中进行了总结,如下图所示:
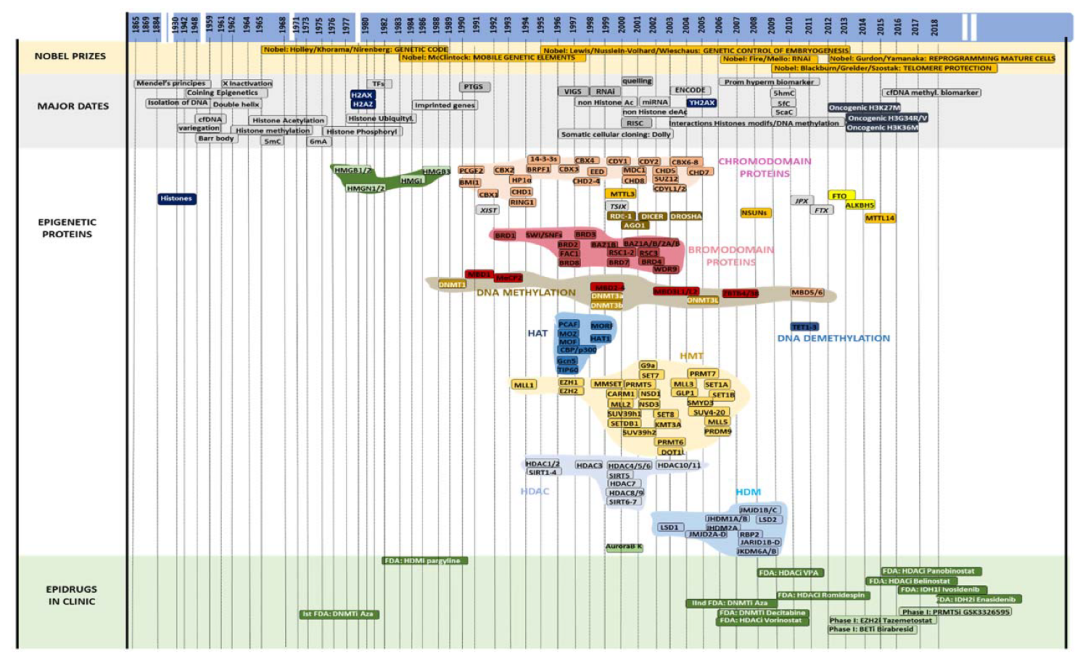
2. DNA 甲基化
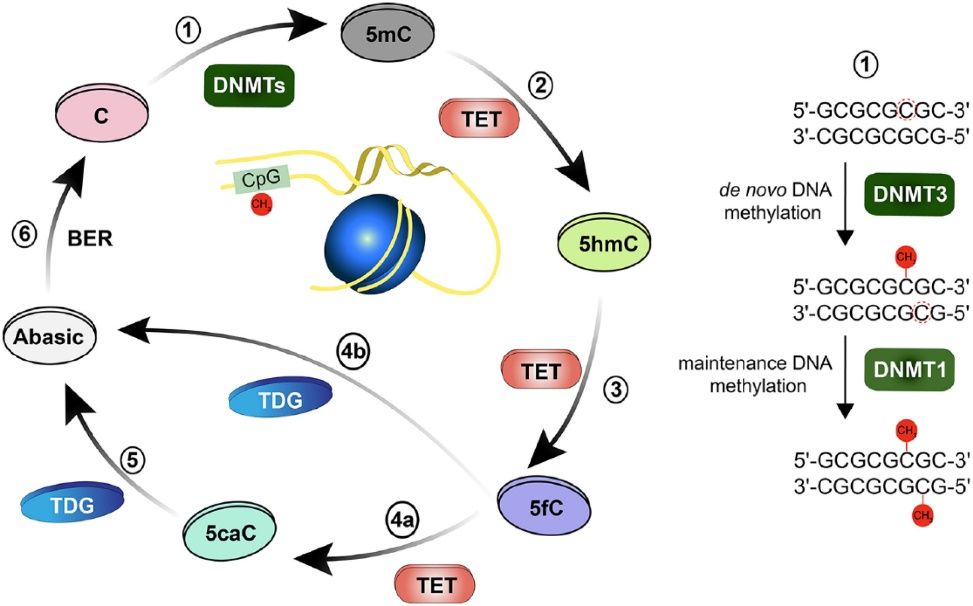
DNA 甲基化 5mC 是最稳定的表观遗传标记,其在基因调控和异染色质维持中的负面作用已经有所研究。鉴定 DNA 甲基化的 Writers 和 Erasers 花费了很长时间:从 1988 年第一个 DNA 甲基转移酶 1 (DNMT1) 被克隆出来开始历经了 20 多年,直到 2010 年去甲基化酶 TET 家族才被鉴定出来 [11–17]。
DNMT1 是第一个被鉴定的真核生物甲基转移酶,在哥伦比亚大学 Timothy Bestor 的实验室中被纯化和克隆。这个团队随后与 Whitehead Institute 的 Rudolf Jaenisch 实验室合作,敲除了 DNMT1 基因,揭示了这个基因对转座子沉默、X 染色体失活和印记基因调控至关重要,因此,DNA 甲基化写入涉及许多不同的生物过程。
DNMT1 催化 DNA 复制后胞嘧啶 C 上维持了 DNA 甲基化修饰状态,以支持在有丝分裂期间将这一表观遗传标记准确传递给未来的子代细胞。DNMT1 的鉴定刚刚在主要的 5mC 结合蛋白家族成员 MeCP2 以及 MBD1–4 之前,这些蛋白特异识别 5mC 并协调基因抑制 [18–22]。实际上,爱丁堡大学 Adrian Peter Bird 实验室是第一个鉴定 MeCP2 对甲基化 CpG 的招募及其在基因抑制中的作用的实验室。A.P. Bird 表明,MeCP2 对 DNA 甲基化识别的阻断与 Rett 综合征相关联。
这些发现揭示了 DNA 甲基化被特定阅读蛋白识别,导致抑制信号传导,以及这些机制的破坏与人类疾病相关联 [23]。在 DNMT1 之后十年,de novo DNMT3A 和 DNMT3B 在 1998 年被鉴定,并解释了在 DNA 复制独立的情况下,DNA 甲基化在双链上的获得,这一现象在胚胎发育期间的基因表达调控和许多疾病如癌症中异常基因抑制中特别重要 [12]。
实际上,Bestor 团队鉴定了非常罕见的免疫缺陷、着丝粒区域不稳定性、面部异常(ICF)综合征,主要由 DNMT3B 基因的突变引起,表明在发育过程中的 DNA 甲基化写入是至关重要的 [24]。几年后,DNMT3L 被描述并显示参与激活 de novo DNMTs 和包含 DNMT 的复合体,但 DNMT3L 本身缺乏催化活性 [13,25]。尽管在原核生物中几十年前就已知 DNA 去甲基化蛋白,但在哺乳动物中这类蛋白的寻找持续了多年。
实际上,在 2009 年,哺乳动物中一个令人信服的 DNA 去甲基化过程随着 5hmC 的重新发现而被鉴定,这是在 Trypanosoma 中一个 40 年后被遗忘的观察结果 [26]。然后,5fC 和 5caC 这 2 个修饰碱基的观察结果表明 DNA 去甲基化可能是一个主动的过程,这导致了特定 DNA 去甲基化酶的鉴定,当 TET(Tet-eleven 1, 2 和 3)家族在 2010 年在哈佛大学医学院的张毅实验室中被发现时,这在表观遗传学领域是一个革命性的进步 [17]。
此外,在 2003 年,通过不同蛋白复合体的表征提出了 DNA 甲基化和组蛋白修饰在基因抑制中的合作:(i)MBD1, CAF1 和 HP1,(ii)MBD1, SUV39H1 和 HP1 以及(iii)SUV39H1, HP1b 和 DNMTs [27–29]。DNMT 识别的 DNA 序列并不是特定的。
例如,DNMT3A 和 DNMT3B 存在于 A/T/C, T/A/C, A/T, T/G/A, C, G, C/G 和 A/G DNA 序列上,这表明蛋白质与 DNMTs 的相互作用涉及特定的 DNA 甲基化 [30,31]。
2002 年在欧洲肿瘤研究所 Pier Guiseppe Pelicci 课题组首次证明了这一假设,表明致癌 PML-RAR(早幼粒细胞白血病 - 视黄酸受体)蛋白通过特定的相互作用和招募 DNMT1 和 DNMT3A 来调节目标启动子 [32]。几年后,在 2005 年和 2006 年,DNMTs 与转录因子 P53、c-MYC 或 PU.1 的相作确认了基因还通过 DNMTs 的特定招募而受到调控 [33–35]。在 2009 年和 2010 年,数个课题组同时报到了数十种假定的转录因子 (TF)/DNMT 相互作用,表明特定的 DNA 甲基化可能主要参与了这一过程 [36,37]。
3. 蛋白质乙酰化
从 1992 年到 2005 年,许多展示出含有溴结构域的蛋白质被报道,这个术语历史上来源于果蝇(Drosophila melanogaster)中由 brm 基因编码的蛋白质 [38]。实际上,含有溴结构域的蛋白质,其首个成员是 BRD1 [39],包含一个大约 100 个氨基酸的区域,该区域特异识别组蛋白尾部的乙酰化赖氨酸,并有利于通过重新组织局部染色质来促进基因转录。
尽管组蛋白乙酰化在 1968 年 [40–42] 就已被早期描述,并且其在局部染色质开放中的作用是通过中和赖氨酸的正电荷并因此减少组蛋白 - DNA 相互作用,但乙酰化 Writers 即组蛋白乙酰转移酶(HATs)的身份长期不为人所知 [43]。30 年后,直到分子克隆技术和蛋白质生化纯化技术的出现,在不到 2 年的时间内(1996–1998)内诸多课题组鉴定了含有乙酰转移酶结构域的八种不同的 HATs [44–49]。
洛克菲勒大学的 C. David Allis 实验室是首个鉴定和纯化 HAT 的团队,为理解组蛋白翻译后修饰是如何进行的以及如何调控基因表达奠定了基础。此外,该团队在理解同一组蛋白尾部或不同组蛋白之间的串扰方面是先驱,从而引出了一个概念,即 “组蛋白密码”,它管理着局部基因表达。一些具有组蛋白去乙酰化酶活性(HDAC)的蛋白质在 1995 年首次被鉴定,并与含有去乙酰化酶结构域的蛋白质相关联。
随后的 7 年时间(1995–2002)内,又相继报道了 18 种不同的 HDACs [50–65],并根据它们与酵母的序列同源性、催化结构域的组织以及它们在细胞中的定位被分为四个类别。类别 I(HDAC1, 2, 3 和 8)具有一个简单的结构,包含一个带有短 N 端和 C 端延伸的去乙酰化酶结构域,IIa(HDAC4, 5, 7 和 9)、IIb(HDAC6 和 10)和 IV(HDAC11)被认为是经典的 HDACs,并且具有一个锌依赖的活性位点;类别 III(SIRTUINs:SIRT1–7)具有一个 NAD 依赖的活性位点。
此外,一些 HDAC 蛋白质似乎主要定位于细胞核,其他的在细胞核和细胞质之间转移,还有一些主要存在于细胞质中,表明这些酶的作用比最初认为的要多样化。
实际上,自 1997 年以来,已报道了许多非组蛋白靶标,一些研究者已将这些酶重新命名为赖氨酸去乙酰化酶(KDACs),这最初是因为乙酰化诱导的 P53 构象变化显著提高了其 DNA 结合能力 [66]。类似地,非组蛋白蛋白质的去乙酰化随后被描述。例如,2000 年报道的由包含 HDAC1 的复合体去乙酰化的 P53 证实了蛋白质的乙酰化和去乙酰化并不严格与染色质调控相关联 [67]。
实际上,为了澄清这些蛋白质的染色质依赖和不依赖作用,已提出了一种新的染色质修饰酶的命名法 [68]。
4. 蛋白质甲基化
与组蛋白乙酰化类似,组蛋白甲基化的作用,这些标记自 1962 年被识别以来,被研究了很长时间,才鉴定出这些标记的写入器和擦除器。组蛋白甲基化发生在组蛋白的不同赖氨酸和精氨酸上,可能涉及同一残基上的单甲基化、二甲基化和三甲基化。此外,精氨酸的二甲基化可以是对称的(me2s)或非对称的(me2a)。根据目标残基、甲基化水平和对称性,甲基化标记可以被解释为基因转录的允许性或抑制性标记(例如,局部的 H3K4me3 和 H4R3me2a 有利于转录,而 H3K27me3 和 H4R3me2s 抑制转录)。
从 1991 年到 2005 年描述的含有染色质结构域(chromodomain,简称 chromo)的蛋白质 [69–92],呈现出一种大约 40-50 个氨基酸的区域,该区域特异识别染色质,特别是组蛋白甲基化,并正向或负向调控基因表达。
尽管染色质结构域含有蛋白质在基因抑制中的作用自 20 世纪 90 年代初就被怀疑,但组蛋白甲基化和染色质结构域之间的联系直到 2001 年才被识别,这与异染色质蛋白 1(HP1)蛋白的作用有关 [93]。
实际上,圣路易斯大学的 Joel Eissenberg 实验室(2000 年)首次提出 HP1 可能作为一个交联器,将核小体 DNA 和非组蛋白复合体连接起来,形成更高阶的染色质结构 [94],表明某些蛋白质可能检测特定的组蛋白甲基化,从而导致基因抑制。
在哺乳动物中于 1993 年被鉴定和克隆的 HP1,最初是属于果蝇中的同源蛋白家族的成员,之前与异染色质结合、核定位和基因沉默相关联 [95]。HP1 自 20 世纪 50 年代以来就已经被发现,但数十年来未被解释其主要的作用机制。HP1 也是第一个解释基因抑制的含有染色质结构域的蛋白质,这种基因抑制是在活性基因转移到异染色质环境中后观察到的,这种现象称为果蝇中的位点效应变异 [96] [97]。
HP1 包含两种不同种类的染色质结构域:一个经典的 N 端染色质结构域和一个称为染色质阴影域的 C 端域 [69]。这些域,就像其他含有染色质结构域的蛋白质一样,识别并与其他蛋白质相互作用以调控异染色质结构。

早在 2000 年,就有研究称染色质阴影域与特定蛋白质伙伴中存在的共识五肽相互作用 [98],在 2001 年,报道称这些染色质结构域识别 H3K9 甲基化 [99]。实际上,含有染色质结构域的蛋白质被分为三个类别。像 HP1 这样展示 N 端染色质结构域后跟一个染色质阴影域的蛋白质属于第一类。第二类包括具有单个染色质结构域的蛋白质,而第三类包括具有成对串联染色质结构域的蛋白质。这些蛋白质的鉴定使我们能够更好地理解表观遗传标记是如何根据组蛋白密码真正调控基因表达的。
与 HATs 和 KDACs 不特定于单个残基不同,组蛋白的甲基化是在一个特定残基上特异性催化的,活性的冗余性相当有限。基于这些原因,鉴定负责每种甲基化的组蛋白甲基转移酶(HMTs)花了 12 年的时间(1993–2005)[100–126]。
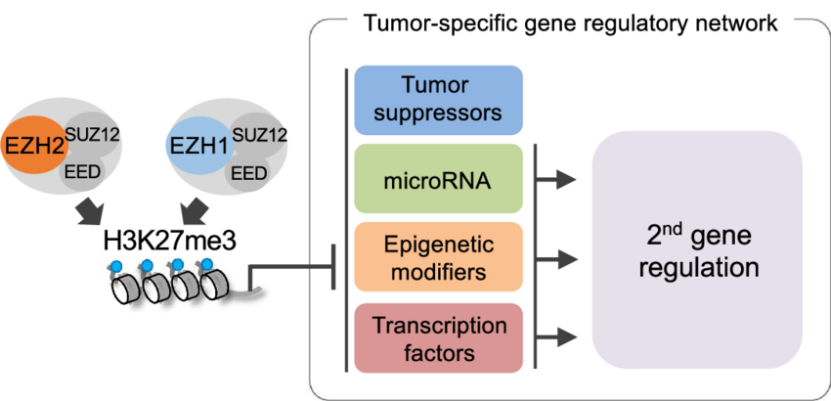
尽管一些蛋白质自 20 世纪 90 年代初就被已知参与基因抑制,但它们的组蛋白甲基转移酶活性要晚得多才被鉴定。实际上,增强子的 zeste 同源物 1 和 2(EZH1 和 EZH2)在 1996 年被克隆 [101,104],并被描述为基因抑制因子 Polycomb 复合体的成员,这是果蝇相应蛋白家族的同源蛋白。然而,这两个蛋白质的 H3K27 HMT 活性直到 2002 年(EZH2)和 2008 年(EZH1)才被表征 [127–129]。
此外,在 2004 年发现了更高级别的复杂性,当时报道称 PRC2 复合体的两个 Polycomb 成员,胚胎外胚层发育(EED)和 SUZ12,它们与 EZH2 相互作用,对 H3K27me3 活性是必需的 [130]。HMTs 包含一个 SET 结构域,由大约 130 个氨基酸组成,其名字来源于最初报告的三个果蝇 HMTs 的 HMT 活性:(Su (var) 3–9 Suppressor of variegation 3–9)、增强子的 zeste(EZ)和 thorax(Trx)。SET 结构域对赖氨酸残基的 ε- 氨基基团具有催化活性,用于单甲基化、二甲基化或三甲基化,使用甲基供体 S - 腺苷蛋氨酸(SAM)作为辅助因子。
类似于乙酰化和去乙酰化活性,自 2004 年以来,已报道 HMT 的非组蛋白甲基化靶标对许多蛋白质 [131],表明与几年前乙酰化写入器和擦除器的情况一样,这些酶并不特定于组蛋白,并且例如,通过控制转录因子(如 P53)的活性,参与调控基因表达,P53 通过 SET9 介导的甲基化被稳定化 [131,132]。
当然了组蛋白甲基化去甲基化酶的发现要晚得多。尽管在 1973 年 [133] 报道了牛胸腺组蛋白的酶促去甲基化,其机制未知,但长期以来组蛋白甲基化被认为是一个永久性的标记(即发生了组蛋白修饰后是不可逆的)。实际上,提出甲基化是通过切割组蛋白尾部 [134] 或通过用变体组蛋白交换甲基化组蛋白 [135–138] 来去除的。
在 2004 年,哈佛大学医学院的施扬教授课题组解析了赖氨酸特异性组蛋白去甲基化酶(LSD1)的分子活性,最初称为 KIAA0601 [139],建立了活性组蛋白去甲基化酶(HDM)的存在,这一发现打破了诸多教条固有理念,随后施扬教授又迅速鉴定了许多不同的 HDMs。
实际上,LSD1 家族包括两个成员(LSD1 和 LSD2),它们是胺氧化酶的同源物(包含一个 C 端氧化酶结构域(AOD),通过黄素腺嘌呤二核苷酸(FAD)催化的氧化反应去甲基化甲基化 H3K4,从而产生导致去甲基化的甲醛)。从 2004 年到 2009 年,鉴定了 15 种不同的 HDMs [140–148]。另一种 HDM 家族在 2006 年被发现 [147],包含一个 Jumonji 样结构域 C 末端(JmjC),包括使用这些辅助因子在氧气存在下羟基化甲基化赖氨酸的蛋白质,特别是产生不稳定的羰基胺,自发反应生成甲醛,去甲基化赖氨酸。
5. 其他翻译后组蛋白修饰
如前所述,已报道了其他翻译后组蛋白修饰,如组蛋白泛素化、小泛素相关修饰(SUMO)化或 ADP 核糖化。组蛋白泛素化已被牵涉到转录调控和 DNA 损伤响应 [149]。实际上,H2A 的单泛素化通过抑制 H3K4me2 甲基化来抑制转录。组蛋白 SUMO 化,它涉及通过一个与蛋白泛素化涉及的酶级联非常接近的过程,将一个小的泛素相关修饰物(SUMO)蛋白添加到组蛋白上,也可能调节基因表达。组蛋白 H4 与 E2 偶联酶结合并在 E1(SUMO 激活酶)和 E2 依赖的方式下被 SUMO 化,通过招募组蛋白去乙酰化酶和 HP1 介导基因沉默 [150]。组蛋白还可以在天冬氨酸 / 谷氨酸残基上 ADP 核糖化。这种由 ADP - 核糖转移酶(ARTs)催化的翻译后修饰对 DNA 损伤修复是必需的。然而,这些修饰在 DNA 损伤响应和修复中的确切贡献仍然不清楚 [151]。近些年来,组蛋白乳酸化修饰也是成为了诸多课题研究的热点。
6. 组蛋白变体
1980 年以来,已报道了主要的组蛋白 H2A、H2AX 和 H2AZ 变体 [152]。H2AX 占总 H2A 的大约 10%,但其在 DNA 修复中的作用直到 2002 年才被发现,当时鉴定了磷酸化的 H2AX 形式 γH2AX(可能占总 H2AX 的 10%),以及负责这种磷酸化的激酶 [153]。
NIH 的 William M. Bonner 及其团队在这一领域做出了重大贡献。实际上,γH2AX 迅速与双链断裂相关联,并发出 DNA 修复信号。虽然 H2AZ 变体比 H2AX 更少,并且不与特定过程相关联,但最近发现 H2AZ 受到许多不同经典翻译后修饰的影响,如传统组蛋白,特别是通过其乙酰化形式,特别与干细胞生物学中涉及的基因的转录起始位点和增强子相关(综述见 [154])。除了天然的组蛋白变体外,近年来还报道了几种突变形式,并与癌症相关联,导致了 “癌组蛋白” 的概念。
细胞中存在不同的组蛋白形式例如,H3.1 在 S 期被纳入并存在于整个基因组中,而 H3.3 则与细胞周期无关,更具体地与它调节的启动子相关联。实际上,H3.1K27M、H3.3K27M、H3.3K36M 和 H3G34R/V 在 2012 年和 2013 年被报道 [155,156]。
实际上,H3K27M 和 H3K36M 均阻断了负责该赖氨酸特定甲基化的 HMT,导致这些癌症中甲基化标记的全局丢失 [157]。相反,H3G34R/V 的影响仅限于包含突变体的核小体的染色质位点。
7. 表观转录组学:非编码 RNA 领域
1990 年代初以来,随着转基因的引入,植物中报告了基因共抑制现象 [158,159]。一个著名的实验报告了在紫色种群中出现了白色矮牵牛变体。这个过程在植物中被称为转基因诱导的转录后基因沉默(PTGS)和真菌中的消隐 [160],但分子机制多年来一直未知。在植物中,PTGS 也可以由表达宿主基因的病毒引发,称为病毒诱导的基因沉默(VIGS)[161]。
RNA 干扰过程,称为 RNAi,最初是在 1998 年由 Craig Cameron Mello(马萨诸塞大学医学院)的团队在秀丽隐杆线虫中识别的。C.C. Mello 和他的合作者 Andrew Fire 因为这一革命性的发现获得了诺贝尔奖 [162]。
RNAi 导致双链 RNA(dsRNA)被处理成 21-22 个核苷酸的双链 RNA,即小干扰 RNA(siRNA),它既靶向又破坏互补的 mRNA,导致基因沉默。自 1999 年以来已鉴定出参与此过程的蛋白质 [163–167]。实际上,RNAi 缺陷 1(RDE-1)和 Dicer 对 RNAi 至关重要。Dicer 家族成员负责 dsRNA 的处理,并包含一个解旋酶结构域、一个 Piwi/Argonaute/Zwille(PAZ)结构域、两个核糖核酸酶 III 结构域和一个或两个双链 RNA 结合结构域 [167]。
由 siRNA 引导并靶向 mRNA 破坏的多蛋白复合体在 2000 年被描述,并被称为 RNA 诱导的沉默复合体(RISC)[168,169]。在 2001 年,在脊椎动物中鉴定了一类特定类别的非编码 RNA,即 miRNA,表明抑制基因表达是哺乳动物中的生理机制。miRNA 的特性揭示了基因表达在意想不到的水平上受到控制 [170]。
长非编码 RNA(lncRNA)领域的研究始于 1990 年代,当时鉴定了 XIST lncRNA(1991 年)[171] 及其在 X 染色体失活中的主要作用,这一现象由 Marie Lyon 在 1961 年描述 [172],以及之前在 1948 年发现的 Barr 体,但直到发现 XIST 之前,其分子机制仍然未知。随着时间的推移,鉴定了其他几个在 X 染色体失活中起作用的 lncRNA(Tsix, Ftx, Jpx)以及数千个涉及不同基因调控系统的 lncRNA [173–175]。越来越多的证据表明,许多 lncRNA 通过干扰其他非编码 RNA 或通过在染色质上靶向多蛋白复合体的特定角色参与基因调控。
8. 表观转录组学与 RNA 甲基化
目前为止,已经报道了 160 多种 RNA 修饰。其中,RNA 甲基化似乎在 RNA 上普遍存在。然而,尽管 RNA 的甲基化早在 1970 年代初就被几个独立研究小组报道,但由于多年来在体外水平去操纵 RNA 修饰受限于技术瓶颈导致操作十分困难,确定其在细胞中的具体作用机制花费了数十年的时间 [176]。
目前诸多 RNA 修饰中 m6A 修饰最为代表性。这种 RNA 中甲基化修饰比例和丰度很高,大约每 2000 个碱基中有 1 个 m6A,更具体地说,在保守的 Motif 结构 G/A、G/A、A、C、A/C/U(也叫 RRACH motif 结构)中。甲基转移酶样 3(METTL3)是在 1997 年发现的第一个 RNA 甲基转移酶,远早于 2014 年发现的第二个成员 METTL14 [177–179]。METTL3 包含一个 SAM 结合位点和一个催化位点,称为 CMIId 结构域。
类似于 HDM 的晚期鉴定,两种不同的 RNA 去甲基化酶 FTO 和 ALKBH5 由芝加哥大学何川教授课题组和中科院北京基因组研究所的杨云贵课题组在 2012 年和 2014 年被报道 [180,181]。实际上,ALKBH5 包含一个铁结合位点和一个 α- 酮戊二酸相互作用结构域,参与 RNA 去甲基化活性。而 FTO 本身也为 Alkb 家族蛋白成员之一。
2012 年,建立了 m6A 作为 RNA 结合蛋白(ELAV1、YTHD2、YTHD3)的对接位点的角色,这些蛋白可能进一步招募其他蛋白质 [182]。同样,RNA 中的 m5C,一种在 1974 年首次发现的常见表观转录组标记 [183],在 mRNA 和非编码 RNA 中存在,它调节翻译。
然而,这种甲基化修饰究竟作用机制是什么在很大程度上是未知的,并且这种碱基修饰的 Writers 的鉴定直到最近才开始。实际上,与 DNMT2 不同,其在 1998 年报道在 tRNAAsp 的 C38 甲基化中的作用 [184],第一个 NSUN(NOP2/Sun RNA 甲基转移酶)m5C RNA 甲基化酶家族的成员在 2000 年代被鉴定 [185]。2019 年,报道了特定甲基化的 miRNA 在胃肠道癌症中的作用,表明这一过程可能涉及疾病中特定基因表达的调控 [186]。关于 m6A 修饰,联川生物已发表诸多 m6A 修饰的综述论文,欢迎大家点击下方链接进行学习:
万字综述:RNA 修饰 m6A 和 DNA 表观遗传机制之间的关系 | m6A 专题
珍藏版综述:肿瘤 mRNA 和非编码 RNA 的 m6A 修饰 | m6A 专题
9. 表观遗传药物:走向不可或缺的治疗手段
1964 年首次报告了阿扎胞苷的抗癌属性 [187],第一次临床试验始于 1967 年。这种药物在 1971 年获得 FDA 批准,但其作为 DNA 甲基转移酶抑制剂(DNMTi)的角色被忽略了 13 年 [188]。
实际上,高剂量阿扎胞苷的药理作用被认为主要由在 DNA 中形成的能够掩盖通过克隆扩展的耐药细胞的 DNA 去甲基化效应的阿扎胞苷 - DNMT 加合物引起。由于高毒性和对表观遗传学在病理中所扮演角色的相对无知,阿扎胞苷被 FDA 拒绝,并且花了 30 多年才在 2004 年再次获得 FDA 批准,用于治疗骨髓增生异常综合征(MDS)患者。这种分子成为了第一个获准用于这种病理的药物 [189]。
Moshe Szyf 实验室(McGill)是第一个将 DNA 甲基化修饰与病理联系起来的实验室,特别是癌症。Moshe Szyf 很早就预测到,表观遗传药物将在癌症中调节基因表达方面至关重要,并且他创建了第一个药物实验室来开发潜在的临床表观遗传药物。
2006 年,地西他滨也被 FDA 批准,这是另一种 DNMTi,被认为在低剂量下副作用较少。同样,HDAC 抑制剂(HDACi)的生物学效应在它们作为 HDAC 抑制剂的角色被鉴定之前就已经被观察到。实际上,在 1971 年,DMSO 被报道为一种分化诱导剂,几年后,与 DMSO 结构相似的亚胺,亚胺的前体,呈现了类似的效应。
曲古菌素 A(TSA)是第一个在 1990 年被鉴定为 HDACi 的分子 [190]。与地西他滨同时,伏立诺他(vorinostat)在 2006 年获得 FDA 批准,用于治疗 T 细胞淋巴瘤 [191]。很快,几个 HDACi 也被批准用于不同的疾病。
实际上,在过去 5 年中,数十个临床试验测试了许多其他表观遗传药物在多种病理中的使用,单独使用或大多数情况下与其他药物联合使用,包括 HMTi 和 BETi(Bromo 和额外末端抑制剂)。此外 RNA 甲基化 m6A 诸多小分子抑制剂如 METTL3 抑制剂、FTO 抑制剂等也正在相继进入临床试验阶段。
毫无疑问,表观遗传学现在已经进入临床领域,并且在未来可能在病人治疗中发挥重要作用。
英文单词缩写
ARTs:ADP-ribose transferases
BRD1:Bromodomain-containing 1
DNMT:DNA methyl transferase
EZH2:Enhancer of zeste homolog
HAT:Histone acetyltransferase
HDAC:Histone deacetylase
HDM:Histone demethylase
HMG:High-mobility group
HMT:Histone methyl transferase
HP1:Heterochromatin-1
JmjC:Jumonji-like domain C terminus
KDAC:Lysine demethylase
lncRNA:Long non-coding RNA
LSD1:Lysine-specific histone demethylase
MBD:Methyl-binding domain
METTL:Methyltransferase like
RISC:RNA-induced silencing complex
RNAi:RNA interference
SAM:S-adenosyl methionine
SUV39H1:Suppressor _ variegation 3-9 homolog 1
TF:Transcriptional factor
参考文献详细信息请点击:
https://www.mdpi.com/1422-0067/21/20/7571
-
万字综述:1957 年至今跨越 60 年的表观遗传学简史(重点关注 DNA 甲基化和组蛋白修饰)原创 市场部 - SLZ 联川表观 2024 年 05 月 28 日 16:00 浙江
Nature | 改写基因表达的未来:表观遗传编辑技术的突破及其潜力
原创 K 生物探索 2024 年 03 月 04 日 16:59 江苏
引言
在当今医学研究领域,基因沉默技术的发展为治疗各种遗传性和获得性疾病提供了新的可能性。尤其是,永久性表观遗传沉默的概念,即通过修改 DNA 周围的化学结构而非改变 DNA 序列本身来抑制特定基因的表达,为我们提供了一种潜在的治疗手段。这种技术不仅能够靶向并沉默疾病相关基因,还能保留基因组的完整性,减少潜在的遗传风险。
表观遗传编辑技术,尤其是 CRISPR 技术的最新进展,已经显示出在细胞和动物模型中靶向特定基因并实现其沉默的巨大潜力。这一技术的成功应用预示着我们距离实现精准医疗又近了一步,尤其是在遗传性疾病和某些类型的癌症治疗领域。
2 月 28 日Nature的报道的研究 “Durable and efficient gene silencing in vivo by hit-and-run epigenome editing”,围绕一种新型的表观遗传编辑工具 ——进化工程转录抑制因子(EvoETR,evolved engineered transcriptional repressor),通过对 Pcsk9 基因的靶向沉默,不仅验证了这种工具在体内实现基因沉默的能力,而且还证实了其沉默效应的持久性和特异性。Pcsk9 基因作为调节胆固醇代谢的关键因子,其沉默对于治疗高胆固醇血症及其相关心血管疾病具有重要意义。
研究表明,通过一次性的表观遗传编辑,可以实现对 Pcsk9 基因的长期沉默,而且该技术具有较高的安全性和特异性。这些发现不仅为表观遗传编辑技术的临床应用奠定了基础,也为使用该技术治疗其他遗传性和获得性疾病提供了重要的实验数据支持。

表观遗传编辑技术
表观遗传编辑技术是近年来生物医学领域的一大突破,它允许研究人员在不改变 DNA 序列的前提下,调控基因的表达。这项技术的核心在于对基因组周围的化学标记进行精确的修改,从而影响特定基因的活性。其中,CRISPR 技术的发展为表观遗传编辑提供了强有力的工具,使得目标基因的精确编辑成为可能。
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)技术,最初被发现为细菌的一种免疫机制,用以抵御外来病毒。研究人员随后开发出基于 CRISPR 的 Cas9 蛋白质,能够在 DNA 上寻找并切割特定序列,实现基因编辑。表观遗传编辑则进一步扩展了 CRISPR 技术的应用范围,通过将 Cas9 蛋白质与不同的转录调控因子结合,不切割 DNA 链的情况下调控基因的活性。
通过表观遗传编辑实现基因沉默
基因沉默是表观遗传编辑中的一项关键应用,它通过修改 DNA 周围的表观遗传标记来抑制特定基因的表达。这些表观遗传标记包括 DNA 甲基化和组蛋白修饰等,它们影响基因转录的启动和进行。例如,DNA 甲基化通常发生在基因启动子区域,导致转录机制无法识别和结合,从而实现基因的沉默。
表观遗传编辑技术通过精确地定位到目标基因的启动子区域,使用特定的编辑复合物(如融合了转录抑制因子的 dCas9 蛋白)介导甲基化或其他表观遗传修改,从而实现对基因表达的静默。这种技术的优势在于其可逆性和高度的特异性,相比传统的基因敲除技术,表观遗传编辑能够在不改变基因组本身的情况下,实现对疾病相关基因的有效调控。
表观遗传编辑技术的发展为基因治疗领域带来了新的希望,它不仅为研究基因表达调控机制提供了强大的工具,也为治疗遗传性疾病和癌症等疾病开辟了新的途径。随着该技术的不断完善和应用,未来有望实现更加精准和安全的基因治疗策略。
主要的表观遗传编辑工具
表观遗传编辑作为一种前沿科技,其核心在于利用特定的 DNA 结合平台精确调控基因表达,而不改变 DNA 序列本身。
不同的 DNA 结合平台比较
Zinc-finger: 作为一种早期的基因编辑工具,zinc-finger 蛋白可以被设计来识别特定的 DNA 序列。尽管其设计灵活,但在实际应用中,zinc-finger 的特异性和稳定性仍存在局限。
TALEs(Transcription Activator-Like Effectors): 与 zinc-finger 相比,TALEs 提供了更高的定制性和更强的 DNA 结合能力。TALEs 通过其独特的重复序列识别 DNA,使得在基因编辑中具有更高的精确性。
dCas9(deactivated Cas9): 基于 CRISPR-Cas9 系统的 dCas9 技术,通过去活化 Cas9 蛋白的切割功能,保留其 DNA 结合能力,成为了一种高度灵活和特异性强的基因调控工具。dCas9 可与不同的效应器结合,实现基因的激活或沉默。
EvoETR 的设计及其优势
进化工程转录抑制因子(EvoETR,evolved engineered transcriptional repressor)代表了表观遗传编辑工具的新一代。EvoETR 的原理是结合 DNA 结合域(DBD)和效应域(ED)于一个单一分子中,以便靶向和调控特定基因的表达。
DBD 是专门设计的,可以精确结合到基因组中特定的 DNA 序列,确保 EvoETR 能够精准地定位到目标基因。常见的 DBD 包括锌指蛋白(ZFPs)、转录激活样效应子(TALEs)和 CRISPR-Cas9 系统中的 dCas9(催化失活的 Cas9),它们都可以被用来引导 EvoETR 到指定的基因位点。
ED 是负责执行基因沉默功能的部分,通常来自于自然存在的转录抑制因子。在 EvoETR 中,ED 可以通过招募组蛋白修饰酶等机制,在目标基因的启动子区域引入抑制性的表观遗传标记,如组蛋白甲基化,从而抑制基因的表达。
通过将 DBD 和 ED 组合在一个分子中,EvoETR 能够靶向并持久地沉默特定基因的表达,而不需要持续的外源因子介入,这为治疗人类疾病提供了一种新的策略。 EvoETR 的设计旨在提高靶向性和减少脱靶效应,使其成为一种安全且有效的基因调控工具。
该研究中的 EvoETR 结合了 dCas9 的高特异性 DNA 结合能力和先进的转录抑制因子,使其在基因沉默方面展现出卓越的性能,具体表现为:
高度特异性: EvoETR 通过精确设计的 dCas9 与特定基因启动子结合,确保了目标基因沉默的高度特异性,减少了非目标效应的风险。
持久效果: 通过引入先进的转录抑制因子,EvoETR 能在表观遗传层面实现基因的持久沉默,即使在细胞分裂过程中也能保持沉默状态。
广泛适用性: EvoETR 的设计不仅适用于人类细胞,也能在多种模型生物中有效应用,为基因疗法的研究与开发提供了广阔的平台。
安全性: 与传统的基因剪切技术相比,EvoETR 通过表观遗传层面调控基因表达,避免了对 DNA 序列的直接修改,从而提高了治疗的安全性。
Pcsk9 基因沉默的研究
研究选择 Pcsk9 基因作为目标基因进行研究,原因在于其在调节血浆胆固醇水平、尤其是低密度脂蛋白胆固醇(LDL-C)中的重要作用。Pcsk9 基因编码的蛋白能够促进 LDL 受体的降解,减少肝细胞表面的 LDL 受体数量,从而影响血浆中 LDL-C 的清除。因此,Pcsk9 的功能失调与多种心血管疾病的风险增加密切相关。
编辑工具的选择与优化
研究团队首先评估了多种表观遗传编辑工具,包括 zinc-finger、TALEs 以及 dCas9 系统,最终选择了具有高特异性和高编辑效率的进化工程转录抑制因子(EvoETR)进行进一步研究。EvoETR 的设计旨在通过特定的表观遗传标记,如 DNA 甲基化,实现对 Pcsk9 基因的靶向沉默。
编辑效率的评估: 通过定量 PCR 技术,测量每种编辑工具对 Pcsk9 基因表达水平的影响,从而评估其沉默效率。
特异性分析: 通过全基因组测序技术,分析每种编辑工具可能引起的非目标效应,以确保编辑的特异性。
载体选择与优化: 考虑到递送效率和细胞毒性,对携带编辑工具的载体系统进行了筛选和优化。
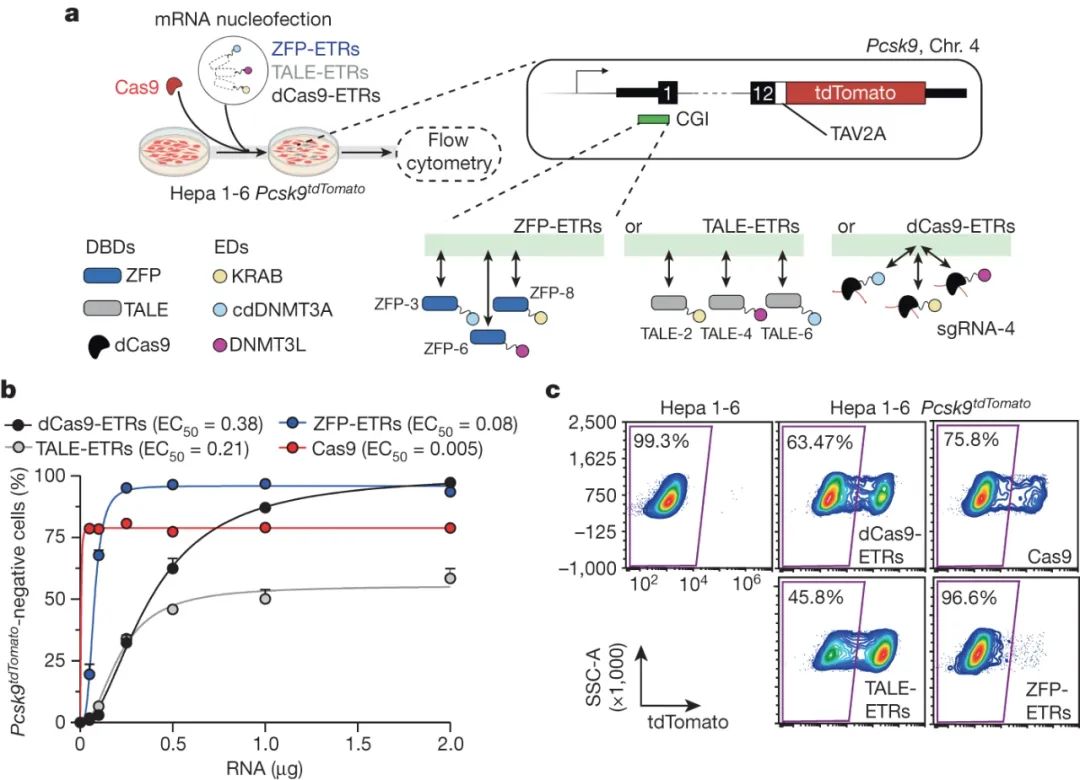
在 Hepa 1-6 Pcsk9 细胞中进行的筛选(Credit:Nature)
体外筛选
在进行体内实验之前,研究团队在体外细胞模型中对 EvoETR 的效率和特异性进行了筛选和验证。通过对不同设计的 EvoETR 进行比较,确定了最优化的编辑器配置。
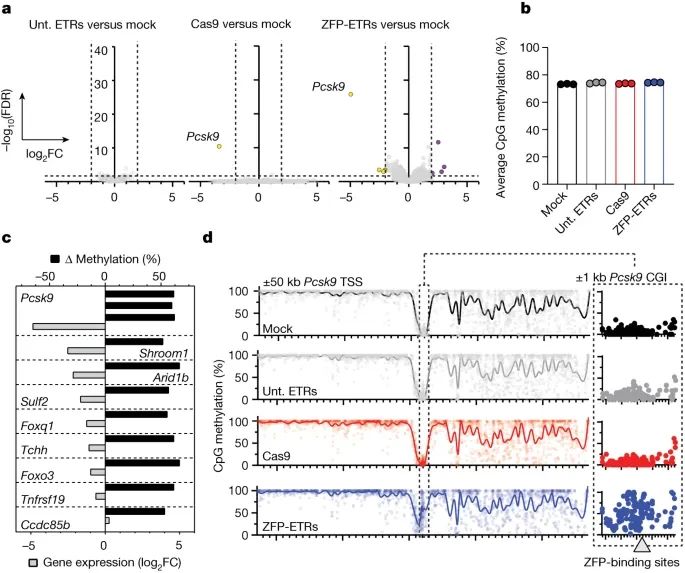
通过基于 ZFP 的 ETRs 对 Pcsk9 进行表观沉默后,实现针对性转录的下调,同时最小化脱靶效应(Credit:Nature)
体内实验设计
确定最佳编辑器后,研究团队在小鼠模型中进行了体内实验,旨在评估 EvoETR 对 Pcsk9 基因沉默的效率及其对血浆 LDL-C 水平的影响。实验设计包括对照组和实验组,其中实验组小鼠通过尾静脉注射接收含有 EvoETR 的脂质纳米粒子(LNP)。在注射后的不同时间点,收集小鼠的血液样本,通过 ELISA 技术测定血浆中 PCSK9 蛋白的水平,以评估基因沉默的效率。同时,通过 PCR 技术监测 Pcsk9 基因的表达水平,以评估基因沉默的持续性。
安全性与特异性分析
在进行表观遗传编辑的实验过程中,确保编辑操作的安全性与特异性是至关重要的。
编辑特异性和潜在的脱靶效应
特异性分析方法: 研究人员采用了高通量测序技术,对编辑操作后的基因组进行了全面扫描,以识别可能的非目标编辑事件。此外,通过比对处理组与对照组的基因表达谱,进一步验证编辑的特异性。
非目标效应评估: 尽管 EvoETR 显示出高度的特异性,但在极少数情况下,研究人员仍观察到了微弱的非目标编辑活动。这些非目标效应主要集中在基因组的非编码区域,且对细胞功能和生理状态的影响极小。
风险管理措施: 针对检测到的非目标效应,研究人员采取了一系列风险管理措施,包括优化编辑器设计、提高递送系统的精准度,以及开发更为严格的筛选标准,确保治疗的安全性。
治疗后肝脏再生能力的保持
再生能力评估方法: 通过对小鼠模型进行长期跟踪观察,评估了 EvoETR 编辑操作后肝脏的再生能力。特别是,研究人员监测了肝脏损伤后的自然恢复过程,以及肝功能指标的变化情况。
实验结果: EvoETR 处理后的小鼠,其肝脏的再生能力未受明显影响。肝功能指标(如 ALT、AST 水平)与对照组相比,没有显著差异,表明编辑操作不会损害肝脏的自我修复能力。
这一发现对于表观遗传编辑技术的临床应用具有重要意义,说明了其在保持器官功能方面的安全性。
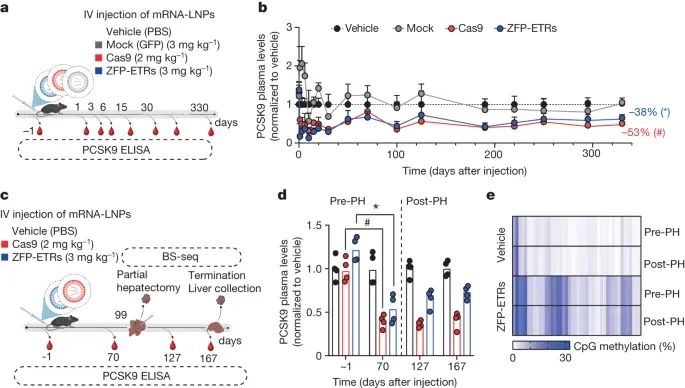
经过脂质体介导的 ZFP-ETRs 输送后,在小鼠肝脏中对 Pcsk9 进行持久的表观遗传沉默(Credit:Nature)
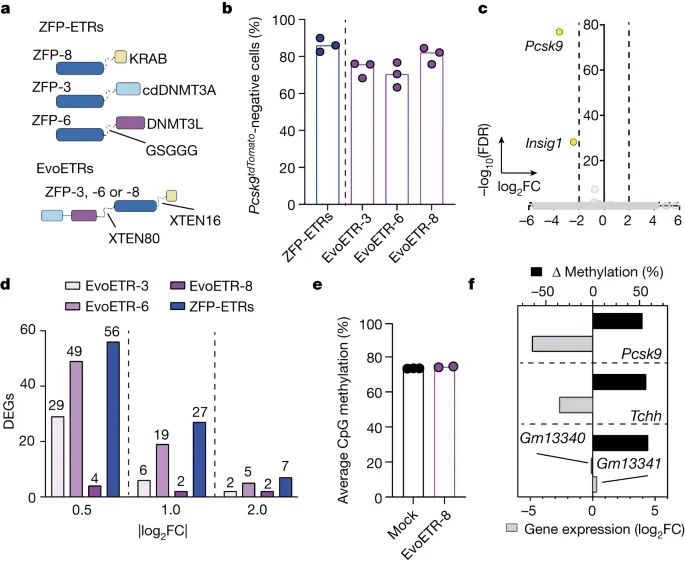
EvoETRs 的体外功效和特异性分析(Credit:Nature)
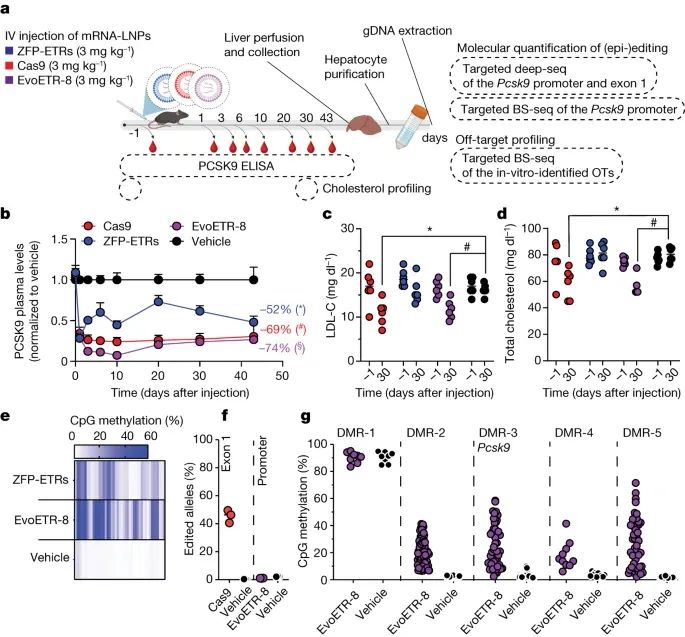
在通过 LNP 介导的 EvoETR-8 传递后,Pcsk9 在体内的表达被显著抑制(Credit:Nature)
研究的意义与应用潜力
表观遗传编辑技术,尤其是通过进化工程转录抑制因子(EvoETR)实现的基因沉默,已经展示出其在医学研究和疾病治疗中的巨大潜力。这项技术不仅为我们提供了一种精准调控基因表达的方法,而且还开辟了一条通往一次性治疗多种遗传性和后天性疾病的新途径。
疾病治疗中的应用前景
遗传性疾病的治疗: 对于那些由特定基因突变引起的遗传性疾病,表观遗传编辑技术能够直接靶向并沉默这些致病基因,从而根除疾病的根本原因。
癌症治疗: 通过精准地调控癌细胞中的关键基因,例如促癌基因或肿瘤抑制基因,表观遗传编辑有望成为一种有效的癌症治疗手段,尤其是在传统治疗(如化疗和放疗)效果不佳的情况下。
感染性疾病的治疗: 针对某些病毒性疾病,例如 HIV/AIDS,表观遗传编辑技术可以通过靶向并沉默病毒 DNA 来阻断病毒复制,为治疗提供新的策略。
一次性治疗的可能性和优势
持久效果:与传统的基因编辑技术相比,表观遗传编辑通过修改染色质结构而非 DNA 序列本身,可以实现长期甚至永久性的基因沉默,从而为患者提供一次性治疗的可能。
安全性:由于不直接改变 DNA 序列,表观遗传编辑减少了潜在的基因组不稳定性和非目标效应,提高了治疗的安全性。
可逆性:相较于永久改变 DNA 序列的 CRISPR/Cas9 系统,表观遗传编辑的效果理论上是可逆的,这为控制和调节治疗提供了更大的灵活性。
当前技术的局限性
编辑效率和特异性: 虽然现有技术已经能够实现相对高效和特异性的基因沉默,但在不同细胞类型和生物体中的效率及特异性仍有待提高。
长期安全性: 关于长期对宿主基因组可能产生的影响,特别是潜在的非目标效应和基因组稳定性问题,尚需进一步研究和监测。
临床应用的复杂性: 从体外实验到临床应用存在许多挑战,包括但不限于递送系统的选择、免疫原性问题以及个体差异的考量。
需要进一步研究的问题
递送系统的优化: 开发更为高效、安全的递送系统,以确保编辑工具能够精确地到达目标细胞,是实现表观遗传编辑临床应用的关键。
脱靶效应的最小化: 通过改进编辑工具的设计和优化编辑条件,进一步降低非目标效应,提高治疗的安全性。
多基因疾病的治疗策略: 对于涉及多个基因的复杂疾病,如何有效整合表观遗传编辑技术,实现对多个目标基因的精准调控。
未来表观遗传编辑技术可能的发展方向
个体化医疗: 结合个体的遗传背景和疾病特性,定制化设计编辑策略,实现更为精准的治疗。
组合治疗: 与传统治疗方法(如化疗、放疗)或其他新兴治疗技术(如免疫疗法)结合,以提高治疗效果和患者的生存率。
智能生物材料的开发: 开发新型生物材料作为递送载体,提高编辑工具在体内的稳定性和递送效率。
伦理和法律框架的完善: 随着技术的发展和应用,建立相应的伦理和法律框架以指导研究和临床应用,保护患者权益,是不可或缺的。
Q&A
表观遗传编辑与传统基因编辑有何不同?
表观遗传编辑技术和传统基因编辑技术在目标和机制上存在本质的区别。传统基因编辑,如 CRISPR-Cas9 系统,直接在 DNA 序列层面进行切割或替换,从而改变基因的表达或功能。相比之下,表观遗传编辑不直接改变 DNA 序列,而是通过修改 DNA 周围的化学标记(如甲基化或乙酰化),影响基因的活性而不改变其编码信息。这种方法允许更为精细的基因表达调控,减少了永久性基因改变带来的风险。
EvoETR 是如何设计的,其优势在哪里?
进化工程转录抑制因子(EvoETR)是一种创新的表观遗传编辑工具,通过筛选和优化特定的转录抑制因子,实现对目标基因表达的高效沉默。EvoETR 的设计过程包括使用高通量筛选技术从广泛的候选因子中选择具有最佳编辑活性和特异性的因子,然后通过进化工程进一步增强其性能。
EvoETR 的主要优势在于其高度的特异性和调控的可逆性。与传统基因编辑工具相比,EvoETR 能够精确地靶向特定基因,减少非目标效应的风险,同时其对基因表达的调控是可逆的,为未来的治疗提供了更多的灵活性和安全保障。此外,EvoETR 在没有外部切割酶介入的情况下实现基因沉默,避免了 DNA 损伤和潜在的基因组不稳定性,从而为患者提供了一种更为安全的治疗选项。
在体内实验中如何确保编辑的特异性和安全性?
在体内实验中确保编辑特异性和安全性是表观遗传编辑技术研发的重中之重。为此,研究人员采用了多项策略来最小化潜在的风险。首先,通过精确设计编辑工具的靶向序列,确保其能够特异性地识别并作用于目标基因,避免对非目标基因产生影响。其次,利用高通量测序技术对编辑后的细胞进行全面分析,评估非目标效应的发生情况。此外,通过在动物模型中进行长期的安全性跟踪,评估编辑操作对生物体健康的长期影响。
表观遗传编辑在临床应用中面临的主要挑战是什么?
表观遗传编辑技术虽然展现出巨大的潜力,但在临床应用中仍面临多重挑战。首先,编辑效率和特异性的进一步提升仍是研究的重点,需要开发出更为精确和高效的编辑系统。其次,编辑工具的递送方式也是一个重大挑战,如何确保编辑工具能够安全、有效地到达目标细胞并执行其功能,需要进一步的技术创新。此外,长期安全性和潜在的免疫反应问题也需要在临床前和临床试验中得到充分考虑和评估。最后,伦理和法律问题也是表观遗传编辑技术面临的重要挑战,需要在技术发展的同时,建立相应的伦理指南和法律框架,以确保技术的安全和负责任的应用。
原文链接
-
Durable and efficient gene silencing in vivo by hit-and-run epigenome editing | Nature
Cappelluti MA, Mollica Poeta V, Valsoni S, et al.
Published online February 28, 2024. doi:10.1038/s41586-024-07087-8
责编 | 探索君
排版 | 探索君
来源【生物探索】
via:
-
Nature | 改写基因表达的未来:表观遗传编辑技术的突破及其潜力 原创 K 生物探索 2024 年 03 月 04 日 16:59 江苏
表观遗传修饰研究进展
原创 庞景杰 文献与实验 2024 年 04 月 17 日 09:40 河南
表观遗传修饰研究进展
摘要:
表观遗传学是一门研究基因表达调控的科学,它揭示了基因表达可以受到基因序列之外的因素影响。表观遗传修饰是指对基因表达的调控,通过化学修饰改变染色体上的 DNA 和蛋白质,从而影响基因的表达。这种修饰可以影响基因的转录、剪接、稳定性、翻译、核小体组装和染色质结构等多个层面。本文综述了近年来表观遗传修饰研究的主要进展,包括 DNA 甲基化、组蛋白修饰、非编码 RNA、RNA 修饰和染色质重塑等方面的研究。
1. 引言
表观遗传学是一门新兴的生物学分支,它专注于研究基因表达的调控机制,特别是那些不涉及 DNA 序列改变的调控方式。这一领域的研究揭示了一个重要的生物学现象:基因的表达不仅仅受到遗传序列的控制,还可以受到环境因素的影响。这种调控方式对于生物体的发育、健康和疾病等方面都有着深远的影响。
表观遗传修饰是指在不改变 DNA 序列的前提下,通过化学修饰来调控基因表达的过程。这些化学修饰主要包括 DNA 甲基化、组蛋白修饰和非编码 RNA 的调控等。这些修饰可以单独或共同作用于基因表达的不同阶段,从而实现对基因活性的精细调控。
首先,DNA 甲基化是一种常见的表观遗传修饰方式,它涉及到在胞嘧啶(Cytosine)的碳 5 位上添加甲基基团。这种修饰通常发生在 CpG 岛上,CpG 岛是指基因启动子区域富含 CpG 双核苷酸对的区域。当 CpG 岛发生甲基化时,通常会导致相应基因的沉默,即该基因的表达被抑制。DNA 甲基化在胚胎发育、细胞分化以及 X 染色体失活等过程中起着关键作用。
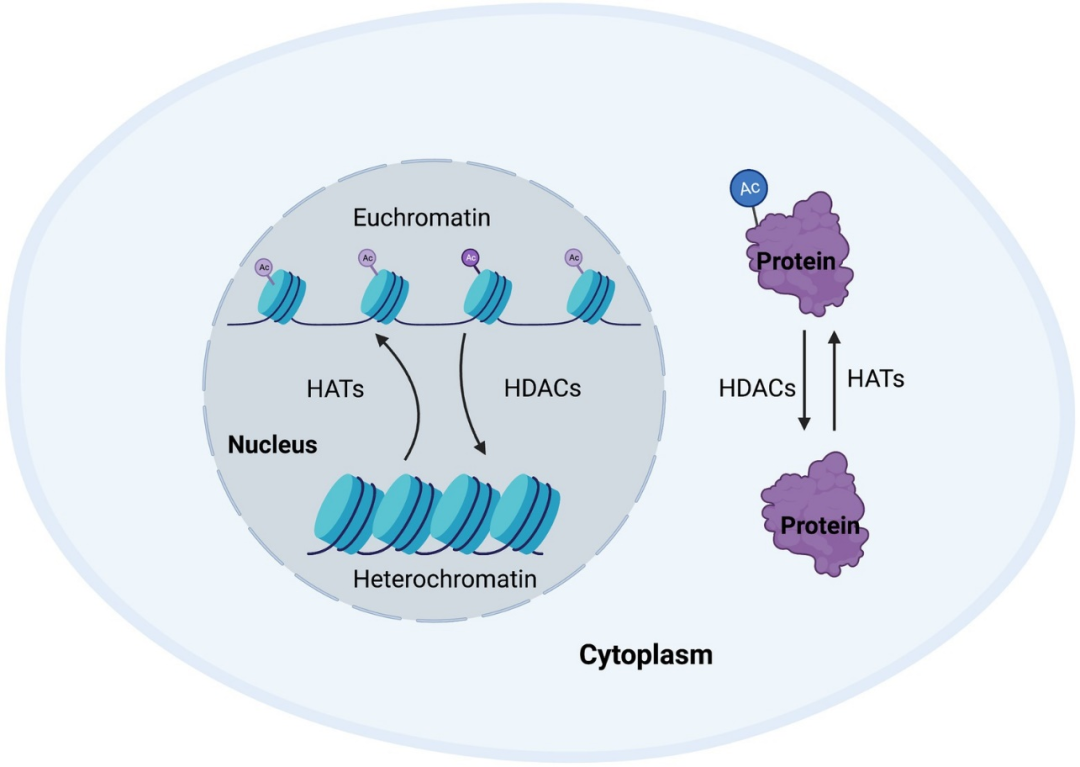
其次,组蛋白修饰也是表观遗传调控的重要方式。组蛋白是 DNA 的包装蛋白,它们与 DNA 一起构成了染色体的基本结构单元 —— 核小体。组蛋白可以通过乙酰化、甲基化、磷酸化等多种方式被修饰。这些修饰可以改变核小体的紧密程度,从而影响 DNA 的可及性和基因的转录活性。例如,组蛋白乙酰化通常与基因激活相关,因为它减少了核小体的紧密程度,使得转录因子更容易接触到 DNA。
除了 DNA 甲基化和组蛋白修饰,非编码 RNA 也在表观遗传调控中扮演着重要角色。非编码 RNA 是指不编码蛋白质的 RNA 分子,它们可以通过多种机制影响基因表达。例如,microRNA(miRNA)可以通过与靶 mRNA 的 3’ 非翻译区结合,导致 mRNA 的降解或抑制其翻译。长非编码 RNA(lncRNA)则可以通过影响染色质结构、调控基因剪接或参与转录调控复合体的形成等多种方式,来影响基因的表达。
表观遗传修饰的动态变化对于生物体的发育和适应环境至关重要。在胚胎发育过程中,精确的表观遗传调控确保了细胞分化和组织特化的正常进行。在成年期,表观遗传修饰的变化则与个体对环境变化的适应密切相关。例如,营养状况、压力、毒素暴露等环境因素都可以影响表观遗传修饰的模式,进而影响个体的健康状况和疾病风险。
此外,表观遗传学的研究还为疾病的预防和治疗提供了新的视角。许多疾病的发生与表观遗传修饰的异常有关,包括癌症、神经退行性疾病、心血管疾病等。通过研究这些疾病的表观遗传机制,科学家们有望开发出新的治疗方法,例如通过药物干预表观遗传修饰过程,来治疗或预防这些疾病。
总之,表观遗传学是一门极具前景的科学领域,它不仅为我们理解基因表达调控的复杂性提供了新的视角,也为疾病的预防和治疗带来了新的希望。
2. DNA 甲基化
DNA 甲基化是表观遗传修饰中最为人熟知的机制之一。它在生物体的发育、细胞分化、基因组稳定性和疾病发生等过程中起到重要作用。本文将详细探讨 DNA 甲基化的机制、生物学意义以及近年来在研究中的进展。
2.1 DNA 甲基化的机制
DNA 甲基化是指在 DNA 分子上加上一个甲基基团,通常发生在 CpG 二核苷酸上。CpG 岛是指在基因组中连续出现多个 CpG 二核苷酸的区域,通常富含非甲基化的 CpG 二核苷酸。DNA 甲基化主要由 DNA 甲基转移酶(DNMTs)催化完成。人类有三种主要的 DNMTs,分别是 DNMT1、DNMT3A 和 DNMT3B。其中,DNMT1 主要负责维持甲基化模式,而 DNMT3A 和 DNMT3B 则负责新的甲基化。
DNMTs 通过识别特定的 DNA 序列,将甲基基团转移到 DNA 的 5’- 端胞嘧啶上,从而实现 DNA 甲基化。DNA 甲基化是一个动态的过程,既可以发生在细胞分裂的间期,也可以发生在细胞分裂的周期中。DNA 甲基化的生物学意义在于,它可以通过影响染色质的结构和紧密度,进而影响基因的表达。
2.2 DNA 甲基化的生物学意义
DNA 甲基化在生物体的发育和细胞分化过程中起到重要作用。在发育过程中,DNA 甲基化模式的改变与细胞分化的命运决定密切相关。例如,在胚胎干细胞分化为特定细胞类型的过程中,DNA 甲基化的模式会发生改变,从而实现基因表达的调控。在细胞分化过程中,DNA 甲基化可以抑制某些基因的表达,从而使细胞获得特定的功能和特性。
DNA 甲基化在基因组稳定性中也起到重要作用。DNA 甲基化可以抑制基因表达,从而减少基因产物的合成,降低基因组的不稳定性。此外,DNA 甲基化还可以影响 DNA 的修复过程,进一步维持基因组的稳定性。
DNA 甲基化与疾病发生密切相关。许多疾病,如癌症、神经系统疾病和免疫系统疾病等,都与 DNA 甲基化的异常有关。例如,在癌症中,DNA 甲基化的异常可以导致基因的异常表达,促进肿瘤的发生和发展。在神经系统疾病中,DNA 甲基化的异常可以影响神经元的行为和功能。在免疫系统疾病中,DNA 甲基化的异常可以影响免疫细胞的发育和功能。
2.3 DNA 甲基化的研究进展
近年来,随着高通量测序技术的发展,对 DNA 甲基化的研究越来越深入。例如,通过高通量测序技术,可以研究 DNA 甲基化的全基因组分布。通过 RRBS(重亚硫酸盐测序)和 WGBS(全基因组甲基化测序)等技术,可以研究 DNA 甲基化与基因表达的关系。
此外,研究者还开发了许多生物信息学方法,用于分析 DNA 甲基化的数据。例如,研究者可以通过拟南芥、哺乳动物细胞等模型系统,研究 DNA 甲基化在特定生物学过程中的作用。通过比较不同样本的 DNA 甲基化数据,研究者可以揭示 DNA 甲基化与疾病发生的关系,为疾病的诊断和治疗提供新的思路和方法。
DNA 甲基化是表观遗传修饰中最重要的机制之一,它在生物体的发育、细胞分化、基因组稳定性和疾病发生等过程中起到重要作用。近年来,随着高通量测序技术的发展,对 DNA 甲基化的研究越来越深入。
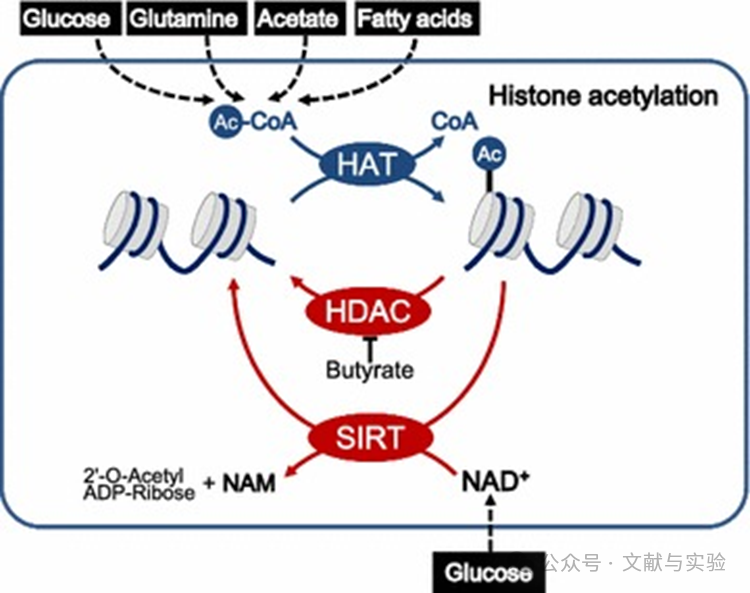
参考文献:10.1186/s40880-018-0302-3
癌细胞将营养状态与组蛋白乙酰化相协调。癌细胞根据不同碳源的可用性改变组蛋白乙酰化。Ac-CoA 是乙酰辅酶 A,HAT 是组蛋白乙酰转移酶,HDAC 是组蛋白去乙酰化酶,SIRT 是依赖 NAD + 的脱乙酰酶家族成员,NAM 是烟酰胺。
3. 组蛋白修饰
组蛋白修饰是指对组蛋白进行翻译后修饰,包括乙酰化、甲基化、泛素化等,可以影响染色质的结构和紧密度,进而影响基因表达。组蛋白修饰是表观遗传学中的一个重要研究领域,对于理解基因表达调控的机制具有重要意义。
3.1 组蛋白修饰的类型
组蛋白修饰主要包括乙酰化、甲基化、泛素化等类型。乙酰化是指在组蛋白的赖氨酸残基上加上乙酰基团,通常由组蛋白乙酰转移酶(HATs)催化完成。乙酰化可以增加组蛋白的柔性,促进染色质的开放,从而有利于基因的转录。甲基化是指在组蛋白的赖氨酸或精氨酸残基上加上甲基基团,通常由组蛋白甲基转移酶(HMTs)催化完成。甲基化可以改变组蛋白的电荷性质,进而影响染色质的结构和紧密度。泛素化是指在组蛋白的赖氨酸残基上加上泛素化链,通常由泛素化酶(E3 ligases)催化完成。泛素化可以促进组蛋白的降解或招募其他蛋白质,从而影响基因表达。
3.2 组蛋白修饰的关键酶类
组蛋白修饰的实现依赖于一系列关键酶类。组蛋白乙酰化主要通过组蛋白乙酰转移酶(HATs)和去乙酰化酶(HDACs)调控。HATs 可以催化组蛋白的乙酰化,而 HDACs 可以催化组蛋白的去乙酰化。组蛋白甲基化主要通过组蛋白甲基转移酶(HMTs)和组蛋白去甲基化酶(HDMs)调控。HMTs 可以催化组蛋白的甲基化,而 HDMs 可以催化组蛋白的去甲基化。泛素化主要通过泛素化酶(E3 ligases)和脱泛素化酶(deubiquitinases)调控。泛素化酶可以催化组蛋白的泛素化,而脱泛素化酶可以催化组蛋白的去泛素化。
3.3 组蛋白修饰的生物学意义
组蛋白修饰在生物体的发育、细胞分化、基因组稳定性和疾病发生等过程中起到重要作用。在发育过程中,组蛋白修饰的改变与细胞分化的命运决定密切相关。例如,在胚胎干细胞分化为特定细胞类型的过程中,组蛋白修饰的模式会发生改变,从而实现基因表达的调控。在细胞分化过程中,组蛋白修饰可以影响某些基因的表达,从而使细胞获得特定的功能和特性。
组蛋白修饰在基因组稳定性中也起到重要作用。组蛋白修饰可以影响染色质的结构和紧密度,从而影响 DNA 的复制和修复过程。此外,组蛋白修饰还可以影响转录因子的招募和 DNA 的甲基化过程,进一步维持基因组的稳定性。
组蛋白修饰与疾病发生密切相关。许多疾病,如癌症、神经系统疾病和免疫系统疾病等,都与组蛋白修饰的异常有关。例如,在癌症中,组蛋白修饰的异常可以导致基因的异常表达,促进肿瘤的发生和发展。在神经系统疾病中,组蛋白修饰的异常可以影响神经元的行为和功能。在免疫系统疾病中,组蛋白修饰的异常可以影响免疫细胞的发育和功能。
3.4 组蛋白修饰的研究进展
近年来,随着高通量测序技术的发展,对组蛋白修饰的研究越来越深入。例如,通过高通量测序技术,可以研究组蛋白修饰的全基因组分布。通过 ChIP-seq 等技术,可以研究组蛋白修饰与基因表达的关系。此外,研究者还开发了许多生物信息学方法,用于分析组蛋白修饰的数据。例如,研究者可以通过比较不同样本的组蛋白修饰数据,揭示组蛋白修饰与疾病发生的关系,为疾病的诊断和治疗提供新的思路和方法。
4. 非编码 RNA
非编码 RNA (ncRNA) 是一类不编码蛋白质的 RNA 分子,它们在基因表达调控中发挥着重要作用。近年来,越来越多的研究表明,ncRNA 还在表观遗传修饰中起到关键作用,通过与 DNA、RNA 和蛋白质相互作用,影响表观遗传修饰的过程。本文将详细探讨非编码 RNA 在表观遗传修饰中的作用机制、生物学意义以及近年来在研究中的进展。
$## 4.1 非编码 RNA 的分类
非编码 RNA 可以分为两大类:小 RNA 和非小 RNA。小 RNA 主要包括 microRNA (miRNA)、小干扰 RNA (siRNA)、PIWI 相互作用 RNA (piRNA) 等,长度通常在 20-25 个核苷酸之间。非小 RNA 主要包括长链非编码 RNA (lncRNA)、环状 RNA (circRNA) 等,长度通常超过 200 个核苷酸。
4.2 非编码 RNA 在表观遗传修饰中的作用机制
非编码 RNA 可以通过多种机制参与表观遗传修饰。首先,非编码 RNA 可以作为引导分子,帮助 DNA 甲基化酶、组蛋白修饰酶等定位到特定的基因区域。例如,一些非编码 RNA 可以通过与 DNA 甲基化酶的结合,引导它们定位到特定的基因序列,从而实现 DNA 甲基化。此外,一些非编码 RNA 可以通过与组蛋白修饰酶的结合,引导它们定位到特定的基因区域,从而实现组蛋白修饰。
其次,非编码 RNA 可以通过与 DNA、RNA 和蛋白质的相互作用,直接影响表观遗传修饰的过程。例如,一些非编码 RNA 可以通过与 DNA 的结合,改变 DNA 的构象和稳定性,进而影响染色质的结构和基因的表达。一些非编码 RNA 可以通过与 RNA 的结合,影响 RNA 的稳定性和加工过程,进而影响基因的表达。一些非编码 RNA 可以通过与蛋白质的结合,影响蛋白质的活性和功能,进而影响基因的表达。
4.3 非编码 RNA 的生物学意义
非编码 RNA 在生物体的发育、细胞分化、基因组稳定性和疾病发生等过程中起到重要作用。在发育过程中,非编码 RNA 的改变与细胞分化的命运决定密切相关。例如,在胚胎干细胞分化为特定细胞类型的过程中,非编码 RNA 的表达模式会发生改变,从而实现基因表达的调控。在细胞分化过程中,非编码 RNA 可以影响某些基因的表达,从而使细胞获得特定的功能和特性。
非编码 RNA 在基因组稳定性中也起到重要作用。非编码 RNA 可以通过影响染色质的结构和基因的表达,从而影响 DNA 的复制和修复过程。此外,非编码 RNA 还可以通过影响转录因子的招募和 DNA 的甲基化过程,进一步维持基因组的稳定性。
非编码 RNA 与疾病发生密切相关。许多疾病,如癌症、神经系统疾病和免疫系统疾病等,都与非编码 RNA 的异常表达有关。例如,在癌症中,非编码 RNA 的表达失调可以导致基因的异常表达,促进肿瘤的发生和发展。在神经系统疾病中,非编码 RNA 的表达失调可以影响神经元的行为和功能。在免疫系统疾病中,非编码 RNA 的表达失调可以影响免疫细胞的发育和功能。
4.4 非编码 RNA 的研究进展
近年来,随着高通量测序技术的发展,对非编码 RNA 的研究越来越深入。例如,通过高通量测序技术,可以研究非编码 RNA 的全基因组表达谱。通过 RNA-seq 等技术,可以研究非编码 RNA 与基因表达的关系。此外,研究者还开发了许多生物信息学方法,用于分析非编码 RNA 的数据。例如,研究者可以通过比较不同样本的非编码 RNA 数据,揭示非编码 RNA 与疾病发生的关系,为疾病的诊断和治疗提供新的思路和方法。
非编码 RNA 是一类重要的分子,它们在基因表达调控中发挥着重要作用。近年来,越来越多的研究表明,非编码 RNA 还在表观遗传修饰中起到关键作用,通过与 DNA、RNA 和蛋白质相互作用,影响表观遗传修饰的过程。
5. RNA 修饰
RNA 修饰是指对 RNA 分子进行化学修饰,包括剪接、编辑、甲基化等,可以影响 RNA 的稳定性和功能。RNA 修饰是基因表达调控中的一个重要环节,对于理解基因表达调控的机制具有重要意义。本文将详细探讨 RNA 修饰的类型、机制、生物学意义以及近年来在研究中的进展。
5.1 RNA 修饰的类型
RNA 修饰主要包括剪接、编辑、甲基化等类型。剪接是指在 RNA 加工过程中,将前体 RNA 中的内含子去除,留下外显子,形成成熟的 mRNA。编辑是指在 RNA 加工过程中,对 RNA 分子进行化学修饰,如腺苷酸化、胞苷酸化等。甲基化是指在 RNA 分子的某些核苷酸上加上甲基基团,如甲基化胞苷酸化等。
5.2 RNA 修饰的机制
RNA 修饰的实现依赖于一系列关键酶类。剪接主要通过剪接酶催化完成。剪接酶可以识别前体 RNA 中的内含子和外显子,将内含子去除,留下外显子。编辑主要通过 RNA 编辑酶催化完成。RNA 编辑酶可以识别 RNA 分子中的特定核苷酸,对其进行化学修饰。甲基化主要通过甲基化酶催化完成。甲基化酶可以识别 RNA 分子中的特定核苷酸,在其上加上甲基基团。
5.3 RNA 修饰的生物学意义
RNA 修饰在生物体的发育、细胞分化、基因组稳定性和疾病发生等过程中起到重要作用。在发育过程中,RNA 修饰的改变与细胞分化的命运决定密切相关。例如,在胚胎干细胞分化为特定细胞类型的过程中,RNA 修饰的模式会发生改变,从而实现基因表达的调控。在细胞分化过程中,RNA 修饰可以影响某些基因的表达,从而使细胞获得特定的功能和特性。
RNA 修饰在基因组稳定性中也起到重要作用。RNA 修饰可以影响 RNA 的稳定性和功能,从而影响基因的表达和调控。此外,RNA 修饰还可以影响转录因子的招募和 DNA 的甲基化过程,进一步维持基因组的稳定性。
RNA 修饰与疾病发生密切相关。许多疾病,如癌症、神经系统疾病和免疫系统疾病等,都与 RNA 修饰的异常有关。例如,在癌症中,RNA 修饰的异常可以导致基因的异常表达,促进肿瘤的发生和发展。在神经系统疾病中,RNA 修饰的异常可以影响神经元的行为和功能。在免疫系统疾病中,RNA 修饰的异常可以影响免疫细胞的发育和功能。
5.4 RNA 修饰的研究进展
近年来,随着高通量测序技术的发展,对 RNA 修饰的研究越来越深入。例如,通过高通量测序技术,可以研究 RNA 修饰的全基因组分布。通过 RIP-seq 和 RNA-seq 等技术,可以研究 RNA 修饰与基因表达的关系。此外,研究者还开发了许多生物信息学方法,用于分析 RNA 修饰的数据。例如,研究者可以通过比较不同样本的 RNA 修饰数据,揭示 RNA 修饰与疾病发生的关系,为疾病的诊断和治疗提供新的思路和方法。

参考文献:10.1186/s40880-018-0302-3
肿瘤代谢物的产生扰乱了癌症的表观遗传学。代谢酶 IDH、FH 和 SDH 的突变(红色)分别促进了肿瘤代谢物 2-HG、延胡索酸和琥珀酸的生成。低氧条件下,LDH 和 MDH(灰色)产生 2-HG,它作为 α- 酮戊二酸依赖性双加氧酶的竞争性抑制剂,扰乱了 DNA 和组蛋白的甲基化。这导致异常的基因表达和癌症的发生。
6. 染色质重塑
染色质重塑是指染色质结构的变化,包括核小体的组装和解聚,以及染色质的紧密度变化。染色质重塑是表观遗传学中的一个重要研究领域,对于理解基因表达调控的机制具有重要意义。本文将详细探讨染色质重塑的类型、机制、生物学意义以及近年来在研究中的进展。
6.1 染色质重塑的类型
染色质重塑主要包括核小体定位、染色质 looping 和染色质开放等类型。核小体定位是指通过改变核小体的组装和解聚,改变染色质的结构。染色质 looping 是指通过染色质 looping,将远距离的基因连接在一起,形成染色质环。染色质开放是指通过改变染色质的紧密度,使染色质更加开放,有利于基因的转录。
6.2 染色质重塑的机制
染色质重塑的实现依赖于一系列关键酶类。核小体定位主要通过染色质重塑酶催化完成。染色质重塑酶可以识别特定的 DNA 序列,改变核小体的组装和解聚,从而改变染色质的结构。染色质 looping 主要通过染色质环化酶催化完成。染色质环化酶可以识别远距离的 DNA 序列,将它们连接在一起,形成染色质环。染色质开放主要通过染色质解聚酶催化完成。染色质解聚酶可以识别染色质的紧密区域,将其解聚,使染色质更加开放。
6.3 染色质重塑的生物学意义
染色质重塑在生物体的发育、细胞分化、基因组稳定性和疾病发生等过程中起到重要作用。在发育过程中,染色质重塑的改变与细胞分化的命运决定密切相关。例如,在胚胎干细胞分化为特定细胞类型的过程中,染色质重塑的模式会发生改变,从而实现基因表达的调控。在细胞分化过程中,染色质重塑可以影响某些基因的表达,从而使细胞获得特定的功能和特性。
染色质重塑在基因组稳定性中也起到重要作用。染色质重塑可以影响染色质的结构和基因的表达,从而影响 DNA 的复制和修复过程。此外,染色质重塑还可以影响转录因子的招募和 DNA 的甲基化过程,进一步维持基因组的稳定性。
染色质重塑与疾病发生密切相关。许多疾病,如癌症、神经系统疾病和免疫系统疾病等,都与染色质重塑的异常有关。例如,在癌症中,染色质重塑的异常可以导致基因的异常表达,促进肿瘤的发生和发展。在神经系统疾病中,染色质重塑的异常可以影响神经元的行为和功能。在免疫系统疾病中,染色质重塑的异常可以影响免疫细胞的发育和功能。
6.4 染色质重塑的研究进展
近年来,随着高通量测序技术的发展,对染色质重塑的研究越来越深入。例如,通过高通量测序技术,可以研究染色质重塑的全基因组分布。通过 ChIP-seq 等技术,可以研究染色质重塑与基因表达的关系。此外,研究者还开发了许多生物信息学方法,用于分析染色质重塑的数据。例如,研究者可以通过比较不同样本的染色质重塑数据,揭示染色质重塑与疾病发生的关系,为疾病的诊断和治疗提供新的思路和方法。
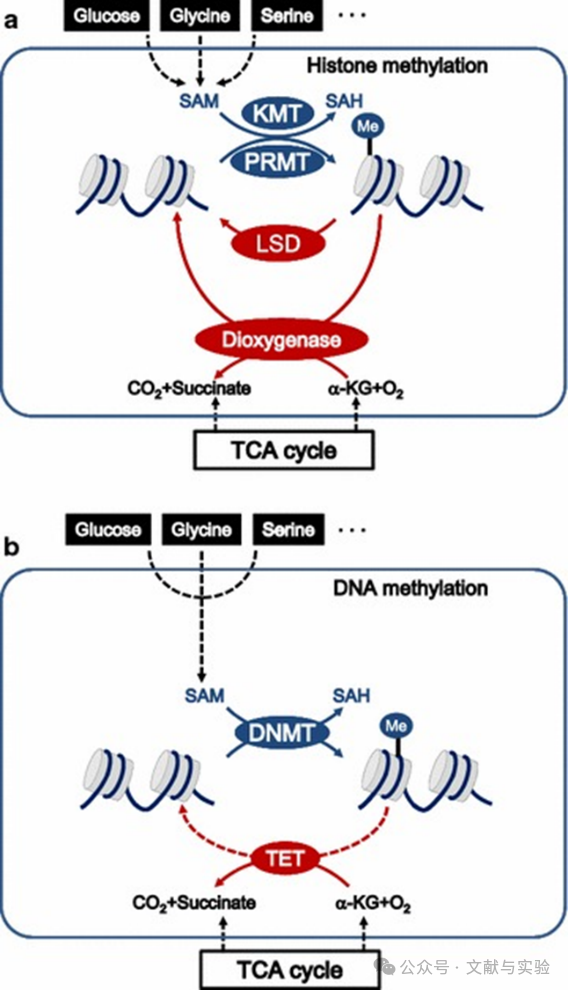
参考文献:10.1186/s40880-018-0302-3
癌细胞将营养状态与组蛋白和 DNA 的甲基化相协调。癌细胞根据营养状态改变组蛋白(a)和 DNA(b)的甲基化。SAM 是 S - 腺苷甲硫氨酸,SAH 是 S - 腺苷同型半胱氨酸,KMT 是赖氨酸甲基转移酶,PRMT 是蛋白精氨酸甲基转移酶,LSD 是赖氨酸特异性去甲基酶,DNMT 是 DNA 甲基转移酶,TCA 是三羧酸循环,TET 是十 - 十一转位甲基胞嘧啶二氧化酶。
7. 总结
表观遗传修饰是生物体基因表达调控的重要机制,对生物体的发育、生长、分化和繁殖等过程起到重要作用。近年来,随着高通量测序技术的发展,对表观遗传修饰的研究越来越深入。未来的研究将继续揭示表观遗传修饰的分子机制,为疾病治疗和生物技术应用提供理论基础。
7.1 表观遗传修饰的分子机制
表观遗传修饰的分子机制包括 DNA 甲基化、组蛋白修饰、非编码 RNA、RNA 修饰和染色质重塑等方面。DNA 甲基化是指在 DNA 分子上加上一个甲基基团,从而改变 DNA 的化学性质和结构,影响基因的表达。组蛋白修饰是指对组蛋白进行翻译后修饰,包括乙酰化、甲基化、泛素化等,可以影响染色质的结构和紧密度,进而影响基因表达。非编码 RNA 是指不编码蛋白质的 RNA 分子,它们在基因表达调控中发挥着重要作用。RNA 修饰是指对 RNA 分子进行化学修饰,包括剪接、编辑、甲基化等,可以影响 RNA 的稳定性和功能。染色质重塑是指染色质结构的变化,包括核小体的组装和解聚,以及染色质的紧密度变化。
7.2 表观遗传修饰的生物学意义
表观遗传修饰在生物体的发育、生长、分化和繁殖等过程中起到重要作用。在发育过程中,表观遗传修饰的改变与细胞分化的命运决定密切相关。例如,在胚胎干细胞分化为特定细胞类型的过程中,表观遗传修饰的模式会发生改变,从而实现基因表达的调控。在细胞分化过程中,表观遗传修饰可以影响某些基因的表达,从而使细胞获得特定的功能和特性。
表观遗传修饰在基因组稳定性中也起到重要作用。表观遗传修饰可以影响染色质的结构和基因的表达,从而影响 DNA 的复制和修复过程。此外,表观遗传修饰还可以影响转录因子的招募和 DNA 的甲基化过程,进一步维持基因组的稳定性。
表观遗传修饰与疾病发生密切相关。许多疾病,如癌症、神经系统疾病和免疫系统疾病等,都与表观遗传修饰的异常有关。例如,在癌症中,表观遗传修饰的异常可以导致基因的异常表达,促进肿瘤的发生和发展。在神经系统疾病中,表观遗传修饰的异常可以影响神经元的行为和功能。在免疫系统疾病中,表观遗传修饰的异常可以影响免疫细胞的发育和功能。
7.3 表观遗传修饰的研究进展
近年来,随着高通量测序技术的发展,对表观遗传修饰的研究越来越深入。例如,通过高通量测序技术,可以研究表观遗传修饰的全基因组分布。通过 ChIP-seq、RRBS、WGBS、RNA-seq、RIP-seq、MeDIP-seq、RNA 修饰测序等高通量测序技术,可以研究表观遗传修饰与基因表达的关系。此外,研究者还开发了许多生物信息学方法,用于分析表观遗传修饰的数据。例如,研究者可以通过比较不同样本的表观遗传修饰数据,揭示表观遗传修饰与疾病发生的关系,为疾病的诊断和治疗提供新的思路和方法。
7.4 表观遗传修饰在疾病治疗和生物技术应用中的前景
表观遗传修饰在疾病治疗和生物技术应用中具有广阔的前景。通过调控表观遗传修饰,可以实现对基因表达的调控,从而治疗相关疾病。例如,通过调控 DNA 甲基化,可以实现对某些基因的沉默,从而治疗癌症、神经系统疾病和免疫系统疾病等。通过调控组蛋白修饰,可以实现对某些基因的激活,从而治疗某些遗传性疾病。通过调控非编码 RNA,可以实现对某些基因的调控,从而治疗某些遗传性疾病。通过调控 RNA 修饰,可以实现对某些基因的调控,从而治疗某些遗传性疾病。通过调控染色质重塑,可以实现对某些基因的调控,从而治疗某些遗传性疾病。此外,通过调控表观遗传修饰,还可以实现对细胞分化和发育的调控,从而治疗相关疾病。
总之,表观遗传修饰是生物体基因表达调控的重要机制,对生物体的发育、生长、分化和繁殖等过程起到重要作用。近年来,随着高通量测序技术的发展,对表观遗传修饰的研究越来越深入。未来的研究将继续揭示表观遗传修饰的分子机制,为疾病治疗和生物技术应用提供理论基础。
via:
-
表观遗传修饰研究进展 原创 庞景杰 文献与实验 2024 年 04 月 17 日 09:40 河南
Nat Rev Genet | 20 年来表观遗传领域核心进展之全景解读
Epigenetics 表观遗传学 2019-02-26 08:43
在过去的 20 多年中,表观遗传学从点到线,从线到面,到如今的全面蓬勃发展,并被认为是最具潜力获得诺贝尔奖的领域之一。2016 年,表观遗传学领域的权威C. David Allis和Thomas Jenuwein于Nature Review Genetics发表了题为The molecular hallmarks of epigenetic control的 Perspectives 文章,系统性回顾了过去 20 年来表观遗传学领域的突破性进展,为理解表观遗传学提供了全景式的解读。文章自 2016 年 8 月发表以来,至今已被引用 489 次(Google scholar 数据)。为了帮助对表观遗传感兴趣的小伙伴深入理解表观遗传学,我们特整理了全文的要点,供大家参考。

全文共分为六个部分,导语部分简要介绍了全文的基本内容,第二部分《表观遗传学的基础》简要介绍了 DNA 甲基化、核小体和组蛋白修饰的基本概念,这些正是构成表观遗传学的物质基础;第三部分《染色质状态的酶学定义》阐明了染色质的两种状态 —— 常染色质和异染色质,以及它们与基因活性之间的关联;第四部分《表观遗传研究的现代时期》中,作者将 1996~2016 年这 20 年间表观遗传的研究定义为 “表观遗传研究的现代时期(the modern era of epigenetic research)”,并从组蛋白密码假说及相关理论、组蛋白修饰和 DNA 甲基化、非编码 RNA 和基因转录沉默、核小体重塑和组蛋白变体、所有染色质标记都是可逆的、二价染色质(bivalent chromatin)和表观基因组特征等六个方面进行阐述;第五部分《发育与疾病》介绍了表观遗传与疾病之间的关联,并从重编程的表观遗传障碍、癌症和表观遗传治疗、免疫防御、染色质遗传(记忆)等四个方面展开,其中还涉及多种表观遗传药物的开发策略;最后展望部分对全文进行了简要总结,并展望了表观遗传学今后的发展。
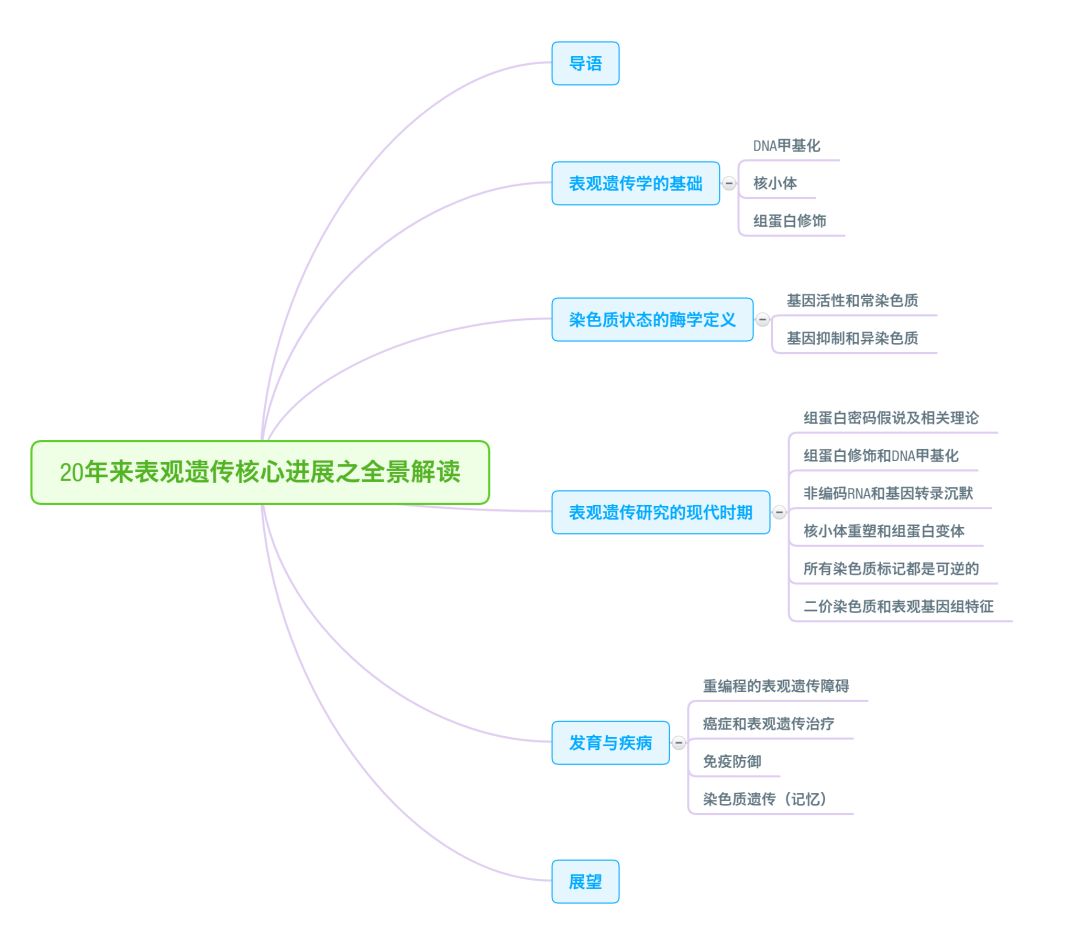
全文超过 14400 字,可收藏阅读,或直接跳转至感兴趣的部分。
摘要:过去 20 年(1996~2016 年)中,科学家们鉴定了多种染色质修饰酶,探索了各种刺激(生理和病理)信号引起染色质改变的分子机制,并取得了一系列突破性进展,这使得我们对于表观遗传学的认知,从一系列不寻常的生物学现象上升为 “一个具有细分功能的研究领域”。本文介绍了表观遗传学的发展历程 —— 从其历史起源到当下的 “表观遗传研究的现代时期(the modern era of epigenetic research)”。文中重点强调了表观遗传调控中的关键分子机制和概念进展,这些进展改变了我们对正常与受扰情况下生物发育的理解。
1. 导语
1942 年,Conrad Waddington 创造出了 “表观遗传学” 一词,用以定义基因型未发生改变而表型改变的现象,以解释发育的各个方面。大约 3/4 个世纪以后,我们发现基因表达模式传递的表观遗传机制并不依赖于 DNA 序列的改变,而是通过改变染色质的状态,而染色质状态同时是我们遗传信息的生理学形式。除了 DNA,表观遗传机制同样能够稳定基因表达程序从而确定细胞的类型。人们早已认识到表观遗传调控的重要性,但是对于何种染色质状态激活基因表达,何种染色质状态抑制基因表达(编者注:染色质状态像酶一样可调控基因表达,即染色质状态具有酶活性),所知依然甚少。
染色质免疫共沉淀测序(ChIP-seq)及其衍生技术使得人们能够在碱基分辨率或者接近碱基分辨率水平上分析表观基因组,同时也可以在正常或非正常的细胞或组织中构建表观基因组图谱。在一些情况下,表观基因组图谱能够更好地定义基因增强子和启动子等基因关键调控元件;其与 DNA 序列整合分析时,可深入探究疾病进程的分子机制。绝大多数已知的表观遗传修饰都是可逆的,如果对表观遗传调控的这种适应性特性加以借鉴,那么从表观遗传角度开发新的治疗策略将大有希望。表观遗传学已然并将继续成为现代生物学和医学最具创新性的研究领域之一。
在文中,作者回顾了表观遗传学从其起源至 “表观遗传研究的现代时期(the modern era of epigenetic research)” 的发展历程,作者将 “表观遗传研究的现代” 定义为 1996 至 2016 这二十年间的表观遗传学研究。本文介绍了关于染色质状态酶活性定义的开创性发现,这种染色质状态包括基因处于活性状态的常染色质(euchromatin)和基因处于抑制状态的异染色质(heterochromatin);此外,还介绍了表观遗传学在染色质稳定性、基因调控、转录沉默以及组蛋白修饰和 DNA 甲基化的可逆性等方面的机制进展。这些机制上的见解反过来加深了我们对于细胞身份的理解,同时也为重编程、染色质对环境的响应、表观遗传治疗以及染色质遗传等方面的研究开辟了新的途径,作者对这些方面的进展也进行了概述。此外,作者描述了许多突破性的发现,重点描述了一些重要的机制和概念上的进展。文中引用了许多具有深远影响的文章,但读者有时也可参考《表观遗传学》教科书(Epigenetics, 2nd edition, CSHL Press)或者其他近期的综述以获取更为深入的讨论和更多的参考内容。
2. 表观遗传学的基础
Miescher、Flemming、Kossel 和 Heitz 在 1869 年到 1928 年间开展的开拓性工作定义了核酸、染色质和组蛋白,这也使得常染色质和异染色质在细胞学上产生了区别(图 1)。之后,Muller(在黑腹果蝇中)和 McClintock(在玉米中)在位置效应花斑(position-effect variegation,PEV)和转座元件上的开创性研究,为非孟德尔遗传(non-Mendelian inheritance)提供了早期的线索。进一步地,对 X 染色体失活以及基因组印记现象的描述催生了这样一个基本概念的产生,即在同一细胞核中,相同的遗传物质可以保持不同的 “开” 或 “关” 的状态,但其背后的机制所知甚少。
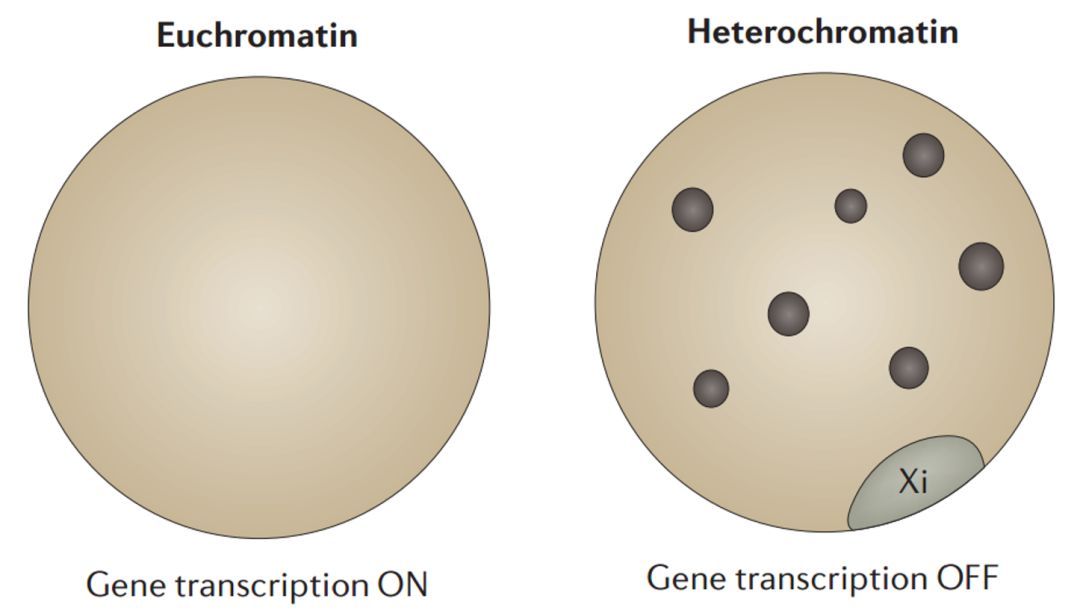
**图 1. 细胞学上可见的活性染色质(常染色质)和抑制性染色质(异染色质)状态。**图中显示了两个来源于雄鼠体细胞的处于细胞间期的细胞核,左边的细胞核中的 DNA 呈现出广阔的非致密的染色,而右边的细胞核呈现出具有典型的异染色质核(黑色的点),而且通过 DAPI 染色,AT 富集的重复序列可见。此外,在核周围的致密染色的 Barr 体(一个失活的 X 染色体)被单独标注出来。
2.1 DNA 甲基化
早在 1948 年,DNA 碱基的化学修饰就已被检测到(编者注:这早于 1953 年 DNA 双螺旋结构的发现);在 20 世纪 70 年代中期,Holiday 和 Pugh 就提出了 DNA 甲基化(特别是 5 - 甲基胞嘧啶)在基因调控中的作用。到了 1980 年,DNA 甲基化和基因抑制的联系被建立,同一时期也发现了 CpG 岛。5 - 氮杂胞苷(也称为 2’- 脱氧 - 5 - 氮杂胞苷,后称为地西他滨)是第一种 “表观遗传药物”,它能够阻断 DNA 甲基化,用于改变成纤维细胞系的基因表达和表型。此后不久, Feinberg 和 Vogelstein 报道了癌症中全基因组 DNA 低甲基化;十年后,肿瘤抑制基因的局部 DNA 高甲基化也被报道出来。这些发现为 DNA 甲基化的 “酶学” 理论(enzymology of DNA methylation)提供了令人信服的证据。小鼠 DNA 甲基化转移酶 1(DNMT1)的成功纯化与克隆,以及 Dnmt1 突变小鼠的构建和分析向着这一理论迈出了重大一步。同一时期,第一个 DNA 甲基结合蛋白 MeCP2 被鉴定出来。时至今日,DNA 甲基化和 5 - 甲基胞嘧啶(被认为是 “第五个碱基”)已经被确立为许多生物体内关键的表观遗传学机制。
2.2 核小体
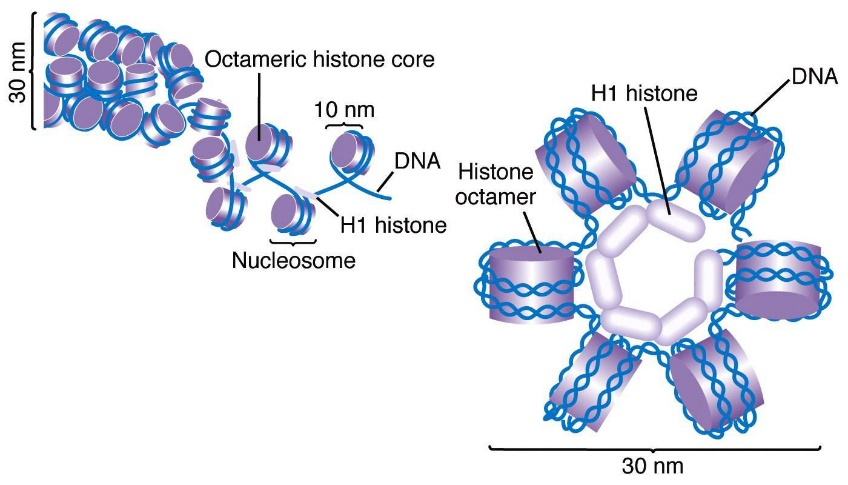
许多研究组的工作共同构建了核小体组织模型。1974 年染色质亚单元模型(chromatin subunit model)首次被清楚阐明,1997 年通过组蛋白八聚体 - DNA 颗粒的 X 射线晶体结构,该模型首次被观测到。正如当时观测到的,染色质纤维的基本单位为核小体核心颗粒,它是由四个组蛋白的各两个拷贝(组蛋白八聚体)组成的,并包裹了 147bp 的 DNA。
2.3 组蛋白修饰
在 20 世纪 60 年代中期,Allfrey 在组蛋白修饰(尤其是组蛋白乙酰化)方面的开创性工作引出了一种假设:乙酰化与基因活性密切相关。随后科学家们进行了许多研究,Grunstein 等研究了酿酒酵母中组蛋白尾部的突变,发现这些突变扰乱了端粒和交配型基因座(mating-type loci)中基因的沉默。这项开创性的工作提供了功能方面的早期证据,其中就包括沉默信息调节蛋白(silent information regulator proteins)的首次表征。由 Turner 等人开发的针对特定修饰或位点的抗体(如组蛋白 H4 第 16 位赖氨酸的乙酰化,H4K16ac)揭示了组蛋白乙酰化的非随机模式,例如雌性哺乳动物中失活的 X 染色体和酵母中沉默的交配型基因的低乙酰化,以及黑腹雄性果蝇中上调两倍的 X 染色体基因或鸡红细胞中表达的 β- 珠蛋白基因的高度乙酰化。
从这些重大发现可以提出一个令人信服的论点:除了 DNA 甲基化外,组蛋白修饰还携带了能够区分常染色质和异染色质的信息。果蝇、酵母和植物中强大的遗传筛选体系已经鉴定了染色质依赖性的基因调控的其他关键因素,如 HP1、Su (var) 3-9、Enhancer of zeste (E (z))、Polycomb、Trithorax、Clr4 和 DDM1 等。 然而,这些染色质因子的分子功能以及染色质是如何在常染色和异染色状态之间 “转换” 的还并不清楚。
3. 染色质状态的酶学定义
3.1 基因活性和常染色质
1996 年,Allis 及其同事使用纤毛原生动物模型 —— 嗜热四膜虫,将生物化学方法与凝胶内实验(in-gel assay)相结合,从该生物体内具有活性的细胞核中纯化和克隆出第一个编码与转录相关的组蛋白乙酰基转移酶(histone acetyltransferase,HAT)基因。引人注目的是,纤毛虫中这种 HAT(p55)与此前描述的来自芽殖酵母的转录共激活因子 Gcn5 是直系同源物,这一发现为组蛋白乙酰化和基因活性之间提供了直接的联系,而且酵母 Gcn5 酶也显示出 HAT 活性。有趣的是, 纤毛虫的酶包含了在其他乙酰基转移酶(如酵母的 Hat1)中发现的活性位点残基以及高度保守的溴结构域(bromodomain),这提示它可能指导染色质招募,但机制至今尚不清楚。在随后的研究中 Allis 团队提供了通过 Gcn5 靶向组蛋白乙酰化导致基因激活的确凿证据。一些其他的 HAT,包括 TAF1(也称为 TAF (II) 250)、PCAF 和 CBP /p300 也被鉴定出来,从而证实这一调控范式,并进一步将这一范式扩展到哺乳动物细胞中。
在 p55-Gcn5 结果发表后大约一个月,Schreiber 及其同事利用 HDAC 抑制剂 trapoxin,纯化和克隆了第一个组蛋白去乙酰化酶(histone deacetylase,HDAC)。值得注意的是,研究人员发现哺乳动物中与 trapoxin 结合的蛋白质是芽殖酵母转录共抑制子 Rpd3 的直系同源物。这一具有里程碑意义的发现表明,组蛋白去乙酰化与转录抑制有关。总而言之,1996 年 HAT 和 HDAC 的工作给出了令人信服的接连冲击(one–two punch),即组蛋白乙酰化和去乙酰化直接与基因调控的 “开启” 和 “关闭” 状态相关联,这也正如 Allfrey 当初预想的那样。
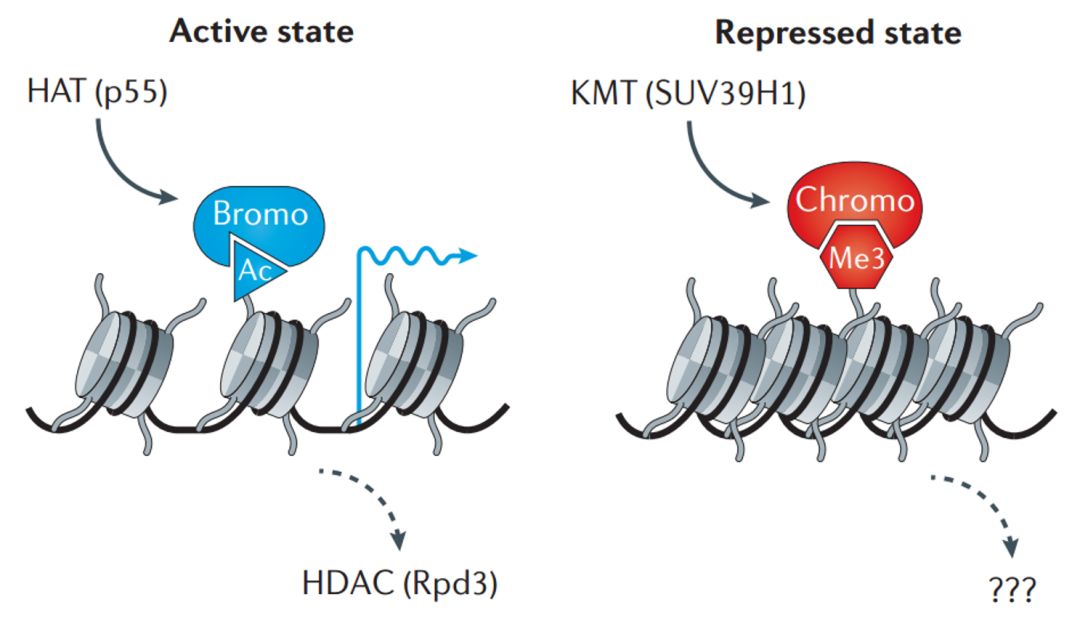
**图 2. 染色质状态的酶活定义,包括 p55 催化的组蛋白乙酰化刺激基因激活或 SUV39H1 催化的组蛋白甲基化抑制基因活性。**1996 年,嗜热四膜虫中组蛋白乙酰基转移酶 p55 被鉴定为转录共激活因子,可以催化组蛋白 H3 乙酰化。H3K14ac 为溴结构域蛋白提供了停靠位点,进一步刺激核小体的可及性以及转录活性。组蛋白乙酰化可以被 HDAC 去除,进而造成转录抑制。2000 年,人类组蛋白赖氨酸甲基转移酶 SUV39H1 被鉴定为果蝇中 Su (var) 的同源类似物,可甲基化组蛋白 H3 的 N - 端尾巴。H3K9me3 为染色质域(chromodomain)蛋白 HP1 提供了停靠位点,随后损害了染色质的可及性并诱导基因抑制。在当时,这种组蛋白甲基化是否可逆还不清楚。
HAT 和 HDAC 的开创性发现使得人们猜想,是否还存在其他具有类似活性的蛋白。2000 年,Guarente 和同事证明,酵母中基因沉默所需的关键蛋白 Sir2 是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD)的 HDAC。随后,研究人员在哺乳动物细胞中鉴定出 7 种类似 Sir2 的酶,现在称之为 Sirtuin 蛋白家族。与其他 HDAC 相比,除了具有独特的辅助因子和催化需求外,Sir2 相关的 HDAC 在新陈代谢和衰老方面的作用也引起了科学家们浓厚的兴趣。
虽然取得了一些显著的进展,但组蛋白乙酰化诱导形成活性染色质状态的机制仍然未知。长期以来人们认为,组蛋白乙酰化通过中和组蛋白中的基本电荷,减弱与 DNA 的相互作用(顺式效应),进而调节染色质结构和基因活性。1999 年,Zhou 和同事发现,PCAF 的溴结构域可作为乙酰基 - 赖氨酸结合模块,用于对接乙酰化组蛋白。这是本文将要描述的第一个组蛋白修饰结合结构域,它揭示了含溴结构域的因子与染色质中乙酰化靶标结合的新机制(反式效应)(图 2)。截止目前,已经鉴定了多种染色质结合模块以及它们同源的组蛋白配体。
3.2 基因抑制和异染色质
Reuter 鉴定果蝇的 PEV(Position-Effect Variegation, 位置效应花斑,在某些细胞中由于染色体重排或转座使某些基因移到异染色体的附近而不能表达,从而形成花斑的现象)修饰因子,其含有一个进化保守的 SET 结构域;而 Jenuwein 克隆和表征了其在哺乳动物中的同源类似物。第一个组蛋白赖氨酸甲基转移酶(KMT)将这两个发现联系了起来。SET 结构域存在于 Su (var) 3-9、E (z) 和 Trithorax 蛋白中,这些蛋白都与表观遗传调控有关,但是缺乏酶活性相关的证据。Jenuwein 预测了 SET 结构域的催化活性,然而,要揭示 SET 结构域与甲基转移酶的远距离关系还需要更精细的生物信息学分析。而研究发现,SUV39H1(Su (var) 3–9 同源类似物 1)介导的组蛋白 H3 磷酸化与基因调控有关,这一发现启发了一个关键的实验:检测重组的 SUV39H1 的组蛋白赖氨酸甲基转移酶活性。该体外实验揭示了重组 SUV39H1 的 SET 结构域对组蛋白 H3 强烈的催化活性。随后,Jenuwein 和 Allis 实验室合作研究表明,SUV39H1 选择性地甲基化组蛋白 H3 第 9 位赖氨酸(形成 H3K9me3);这是表观遗传魔法(epigenetic ‘magic’)卓有成效的案例,因为 Su (var) 3-9 基因的遗传分类显然预测了酶的底物和位点特异性。2000 年,Jenuwein 发表文章,鉴定了第一个组蛋白赖氨酸甲基转移酶 SUV39H1。
SUV39H1 发现后不久,就发现 HP1 的染色质域(chromodomain)可以与甲基化的 H3K9 结合,正如裂殖酵母中 HP1 相关的蛋白 Swi6 一样。综上所述,这些发现为自 1928 年以来一直空缺的异染色质的形成和传播提供了生化解释,并鉴定了自 20 世纪 60 年代以来一直令人费解的组蛋白赖氨酸甲基化的酶类。非常重要的是,负责基因抑制和异染色质组装的 SUV39H1-HP1-H3K9me 系统比 DNA 甲基化更为保守,它们存在于单细胞生物(例如裂殖酵母)、植物和无脊椎动物(例如果蝇)以及复杂的多细胞生物(哺乳动物和人类)中。
SUV39H1 的 SET 结构域提供了一个标志性的催化域,大量含有 SET 结构域的蛋白作为潜在的 KMT 被检测。在哺乳动物基因组中发现了大约 50 个编码含有 SET 结构域蛋白的基因,其中许多蛋白得到了深入研究。组蛋白赖氨酸甲基化既可能发挥抑制作用,如 SUV39H1 介导的 H3K9me3,也可发挥激活作用,如 H3K4 甲基化。其他研究组在哺乳动物中鉴定了受发育调控的沉默或激活的染色质状态(如 G9a 催化的 H3K9me2,EZH2 催化的 H3K27me3,Trithorax 和 MLL 催化的 H3K4me3),以及失活的 X 染色体的抑制性染色质结构。此外,还鉴定了不包含 SET 结构域的 KMT,它们可以甲基化组蛋白核心区域(非尾巴)位点(如 DOT1L 甲基化 H3K79)。除了组蛋白赖氨酸甲基化外,组蛋白精氨酸甲基化也与基因调控有关,如共激活子 CARM1 或 PRMT1 可以通过 H3R17 或 H4R3 甲基化介导依赖于激素的转录刺激。
显然,组蛋白修饰对于依赖于染色质的基因调控至关重要。然而,在当时组蛋白赖氨酸甲基化是否像组蛋白乙酰化一样是可逆的仍然是一个关键问题,这有待更深入的研究。
4. 表观遗传研究的现代时期
可以认为,上述研究,再加上全基因组染色质图谱等新技术的发展,开辟了我们所说的 “表观遗传学现代研究”,自 2000 年以来该领域的大量出版物也证明了这一点。新的会议和倡议推动了世界范围内对表观遗传控制的本质机制深入研究的浪潮。典型的例子包括由冷泉港实验室、美国癌症研究协会(AACR)、戈登研究会议(GRC)组织、美国实验生物学协会联合会(FASEB)和 Keystone 专题研讨会等机构组织的专门致力于表观遗传学的会议。此外,还成立了几个大型联盟,如欧洲的卓越的 “表观基因组” 和 “表观基因系统” 网络(The Networks of Excellence ‘The Epigenome’ and ‘EpiGeneSys’)、美国国立卫生研究院(NIH)的表观基因组计划路线图(Roadmap Epigenomics Project)和 ENCODE 计划,以及国际人类表观基因组联盟(IHEC),这些联盟将欧洲、美国、加拿大、亚洲等地的科学家紧密联系起来。
下面本文将描述 2000 年至 2016 年间的重大突破性发现。这些发现在图 3 中是按时间顺序排列的,我们并不总是按照严格的顺序来展示它们,而是将它们归类为连贯的机制和概念上的进展。
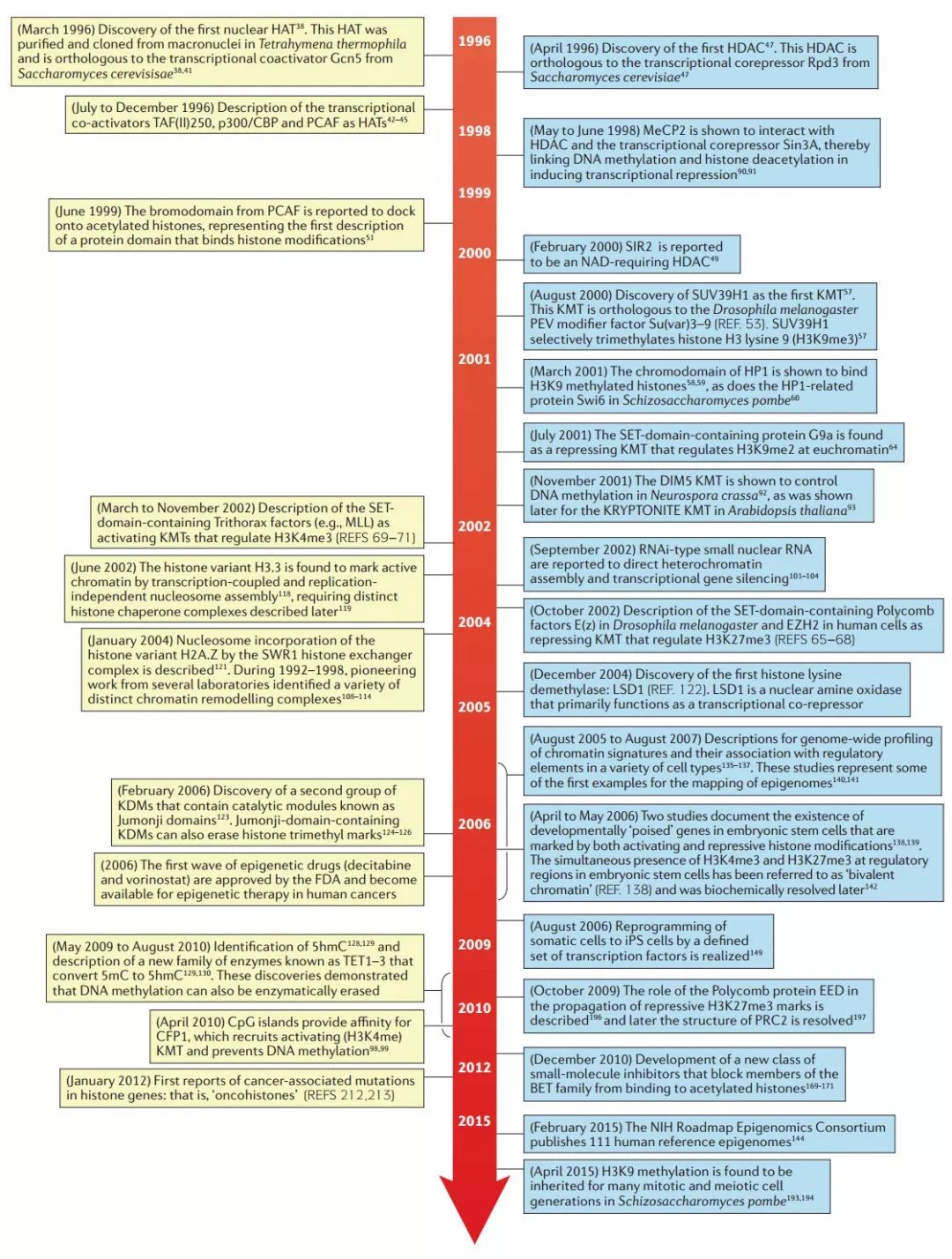
图 3. 1996~2006 年间表观遗传研究领域重要发现和进展的时间线
4.1 组蛋白密码假说及相关理论
越来越多的组蛋白共价修饰表明核小体携带表观遗传信息,然而这种信息是否由顺式或反式的机制介导尚不清楚。1999 年 Zhou 和他的同事发现了结合乙酰化赖氨酸的溴结构域,为一年后提出的一个有影响力的假说 ——“组蛋白密码假说(histone code hypothesis)” 提供了第一条实验证据。“组蛋白密码假说” 认为,组蛋白修饰的组合模式导致了不同的生物学结果,部分通过反式招募下游效应蛋白(称为 “阅读者”,以匹配组蛋白修饰酶的 “书写者”)或复合物。“组蛋白密码假说” 预测,此后还会鉴定其他组蛋白修饰的阅读者。事实上,很多种类型的组蛋白结合模块已经被鉴定(例如染色质域、tudor 域和 PHD 指结构域),其结构深入阐明了它们与相应配体结合的特异性,这又进一步拓展了 “组蛋白密码假说”,包括将其翻译成更广泛的 “表观遗传密码(epigenetic code)”。这些假说的其他后续拓展包括组蛋白盒(histone cassettes),二元开关(binary switches)和效应子 - 配体结合反应的多价性(multivalency)。尽管科学界质疑组蛋白修饰的共价 “语言” 是否满足成为真正 “密码” 的标准,但毫无争议的是,除了顺式机制(电荷效应),效应蛋白结合的反式机制在组蛋白和 DNA 修饰读取中发挥重要作用。
4.2 组蛋白修饰和 DNA 甲基化
组蛋白修饰的组合特性也不禁让人们好奇:组蛋白修饰与 DNA 甲基化是否在功能上存在联系。MeCP2 与 HDAC、转录共抑制因子 SIN3A 相互作用,引发转录抑制。Selker 及其同事利用真菌模型粗糙链孢霉提供了令人信服的证据:组蛋白 H3K9 甲基化(由 DIM5 催化)是 DNA 甲基化所需要的。随后在植物中的研究进一步支持了这些发现,其中 H3K9 甲基转移酶 KRYPTONITE 控制 DNA 甲基化。此时,H3K9 甲基化作为 DNMT 染色质甲基化酶(chromomethylase)的停靠位点,进而抑制沉默重复元件。多结构域蛋白,如 UHRF1(也称为 Np95)可以连接 H3K9 甲基化和半甲基化 DNA,以稳定 DNMT1。催化失活的 DNMT3 样衔接子(DNMT3-like adaptor)通过其 ADD 结构域选择性地结合未修饰的 H3K4,一旦 H3K4 被甲基化为 H3K4me3,这种选择性结合就被阻断。
对于发育控制的基因表达和多梳蛋白复合物介导的沉默而言,组蛋白修饰和 DNA 甲基化之间的相互依赖揭示了它们之间复杂的关系。然而,不同的 DNA 序列是否可以指导 DNA 甲基化的存在与否仍然不清楚。2010 年突破性地发现, CpG 岛对转录因子具有亲和力,例如 CXXC 型锌指蛋白 1(CFP1),它可以募集活化的 KMT 并阻止 DNA 甲基化。因此,富含 CpG 的 DNA 可以靶向活性染色质结构并保护其免于从头 DNA 甲基化,即使在转录暂停或中止情况下也是如此。低、中、高水平 CpG 的 DNA 甲基化的差异也可以解释不同的转录因子是否可以进入其同源结合位点。
4.3 非编码 RNA 和基因转录沉默
尽管在组蛋白和 DNA 修饰方面取得了显著进展,但对于这些标记是如何被添加到特定的基因组位置还知之甚少。研究发现小 RNA 可作为潜在 “模板” 分子,这为该问题提供了部分解答。在 2002 年,四个研究组使用裂殖酵母(Grewal 和 Martienssen)和四膜虫(Allis 和 Gorovsky)模型,报道了小 RNA 与基因组特定位点相互作用,并可能指导基因组特定位点的染色质修饰活性。在细胞质中,小 RNA 阻断信息翻译从而抑制基因表达,这一过程称为 RNA 介导的干扰(RNAi)或转录后基因沉默(PTGS);而在细胞核中,这些小核 RNA 介导了 “基因转录沉默(tranional gene silencing,TGS)” 过程,不仅指导了裂殖酵母中的异染色质组装和基因沉默,还指导了嗜热菌的程序化 DNA 消除。在这两个模型中,小 RNA 与组蛋白赖氨酸甲基化复合物的已知组分相互作用,这使得人们怀疑这些系统进化是为了保护基因组免受有害 DNA 元件或病毒的侵害;因为如果没有适当的沉默机制,这些有害的 DNA 元件或病毒可能会破坏基因组。在该模型的扩展中,非编码 RNA(ncRNA)的转录通常被认为是一种全基因组的监控机制,在 RNA 质量控制中发挥着重要作用。
尽管这些途径中不同分子步骤的顺序仍不清楚,但这些发现强调了 DNA、RNA 和组蛋白及其修饰以协同方式发挥作用,以产生对发挥基因功能很重要的染色质状态。TGS 途径代表了 RNA 介导的异染色质化机制中的一种序列互补机制,其中 RNA 信号回到 DNA 并建立抑制性的染色质状态,而且可以在许多细胞分裂中传递下去。
4.4 核小体重塑和组蛋白变体
ATP 依赖的染色质重塑复合物为改变组蛋白 - DNA 接触、促进 DNA 可及性以及新旧组蛋白的交换或转录因子进出染色质提供了另一种重要机制。在 1992-1998 年期间,遗传和生化研究鉴定了 SWI/SNF、NURF 和其他 ATP 依赖的核小体重塑复合物,并对它们的作用机制提供了早期的阐述,而这正是目前非常活跃的表观遗传学研究领域。癌症中人 BAF 重塑复合物组分的高频突变进一步刺激人们的研究热情。
组蛋白变体,与其主要的经典组蛋白仅有少量氨基酸的差异,起初人们认为它们与经典组蛋白在氨基酸序列上过于相似,差异太过微小,因而并不重要。当研究聚焦于黑腹果蝇组织培养细胞中的 H3 变体(H3.3)时,发现 H3.3 可独立于 DNA 复制而放置入染色质中,并优先靶向转录活跃的染色质。此后不久,生化方法记录了一个 H3.3 选择性伴侣(HIRA),它不同于在 S 期执行的 H3(H3.1 和 H3.2)置入系统(染色质组装因子 1,CAF1)。组蛋白变体进出染色质的快速交换,这一过程由专门的分子机器介导,这种分子机器可以识别特定的组蛋白变体,这种现象支持了这样的理论:组蛋白变体是染色质纤维变异的主要机制。甚至着丝粒染色质也有其特异的 H3 变体(在哺乳动物中被称为着丝粒蛋白 A,即 CENP-A),越来越多的证据表明,CENP-A 标记了具有自身表观遗传身份的着丝粒。其他非 H3 组蛋白变体也引起了相当大的关注,例如, H2A.X,当其磷酸化时,显著标记染色质中 DNA 双链的断裂;H2A.Z,一种富集在转录起始位点的变体,该位点与 5mC 呈反相关;macroH2A,一种富集在无活性 X 染色体上长的 H2A 亚型。显然,染色质介导的表观遗传调控的难题有很多,但组蛋白变体表明,即使是一些最小的一个也至关重要。
图 4. 染色质促进表观基因组功能的关键案例
4.5 所有染色质标记都是可逆的
组蛋白的 “擦除者” 因组蛋白乙酰化(去乙酰化酶)和磷酸化(磷酸酶)而为人所知,这是两种主要的组蛋白修饰,它们具有良好的周转特性,可动态响应细胞的转录需求。相比之下,组蛋白甲基化的擦除者并不为人所知,这使得它很可能成为 “永久性的” 组蛋白标记 —— 也就是说,可能不具有酶促可逆性。这是一个有吸引力的概念:如果组蛋白甲基化标记是稳定的表观遗传标记,它们可能具有遗传潜力。2004 年,Shi 和同事打破了这个概念,他们发现并鉴定了第一个组蛋白赖氨酸去甲基化酶(KDM)——LSD1(赖氨酸特异性去甲基化酶 1),一个核 FAD 依赖的胺氧化酶同源物。但是,LSD1 不能使组蛋白赖氨酸三甲基去甲基化,表明赖氨酸三甲基化可能是一个永久性的表观遗传标记。然而,不久之后,Zhang 和同事通过在该领域引入第二类赖氨酸去甲基化酶 —— Fe(II)和 α- 酮戊二酸依赖的含有 Jumonji 结构域的双加氧酶,进而反驳了这一观点。这类酶能够去除组蛋白中的三甲基 - 赖氨酸标记,从而支持所有表观遗传标记都可能是可逆的这一普遍观点。与其他擦除者一样,KDM 表现出了显著的底物和位点特异性,KDM 研究迅速发展成为具有重要催化和调节功能的表观遗传调控物质。
从历史角度看,对于 DNA 甲基化的可逆性这一基本问题,特别是对于 5mC 的丢失,也存在相当大的困惑。长期以来发育生物学家描述了在生殖细胞成熟和早期胚胎发生过程中出现的两波全基因组 DNA 去甲基化浪潮;然而,DNA 甲基化去除过程长期以来一直难以捉摸,因此研究认为,DNA 甲基化去除是被动过程(通过 DNA 复制稀释),而非主动过程(酶促驱动)。5 - 羟甲基胞嘧啶(5hmC)的鉴定为解答这个难题提供了关键一环。重要的是,Rao 和 Zhang 的研究鉴定了一个新的 TET1-3 酶家族,它们能够将 5mC 氧化为 5hmC,还可以进一步氧化为 5 - 甲酰基胞嘧啶(5fC)和 5 - 羧基胞嘧啶(5caC)。随后可以通过 DNA 糖基化酶对这些修饰碱基进行酶促切除,从而产生完全去甲基化的 DNA 模板。与组蛋白甲基化一样,DNA 甲基化也具有丰富的书写者、阅读者和擦除者。显然,DNA 共价修饰 “语言” 的复杂性与组蛋白的复杂性一样在增加。
4.6 二价染色质(bivalent chromatin)和表观基因组特征
到 2005 年,组蛋白乙酰化、磷酸化和甲基化等标记作为一组受到广泛研究的组蛋白修饰脱颖而出。质谱等敏感方法持续揭示出数量惊人的组蛋白修饰,尽管其中许多修饰的数量并没有主要标记那么丰富。相应地,修饰选择性抗体也被开发出来,并经常被用于 ChIP 分析,用来检测你最感兴趣的基因。几个有远见的实验室采用了一种不同的、强大的方法,开发了全基因组 ChIP 的衍生方法,在正常和异常状态下更广泛地剖析表观遗传景观。该方法的早期版本将 H3K4me2(作为染色质 “开” 的标记)与 H3K9me2(作为染色质 “关” 的标记)进行了比较,结果既丰富又引人注目,发现这些标记间具有显著的负相关性。借助 ChIP-seq 将这些研究可以很好地扩展到胚胎干细胞(ES)中,部分原因是由于 ES 细胞具有被诱导进入特定分化途径的能力。不久,组蛋白标记的一致模式出现了。例如,H3K4me3 与活性启动子元件相关,而 H3K27me3 则富集于发育控制的抑制性染色质状态中。这些有指导意义的表观基因组 “特征” 开始出现,引起了人们对今天仍在使用的全基因组方法的兴趣。
然而,在 2006 年,对组蛋白标记来说,这种具有吸引力的开关逻辑被证明过于简单。Lander 和 Fisher 里程碑式的研究意外地发现,胚胎干细胞中存在同时具有激活和抑制标记的,处于发育 “蓄势待发的(poised)” 基因。H3K4me3 和 H3K27me3 重叠的模式被称为 “二价染色质(bivalent chromatin)”。“蓄势待发的(poised)” 基因的二价特征的发现是出乎意料且非常重要的。它提供了第一个关于 “中间” 状态的线索,其中二价标记的基因可以在发育过程中分解为活性或非活性状态。二价染色质不是胚胎干细胞特异性的,在其他细胞类型中也有详细的记录。
如何在核小体水平上建立和组织二价染色质仍然是一个重要的问题。相反的 H3K4me3 和 H3K27me3 是标记在同一个 H3 尾部还是不同 H3 尾部,是同一个核小体内或相邻核小体上的?由 Reinberg 牵头的研究表明,H3K4me3 和 H3K27me3 标记并不是存在于同一个 H3 尾部,这导致了核小体内的不对称分布。这种排列对二价结构域的建立和传播有影响。
不出所料,这种复杂性在一定程度上有助于微调染色质中其他基因顺式调控元件的标记。细胞类型特异性的 “活性” 增强子通常由一组表观遗传标记来定义,如 H3K4me1 和 H3K27ac。因此,当在基因组水平上分析组蛋白修饰时,发现了可复制的模式,从而可以预测哪些遗传元件是有功能的(称为表观基因组分析)。将染色质改变(核心组蛋白修饰和 DNA 甲基化的集合)与核小体位置和转录因子结合位点共定位,并与基因组的总 RNA 输出整合。具有指导意义的组蛋白修饰模式 —— 如增强子区的 H3K4me1 和 H3K27ac,启动子区的 H3K4me3,转录区的 H3K36me3,Polycomb 介导的抑制区域中的 H3K27me3 和异染色质区的 H3K9me3,已被 NIH 路线图表观基因组学联盟(Roadmap Epigenomics Consortium)和 IHEC 用于简要描述参考表观基因组并比较正常和疾病细胞状态的表观基因组特征。现在,技术的新进步使得对单细胞表观基因组的分析更加精确,其对细胞谱系维持的贡献也有了新的认识。单细胞转录组进一步拓展,已经揭示了几乎整个基因组都被转录,从而产生一系列具有不同调节功能的 ncRNAs,这些 ncRNAs 可能在表观遗传景观方面发挥重要作用,目前仍在积极研究中。
5. 发育与疾病
从上述许多突破性的发现和概念上的进展来看,涌现出了表观遗传控制的分子标志(molecular hallmarks of epigenetic control),其对于细胞身份和细胞重编程非常重要。最重要的是,这些标志响应发育和环境变化,并且可能会被染色质修饰酶的化学抑制和修饰阅读蛋白所逆转。表观遗传响应(epigenetic response)的许多方面 —— 例如,不同饮食的代谢波动、昼夜节律、衰老以及从同一基因组模板表现出表型多样性(例如基因组印记和双胞胎研究)最近已得到综述,这些超出了本文的范围。在这里,我们关注表观遗传控制的分子标志在发育(例如重编程)以及正在治疗或已被证明对表观遗传治疗有响应的人类疾病的一些关键例子(例如癌症、炎症和免疫反应)中的作用。
5.1 重编程的表观遗传障碍
表观遗传控制对细胞类型特性和细胞重编程至关重要。Weintraub 及其同事的开创性实验表明,顺式作用转录因子 MyoD—— 一种对肌肉分化至关重要的因子,可以重编程成纤维细胞。20 年后,当 Yamanaka 和他的同事们使 “时光倒流” 时,这种逻辑重新浮出水面,为 Gurdon、Briggs 和其他人经典的细胞核重编程实验提供了开创性的机制见解。他们开创性的研究表明,在分化成体成纤维细胞中表达的一小部分特定转录因子(现在称为 “Yamanaka 因子”,包括 Sox2、Oct3/4、Klf4 和 c-Myc)将诱导产生多能性,从而产生诱导多能干细胞(iPS 细胞)。
从成体组织中重新编程体细胞的潜力对再生医学具有令人兴奋的意义,尽管诱导多能干细胞的过程效率低下,且尚未准备好用于人类。染色质状态在多大程度上阻碍体细胞重编程的能力呢?通过阻断 H3K9me3 的 KMT 或用维生素 C 刺激 Jumonji 组蛋白赖氨酸去甲基化酶和 TET 酶,可提高重编程效率,这表明异染色质可能是一个障碍,至少在一定程度上,导致了这些重编程事件的低效率。为了支持这一观点,已经鉴别了 “先驱” 转录因子(pioneer tranion factors),它们能够结合到抑制性染色质区域,招募辅助因子和染色质调控因子,这些辅助因子和染色质调控因子能够诱导下游基因调控级联反应,而这种级联反应可以克服抑制性染色质状态。一般认为谱系可塑性(细胞身份的变化)具有表观遗传学基础,可能在重编程中发挥重要作用,研究观察到了染色质修饰酶表达水平变化和改变表观遗传机器的辅助因子的波动,这些为上述观点提供了支持,并会导致细胞命运的转变。
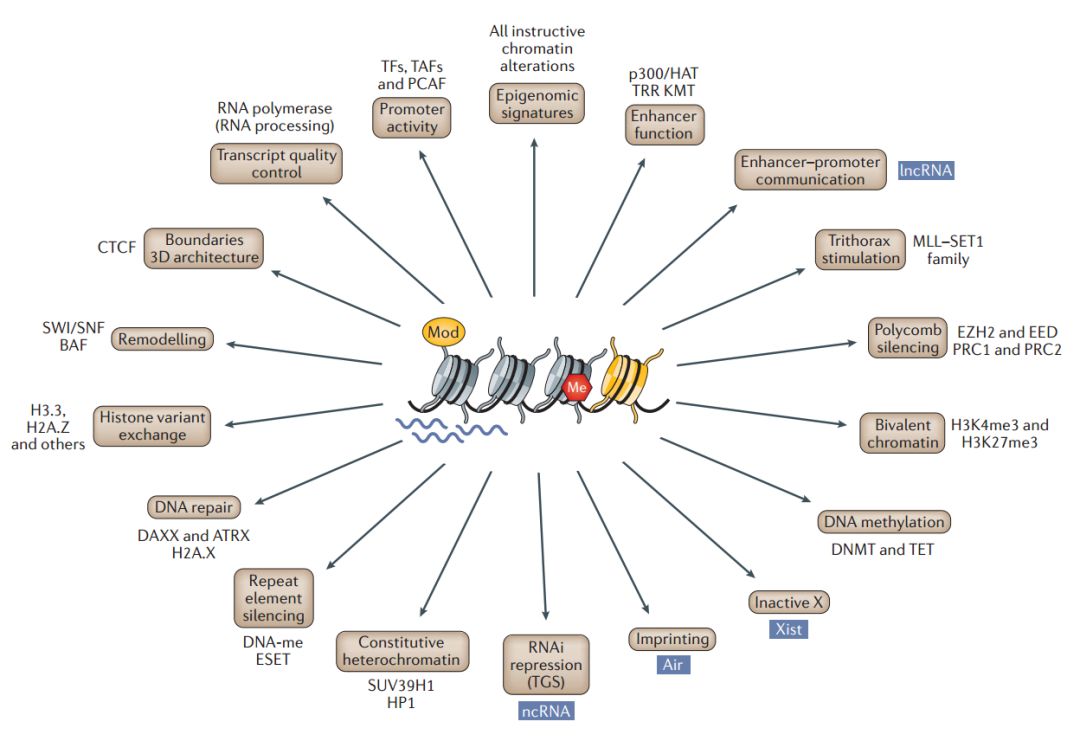
图 5. 表观遗传控制的分子标签以及它们医学相关性的案例,还有可能的治疗策略
5.2 癌症和表观遗传治疗
上面提到的大多数突破性发现的动机,并不需要与疾病产生明确的联系。癌症研究通常聚焦于肿瘤发生过程中的基因变异(如突变、基因重排和拷贝数变异),使得大多数癌症显示出明确的 “标签”。早期,人们发现异常的表观遗传特征(例如 DNA 甲基化)在癌症中具有潜在的临床重要性,为推进表观遗传治疗提供了强大动力。Jones 和 Baylin 应用 DNA 甲基化的化学抑制剂(DNMTi)重新激活异常沉默的肿瘤抑制基因,同时还使用 HDACi,例如由 Yoshida 开发的 TSA(曲古抑菌素 A)和 trapoxin,随后使用由 Marks 临床应用的 SAHA(辛二酰苯胺异羟肟酸,也称为伏立诺他),为表观遗传学这一激动人心的领域铺平了道路。
2006 年,随着美国食品和药物管理局(FDA)批准的第一批表观遗传药物(地西他滨和伏立诺他)用于人类癌症的治疗,这些概念变成了现实。逆转癌症患者的表观遗传错误为表观遗传学的重要性提供了最有说服力的论据之一。一种以表观遗传学为中心、以试剂为基础的生物技术公司产业正在兴起。甚至大型制药公司也开始采取行动,他们普遍认为,与基因改变不同,表观遗传特征中的错误将是可逆的。用 DNMTi 和 HDACi 治疗可以获得有希望的临床结果,我们从中获得启发,即其他类型的 “书写者” 和 “擦除者” 也可能成为有价值的药物靶点。此外,耐药癌细胞可以对 HDACi 和去除 KDM 的联合疗法产生响应,这种联合疗法切断了癌细胞的存活通路,并诱导更高水平的 DNA 损伤。一般认为,癌症细胞可能有更脆弱的染色质和更高的 “表观遗传噪声(epigenetic noise)”,这种概念可以解释为什么它们更容易响应选择性的杀伤治疗(通过表观遗传抑制剂与放疗结合)。
尽管迅速涌现的文献提供了表观遗传学和其他非癌症疾病之间的大量联系,但是癌症仍然是可能响应表观遗传学治疗的最有说服力的疾病。2012 年,某些类型的癌症甚至与组蛋白中的 “驱动” 突变有关,这类突变被称为 “原癌组蛋白(oncohistones)”。
组蛋白修饰酶,无论是阅读者还是擦除者,都被证明是肿瘤学中具有潜力的药物靶点。Bradner、Tarakhovskly 和 Kouzarides 团队的研究为表观遗传靶点和疗法添加了新的阅读者。他们选定了一些含溴结构域的蛋白质,例如 BET 家族的成员,而且证明这些蛋白可作为小分子(例如抑制剂 JQ1 或 iBET)的成药靶蛋白,这些小分子与乙酰赖氨酸结合口袋结合,以破坏关键蛋白质 - 组蛋白的相互作用。与 HAT 和 HDAC 的其他小分子抑制剂一样,下游反应是非随机的。例如,被这些小分子靶向的溴结构域蛋白之一 BRD4 研究得更为透彻,BRD4 反过来又参与转录延伸通路,这种通路对血癌中促进肿瘤的关键致癌基因(如 MYC)和促炎基因(如 NFKB)的表达非常关键。而现在,随着溴结构域抑制剂的成功,其他染色质阅读者也受到了极大的关注。
5.3 免疫防御
在细胞谱系特化、对外界信号的响应和细胞记忆的诱导中,染色质介导的基因调控富集于免疫系统。造血细胞系的细胞通过改变染色质状态整合信号,而且可以引起对激活状态的 “记忆”,正如巨噬细胞中那样。炎症信号(例如脂多糖)引起促炎基因(例如 NFKB,其通常已经被 RNA 聚合酶 II(Pol II)占据)的转录激活,以实现快速响应。停滞不前的 RNA Pol II 的延伸被阻止,并需要 PCAF-HAT 延伸复合物,这是许多基因的特征。NFKB 对 iBET 的选择性响应是通过干扰 PCAF 与促炎基因的结合来抑制炎症。
表观遗传控制对免疫细胞的激活也很重要,并可通过药理学治疗增强免疫反应。出乎意料的是,研究发现组蛋白甲基转移酶 EZH2 通过甲基化细胞质的肌动蛋白而转导 T 细胞活化,这为许多组蛋白修饰酶具有非组蛋白底物提供了典型的案例。此外,HDACi 可通过阻止活化诱导的细胞死亡(activation-induced cell death)来维持 T 细胞的活化。KMT G9a 的药理学抑制和释放的基因抑制导致干扰素基因的激活,并导致对病原体的抗性增加。DNMTi 不仅影响肿瘤抑制基因,还影响那些对 DNA 甲基化降低做出响应的重复元件。用低剂量的 DNMTi 对几种癌症进行治疗,激活了内源性逆转录病毒,引起 dsRNA 介导的免疫反应,随后这种免疫反应靶向肿瘤细胞。打破免疫耐受和增强免疫反应是对抗癌细胞的两种主要机制。因为几乎所有的组蛋白修饰酶也靶向许多非组蛋白蛋白(这是 Roeder 及其同事首次描述肿瘤抑制因子 p53 乙酰化时提出的概念),因此临床研究需要仔细使用和分析小分子抑制剂。具体而言,需要慎重考虑表观遗传治疗在攻击肿瘤细胞和不削弱防御性的免疫细胞之间的平衡。
涉及非组蛋白蛋白(non-histone proteins)的翻译后修饰的表观遗传控制进一步扩展了功能性染色质输出的调节。例如,组蛋白中的不同修饰盒(modification cassettes),特别是 ARKS/T 型的修饰盒也存在于几种非组蛋白的蛋白质中,并允许翻译后修饰和识别者蛋白的识别。据报道,G9a 中的一个短的组蛋白模拟物(histone mimic)需要通过自甲基化(automethylation)来触发其活性,从而产生组蛋白 “拟态(mimicry)” 的概念。流感病毒的非结构蛋白 1(NS1)含有一个氨基酸序列,该氨基酸序列与组蛋白 H3 的 N - 端密切相关,可感应 H3K4 甲基化。NS1 中的 H3K4 样甲基化会转运 PCAF 并减弱抗病毒基因的转录。因此,“组蛋白拟态” 被病原体衍生的蛋白用于抑制细胞防御。这些激动人心的发现已经被正式提出,某些组蛋白肽模拟物具有发展成新型的表观遗传药物的潜力。
5.4 染色质遗传(记忆)
在表观遗传研究的激烈争论中,一个核心问题是组蛋白及其修饰是否是表观遗传学信息的真正载体。与 DNA 甲基化或其他修饰不同,组蛋白遗传的机制仍未得到解决,部分原因是长期以来关于组蛋白(旧与新)是如何在复制叉上分离的争论。早期 Grewal 和 Klar 在裂殖酵母、Paro 及其同事在黑腹果蝇中的研究暗示染色质状态转换可能是可遗传的。最近,Moazed 和 Allshire 团队的研究表明,在缺乏顺式作用的转录因子或结合 H3K9 的 DNA 序列的情况下,H3K9 甲基化可以被瞬时诱导并在多代中遗传。重要的是,这种染色质遗传需要缺失阻碍 H3K9 甲基化的拮抗因子。Strome 及其同事的类似发现揭示了在秀丽隐杆线虫中 PRC2 介导 H3K27me3 的染色质遗传。综上所述,这些研究表明,至少在这些模型中,组蛋白可以传递它们的信息,尽管确切的分子机制正在积极研究中。为此,Reinberg、Gamblin 及其同事表明,抑制性组蛋白标记 H3K27me3 的传播是通过其非催化亚基 EED 对 PRC2 复合物的正向变构调节引起的。这些关于 PRC2 的研究和新的结构工作非常重要,因为它们为染色质前馈环路(feed-forward loops)提供了生化证据,而前馈环路很可能有助于组蛋白修饰的遗传。
这样的结果是否可以推广到表观遗传因子的多代遗传,即跨代遗传(transgenerational inheritance)这一普遍现象?事实上,果蝇和小鼠中的研究表明,饮食和其他环境因素的变化,特别是父亲的饮食,可以传递给子代,并重新编程子代的代谢,从而导致世代的肥胖。和在裂殖酵母中的实验一样,组蛋白甲基化的改变似乎参与其中。由于组蛋白标记可以影响负责从头 DNA 甲基化以及 ncRNA 表达的酶系统,因此其他更传统的核酸模板机制也可能进入整体的表观遗传学遗传程式。在植物中,“表观遗传控制者”—— 移动 RNA,已被证明是表观遗传信息的载体,并且小 RNA 序列已被用于受精的小鼠卵母细胞的重编程。近期研究在精子中检测到 ncRNA 和 tRNA 片段,这表明不仅只有 DNA 序列可以被遗传。
6. 展望
在过去的 20 年里,表观遗传调控的分子机制的解析取得了意想不到的进展,这对更好地理解正常发育以及人类疾病的治疗具有深远影响。在此,我们提倡对表观基因组特征进行更精确的定义,借鉴单细胞分析的进展,但强调有必要区分表观基因组改变的原因或结果。为此,我们将继续使用 CRISPR-Cas9 基因编辑技术,以便对遗传和表观遗传调控进行更全面的解析。染色质动力学不再被认为是一维或二维的问题,因为三维空间中的长期相互作用,产生了构建基因组的拓扑相关结构域(TAD)和其他染色质区域(chromatin territories),其有很好的文献记载以及定义它们的新方法。此外,ncRNA 在表观遗传调控的许多方面的重要性远远超出 RNAi 介导的 TGS 和 miRNA 依赖的 PTGS,并揭示了越来越多的染色质相关的 RNA(例如,lncRNAs、增强子 RNA 和重复 RNA),它们可以启动和稳定不同的染色质状态,甚至在具有相同 DNA 序列的等位基因中也是如此。事实上,RNA 被认为是表观遗传调控的 “主要分子” 之一,ncRNA 的重要功能在最近的综述中已经被详细阐述。
随着更精准的抑制剂(如 HDACi、DNMTi、iBET 和去乙酰化酶抑制剂)的开发,对更复杂的人类疾病(如代谢和神经退行性疾病)和习以为常的功能(如学习和记忆)的探索性研究将揭示对表观遗传联合疗法的响应。此外,新的实验系统正被用来分析表观遗传学对群居昆虫行为和表型多态性的贡献。特别是对于代谢紊乱和环境驱动的适应,染色质似乎是整合变化输入的生理模板。鉴于 1996 年至 2016 年间取得的进展,我们预计会有更多的发现将继续揭示染色质适应性是如何组织和显露存储在我们基因组中的信息的。
全文完。
编译整理:杨智聪、刘梦醒、徐鹏
via:
- Nat Rev Genet | 20 年来表观遗传领域核心进展之全景解读_部分 Epigenetics 表观遗传学 2019-02-26 08:43
https://www.sohu.com/a/297864389_688647
Nature 综述 | 表观遗传研究将遗传与环境和疾病相连接
发布于 2019-12-01 11:31
BioArt 生物艺术
编译 | 章台柳
责编 | 兮
从受精卵如何发育成为成百种高度特化的细胞类型组成的生物体,一直都是生物学家所追寻的奥秘。不同类型的细胞表达 “一套特定组合” 的基因,即细胞身份决定。这种基因表达模式需要建立和维持,两个过程既不同又互相关联。初始细胞的多能性和细胞类型的建立依赖于成百个转录因子的协同作用,其与特定的 DNA 序列结合激活或抑制细胞谱系基因的转录。
在 1942 年 Conrad H. Waddington 提出 “表观遗传学” 概念的初始阶段,所对应的的意思和当今主流定义有别,主要用于描述个体生物发育过程中基因型决定表型的机制。
而后续围绕 “表观遗传” 的定义则是强调不改变 DNA 序列,对可变化的染色质状态的遗传,这一主流 “表观遗传学” 概念首先由 Nanney D.L 提出,然后 Arthur D. Riggs 和 Holliday 推动,Bird 等进一步修正得到(1996 年, Arthur D. Riggs 将 “表观遗传学” 定义为 “研究在有丝分裂和 / 或减数分裂过程中不能用 DNA 序列改变来解释基因功能的可继承性改变”;2008 年,在美国举行的染色质冷泉港会议上, “表观遗传学” 被正式定义为 “不依赖于 DNA 序列的变化而是由于染色体改变所产生的稳定可遗传的表型”。)。
DNA 甲基化、染色质蛋白、非编码 RNA 都是表观遗传信息的重要载体。如组蛋白变体和组蛋白修饰直接或间接地影响染色质结构。同时,高阶 3D 染色质折叠也可以调控基因表达,有助于遗传。表观遗传研究在 21 世纪发展迅速,给我们带来兴奋和希望的同时,也产生 “过度热议”。

近日,来自法国的Giacomo Cavalli和Edith Heard在*Nature*杂志上发表综述文章Advances in epigenetics link genetics to the environment and disease*,文章对表观遗传学的定义采用 “在相同 DNA 序列条件下,能够持续性改变基因活性状态的分子和机制的研究”。
重点探讨以下几个问题:调节可塑性和稳定的表观遗传力之间的相互作用,包括发育、生理刺激、疾病状态下细胞谱系决定和重编程;非编码 RNA、DNA 甲基化、异染色质、多梳蛋白(Polycomb)、Trithorax 蛋白、3D 基因组结构如何调控遗传和基因表达,以及研究中发明的最新技术;探讨代际间的表观遗传,特别是哺乳动物;环境对表观遗传的影响,表观遗传改变对基因完整性的影响;表观遗传研究如何惠及人类健康。

表观遗传的继承性与可塑性
对多种模式动物生物过程的研究表明,染色质作为表观遗传信息的载体,在细胞分裂中能够传递基因激活和失活的状态。比如酵母中异染色质的遗传;哺乳动物中 X 染色体失活和基因组印记;植物的春化作用;果蝇的位置效应斑等。这些研究证明一旦表达模式建立,即使没有原始信号,不同的基因表达状态也可以在细胞分裂的子代细胞中传递。种系和早期胚胎发生、诱导多能干细胞(iPS)、体细胞核转移中的细胞重编程研究显示染色质和 DNA 甲基化是重要的 “表观遗传障碍”,阻止基因表达变化和细胞身份决定。

表观遗传系统(epigenetic systems)包括异染色质(HP1)、H3K9me3、多梳蛋白(PRC1、PRC2)和 Trithorax(complex proteins associated with SET1,COMPASS)复合物等。通过修饰组蛋白,与各自的组蛋白标志结合保证稳定的遗传。
实际上,核小体不断地被重塑,组蛋白可以交换,所有的 DNA 和组蛋白标志都是可逆的,虽然不同的基因组结构域其交换的速率和标志的稳定性不同。因此,一旦维持染色质状态的自我加强环路消失,大部分的调节性信号都会迅速失去。而且表观遗传标志物需要在细胞分裂过程中经历 DNA 复制和有丝分裂。
核小体的复制并不是一个 DNA 模版为基础的复制系统,亲本的 H3、H4 组蛋白位于要复制位点的几百个碱基内,一旦复制,它们需要在特定分子复合物的作用下大致均匀分布到 DNA 分子的先导链和后随链。即染色质成熟因子,包括 DNMT1-UHRF1、EZH2 和 HP1 利用 PCNA 或 ORC 作为连接组分;Polycomb 利用其 DNA 锚定因子传递有丝分裂记忆(mitotic memory);有丝分裂中调节性组分包括转录因子和上述表观遗传因子。
有丝分裂和减数分裂中,核小体缺乏精确的 “复制过程”,并伴随着很多 DNA 结合因子和染色体相关组分的丢失,对单个核小体标志物的遗传变得极具挑战。数学建模分析和生物相关证据表明染色质遗传需要建立几百 kb 的结构域。
而基因组是由核小体结合、染色质环、染色体域(拓扑结构域,TADs)、活跃或抑制性间隔和染色体域等一系列的 3D 结构组成,TADs 和间隔能稳定染色质的功能性状态,并驱动子代对其的继承。
总之,表观的遗传有多种层次的调控,需要依赖 DNA 序列,而且需要部分重叠信号的协同。**每一层的调控都增加表观遗传的稳定性,但它们均是可逆的,这就给重塑提供可能。**对染色质状态的继承依赖于染色质结构域、自我增强机制,需要在 DNA 复制和有丝分裂中保留转录因子、组蛋白变体和组蛋白修饰。
表观遗传与 DNA 序列变化
DNA 序列变化和表观遗传紧密相关。染色质状态影响转录因子的结合,DNA 序列多态性影响染色质状态。染色质和 DNA 甲基化在人类中间差异很大,而且可以调控基因组的稳定性和可变性。转座子元件是表观沉默的常见靶点,影响基因表达和基因组完整性。
表观遗传的遗传效应
每个个体的基因组都要经历自然的和环境诱导的突变。虽然大多数突变是中性的,但序列的多态性可以影响表观基因组图谱。例如,对来自于不同祖先的父母和孩子的染色质可接近性和 CTCF 的 DNA 结合情况进行分析,发现相当多的结合位点具有祖先特异性,即遗传性变异导致不同的结合情况。而 CTCF 可以影响 3D 基因组结构和基因表达,那么突变可能导致表观遗传图谱的改变。此外,疾病中常常出现突变影响组蛋白和 DNA 甲基转移酶、去甲基化酶、染色质重塑蛋白、组蛋白等其他染色质因子的功能,影响表观遗传图谱。
染色质、DNA 甲基化和突变
不同条件下,基因组的不同部分的突变速率各异,与细胞来源、环境因素和疾病种类如癌症类型有关。DNA 甲基化、核小体位置、高阶染色质折叠都能够影响突变速率。对先天畸形的病人调查的染色质异常进行调查分析,其中 7.3% 的病人其已知综合征相关基因位点的 TADs 被破坏;人类癌症中经常检测到 CTCF 突变,对多发性骨髓瘤进行 Hi-C 检测,发现 CTCF 结合的 TAD 边界的变异断点的拷贝数显著富集。癌症中存在失活 X 染色体的过度突变,可能由于癌症细胞需要异常过度增殖导致 DNA 复制压力。
重复基因组的作用
转座子元件(transposableelements,TE)即一段可移动的 DNA 序列,能够插入到基因组的其他位置。TE 是大多数真核细胞基因组的重要组成部分,具有基因调控的潜能,导致表型的多样性。McClintock 提出,环境变化或发育过程中,TE 可以被 “on” 或者 “off”,可作为 “控制元件”。转座子通过作为调控元件或干扰转录过程而影响基因活性。基因组进化出物种特异的机制来限制转座子活性,如利用特定 RNA 或 DNA 结合因子靶向抑制性异染色质机器。
果蝇中,异染色质依赖的机制促进特定簇的转座子表达,产生 PIWI 作用 RNA(piRNA);反过来,piRNA 抑制转座作用。piRNA 是亲本遗传的,可以通过 ping-pong 系统扩增,有效帮助机体抵制新的入侵。线虫利用异染色质组分抑制不合理的重复 DNA 转录,维持基因组稳定性。植物利用专用聚合酶产生小 RNA,靶向 DNA 甲基化和 H3K9 甲基化机器。哺乳动物利用多种策略,近期研究较多的是 KAP1 蛋白(又叫 TRIM28)通过与 KZFPs 蛋白的相互作用,招募异染色质蛋白如 SETDB1,抑制内生逆转录病毒(ERVs);同时 KZFP 和 ERVs 附近的基因相结合,加快基因调控策略的进化速度,影响基因表达动力学和表达幅度。
环境表观遗传学
基因 - 环境的相互作用决定了具有相同或不同表型的个体如何对环境变量响应。环境对表观遗传的重要性,特别是 Polycomb 为基础的植物春化作用,在植物中研究颇多;而类似的过程也存在于一些动物物种。
动物中的环境表观遗传调控
果蝇中,环境诱导的表型依赖于表观遗传调控,可以传递几代;线虫可以将几种环境刺激如病毒感染、饥饿、温度升高等转换成表观遗传组分的修饰。环境影响表观遗传绝不仅仅只在模式研究动物中出现。有一种海龟品种,其性别取决于孵化过程中的温度;KDM6B H3K27me3 特异的去甲基酶具有两性、温度依赖性表达的特性,能够调控性别决定基因 Dmrt1(Science 丨浙江万里学院青年教师破解半个世纪的谜团,揭示乌龟性别决定机理)。一种澳大利亚的蜥蜴,染色质的性别决定被高温所改写,产生了性别反转的雌性后代;温度诱导 KDM6B 和 JARID2 产生可变剪切,影响 PRC2 的招募。
哺乳动物中代谢和表观遗传
DNA 和染色质修饰需要使用代谢性产物。如 S - 腺苷基甲硫氨酸(SAM)是 DNA 和组蛋白甲基化的甲基供体;叶酸和维生素 B6、B12 诱导 SAM 产生;α- 酮戊二酸(αKG)对 DNA、组蛋白去甲基化是必需的;琥珀酸和延胡索酸抑制 DNA、组蛋白去甲基化酶;乙酰 - 辅酶 A 是组蛋白乙酰化的乙酰基供体;β- 羟丁酸抑制 I 类组蛋白去乙酰化酶;NAD+/NADH 调控 III 类组蛋白去乙酰化酶。因此,代谢的改变能够引起表观基因组的全局性扰动,如 DNA 甲基化、Polycomb 组分、tRNA 片段等,而代谢组分的突变或许代表着潜在的治疗靶点。
另一方面,代谢改变调控特定位点,诱导能够在代际间遗传的持久性表观遗传修饰。在小鼠中限制蛋白的摄入诱导 DNA 甲基化,抑制一部分 rDNA 基因的表达。总之,诸多的证据表明环境和表观遗传调控相关联。但是评估混杂效应、多因素暴露的影响等与表观遗传变异的因果关系仍然具有挑战,尤其是在人类样本中。而最近的发现 —— 组蛋白去甲基化酶 KDM5A、KDM6A 可以感知氧浓度,调控 H3K4me3、H3K27me3—— 或许是这个方向研究的第一步。
表观遗传的隔代效应
现代进化理论认为进化主要通过表型的自然选择,最终影响 DNA 序列。非 DNA 序列信息如父母、生态、行为和文化信息等可以遗传,这个发现与现代进化理论的框架并不冲突。我们可以推断最终是 DNA 驱动的父母、生态、行为等信息,DNA 序列可以解释遗传的复杂性。
植物和动物中多项证据显示表观遗传的隔代效应,并且可能参与建立早期发育模式。酵母存在着隔代的表观遗传继承(TEI),参与 RNAi 依赖的异染色质沉积,导致 Clr4 - 依赖的 H3K9me3 修饰;如果没有 RNAi 依赖的扩增过程,H3K9me3 修饰不足以驱动稳定的表观遗传记忆,除非组蛋白去甲基化酶 Epe1 突变失活。植物也存在 TEI,植物的表观等位基因可以在多代中保持稳定。TEI 通常由 RNA 介导的 DNA 甲基化维持,染色质组分如组蛋白伴侣分子 CAF-1 可以调控 DNA 甲基化依赖的 TEI。
与植物不同,大多数有性繁殖的有机体中,生殖系和体细胞分离,信息的流动方向智能是从生殖细胞到体细胞。而且,大多数表观基因组特征在减数分裂过程中被抹去。那么一个重要的问题是,有多少的表观遗传能够在减数分裂过程中保留?线虫的表观等位基因由异染色质组分介导,根据诱导模式不同可能依赖或非依赖 piRNA。果蝇中,热激或渗透压应激条件下,异染色质组分诱导 TEI;转座子元件活性导致 piRNA,pi RNA 产生 TEI;Polycomb 蛋白依赖的机制可以导致 TEI。低蛋白饮食导致 PRC2 酶活性亚基 E(z)上调或者抑制 PRC2 能够导致 H3K27me3 的变化,并影响寿命,这种影响至少能够传递 2 代。这些数据表明异染色质和 Polycomb 可以诱导隔代的表观遗传继承(TEI)。
哺乳动物的隔代遗传
脊椎动物在受精后和发育原始生殖细胞过程中,其 DNA 甲基化经历两次全局性的削弱,组蛋白标记和 3D 基因组排列也经历重编程,而且在哺乳动物,尤其是人类中很难排除潜在的混杂因素,如母亲的贡献、精液的成份、子宫的变化及产后影响等。所以哺乳动物中存在隔代的表观遗传吗?
一个经典的例子就是,IAP 内生逆转录病毒在小鼠皮毛颜色位点的插入取决于遗传的皮毛颜色基因的替代启动子上 IAP 逆转录病毒的甲基化状态。但最近的调查显示 IAP 的插入能经历多代遗传的很少。有些报道称饮食或化学暴露和行为应激能够遗传多代,但其中一些结果值得质疑。
人群数据调查显示 20 世纪初祖父母的食物供给和后几代的死亡率有关,但具体分子机制不明。DNA 甲基化有可能参与其中,人类原始生殖细胞生成需要经历去甲基化,但参与神经和代谢紊乱的逆转录因子和一些基因仍保持甲基化状态。
最近一项研究显示,高脂饮食诱导胰岛素抵抗、肥胖和成瘾性行为可以最多遗传到第三代,但是没有检测出 DNA 甲基化的遗传性变化。其他的染色质组分也可能参与其中。在精子生成过程中,瞬时过表达 H3K4 特异的 KDM1A 组蛋白去甲基化酶导致 TEI。这些研究表明 TEI 在人类中受到限制,但是有存在的可能性。我们需要对 TEI 的形成机制、DNA 序列和表观遗传变化在疾病中的作用等问题进一步研究。
表观遗传、健康和疾病
表观遗传组分的突变如 DNA 甲基化、组蛋白修饰、非编码 RNA 等改变在疾病中非常普遍,如果能够区分表观遗传改变是疾病发生的 “驾驶员” 还是 “乘客” 角色,那么就能够判定表观遗传对疾病诊断、预后和治疗的影响。研究表观遗传组分和其他疾病间相互作用有利于开发组合干预的方法。
衰老的表观遗传
利用机器学习分析高通量 DNA 甲基化数据显示,353 个基因组位点的 CpG 甲基化状态与年龄高度相关,所以称为表观遗传时钟(epigenetic clock)。而且,高体质指数加快表观遗传时钟;较高的教育水平、运动状态、低体质指数、健康的饮食能够减缓表观遗传时钟。多数的 353CpG 位于二价基因(bivalent gene)的平衡启动子或活跃启动子上,表明衰老可能与二价基因表达的可塑性减少相关。近期,综合年龄的临床表型,鉴定出一组能够更好地预测寿命和健康的 CpG 基因组位点。建立老化过程和 CpG 甲基化改变之间的联系对确定老化原因至关重要。
发育表观遗传学和疾病
Barker 提出假说,在特殊敏感时期如胎儿发育和幼年时期,一些环境因素的暴露如化学因素、药物、应激、感染等可能导致机体在成年期得病。后续的工作表明表观遗传组分可能参与其中,表观遗传组的长期改变影响癌症、肥胖、糖尿病、神经疾病、以及年龄相关的疾病如帕金森、阿尔兹海默症等疾病的易感性。
胚胎发育和幼儿期是两个重要的窗口期,此时的表观遗传编程对环境因素如饮食、温度、环境毒素、母亲的行为、童年的虐待等都很敏感。而青春期是行为分子表观遗传的重要窗口期,不良生活经历影响焦虑、抑郁和攻击性行为的风险,可能与特定基因的 DNA 甲基化或 HDAC1 水平变化有关。而且,记忆的形成与环境刺激相关,与特定位点上组蛋白和 DNA 的修饰相关。未来的研究应该要确定这些变化是否存在因果关系。
癌症的表观遗传学
在多种癌症中,编码表观遗传组分的基因发生突变,包括 DNA 甲基化酶、去甲基化酶、组蛋白、组蛋白修饰、参与染色质重塑和染色体结构的基因等,同时代谢性基因如 IDH1、IDH2 能够影响组蛋白和 DNA 甲基化,进而影响 3D 基因组结构,在癌症中也常常发生突变。重复的 DNA 元件也参与癌症的发生。
例如,在霍奇金淋巴瘤中,IRF5 的转录是由位于启动子上游的一个正常休眠的内生性逆转录冰露长末端重复序列的 DNA 地甲基化诱导,驱动肿瘤的发展。虽然表观遗传的变动常常伴随着肿瘤驱动基因的突变,但在小鼠中出现没有驱动基因的 DNA 突变也可以诱导肿瘤产生的案例。而且,对胰腺癌转移的分析没有发现任何明显的驱动突变;相反,观察到大规模的染色质重编程,许多染色体区域的 H3K9me3 水平发生改变。这些发现表明表观遗传的改变在特定情景下能够是癌症进程的主要驱动者。
总结
20 世纪下半叶的重大发现是人们对于 DNA 在进化、生物学、医学中的作用的认知,从而将 DNA 视为 “生命之书”。但 “DNA 不是你的宿命”,因为相同的 DNA 对应着不同的遗传表型,这就是表观遗传学的力量。表型是由基因组组成、表观遗传组分、环境输入三者间的结合而造就。对表观遗传的研究可以推动着个人化的精准药物的研发,可以阐述生活习惯和 “心 - 身” 干扰对健康的作用,这些表观遗传的深入研究必将深化我们的知识,惠及人类的健康。
原文链接:
https://doi.org/10.1038/s41586-019-1411-0doi.org/10.1038/s41586-019-1411-0
制版人:小娴子
发布于 2019-12-01 11:31
-
『珍藏版』 Nature 综述 | 表观遗传研究将遗传与环境和疾病相连接 - 知乎
Science|新研究揭示表观遗传学如何影响哺乳动物记忆形成
原创 生物谷 生物谷 2024 年 08 月 10 日 19:59 上海
当我们形成新的记忆时,大脑不仅是一个静默的观察者,它会经历显著的物理与功能转变,这些转变共同构成了所谓的 “记忆痕迹”(memory trace)。记忆痕迹代表了特定活动模式和神经元的结构变化,这些变化发生在记忆的形成过程中以及后来的回忆中。
然而,大脑是如何 “选择” 特定的神经元参与到记忆痕迹中的呢?现有的研究表明,神经元自身的兴奋性在这个过程中扮演了重要角色,但长久以来,对于神经元核心 —— 细胞核的探索却鲜少触及。
在细胞核中,存在着一个尚未被充分探索的领域:表观遗传学。 尽管所有细胞共享相同的 DNA 编码,但皮肤细胞、肾脏细胞或是神经细胞等不同细胞类型,各自激活独特的基因组合。表观遗传学研究的是细胞如何在不改变 DNA 序列的前提下调控基因活性的机制。

如今,在一项新的研究中,洛桑联邦理工学院神经科学家 Johannes Gräff 及其团队 深入探索了表观遗传学在决定神经元能否成为记忆编码一员中的作用。他们通过小鼠实验揭示,神经元的表观遗传状态对其在记忆形成中的参与至关重要。
相关研究结果发表在 2024 年 7 月 26 日的Science期刊上,论文标题为*“Chromatin plasticity predetermines neuronal eligibility for memory trace formation”。*
Gräff 团队旨在探讨表观遗传因素如何影响神经元的记忆功能。当神经元细胞核内的 DNA 结构松弛时,神经元在表观遗传层面上处于开放状态;反之,若 DNA 紧密缠绕,则神经元处于闭合状态。Gräff 指出,“我们的研究从 DNA 层面解开了记忆形成的第一环。”
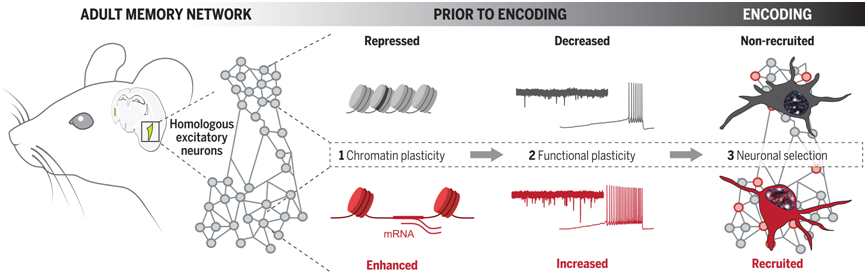
染色质可塑性有利于信息编码
图片来自 Science, 2024, doi:10.1126/science.adg9982
他们发现,处于开放状态的神经元更可能被纳入记忆痕迹之中。 记忆痕迹,即大脑中稀疏分布的神经元群,其电活动在学习新知时尤为活跃。实际上,染色质更开放的神经元展示出更高的电生理活性。
接下来,研究者通过病毒载体递送表观遗传酶,人工诱导神经元的开放性,结果发现小鼠的学习表现显著提升。相反,当采用手段使神经元 DNA 闭合时,小鼠的学习能力则大打折扣。这些发现开启了理解神经元核内编码学习过程的新视角,未来或许能催生改善学习效能的疗法。
正如 Gräff 所言,“我们的成果挑战了神经科学中关于学习与记忆的传统观点,即过度强调突触可塑性,转而聚焦于神经元核内部的动态,特别是其 DNA 层面。这一视角的转变尤为重要,因为诸如阿尔茨海默病和创伤后应激障碍等认知障碍,其病理机制往往与表观遗传调节失常息息相关。”
参考资料:
Giulia Santoni et al. Chromatin plasticity predetermines neuronal eligibility for memory trace formation. Science, 2024, doi:10.1126/science.adg9982.
via:
- Science|新研究揭示表观遗传学如何影响哺乳动物记忆形成 原创 生物谷 2024 年 08 月 10 日 19:59 上海
https://mp.weixin.qq.com/s/eqEVv9O6Tr_7u0Q2FlLpKg
男女思维不同?可能与性别差异的表观遗传机制有关
原创 医学论坛网 2024 年 08 月 27 日 17:59 北京
【CMT&CHTV 文献精粹】
导语:性别差异,源自大脑深处的奥秘,一项研究揭示了表观遗传学在其中的作用。
在日常生活中,性别差异可能以微妙而有趣的方式表现出来,比如对同一部电影的喜好、对颜色的偏好,甚至是对同一道菜的口感评价。这些日常中的小差异,实际上与大脑的工作方式紧密相关。
研究表明,性别可能影响个体对情绪的表达和理解,以及对环境变化的适应能力。在认知功能方面,如空间能力、语言处理和记忆力,男性和女性有时表现出各自的优势。此外,性别还与某些神经和精神疾病的发病机制和治疗效果有关,这可能与大脑中神经递质的活动、激素水平或神经网络的结构差异有关。
性别差异的生物学基础,尤其是在表观遗传学层面的调控机制,仍有许多未知之处。探索这些差异背后的分子机制,不仅能够更好地理解大脑如何影响行为和情感,还可能为开发针对特定性别的疾病预防和治疗策略提供线索。
2024 年 1 月,Trends in Neurosciences发表了一篇题为 “Epigenetic mechanisms underlying sex differences in the brain and behavior” 的综述,旨在整合当前的科学发现,探讨性别差异背后的表观遗传机制,为理解性别在大脑疾病中的作用提供了新的视角。

综述的核心目的在于深入探讨性别差异如何在大脑和行为中通过表观遗传机制得到体现,并总结这一领域的科学发现。通过系统性地分析和整合现有的科学文献,本研究旨在提供一个全面的视角,以理解性别如何影响大脑的结构与功能。
综述采用了系统性的方法来分析文献,确保了研究的全面性和客观性。纳入的研究涵盖啮齿类动物和人类的研究,以揭示性别差异在不同物种中的共性和特异性。通过对研究的分组,作者专注于不同生命阶段的性别特异性神经行为变化,包括产前、围产期、青春期和成年期。
01 内容概述
性别差异不仅在分子层面有所反映,更在结构和行为层面展现出性别之间的特异性。具体来说,性腺激素、性染色体以及环境因素通过调控脑细胞的染色质和转录状态,对神经行为变化起到了决定性作用(图 1)。
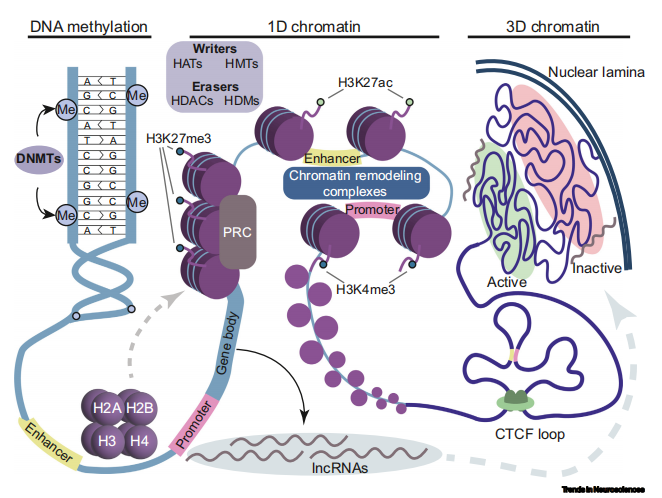
图 1 表观遗传调控概述
围产期性激素的组织性作用
在围产期,性激素如睾酮和雌二醇通过特定的表观遗传机制,对大脑结构进行永久性的改变。例如,睾酮通过转化为雌二醇,进而影响成年后与繁殖相关的行为,这一过程中涉及到 DNA 甲基化和组蛋白修饰的变化。
有研究显示,在围产期暴露于性激素的实验动物,其大脑部分性别二态性核体积(the volume of certain sexually dimorphic nuclei)和神经化学特征出现了性别特异性的差异。
性染色体对神经特征的作用
性染色体,尤其是 X 染色体的失活,是性别差异大脑特征的另一个重要来源。X 染色体失活过程中涉及的长非编码 RNA Xist,通过招募多种蛋白复合体,引起染色质结构的重大变化,包括组蛋白的去乙酰化和 DNA 的甲基化。
此外,一些基因能够逃脱 X 染色体失活,这些基因的表达在性别间存在不平衡,可能对性别特异性的神经行为产生影响(图 2)。
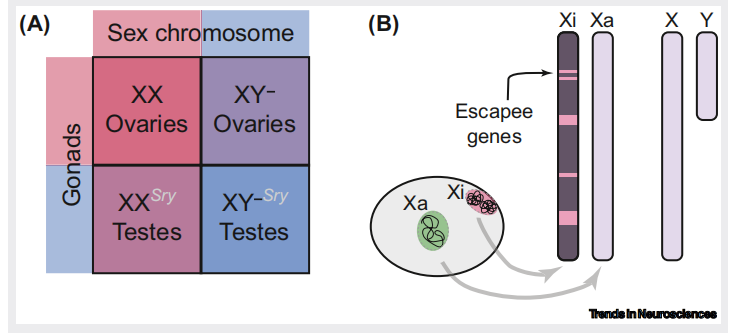
图 2 性染色体对大脑性别差异的贡献
环境因素的调节作用
环境因素,如早期生活压力和药物暴露,也被证实能够通过表观遗传机制影响性别特异性的神经行为。例如,早期生活压力能够引起特定脑区基因表达的性别特异性变化,这些变化与成年后的行为和情绪反应有关。
性别差异对神经精神疾病的意义
综述中指出,性别差异在神经和精神疾病中的体现尤为显著。例如,抑郁症和焦虑症在女性中的发病率显著高于男性,而自闭症则在男性中更为常见。这些性别差异的发现提示在开发治疗策略时,需要考虑到性别因素。例如,针对男性女性不同的激素治疗或环境干预措施,可能在治疗某些神经精神疾病时更为有效。
02 总结讨论
综述讨论部分强调,尽管在性别差异的表观遗传学方面取得了进展,但仍在未来探讨性激素与性染色体如何协同影响大脑性分化,以及环境因素如何通过表观遗传机制与生物学过程相互作用。
解决这些问题对于深入理解性别在神经发育中的角色至关重要,并有助于开发性别特异性的疾病预防和治疗策略。综述同时强调,在神经科学研究中考虑性别变量的重要性,这不仅提升研究的准确性,也是推动科学性别平等的关键。通过这种全面的研究视角,我们能更好地理解性别对大脑结构和功能的影响,为个体化医疗提供支持。
参考文献
KUNDAKOVIC M, TICKERHOOF M. Epigenetic mechanisms underlying sex differences in the brain and behavior [J]. Trends Neurosci, 2024, 47 (1): 18-35. DOI: 10.1016/j.tins.2023.09.007.
“医学论坛网” 发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
编辑:耳东
二审:薄荷
三审:清扬
排版:半夏
via:
-
男女思维不同?可能与性别差异的表观遗传机制有关 原创 医学论坛网 2024 年 08 月 27 日 17:59 北京






















 2495
2495

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








