Functional divergence of CYP76AKs shapes the chemodiversity of abietane-type diterpenoids in genus Salvia
"CYP76AKs的功能分化塑造了鼠尾草属中松香烷型二萜化合物的化学多样性",一片比较转录组的文献,类似比较转录组分析揭示了116种山茶属(Camellia)植物的深层系统发育和次生代谢物演化-文献精读分享1
各位大佬有类似文献评论区留言~

摘要
鼠尾草属(Lamiaceae)包括众多不同的药用植物,其中萜类化合物是其主要的活性化学成分之一。松香烷型二萜化合物(ATDs),如丹参酮和鼠尾草酸,是鼠尾草属特有的,且在不同谱系中展现出分类化学多样性。为了阐明ATD化学多样性的演化过程,我们对71种鼠尾草属植物进行了大规模的代谢和系统发育分析,结合了酶功能、祖先序列和化学特征重建,以及比较基因组实验。这种综合方法表明,鼠尾草属中全谱系的ATD多样性是由于在C-20处萜类骨架的氧化差异引起的,而这是由细胞色素P450亚家族CYP76AK的功能分化所引起的。这些发现展示了植物中独特的化学多样性模式,该模式是通过酶活性的丧失和相关的催化途径所塑造的。
引言
植物来源的天然产物是药理研究和健康产品开发的宝贵资源,它们的结构多样性与各种生物活性相关。紫杉醇是从红豆杉(Taxus chinensis (Pilg.) Rehder)中获得的二萜生物碱,青蒿素是从青蒿(Artemisia annua L.)中得到的倍半萜类化合物,由于它们在抗癌和抗疟效果方面的卓越表现,受到全球关注。由于对天然产物的高需求,通过代谢工程获得特定化合物的方法已成为一种主要趋势,这需要阐明生物合成途径并识别参与这些途径的关键基因。
大多数从植物中获得的天然产物是专业代谢产物。然而,当途径复杂且包含多个步骤时,阐明生物合成途径受到限制,这使得识别相关基因变得具有挑战性。通常情况下,植物专业代谢产物的出现是一种进化的防御机制,它保护植物免受生物和非生物胁迫的侵害,其化学多样性反映在它们骨架的多样性和化学修饰的多样性中。一般来说,相似的骨架来源于同源植物内相似的生物合成途径。然而,基于相同骨架的天然产物通过各种化学修饰(如糖基化、甲基化、羟基化、酰化、引酮化)在物种内部具有多样性。这种结构修饰在植物对外界环境的变化做出反应以促进其生长和发展方面起着重要作用。
鉴于近年来组学技术的迅速发展,现在可以在谱系尺度上追踪代谢物的起源、分布和组成,并揭示它们的古老或新的功能,以及随时间推移其生物合成途径的出现和辐射。例如,薄荷植物基因组计划在此方面做出了重要贡献,通过研究唇形科家族中挥发性萜类化合物的分布模式,探索了该家族各个谱系中环烯醚萜途径的辐射。它们还深入探讨了荆芥属中荆芥内脂生物合成丧失和随后再演化的机制。另一个高度代表性的例子是罂粟属(罂粟科)中吗啡类化合物的起源。通过追踪罂粟属基因组中STORR基因的融合事件,并将其与全基因组重复(WGD)、染色体重排和亚基因组演化相联系,证明了这种专业代谢产物的创新。因此,建立物种间自然产物多样性形成的遗传机制对于了解途径、为代谢工程和分子育种提供合成元素至关重要。
丹参酮和鼠尾草酸相关化合物是唇形科中特有的松香烷型二萜类化合物(ATDs)。丹参酮最初是从丹参(Salvia miltiorrhiza Bunge)中发现的,并被用于治疗冠心病、心绞痛和心肌梗死等疾病。鼠尾草酸及其在欧洲鼠尾草(Salvia officinalis L.)中发现的衍生物具有强大的抗氧化、抗寄生虫、抗肿瘤、抗真菌、抗脂肪生成、抗菌等活性。这些ATDs的特定生物合成始于它们共同前体次丹参酮二烯的生物合成,由焦磷酸合酶(CPS)和类贝壳杉烯合成酶(KSL)催化。在丹参中,CYP76AH1催化次丹参酮二烯在C-12处的氧化形成铁锈醇。此外,CYP76AH亚家族的其他成员可以催化次丹参酮二烯在C-7、-11和-12处的氧化,生成具有ATD环上多种修饰的代谢物阵列。CYP76AK亚家族进一步促进了鼠尾草中ATDs的特异性和多样性。例如,来自欧洲鼠尾草、丛鼠尾草和苹果鼠尾草的CYP76AK6,以及来自迷迭香鼠尾草的CYP76AK7和CYP76AK8,将11-羟基铁锈醇转化为鼠尾草酸,通过在C-20处产生羧基基团,而来自丹参的CYP76AK1只执行在C-20处的羟化生成羟基基团。这表明CYP76AK的功能多样性可能有助于不同鼠尾草物种中存在不同类型的ATDs。此外,值得注意的是,存在于C-20位置的氧化模式也可能在形成丹参酮的关键前体米特酮中起着至关重要的作用。这可能涉及解甲基化过程(导致C-20的丧失)和B环的芳香化,这些在途径中仍然是未解决的催化步骤。因此,对ATDs分布的全谱系特性、CYP76AKs功能以及相关的进化事件进行评估对于揭示丹参酮生物合成途径至关重要。此外,在植物CYP家族演化的情况下,CYP76AKs的动态将为CYP76AK家族演化中功能分化和基因组演化之间的相互作用提供见解。
鼠尾草属(Lamiaceae, Nepetoideae)是唇形科中最大的属,包括约1000种植物,其中包括一些文化和经济上重要的物种,被用作传统草药(例如丹参和欧洲鼠尾草)、香料(例如香草鼠尾草)、观赏植物(例如一串红)和功能性食品(例如凤梨藜)等。鼠尾草分布广泛,包括三个物种多样性中心:中南美洲(约500种)、西南亚洲-地中海(约250种)和东亚(约100种)。鼠尾草以其丰富的ATDs种类而闻名,使其成为研究该属中ATDs多样性的合适模式属。丹参酮主要积累在丹参、甘西鼠尾草(Salvia przewalskii Maxim.)和云南鼠尾草(Salvia yunnanensis C.H.Wright)中,而鼠尾草酸相关代谢物在欧洲鼠尾草等欧洲种中发现。然而,尚不清楚这种代谢差异是一种孤立事件还是由属内克隆分化引起的一种一致变异。因此,基于该属的健壮系统发育树,化学多样性与遗传多样性之间的整体相关模式是调查该经济重要属中ATDs形成的基础支持。
在这里,我们将系统发育重建、代谢组分析、途径分析和进化机制的概念相结合,对71种鼠尾草物种进行了表征,以研究在该属中导致ATDs多样性的分子和进化机制。我们的代谢组分析揭示了该属中ATDs的分布,并进行了体外酶活性测定,以研究CYP76AK亚家族参与ATDs生物合成的机制。此外,还根据比较基因组学、系统发育分析和重建的祖先生物合成酶的酶学提出了CYP76AK亚家族的进化模型。我们的结果表明,CYP76AK家族的演化可能在鼠尾草中ATDs的化学多样性中起着重要作用。
结果
鼠尾草属内的系统发育关系
为了表征鼠尾草属内的化学多样性和系统发育关系,我们对77个物种进行了采样,包括六个外群(香蜂花(Melissa officinalis L.)、薄荷(Mentha spicata L.)、灯笼草(Clinopodium polycephalum (Vaniot) C.Y.Wu & S.J.Hsuan)、牛至(Origanum vulgare L.)、荆芥(Nepeta cataria L.)和夏枯草(Prunella vulgaris L.))进行了分析(补充资料1),覆盖了该属的主要地理分布区域(美洲、西亚、欧洲和东亚),除了非洲。总共,我们生成了72个新的转录组,来自混合的叶片和根的cDNA文库,每个物种平均包含40,876个转录本,代表38.2Mb(补充资料1)。除了三个已发表的转录组(先锋话、薄荷、牛至)和两个基因组(丹参、荆芥)外,我们还获得了77个核基因组用于分析。我们使用了五组拥有2178、1532、1169、512和130个拥有同源基因的OGs来重建鼠尾草的系统发育关系,通过考虑到长度、物种覆盖和其他因素的多步骤过程使用了凝聚法(图1;补充图2-6)。鼠尾草属和六个亚属(Calosphace、Audibertia、Glutinaria、Sclarea、“Heterosphace”和Salvia)的单系性得到了最大支持(bootstrap支持率[BS] = 100%;图1;补充图2-6)。与之前的系统发育研究一致,该属被分为三个连续的主要支系(I、II和IV支系),反映了它们的地理分布,大致可分为欧亚大陆、美洲和东亚。属于亚属分药花属和迷迭香属(PR)的欧洲马鞭草(Salvia abrotanoides (Kar.) Sytsma)和迷迭香(S. 迷迭香属)是I支系的姐妹群。因此,鼠尾草的系统发育为进一步进行全谱系代谢组分析提供了有力的分组支持。
五个不同水平的Bootstrap值用红色、蓝色、黄色、黑色和绿色的实心圆圈表示。绿色实心圆圈表示节点在五棵树中的备选拓扑结构(见补充图2-6)。属于同一亚属的物种用相同的分支颜色标记。物种名称显示在树的右侧,支系显示在最右侧,并用彩色标签突出显示。彩色实心星标记了本研究中鉴定的基因组重复事件。Mya表示百万年前,P表示更新世,Q表示第四纪,WGD表示全基因组重复,WGT表示全基因组三倍化。PR代表亚属分药花属和迷迭香属。
根据由130个OGs串联构建的树,所有分类群都使用四个化石作为校准点进行了进化时间尺度的估算(图1,补充图7)。我们的年代图说明了鼠尾草属的起源可以追溯到晚始新世(约3800万年前,Mya)至中渐新世(约2610万年前),因为鼠尾草的冠群预计出现在约3210万年前,95%的可信区间(CI)为2610万年至3810万年。在此之后不久,I支系、迷迭香和马鞭草的冠群可能出现在约2950万年前(95% CI:2370万年至3520万年)。与此同时,同时包含II支系和IV支系的节点可能起源于约2820万年前(95% CI:2270万年至3380万年)。随后,II支系和IV支系的分化被估计为分别发生在约2210万年前(95% CI:1760万年至2700万年)和约910万年前(95% CI:670万年至1180万年)。
根据手头上的转录组和基因组数据集,我们还根据同义替换率(KS)在同源基因对之间确定了鼠尾草物种中的整个基因组重复(WGD)事件(图1;补充图8)。首先,我们在采样尺度上确认了两个已知的WGD事件,即核心真双子叶植物共享的gamma事件(平均KS = 2.27)和唇形科共享的WGD事件(平均KS = 1.18)37,49。我们并没有在整个鼠尾草属中发现共同的WGD事件,但是我们在II支系中鉴定了一个共享的WGD事件(平均KS = 0.30)。此外,一些个体物种似乎经历了独特的WGD事件,例如一串红(一串红)、撒尔维亚(Salvia lyrata L.)和猩红鼠尾草(Salvia roemeriana Scheele)。
鼠尾草中ATDs的化学多样性和分布
理解化学多样性与遗传信息之间的关联对于解析生物合成途径和挖掘功能基因至关重要。我们使用液相色谱-质谱(LC-MS)基于代谢组学的方法对71种鼠尾草物种的根和叶进行了制备和分析。总离子流(TIC)色谱图显示,酚酸和ATDs是鼠尾草根和叶的主要代谢物(补充图9-24)。在峰检测、对齐和使用MS-DIAL工具进行标准化后,得到的特征表格根据酚酸和ATDs的积累水平分成两个表格,并导入SIMCA-P进行探究哪种分类的代谢物与鼠尾草的进化密切相关(补充资料2-7)。与酚酸相比,ATDs在根和叶中的积累导致四个支系之间在主成分分析(PCA)中有明显的分化,特别是在正离子模式下的聚类结果(补充图25和26),这与系统发育分析结果一致(图1)。
在图2a中,鼠尾草71种物种的根和叶中共识别出了36种最常见的ATDs,并根据结构特征分为五组(A-E)。使用参考标准和诊断性的中性丢失来识别C-20位环的化学修饰(补充资料8和图27-31)。图2b描述了71种鼠尾草中36种ATDs的积累模式,以及化学修饰与器官特异性之间的关系。环上的羟基化和羰基化是ATD生物合成途径中的常见反应,在鼠尾草的四个支系中都发生。20-酮基和20-羧基ATDs在I支系、II支系和PR中显示出物种特异性的积累。此外,只在I支系、II支系和PR的个别物种的叶中检测到了羧化和环氧化衍生物的强烈器官特异性,例如鼠尾草酸和远志酮。与其他具有20个碳原子的ATDs相比,丹参酮(B组)在正离子模式下具有更大的离子响应,并且特异地在根中积累。因此,尽管ATD化学多样性源自环和甲基基团的各种化学修饰,但积累模式和器官特异性与特定的甲基基团修饰相关。米特酮(图2中的化合物6)是丹参酮合成的关键前体,在所有支系中均存在,是通过耦合去甲基化C-20和环B的芳香化不明确的反应形成的11-羟基雌黄酮。然而,通过随后的杂环化、去甲基化和芳香化形成的更多样化的丹参酮仅存在于IV支系中。因此,C-20是一个潜在的关键位置:当C-20处的环和甲基基团通过不同的取代物进行修饰时,与ATD特征结构的多样化形成相关,并促进了鼠尾草中的物种和器官特异性。
36种ATD根据不同的结构特征分为五组。在A、C、D和E组(在叶中特异积累)的ATD在负离子模式下表现出较高的强度,而在B组(在根中特异积累)的ATD在正离子模式下表现出较高的强度。1: 7,20-二羟基-杉木香醌; 2: 16,20-二羟基-杉木香醌; 3: 7-酮基, 20-羟基-杉木香醌; 4: 11,20-二羟基-甘油; 5: 20-羟基-杉木香醌; 6: 米特酮; 7: 隐丹参酮; 8: 丹参酮IIA; 9: 1,2-二氢丹参喹啉醌; 10: 二氢丹参酮I; 11: 亚甲基丹参喹啉醌; 12: 丹参酮I; 13: 普列沃醌C; 14: 7-酮基-罗伊叶醌; 15: 罗伊叶醌; 16: 11-羟基甘油; 17: 7-羟基-罗伊叶醌; 18: 6-羟基-罗伊叶醌; 19: 6-酮基-11-羟基甘油; 20: 7,11-二羟基铁杉醇; 21: 11,14-二羟基甘油; 22: 11-羟基铁杉醇; 23: 20-酮基-2,11-二羟基铁杉醇; 24: 20-酮基-11-羟基甘油; 25: 20-酮基-7-羟基铁杉醇; 26: 20-酮基-6-羟基铁杉醇; 27: 20-酮基-7-乙酰基铁杉醇; 28: 7-羟基-20-羧基-杉木香醌; 29: 7-羟基异康诺醇; 30: 6-羟基康诺醇; 31: 7-酮基-康诺酸; 32: 7-甲氧基康诺醇; 33: 6-甲氧基康诺醇; 34: 康诺醇; 35: 康诺酸; 36: 甲基康诺酸酯。b 36种ATD在71种鼠尾草物种中的分布模式。PR,亚属分药花属和迷迭香属。
CYP76AK亚家族的催化分化
由于C-20上的氧化模式可能导致鼠尾草谱系中ATDs的分化。因此,CYP76AK是一种Lamiaceae特有的CYP亚家族,先前已发现可催化C-20的氧化反应,可能塑造了这种代谢多样性。为了检查CYP76AK的酶活性,在我们生成的71个转录组中首先注释了所有的CYP76AK基因,以研究它们的系统发育关系。共获得了185个推测的全长序列,并用于生成最大似然(ML)树(图3),将CYP76AK亚家族分类为九个分辨率良好的分支(即CYP76AK1、2、3、5、6、7、8、18和22;参见补充数据9和图32),具有广泛的分类分布。CYP76AK6是Clade I的特有亚谱系,也是该谱系中唯一的CYP76AK亚谱系。CYP76AK7、22、18专属于Clade II谱系。同时,CYP76AK1、2和3基本上特异于Clade IV谱系。此外,还从PR的转录组中注释了CYP76AK3、7、8和22基因。
分支颜色表示含有这些CYP76AK基因的物种所属的谱系。有关已注释的系统发育图,请参阅补充图32。PR,亚属分药花属和迷迭香属。
迄今为止,只有少数CYP76AK成员进行了功能表征。为了调查每个分支是否表现出不同的催化特性,总共选择了16个CYP76AK,涵盖了所有分支,使用酵母微体系表达系统进行体外功能研究。测试了两种底物,11-羟基-铁锈醇和11-羟基柳杉酚,以阐明C-20上的氧化模式。由于11-羟基-铁锈醇不可商业化,将SmCYP76AH3引入酵母株WAT11,将铁锈醇转化为11-羟基-铁锈醇作为底物来源(图4a)。根据它们的质谱特征使用液相色谱-质谱法(LC-MS)分析了顺序氧化产物(补充图33)。使用11-羟基-铁锈醇作为底物时,产生了两种产物(11, 20-二羟基-铁锈醇和鼠尾草酸),代表C-20上的羟基化和羧基化产物。在我们测试的CYP76AK中,未观察到SmCYP76AK3和5的产物。SmCYP76AK2、SpCYP76AK22和ScCYP76AK18表现出羟基化活性,而仅ScCYP76AK18具有随后的羧化活性。综合考虑先前对CYP76AK1、6、7和827,28,29,30的功能描述,我们认为CYP76AK对11-羟基-铁锈醇表现出三种不同的催化特性,即CYP76AK1、2和22只能表现出C-20的羟基化,而CYP76AK6、7、8和18具有进一步氧化的性质,产生鼠尾草酸。除了11-羟基-铁锈醇外,SmCYP76AK1还能将11-羟基柳杉酚转化为11, 20-二羟基柳杉酚。为了测试其他CYP76AK分支是否也具有杂交性,将11-羟基柳杉酚添加到表达每个选定CYP76AK的微体组制备中(图4b)。结果显示,除了CYP76AK3和5外,所有CYP76AK都能催化11-羟基柳杉酚的C-20氧化。与使用11-羟基-铁锈醇作为底物不同,CYP76AK6、7、8和18的产物中检测到20-酮产物。此外,还获得了羧化产物(7-酮鼠尾草酸经核磁共振(NMR)纯化和鉴定,见补充图34)。与11-羟基-铁锈醇添加组相一致,CYP76AK1、2和22只表现出一步氧化,产生11, 20-二羟基柳杉酚。此外,我们还选择了每个分支的互补CYP76AK进行功能验证(补充图35),证明了来自同一分支的CYP76AK具有一致的功能。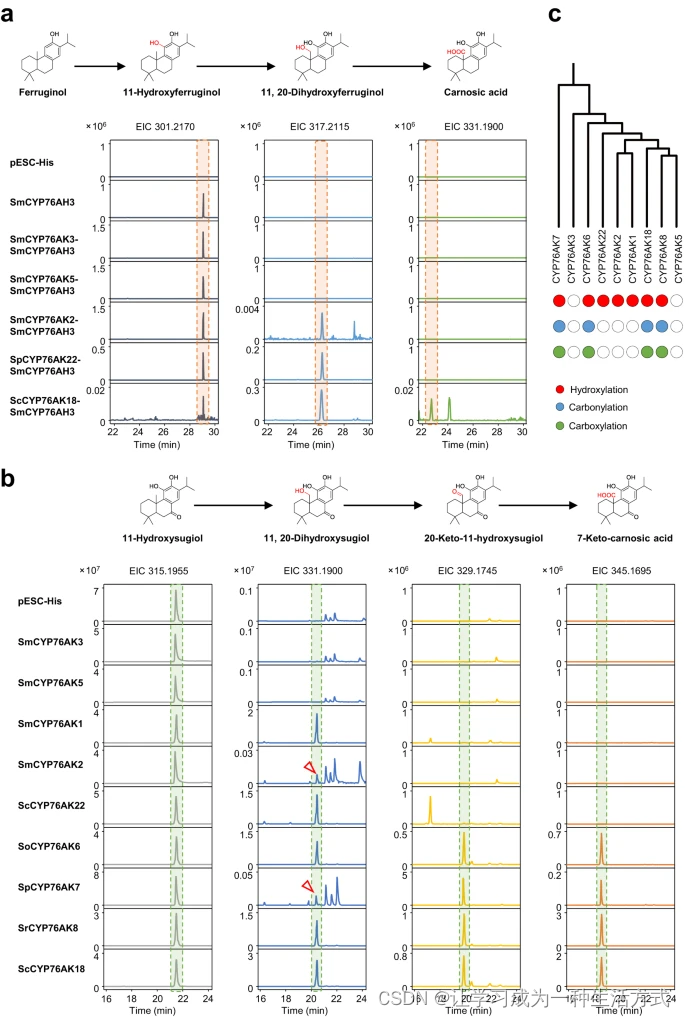
a. 用11-羟基铁锈醇进行体外CYP76AK催化反应的萃取离子色谱图(EIC)分析。为了获得11-羟基铁锈醇,所有质粒均含有将铁锈醇转化为11-羟基铁锈醇的SmCYP76AH3。只含有SmCYP76AH3蛋白的样品作为阴性对照。由潜在产物对应的峰表示,其m/z值为11, 20-二羟基铁锈醇(m/z 317.2115)和鼠尾草酸(m/z 331.1900)。b. 用11-羟基柳杉酚进行体外CYP76AK催化活性的EIC叠加图。只含有空载质粒(pESC-His)的样品作为阴性对照。由潜在产物对应的峰表示,其m/z值为11, 20-二羟基柳杉酚(m/z 331.1900)、20-酮-11-羟基柳杉酚(m/z 329.1745)和7-酮鼠尾草酸(m/z 345.1695)。c. CYP76AK的酶活性总结。
总的来说,CYP76AKs似乎表现出三种类型的催化特性,同时遵循着明显的系统发育分歧(见图4c):i:CYP76AK7、6、18和8能够在C-20上进行连续氧化催化;ii:CYP76AK1、2和22只表现出羟基化步骤;iii:CYP76AK3和5对11-羟基铁锈醇和11-羟基柳杉酚均没有催化能力。为了进一步全面考虑催化性质、CYP76AK亚家族的系统发育关系和ATDs分布,CYP76AKs的功能分歧与不同Salvia谱系中特异性ATDs积累之间似乎存在着密切的相关性。例如,20-酮产物如20-酮-11-羟基柳杉酚仅由CYP76AK6、7、8和18特异性产生。相应地,这种20-酮型ATDs仅限于Clade I、II以及PR(见图2),与CYP76AK亚家族的分布相一致,即CYP76AK6可能对属于该属的Clade I起到贡献作用,而CYP76AK7和8则在该属的Clade II中起作用。
CYP76AK基因的器官限制性转录模式进一步证实了它们对ATDs多样性的贡献。通过RNA测序,我们测试了17种选择性Salvia物种叶片和根中CYP76AK基因的转录模式(见图5),揭示了它们根据谱系和多样的器官特异性表达模式的分布。一般来说,属于同一亚家族的CYP76AK基因具有相同的转录模式,并在谱系中呈现相同的器官分布。例如,在Clade IV和Clade II中,分别,CYP76AK1和22专门催化了C-20的羟基化,具有根特异性表达,表明它们在丹参酮的产生中具有独特的作用。相反,在Clade I和Clade II的基础谱系中,特异性地积累了20-羧基产物,如鼠尾草酸,这很可能是由于相应Salvia物种叶片中CYP76AK6、7、8和18的器官特异性表达所致。值得注意的是,尽管在我们的研究中,CYP76AK3和5对所测试的底物没有表现出活性,但在相关Salvia物种的根中发现了大量的转录水平,这表明它们对其他未知底物的未揭示的催化功能。
CYP76AK亚家族成员的基因表达热图,展示了Salvia每个分支的代表物种在叶片(L)和根(R)中的相对表达水平。热图显示了三个生物学重复实验,每个实验分别绘制。表达值代表Z分数转换后的对数(TPM+1)值。
ATDs在鼠尾草中的生物合成途径的演化
上述的系统发育、代谢和催化功能研究揭示了这种明显的代谢分歧伴随着CYP76AK亚家族在每个鼠尾草谱系中的演化。为了追溯鼠尾草中ATDs途径的演化路线,进行了比较基因组分析和祖先基因及代谢特征的重建。目前,已有六个鼠尾草基因组可供使用,使我们能够调查大多数鼠尾草谱系中CYP76AK基因的演化历史。这些基因组是迷迭香(PR)50、撒尔维亚(Clade I)30、丹参46和南丹参(Clade IV)51、奇亚52(Clade II北美谱系)以及一串红37(Clade II南美谱系)。首先,研究了微型合成区块,以确定CYP76AK的演化历史(图6a)。在所有研究的基因组中观察到了包含CYP76AK的保守合成区域,这些区域并不位于与二萜生物合成相关的已知基因簇中30,53。在N. cataria基因组中存在两个重复区域,使我们能够追踪Salvia分化之前CYP76AK基因的祖先。同时,发现了该区域的重复与每个基因组的WGD事件存在明显的相关性。对于N. cataria和S. 迷迭香属,这个重复可能是由它们独特的WGD事件产生的。在奇亚基因组中,这个重复与Clade II共有的WGD有关。随后,一串红经历了另一个独特的WGD事件,最终导致了一个具有四个重复区域的基因组。因此,发现合成区域及其重复事件表明,该区域包含了鼠尾草祖先的祖先CYP76AK基因。随着基因组的演化,CYP76AK在不同的鼠尾草谱系中起源并演化成了不同的亚家族。在CYP76AK(图3)和鼠尾草的系统发育中,CYP76AK7和22可能首先出现在鼠尾草谱系的祖先中,正如S. 迷迭香基因组所示,随后的重复事件导致了CYP76AK8(S. 迷迭香属)和CYP76AK18(Clade II)。在没有经历WGD事件的分类单元中,CYP76AK分为CYP76AK1(Clade IV)和CYP76AK6(Clade I)。此外,在所有鼠尾草基因组中都没有发现CYP76AK2、3和5的共线性关系(补充数据10)。它们的出现可能是由于某些物种或谱系中的独特重复事件(例如,片段和转座子介导的重复)引起的。
a. 鼠尾草基因组中CYP76AK基因的共线性关系揭示了CYP76AK亚家族的分歧。左侧面板中的系统发育树代表了以N. cataria为外类群的六个鼠尾草物种的系统发育。红点表示WGD事件。CYP76AK基因在合成区块中的微合成。红色多边形显示了CYP76AK基因之间的同源关系,灰色多边形显示了其他基因。Anc-CYP76AK,祖先CYP76AK基因。b. 祖先CYP76AK蛋白的重建。祖先节点(ancNodes)1−6显示了CYP76AK系统发育树每个主要分支点的重建酶。每个分支的功能特性由不同颜色区分。c、d. CYP76AK的祖先功能。提取的离子色谱图(EIC)显示了每个祖先CYP76AK使用11-羟基黄樟醇和11-羟基糖醇作为底物的体外催化活性,分别是e. 鼠尾草中ATDs生物合成的演化。系统发育树显示了鼠尾草谱系的物种分化,菱形代表了每个分化节点的预测代谢特征。方框代表了每个鼠尾草谱系的真实代谢特征,如图3所示。绿色、红色和浅蓝色分别表示对羟基吲哚酮的存在,丹参酮和20-酮类ATD的存在。左侧的时间刻度反映了每个谱系的分化时间。浅蓝色突出显示的分支表示保留了祖先代谢特征的谱系。f. CYP76AK基因的时间顺序。系统发育树表示了根据MCMCtree模型推断的CYP76AK亚家族的演化。标记了每个谱系的分化时间。蓝色突出显示的分支表示保留了祖先催化功能的CYP76AK亚家族,红色突出显示的分支表示失去了功能的亚家族。底部的箭头表示了在相应谱系中产生ATDs类型的CYP76AK亚家族。绿色、红色和靛蓝色的箭头分别表示对羟基吲哚酮、丹参酮和20-酮类ATD的生物合成。
考虑到CYP76AK在其演化历史背景下的功能差异,C-20位置的催化活性的分歧似乎代表了功能的遗失而不是新功能化。因此,进行了祖先基因重建和功能验证。根据CYP76AK的系统发育,选择了六个分支节点进行祖先酶的复活(图6b,附录数据11)。与预期一致,所有CYP76AK祖先在11-羟基黄樟醇和11-羟基糖醇的C-20位点均表现出羟基化、羰基化和羧化作用,因为每个CYP76AK祖先都产生了相应的氧化产物(图6c、d)。节点6代表了最原始的CYP76AK蛋白,它展示了完整的氧化功能,表明这种CYP76AK的催化特性在该亚家族最初出现于鼠尾草时已经获得。节点3(CYP76AK1、2、5、8、18和22的祖先)和节点2(CYP76AK1、2、5、8和18的祖先)也表现出对C-20的完整氧化能力,暗示了CYP76AK1、2和22(仅进行羟基化)失去了羧化活性。CYP76AK3和5对任何评估的底物均未显示出催化活性(图4),这表明这两个类群中的CYP基因经历了对测试底物的完全失活。它们可能经历了伪基因化或对其他未知底物的催化活性。
考虑到鼠尾草中CYP76AK的演化历史,ATDs的代谢多样性似乎代表了一种代谢途径的丧失而不是代谢创新。因此,根据每个分类单元中的实际化学特征进行了祖先表型重建(APR),以预测其共同祖先的化学特征(附录图36)。产生对羟基吲哚酮、丹参酮或20-酮类ATD的能力被视为关键特征。鼠尾草系统发育树(PR和Clade I、II和IV)的早期分化节点的APR被指示为产生所有类型的ATDs,这意味着鼠尾草的祖先很可能产生了所有ATDs。随着鼠尾草的分化,这种化学特征在PR(S. 迷迭香属)和Clade II谱系的北美分类单元中得以保留,但在其他谱系中部分丧失。在CYP76AK的演化历史中观察到了在类群水平上的活性丧失,因此表明这是导致谱系间代谢多样性的主要原因。为了模拟CYP76AK活性的演化如何指导ATDs多样性,进一步评估了所有CYP76AK的时间顺序(附录图37)。展示了源自祖先同源片段的CYP76AK亚家族(图6e、f)。时间顺序显示,CYP76AK的MRCA(约76.4百万年前)出现在CYP76AK7与其他类群分化的第一次分歧之前的时间,每个类群的出现都发生在其相应谱系的分化时期或刚刚之后。例如,CYP76AK6可能伴随着Clade I的分化(约20.4百万年前)而出现。此外,CYP76AK22(约26.3百万年前)和CYP76AK1(约7.9百万年前)的活性丧失发生在S. 迷迭香属(约27.2百万年前)和Clade IV(约9.1百万年前)的分化之后。
基于每个CYP76AK亚家族的催化特性、谱系分布和转录模式,可以确定在特定谱系中贡献于ATDs生物合成的基因。CYP76AK7存在于S. 迷迭香属和Clade II中,因此对应于该谱系对气生部位的羧酸类物质的生物合成。然而,CYP76AK7也可能负责在Clade II南美谱系的根中积累20-酮类ATD。CYP76AK6仅存在于Clade I中,因此可能在特定器官中使与羧酸相关的代谢物和20-酮类ATD的生物合成成为可能。CYP76AK22保留在S. 迷迭香属和Clade II中,并且仅在根中表达,从而负责丹参酮的积累。与此同时,CYP76AK1仅在Clade IV中贡献于丹参酮的生物合成。此外,CYP76AK8/18与CYP76AK22具有相似的分布,并且可能在根中进行羟基化和羰基化,用于20-酮类ATD的生物合成。总的来说,关于ATDs代谢演化的先前研究以及我们对CYP76AK亚家族功能分歧的发现支持了基于功能丧失的鼠尾草谱系代谢多样性模型。
讨论
在这项研究中,我们结合了系统发育、代谢组学、基因组比较和酶功能演化分析,阐明了豆科鼠尾草属中ATDs的分化过程。我们的ATDs代谢组学为ATDs途径的演化提供了模型,并作为植物化学多样性的一个例子,这是由于催化酶活性的丧失导致的。
以往关于鼠尾草的系统发育重建主要基于核糖体、线粒体和叶绿体基因,少量核编码基因用于豆科鼠尾草属在科属水平的系统发育48,49,50,51,52,53,54,55。器官基因的单亲遗传性,以及叶绿体基因组的基因重组和转化,导致了系统发育重建的偏差和不准确性。相比之下,核基因具有许多优势,如数量庞大和双亲遗传。使用经过充分评估的核基因集可以为深层次的被子植物谱系提供有力支持的证据。在这里,我们基于大规模的核基因进行了鼠尾草的系统发育分析,这些基因来自迄今为止鼠尾草谱系的最大样本规模的转录组测序,以推断属内的亚属关系。与以往的研究一致,S. abrotanoides 和 S. 迷迭香属形成了一个与鼠尾草物种类群的克隆,而M. officinalis则作为姐妹克隆出现。
从形态上看,传统定义的鼠尾草属与其他豆科属的区别在于其两个育性花蕊由明显延长的连接组织分隔。然而,分子系统发育研究将鼠尾草扩展到其他属中(例如 Dorystaechas、Meriandra、分药花属、迷迭香属和Zhumeria)。尽管这里代表“迷迭香属”和“分药花属”的物种形成了Clade I的姐妹群(图1),但两个亚属中ATDs的代谢特征和CYP76AK的催化特性与Clade I有着明显不同。因此,以上发现可以从更多角度为Dorystaechas、Meriandra和Zhumeria的分类归属提供新的见解。
细胞色素P450氧化酶(CYPs)在植物萜类物质合成中氧化萜烯合酶生成的碳氢骨架,而化学修饰包括羟基化、连续氧化、环重排和杂环化等。这些反应大大增加了萜类物质的结构多样性,同时为未来修饰的锚点提供了。因此,CYPs被认为是植物萜类物质多样性的关键因素。根据我们的代谢组学分析,具有修饰环的ATDs(C类)在所有类群中均未显示出特定的积累,并且是由CYP76AH亚家族等功能基因产生的,其能够在B环的C-7位进行羰化。与CYP76AH所进行的修饰相比,C-20位的化学修饰由多样性的CYP76AK家族驱动,负责在鼠尾草中ATDs的积累和器官特异性。根据图2和图5,CYP76AK1基因在Clade IV分类单元的根中高 表达,并产生20-羟基ATDs(A类),其积累模式与美鉾烯非常相似,尤其是对于7,20-二羟基黄樟醇喹啉(化合物1)、7-酮-20-羟基黄樟醇喹啉(化合物3)和20-羟基黄樟醇喹啉(化合物5),推测20-羟基ATDs是美鉾烯合成的主要前体。与CYP76AK1类似,CYP76AK22也发现在Clade II和PR中的个别物种中产生20-羟基衍生物用于美鉾烯的合成,并且在根中的转录水平也很高(图5)。与Clade I相反,属于Clade II的物种,如S. pachyphylla、S. apiana和S. columbariae产生隐丹参酮。通过对美鉾烯的杂环化作用产生隐丹参酮(化合物7;图2)的CYP71D家族显示,Clade II物种具有比Clade I物种更全面的丹参酮生物合成途径。然而,大多数下游丹参酮在Clade IV中更丰富,表明Clade IV中的ATDs生物合成主要以丹参酮合成为主(B类)。这也是Clade I和II中常见的具有20个碳原子的ATDs(C类)积累更高的可能原因。此外,环A的后续芳香化需要在C-18或-19进行羟基化的功能基因参与,这些功能基因在Clade IV中是独有的。此外,当使用11-羟基雄黄醇作为底物时,还检测到了SmCYP76AK1和ScCYP76AK22的一个副产物(时间=17.25 min;图4b),该副产物被暂定为6-羟基-7-酮杉二烯醌(补充图38)。这种副功能可能有助于Clade II(化合物18)和IV(化合物18、26和30)中含有羟基的ATDs的形成。相应地,Clade I和PR中C-6氧化的酶反应仍需要进一步探索。
除了CYP76AK1和CYP76AK22对20-羟基ATDs和丹参酮的合成的重要性之外,Clade I、II和PR中20-酮类ATDs(D类)的独特积累基于CYP76AK6、7和8/18的特异性表达。虽然CYP76AK6只在Clade I中表达,但CYP76AK7和8/18在Clade II和PR中表达,并在体外酶活性实验中表现出类似的羟基化、羰基化和羧化的活性(图4)。在酶活性实验中,还发现了20-羧基衍生物,如黄樟酸(化合物35),也可以自发地氧化20-环氧基ATDs,如黄樟醇(化合物34)(补充图39)。然而,叶中具有较高CYP76AK6、7或8/18表达的物种,如Clade I中的撒尔维亚、Clade II中的S. columbariae和PR中的S. 迷迭香属,是唯一叶中同时存在20-羧基和20-环氧基ATDs(E类)的物种(图2和5)。这种物种特异性的黄樟酸相关代谢物积累可能与其在地中海栖息地中抵御恶劣气候条件的能力有关。这些物种的叶片显示出比根更高的CYP76AKs表达,这可能与20-羧基和20-环氧基ATDs在光合绿色器官叶绿体的特定定位有关。之前曾推测黄樟酸是脱甲基(C-20)的潜在中间体,导致C-20和C-7之间形成杂环桥的形成。这反过来表明,C-20上的羧基可能是导致B环芳香化的关键15,最终导致美鉾烯的产生。然而,黄樟酸的积累严格限制在特定器官和物种,这表明它不能作为丹参酮的前体。相反,CYP76AK1和22催化的羟基化(C-20)显示出与后续脱甲基和芳香化的更强相关性,因为它与Clade IV中丹参酮的积累模式相一致。这代表了对丹参酮形成过程的机理研究的重要一步,特别是对脱甲基化和芳香化机制的理解。因此,不同CYP76AKs之间的不同表达特性可能引导了ATD生物合成途径的演化,从而在鼠尾草中产生特定的ATDs,如丹参酮和黄樟酸相关代谢物。
另外,仅基于CYP76AK的体外活性证据,我们不能排除其他酶参与ATDs的连续氧化的可能性。类似于青蒿素生物合成途径,虽然体外证据表明CYP71AV1可以催化爱茉莉素-4,11-二烯的C-12连续氧化形成青蒿醛和青蒿酸,但其他酶,如醇脱氢酶(ADH1)和青蒿醛脱氢酶(ALDH1),也参与了青蒿菊烯醇的最后两个氧化步骤。与大部分情况不同的是,以往的研究都认为功能的创新是导致代谢多样性的原因,而这项研究的结果表明,活性的丧失也可能是代谢多样性的关键因素。
另一方面,在功能分化方面,CYP76AKs还表现出不同的转录模式,最终导致了对黄樟酸衍生物和丹参酮的完全相反的器官特异性积累。基于此,我们推测这些代谢物的生理和生态功能可能与该属中存在的代谢分化有关。例如,黄樟酸和黄樟醇主要积累在绿色组织的叶绿体中,从而在这些植物的光合组织中提供了独特和有效的抗氧化机制。黄樟酸基于叶绿体中的保护机制被证明对于使鼠尾草物种能够适应恶劣气候条件至关重要,而丹参酮可能参与根部与周围土壤微生物的相互作用。
此外,每个CYP76AK分类的转录模式的不同也代表了功能演化的另一个方面。它们的器官特异性模式不是独立的,而是伴随着其他参与黄樟酸衍生物和丹参酮生物合成的催化基因,如KSLs、CYP76AHs和CYP71Ds。同时,这样的模式在不同的鼠尾草谱系中得以保持,因此,关于它们器官特异性转录起源的问题成为了进一步的研究课题。总而言之,鼠尾草中ATD的分化为多个物种、基因家族、代谢多样性和生态演化提供了一个完整的模型,使其成为研究植物化学多样性的基因机制的理想研究对象。
方法
植物材料
最近的分子系统发育研究支持鼠尾草属(Salvia)存在11个亚支系(subclades)(亚属 Audibertia、亚属 Calosphace、亚属 Dorystaechas、亚属 Glutinaria、亚属 Heterosphace、亚属 Meriandra、亚属 分药花属、亚属 迷迭香属、亚属 Salvia、亚属 Sclarea 和亚属 Zhumeria)56,58,59,60。构建了鼠尾草的系统发育树以获取用于分析这些物种化学多样性的采样方案(补充数据1)。总共采样了71个物种,涵盖了该属的三个主要分布中心,代表了鼠尾草已识别的11个亚支系中的8个。另外,从其他Mentheae族选取了六个物种(M. officinalis、M. spicata、C. polycephalum、O. vulgare、N. cataria 和 P. vulgaris)作为外类群。为了获得足够的转录组和化学分析材料,样本在植株的营养期或开花期进行采集。营养期采集了三个器官(根、茎和叶),开花期采集了四个器官(根、茎、叶和花)。为了允许对转录组和化学分析采用相同类型的组织,每个器官的组织都被研磨成细粉,并分成小份。
RNA 分离、转录组测序、组装、注释和分析
为了获得更全面的转录本,采用了混合器官策略进行文库构建,并将生成的转录本数据库用于系统发育研究。对于转录组表达分析,对每个亚属中的典型植物(例如,Clade II 中的 S. rypara、S. karwinskii、S. madrensis、S. pachyphylla、S. apiana 和 S. columbariae;Clade IV 中的 S. castanea f. tomentosa、S. przewalskii、S. roborowskii、S. chinensis、S. trijuga 和 丹参;Clade I 中的 S. deserta、S. roemeriana、撒尔维亚 subsp. lavandulifolia 和 撒尔维亚;PR 中的 S. 迷迭香属)进行了单独的叶片和根系文库构建47,48。使用 TransZol Plus RNA Kit(TransGen Biotech, 北京,中国)进行总 RNA 分离。使用 Illumina TruSeq RNA Sample Preparation Kit(Illumina,美国加利福尼亚州圣地亚哥)制备 cDNA 文库,并在 Illumina NovaSeq 6000测序仪上进行测序,生成2×150 bp配对末端 reads。使用默认参数的 fastp (GitHub - OpenGene/fastp: An ultra-fast all-in-one FASTQ preprocessor (QC/adapters/trimming/filtering/splitting/merging...)) 对 reads 进行评估和修剪。使用 Trinity assembler76 生成转录组组装。对于转录组注释,使用 BLASTX、BLASTP 和 HMMER v3.1b2 将所有转录本与拟南芥蛋白组、SwissProt 和 Pfam 数据库进行搜索,使用 e-value 截断值为1E-5进行比对77。通过 RSEM 软件78 计算基因表达值(每百万 reads 的转录本数 [TPM])。使用 DESeq279 进行差异表达分析,设定 p adjust <0.05 和 |log2FC|≥1 作为阈值。使用 TBtools (GitHub - CJ-Chen/TBtools-II: GUI/CommandLine Tool Box for biologistists to utilize NGS data.) 中的 Heatmap Illustrator 功能生成基因热图。
同源基因识别、单/低拷贝基因选择和系统发育树构建
过滤掉所有组装的转录本以保留最长的转录本异构体,并使用 TransDecoder v5.5.080 进行进一步的预测蛋白序列。使用 OrthoFinder v2.5.481 使用来自所有 77 个物种的 TransDecoder 预测蛋白序列构建同源基因组,构建了五个基因集,包括四个低拷贝基因集(分别为 2,178 个 OGs、1,532 个 OGs、1,169 个 OGs 和 512 个 OGs)和一个单拷贝基因集(130 个 OGs)用于构建系统发育树。使用 MAFFT v7.48782 使用默认设置对来自单/低拷贝基因集的结果蛋白序列进行对齐,并使用 TrimAl v1.4.rev1583 剪切低质量对齐的区域。使用 RAxML-NG v1.0.384 使用 100 个重复模拟的 JTT + I + G4 模型对每个 OG 中的系统发育树进行构建。然后使用 Astral v5.685 将 RAxML 的每个 OG 集的系统发育树连接起来,进行 100 次重复以获得所有节点的 BS 值。此外,将 130 个 OGs 连接成超级矩阵,并使用 RAxML-NG v1.0.384 使用 1000 个重复模拟的 JTT + I + G4 模型对最终的系统发育关系进行重建。在所有 77 个物种中,选择 M. officinalis、M. spicata、C. polycephalum、O. vulgare、N. cataria 和 P. vulgaris 作为外类群。
分化时间估计
使用 PAML 软件包 v4.986 中的 MCMCTree 进行候选物种的分化时间贝叶斯推断。使用合并的 130 个 OGs 的 ML 重建的候选物种拓扑结构作为输入树。将具有密码子替代模型的核苷酸序列与 MAFFT v7.48782 和 TrimAl v1.4.rev1583 的 “backtrans” 参数对齐和修剪。首先,使用 PAML 软件包 v4.986 中的 BASEML 程序在 GTR + G 模型下测量分支长度和总体替代速率 (rgene gamma)。然后,使用 MCMCtree 估计分化时间,并将 burn-in、sampfreq 和 nSample 参数设置为 500,000、150 和 10,000。根据以下化石年代约束估计了候选鼠尾草物种的分化时间:C. polycephalum 和 M. spicata 的分化时间为 11-27 Mya,M. officinalis 与其他外类群(N. cataria、C. polycephalum、M. spicata、O. vulgare 和 P. vulgaris)的分化时间为 21-47 Mya。最后,对 MCMCTree 估计的多次迭代使分化时间的偏差小于 0.1%。
WGD 事件识别
使用“wgd” pipeline87 构建了所有候选物种的 KS 基于年龄的拷贝基因的分布。简要地,使用 Diamond v0.9.18.119 序列相似性搜索工具识别每个物种的拷贝基因。使用马尔科夫簇算法对每个拷贝基因家族进行聚类。使用 MAFFT v7.48782 和默认参数对每个家族内的基因进行对齐,然后使用 PAML 软件包 v4.986 中的 CodeML 程序测量一个家族内所有拷贝基因对的 KS 值。然后使用 FastTree v2.1.790 和 phylogenetic tree 为每个家族进行节点加权以校正 KS 年龄分布。在使用基于 KS 的树构建每个家族的系统发育树时,考虑到所有测试物种的不同替代速率,进一步调整了物种共享或特异的 WGD 事件。在这里,使用来自 OrthoFinder v2.5.481 的 130 个单拷贝基因,用 PAML 软件包 v4.986 中的 CodeML 程序使用自由比率模型计算了 KS 单位中的系统发育树的分支长度。
CYP76AK 序列、系统发育分析和分子钟分析
通过 Pfam 领域 PF00067,将含有 CYP450 家族成员的基因识别为 CYP450 家族成员。从 NCBI 数据库下载了七个已知的 CYP76AK 基因(SmCYP76AK1: KR140169.1,丹参;SmCYP76AK2: KP337688.1,丹参;SmCYP76AK3: KP337689.1,S. miltiorrhiza;SfCYP76AK6: KX431218.1,S. fruticosa;SpCYP76AK6: KT157045.1,S. pomifera;SrCYP76AK7: KX431219.1,S. 迷迭香属;和 SrCYP76AK8: KX431220.1,S. 迷迭香属)。使用 BLASTP 搜索以识别具有 1E-5 的 E 值截止的相应 CYP76AK 基因。然后,选择了编码≥466 氨基酸的选定 CYP450 基因的蛋白质序列,并使用 MAFFT v7.48782 和 TrimAl v1.4.rev1583 分别进行对齐和修剪。使用 CYP76AH1 基因作为外类群推断了 CYP76AK 基因的系统发育。对于编码<466 氨基酸的 CYP450 基因,使用 BLASTP 搜索进行候选基因分类。
根据上述系统发育树,使用 PAML 软件包 v4.986 中的 MCMCTREE 在 GTR + G 模型(model = 7)下进行分子钟分析,迭代次数为 500000 次,采样频率为 150 次,burn-in 为 500,000 次迭代。使用 PAML 软件包 v4.986 中的 BASEML 测量了密码子替代模型的替代速率 rgene gamma,计算结果为 G (1, 5.95)。两个单拷贝基因家族(即 CYP76AK3 和 22)和两个物种特异基因家族(即 CYP76AK1 和 6)的冠节点用于估计每个节点的分化时间。对于每个估计过程,使用以下年龄约束:CYP76AK3 的冠节点(S. abrotanoides 和其他物种的分化时间)的最小年龄约束为 23.7 Mya,最大年龄约束为 35.2 Mya;CYP76AK22 的冠节点(S. 迷迭香属 和其他物种的分化时间)的最小年龄约束为 21.8 Mya,最大年龄约束为 32.9 Mya;CYP76AK6 的冠节点(Clade I 和其他物种的分化时间)的最小年龄约束为 14.3 Mya,最大年龄约束为 22.5 Mya;CYP76AK1 的冠节点(Clade IV 和其他物种的分化时间)的最小年龄约束为 6.7 Mya,最大年龄约束为 11.8 Mya。
CYP76AK 成员的同源性分析
使用 MCScan(Python 版本)在每对候选物种之间进行基因组块的语法分析(N. cataria、S. 迷迭香属、丹参、S. bowleyana、奇亚 和 一串红)。选择目标 CYP76AK 或相邻基因作为种子,搜索保守进化的基因组块。
祖先序列和特征的重构
使用匹配的序列文件、系统发育树文件和配置的控制文件,使用 PAML 软件包 v4.986 中的 CodeML 程序的 JTT + GAMMA 模型估计 CYP76AK 亚家族的假定祖先序列。通过最大简约法分析包含对齐间隙的区域,以确定祖先残基。然后,合成并对功能进行酵母细胞中的功能识别的估计祖先基因。
根据代谢结果和文献研究39,对鼠尾草的物种组成类型进行编码。将成分类型编码为 6 种状态:无(A); TAs(B); 20-酮 ATDs(C); TAs 和 20-酮 ATDs(D); CAs 和 20-酮 ATDs(E); TAs、CAs 和 20-酮 ATDs(F)。以具有分支长度信息的进化树(ML)作为输入树,使用 Reconstruct Ancestral State in Phylogenies (RASP) 软件的统计分散-地理分析(S-DIVA)推断成分类型的祖先状态并计算系统发育信号92。
化学标准
化学标准从上海标准技术有限公司(中国上海)购买。其他化学品和试剂如下购买:乙腈和甲醇(HPLC 级;德国默克公司,达姆施塔特)、华法林(Sigma-Aldrich,西班牙马德里)、氯仿(中科蓝迪,中国上海)、亮氨酸恩啶(Waters,美国马萨诸塞州米尔福德)、纯蒸馏水(香港中国华夏饮用水有限公司)和甲酸(HPLC 级;美国新泽西州费尔劳恩费希尔科学公司)。
ATDs 的提取和 UPLC-QTOF-MS 分析
将每个植物分为根和叶样品,每个样品有三个生物学重复。所有样品都被研磨成细粉,10 毫克粉末与含有华法林(5 毫克/毫升)作为内部参考物的 1 毫升 70% 甲醇(体积比)在 4°C 的超声浴中(53 kHz,350W)超声 60 分钟。然后用纸质滤器将超滤液过滤,并于 4°C 下在玻璃瓶中保存。分别以 0.2 毫升和 0.02 毫升的萃取物进行 100% 和 50% 乙腈稀释。另外,为了确保稳定的 UPLC-MS 分析,使用质量和稳定性良好的基质进行定量浓度测定和质量控制。
采用 UPLC-QTOF-MS 分析技术测定鼠尾草样品中 ATDs 的化学组成。使用 ACQUITY UPLC I-Class PLUS 系统(沃特斯)与二极管阵列检测器联用,以 20 μL 样品(50% 乙腈)作为输入,将样品从 C18 色谱柱(50 mm × 2.1 mm,1.7 μm,沃特斯)中洗脱。使用二级质谱(MS/MS)执行定量分析,使用质谱进行初步结构鉴定,并使用 QTOF 高分辨率进行验证。使用正离子模式进行采集,并将数据以 100 Hz 的频率记录下来。采用标准内部校准方法,并使用质量范围 m/z 100-1,500 进行数据采集。
数据分析和生物信息学
使用 Masslynx 4.2 和 UNIFI 1.9 软件处理 UPLC-QTOF-MS 数据。使用天然药物鉴定工作流程和天然产物二级质谱库通过天然产物检测软件确定化合物的结构。使用 SIMCA-P 14.0 软件进行多变量数据分析,通过 PCA 和 OPLS-DA 模型对化合物进行定性和定量分析,以鉴别物种之间和组织之间的显著性差异。 PCA 和 OPLS-DA 模型评估了组织和物种之间的多变量数据差异,以及它们在特征组成和化合物积累上的贡献。 Significance p < 0.05 被认为是统计显着的。统计分析使用 SPSS v21.0 进行 ANOVA 和 t-检验。化合物的差异性积累被认为是最重要的组分,根据 OPLS-DA 模型和 VIP 值进行筛选,VIP 值 > 1.0 被认为是具有显著差异的化合物。
核酸序列
获得的序列已被提交至 NCBI(BioProject ID: PRJNA715565)。
报告概述
在本研究中,进行了全面的植物转录组分析,旨在识别和表征鼠尾草基因家族、系统发育、分化时间和进化动力学的演变趋势。此外,通过基因组学和蛋白质组学分析,揭示了 CYP76AK 亚家族的发展和代谢功能的进化历史。采用 UPLC-QTOF-MS 技术对鼠尾草 ATDs 进行了深入的分析,并应用了多变量数据分析和统计方法对其化学组成进行了比较。本研究提供了对鼠尾草基因家族、代谢路径和进化动力学的新认识,为进一步揭示其药用和功能特性提供了有益的信息。



























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








