Development of New Multi-Glycosylation Routes to Facilitate the Biosynthesis of Sweetener Mogrosides from Bitter Immature Siraitia Grosvenorii Using Engineered Escherichia coli
开发新型多糖基化途径,通过工程化大肠杆菌促进从苦味未成熟罗汉果中生物合成甜味剂罗汉果苷
优化大肠杆菌菌株和发酵工艺以提高L-赖氨酸生产-文献精读94-CSDN博客

摘要
罗汉果苷(Mogrosides)具有多种药理活性,主要从罗汉果(Siraitia grosvenorii)中提取,广泛用作天然零卡路里甜味剂。然而,罗汉果的种植难度大且成熟周期长,导致罗汉果苷供应不足。为克服这一障碍,我们开发了一种高效的生物合成方法,利用工程化大肠杆菌将苦味罗汉果苷转化为甜味罗汉果苷。在研究中筛选并测试了三种具有主链/分支糖基化活性、作用于罗汉果苷C3/C24位点的UDP-糖基转移酶(UGT)基因。通过增强催化活性,获得了一种突变体M3,该突变体能够催化九种罗汉果苷的糖基化。通过单核苷酸多态性(SNP)和基于3D结构分析的定向进化,成功改进了β-(1,6)-糖苷键的形成效率。为了避免使用昂贵的UDP-葡萄糖(UDPG),我们开发了一种结合三种UGT和UDP-葡萄糖再生的新型多酶系统。最终,未成熟罗汉果提取物中甜味罗汉果苷的含量显著提高,从57%增加至95%。本研究不仅建立了一种高效生产甜味罗汉果苷的新型多酶系统,还为农业废弃物和残留物中丰富的苦味罗汉果苷的高价值利用提供了指导。

引言
高糖摄入是导致肥胖、糖尿病和心血管疾病的主要风险因素之一。为了应对饮食相关的慢性代谢疾病,全球对低热量天然甜味剂的需求正在逐步增加。目前,美国食品药品监督管理局(FDA)已将罗汉果苷、甜菊苷和甘草酸苷认定为安全物质。罗汉果苷主要存在于罗汉果(Siraitia grosvenorii)中,属于葫芦烷型三萜苷类化合物,其糖基成分的数量、位置和糖苷键类型决定了罗汉果苷的味道是苦还是甜。含有四个或以上葡萄糖基的罗汉果苷(如 Siamenoside I、Mogroside V 和 Mogroside IV)具有极高的甜度,并在作为非热量天然甜味剂方面具有巨大潜力。
罗汉果(Siraitia grosvenorii (Swingle) C. Jeffrey)是葫芦科的一种多年生藤本植物,主要种植于中国南部。由于其在治疗肺部充血、感冒和喉咙痛等方面的多种药用价值,同时被用作药食两用植物。罗汉果成熟果实中的甜味来自于葫芦烷型三萜苷。然而,甜味罗汉果苷的产量较低(主要从植物提取物中获得),这与罗汉果种植区域的限制(仅在中国广西桂林的永福和龙胜等特定地理区域)以及果实较长的成熟周期有关。此外,提取工艺产率低、生产成本高以及珍贵成分容易丢失或破坏等因素进一步限制了罗汉果苷的供给,并阻碍了罗汉果苷产业的快速发展。
在罗汉果果实的发育和成熟过程中,罗汉果苷的成分会发生显著变化,从而导致罗汉果提取物的风味变化。例如,成熟果实中富含甜味的三葡萄糖基化合物和四葡萄糖基化合物(如 Siamenoside I 和 Mogroside V),而未成熟果实中则含有高水平的苦味单葡萄糖基和双葡萄糖基化合物(如 Mogroside IE 和 IIE)。此外,在种植和提取过程中,由于未成熟果实(如掉落果、病果和受冻害果实)中苦味罗汉果苷含量较高,往往被丢弃。此前的一项罗汉果代谢组学分析表明,糖基转移酶(GTs)介导的糖基化可以将苦味罗汉果苷转化为甜味罗汉果苷。UDP-糖基转移酶(UGTs)属于 GT1 家族的碳水化合物活性酶,参与天然糖苷(包括萜苷)的合成。有研究表明,UGT720-269-1 和 UGT94-289-3 分别负责罗汉果苷的主链和分支糖基化,但这两种 UGT 的催化效率极低。目前,仅有少数植物 UGT 表现出高催化活性、广泛的底物范围以及易溶的异源表达。此外,关于催化罗汉果苷分支糖基化的 UGT 的研究较少。
近年来,工业生物制造策略(如工程化大肠杆菌)已被用于多种化合物(如乙偶姻、L-酪氨酸、异丙醇、2,5-呋喃二甲酸和甜味罗汉果苷)的生物合成。计算机辅助技术为预测结合位点内关键氨基酸残基以及设计位点突变以提高 UGT 的催化活性和区域选择性提供了指导。有研究报道,通过随机突变和基于计算机的活性位点饱和突变策略,开发出了一种名为 M7 的突变体,在多种三萜糖基化反应中的催化活性显著增强(提升了 102–104 倍)。此外,通过基于活性序列保守性分析的工程策略,开发出了一种名为 UGTMG1 的突变体,其在罗汉果苷分支糖基化中的催化效率提高了 351 倍。通过同源建模和对接分析,另一项研究获得了一种名为 UGTM2 的阳性突变体,其对 Mogroside IIIE 的催化效率比野生型提高了 70 倍。
罗汉果成熟过程中的罗汉果苷生物合成路径涉及耗时的多糖基化过程。通过在大肠杆菌中实现多基因表达构建多糖基化系统,不仅能够克服这一障碍,还可以加深对甜味罗汉果苷合成机制的理解。因此,本研究旨在基于工程化大肠杆菌开发一种可控程序的人工多酶系统,以提高 UGT 的催化活性和区域选择性,并缩短由苦味罗汉果苷合成甜味罗汉果苷的过程。
首先,通过生物信息学分析和体外酶活性检测,筛选和验证了能高特异性催化罗汉果苷 C3 和 C24 位点糖苷键形成的 UGT。基于上述结果,通过单核苷酸多态性(SNP)筛选对 UGT30033 突变体进行催化效率提升的工程化。随后,利用同源建模和分子对接技术,对突变体进行改造,以拓宽其底物特异性。最终,开发了一种结合三种 UGT 和 UDP-葡萄糖(UDPG)再生系统的多酶系统,以避免使用昂贵的 UDPG。当该多酶系统用于催化不同阶段罗汉果提取物的糖基化反应时,其在较短时间内表现出甜味罗汉果苷含量的显著提升。
综上所述,本研究开发了一种新型多酶方法,以缩短罗汉果成熟过程中由苦味罗汉果苷向甜味罗汉果苷转化的时间,为罗汉果农业产业中富含苦味罗汉果苷的废弃物生产高价值甜味剂提供了新途径。
材料与方法
材料和化学试剂
罗汉果(S. grosvenorii)由广西植物研究所(广西壮族自治区,中国科学院,桂林,中国)的蒋水源教授鉴定。研究了六个品种(龙脊、忻宁、生凤、清冠、赖银及杂交品种)在不同生长阶段(授粉后 15 天、30 天、45 天、70 天和 90 天)的果实。标准化学罗汉果苷(mogrol、mogroside IA1、mogroside IE1、mogroside IIA、mogroside IIA1、mogroside IIA2、mogroside IIE、mogroside IIIA1、mogroside III、mogroside IIIE、mogroside IVA、mogroside IVE、siamenoside I、mogroside V、mogroside VI、11-oxo-mogroside IIA、11-oxo-mogroside IIIA1、11-oxo-mogroside III、11-oxo-mogroside IIIE、11-oxo-siamenoside I 和 11-oxo-mogroside V)由 Biopurify Phytochemicals(成都,中国)提供。异丙基-β-d-硫代半乳糖苷(IPTG)由 Solarbio Science & Technology(北京,中国)提供。UDP-葡萄糖由 Bide Pharmatech(上海,中国)提供。
基因挖掘
对来自 欧洲核苷酸档案库(ENA) 的一组已发布的转录组数据(登录号 PRJEB23465、PRJEB23466 和 PRJEB25737)进行了重新分析。使用 Pfam 的 UGT hmm 模型 PF00201(E值 < 1 × 10⁻¹⁰)通过 hmm 搜索预测了罗汉果基因组中的 UGT 基因。基于氨基酸长度(350 < 长度 < 550)筛选了假定的 UGT 蛋白。预测并总结了 UGT720s、UGT94s、UGT74s 和 UGT75s(见补充表 S1),并通过系统进化关系和转录组的差异表达分析对其进一步分类和研究。
RNA 提取与候选 UGT 基因的克隆
使用 TRIzol 试剂(Invitrogen, Carlsbad, CA, USA)从罗汉果果实中提取 RNA,遵循厂家说明。通过反转录聚合酶链式反应(RT-PCR),使用 Prime Script One-Step RT-PCR Kit(Takara, Dalian, China)和特异性引物(见补充表 S2)从罗汉果 RNA 中扩增了 UGT153033 和 UGT30033 的编码序列。得到的 DNA 片段回收并亚克隆至 pET-32a 载体(Novagen)。从枯草芽孢杆菌(B. subtilis 600)基因组中扩增了 yojK1 的开放阅读框(ORF),并亚克隆至 pET-28a 载体(Novagen)。本研究使用的所有质粒和菌株列于补充表 S3。
SNP 分析
从六个品种的罗汉果在五个不同生长阶段中提取总 RNA。使用特异性引物(见补充表 S2)通过 RT-PCR 从 RNA 中扩增 UGT30033 的序列。RT-PCR 产物由 Sangon Biotech(上海,中国)测序。利用 DNAman 软件(版本 9.0,Lynnon Biosoft,魁北克,加拿大)对序列进行比对并鉴定 SNP。
在大肠杆菌中 UGT 的异源表达与 SDS-PAGE 分析
pET-32a 载体通过与高溶解性的硫氧还蛋白 A(TrxA)直接融合来减少包涵体的积累并增强蛋白的溶解性。这种融合蛋白常用于表达功能活性的蛋白质并提高其溶解性。因此,将重组载体(pET32a-UGT153033 和 pET32a-UGT30033)转化至 E. coli Rosetta (DE3) 菌株中进行蛋白表达,该菌株对植物来源的真核基因(如 UGT 基因)表达进行了优化。pET28a-yojK1 质粒被转化至 E. coli BL21(DE3) 菌株中进行异源表达。
转化菌接种于含有 氨苄青霉素(100 μg/mL) 和 氯霉素(25 μg/mL)/卡那霉素(50 μg/mL) 的 Luria–Bertani(LB)培养基中,在 37 °C 培养至 OD600 达到 0.6–0.8。然后以 0.1 mM IPTG 在 16 °C 下诱导 12–16 小时表达重组蛋白。
收获的细胞悬浮于适量预冷的裂解缓冲液(50 mM Tris-HCl,15% 甘油,0.1 mM EDTA 和 5 mM β-巯基乙醇,pH 8.0)中,随后以 70 Hz 超声破碎 5 分钟(Sonics & Materials, USA),4 °C 下以 13,523 × g 离心 10 分钟。收集上清液作为粗酶液。将适量样品与上样缓冲液混合后,于 100 °C 加热 10 分钟,样品随后进行 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
UGT 的体外酶活性测定
将粗酶液在含有 5 mM MgCl₂、5 mM UDP-葡萄糖 和 0.5 mM 罗汉果苷的 400 μL 体系中于 30 °C 反应 12 小时。反应后加入等体积的正丁醇并剧烈振荡终止酶促反应。样品分析前,将上层有机相溶液蒸发后重新溶解于 200 μL 甲醇中,经过 0.22 μm 有机相过滤膜过滤,随后进行高效液相色谱(HPLC)和 LC-MS/MS 分析。
高效液相色谱 (HPLC) 和三重四极杆液质联用 (LC-QQQ-MS) 分析
使用 Nexera UHPLC/HPLC 系统(SHIMADZU,中国)分离和鉴定罗汉果苷。色谱分离在 Poroshell 120 EC-C18 色谱柱(4.6 mm × 250 mm, 4 μm,Agilent Technologies, 美国)上进行,柱温为 30 °C,流速为 1 mL/min,检测波长为 210 nm。流动相梯度由 H₂O(溶剂 A) 和 100% 乙腈(溶剂 B) 组成。样品分离使用优化梯度:0–55 min,22.5%–62.5% 溶剂 B。
罗汉果苷的分离和定量使用 三重四极杆液质联用系统(Triple Quadrupole LC/MS System,Agilent Technologies, 美国)。样品在 Poroshell 120 SB-C18 色谱柱(2.1 mm × 100 mm, 2.7 μm,Agilent Technologies, 美国)上分离,流速为 0.2 mL/min。流动相为 0.1% 甲酸水溶液(溶剂 A) 和 100% 乙腈(溶剂 B),梯度为 25%–80% 乙腈/水,洗脱时间为 0–16.5 min。进样量为 2 μL,柱温保持在 30 °C。定量分析基于峰面积法,监测的质子化分子离子 ([M+COOH]−) 包括:mogrol (m/z 521.4)、mogroside IA1 和 IE1 (m/z 683.5)、mogroside IIA 系列 (m/z 845.5)、11-oxo-mogroside IIA (m/z 843.6)、mogroside III (m/z 1007.6)、11-oxo-mogroside IIIE 和 III (m/z 1005.7)、siamenoside I 和 mogroside IVA/IVE (m/z 1169.6)、mogroside V (m/z 1285.4)、11-oxo-mogroside V (m/z 1329.8)、mogroside VI (m/z 1447.8)。QQQ 参数设置如下:扫描范围为 100–1500 m/z(负离子模式),喷雾电压为 500 V,毛细管温度为 400 °C,干燥气流速为 11 mL/min,干燥温度为 250 °C,雾化器压力为 35 psi。
核磁共振 (NMR) 分析
通过半制备型 HPLC(Basic C18 120A 色谱柱,5 μm,10 mm × 250 mm,Sepsis (Beijing) Technology)在 0–20 min 梯度(22.5%–38.5% 溶剂 B)条件下收集 mogroside IVX 和 VX 样品。化合物通过 NMR 谱验证。NMR 谱由 Agilent 800 MHz 核磁共振仪记录。1H NMR 和 13C NMR 化学位移以 δ 单位(ppm)报告,相对于残留溶剂的化学位移。甲醇在 1H NMR 和 13C NMR 谱中的参考峰分别为 3.31 ppm 和 49.00 ppm。
同源建模、分子对接及分子动力学 (MD) 模拟
使用 NCBI 蛋白 BLAST 工具在蛋白质数据银行(PDB, RCSB PDB: Homepage)中搜索可能的模板结构。由于其高序列同源性和低 E 值,选取水稻中 UGT91C1(PDB ID: 7ERX,链 A)的晶体结构作为模板,通过 SWISS-MODEL 建立 UGT30033 的三维 (3D) 结构。同源建模后,使用 AutoDock Vina v1.2.3 对 UDPG 供体和糖基受体(分别为 mogroside IIE 和 IIIE)与 UGT30033 进行分子对接。
UGT30033 及其突变体的分子动力学模拟通过 Gromacs 2022.3 软件完成,采用 Amber99sb-ildn 力场,水分子选择 Tip3p 模型。模拟在静态温度 300 K 和 1 bar 大气压下进行,每个系统经能量最小化优化后,分别在等温等体系 (NVT) 和等温等压系 (NPT) 平衡条件下运行 100 ps。分子动力学模拟的总时长为 100 ns,时间步长为 2 fs。模拟完成后分析了 RMSD(均方根偏差)、RMSF(均方根波动)和结合自由能 (MM/GBSA)。
糖基转移酶的定点突变
基于对接结果,选择结合位点的关键残基以提高 M1-1 的催化效率。定点突变按照 Beyotime Biotechnology(南京,中国) 的定点基因突变试剂盒说明操作,使用特异性引物。表达后,通过测定突变体对 mogroside IIE 和 IIIE 的活性进行筛选。
构建多酶催化系统以提高罗汉果中甜味罗汉果苷含量
罗汉果提取物的制备如下:从 −80 °C 冰箱中取出新鲜果实样品,置于真空冷冻干燥机中脱水 72 小时。按 1:100 的料液比称取适量样品粉末和水,混合后振荡。混合物在室温(40 kHz)超声水浴提取 1 小时。上清液通过离心收集,用作糖基化反应的底物。
利用具有不同催化位点的 UGT153033、UGT30033 M3 和 yojK1,对罗汉果提取物进行糖基化反应,以去除苦味并提高提取物的质量。为适应工业生产需求,本研究引入了 拟南芥(Arabidopsis thaliana) 的蔗糖合酶(AtSusy)构建 UDP 再生系统,从而降低对昂贵 UDPG 的需求,减少糖基化反应的成本。因此,使用 UGT153033、UGT30033 M3、yojK1 和 AtSusy 构建多酶催化系统以提高甜味罗汉果苷的含量。表达后用于罗汉果提取物的糖基化反应。反应体系包含 0.2 M 蔗糖、2.5 mM UDP 和 1 mM 罗汉果提取物。UGT153033、UGT30033 M3、yojK1 和 AtSusy 的比例为 80:150💯400 mU/mL。在 30 °C 孵育 12 小时后,按照上述 LC-QQQ-MS 方法对罗汉果苷含量进行定量分析。
统计分析
所有实验均进行三次重复,结果以平均值 ± 标准差形式表示。统计分析采用 Tukey 方法进行,显著性水平设定为 p < 0.05。
结果与讨论
UGTs的克隆及UGT30033基因ORF区的SNP鉴定
基于罗汉果(S. grosvenorii)的基因组和转录组数据(10,22),结合已知的目标UGTs,收集了完整的UGTs家族并构建了进化树(图S1)。先前的研究(10,22)对UGT功能进行了分析,发现多个UGT家族成员能够催化三萜类化合物(图S2)。来源于罗汉果的UGT720.269.1展示了显著的催化能力,能够依次催化mogrol分子C24和C3位的初级糖基化(10)。此外,还发现罗汉果中的UGT94.289.2能够催化mogrosides分子在C24位糖链的延伸(10,20)。因此,选择了与UGT720.269.1同源性达到86.1%的UGT153033,以及与UGT94.289.2同源性达到88.73%的UGT30033进行研究并进行鉴定。通过RT-PCR使用对应的引物扩增得到了UGT153033和UGT30033基因(表S2)。
为了检测序列多态性,对RT-PCR产物的ORF序列进行了比对,结果发现了七个SNPs。在UGT30033的ORF区域中未检测到插入缺失突变(InDels)。在595、653、781和848位点发生了核苷酸转换(A-G或C-T),而在590、924和1328位点发生了核苷酸颠换(A-C、A-T)。这些核苷酸的变化导致了氨基酸序列的改变,包括赖氨酸(K)、苏氨酸(T)、丙氨酸(A)、谷氨酸(E)、甘氨酸(G)、甲硫氨酸(M)、精氨酸(R)、丝氨酸(S)和缬氨酸(V)的差异。最终鉴定出三个UGT30033突变体(M1-1、M1-2和M1-3)(图S3)。
UGTs的体外酶活性检测
将UGT153033和UGT30033基因分别克隆到pET-32a载体中,并转化至大肠杆菌Rosetta(DE3)中。由于pET-32a的TrxA融合表达标签,重组的UGT153033和UGT30033的分子质量分别为71.6 kDa和70 kDa(图S4)。以mogroside IA1为受糖体、UDPG为供糖体,测试了UGT153033的催化活性。HPLC和LC-MS分析结果表明,UGT153033在IA1的C3-OH位形成了一个β-d-糖苷键,并且mogroside IA1被完全转化为mogroside IIE,无副产物生成(图1A、B和S5A)。
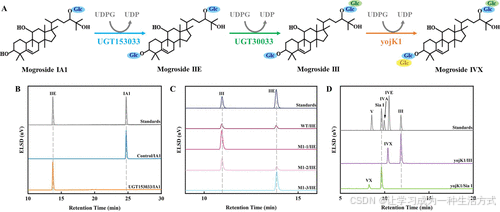
图1. UGTs对罗汉果苷的催化活性
(A) 对UGT153033、UGT30033和yojK1的功能进行表征。蓝色的Glc代表β-d-糖苷基,绿色的Glc代表β-(1,6)-d-糖苷基,黄色的Glc代表β-(1,2)-d-糖苷基。 (B) UGT153033对罗汉果苷IA1的催化活性。 (C) 野生型UGT30033(WT)及其突变体对罗汉果苷IIE的催化效率比较。 (D) yojK1对罗汉果苷III和siamenoside I(Sia I)的催化活性。
随后,研究了UGT30033及其由SNP引起的突变体对罗汉果苷IIE的催化活性。HPLC和LC-MS分析结果显示,UGT30033、M1-1和M1-2能够催化罗汉果苷IIE的C24-O-Glc糖基化生成罗汉果苷III(图1A、C和S5B)。值得注意的是,M1-1对罗汉果苷IIE表现出较高的催化效率,而M1-3则缺乏催化活性,这表明E218G的突变导致酶活性的丧失。
高甜度的天然罗汉果苷通常至少含有四个葡萄糖基单位。UGTs催化罗汉果苷III的糖基化反应生成含有四到六个葡萄糖基的甜罗汉果苷。来源于枯草芽孢杆菌168的UDP-糖基转移酶yojK1(33)催化与人参皂苷Rh1(34)、栀子苷(35)、甘草酸(36)和齐墩果酸(37)的糖基化反应生成β-d-糖苷键,并催化与Reb A的糖基化反应生成β-(1,2)-糖苷键(25)。基于已发表的基因序列,克隆了yojK1的ORF,并将其转化至E. coli BL21(DE3)中进行异源表达。令人惊讶的是,yojK1能够特异性地将罗汉果苷III转化为一种新的含有四个葡萄糖基的罗汉果苷(图1A、D)。此外,它还能够对Sia I进行分支糖基化,生成一种新的甜罗汉果苷。LC-MS和NMR分析结果表明,yojK1催化了罗汉果苷C3位的分支糖基化反应,形成一个β-(1,2)-糖苷键,将罗汉果苷III转化为罗汉果苷IVX,同时将Sia I转化为罗汉果苷VX(表S6和图S5C、S5D、S6–S9)。
UGT30033的催化机制及M1-1分支糖基化活性的分子基础
为了分析UGT30033的分子基础,通过同源建模预测了野生型(WT)的三维结构(图S10)(26−29,38),并利用Autodock Vina(30)解析了WT·UDPG·罗汉果苷IIE(WT·UDPG·IIE)复合物的分子间相互作用。如图2A所示,UGT30033的结构由两个Rossmann折叠结构域(β/α/β)对称组成,分别位于N端和C端,这是典型GT-B折叠糖基转移酶的特征。此外,C端结构域包含一个高度保守的植物次生代谢产物糖基转移酶(PSPG)基序(Trp334-Gln377),决定了对UDPG供体的识别和结合。N端结构域则与受体底物(如罗汉果苷IIE)结合。

图2. UGT30033的分子对接及其与M1-1的结构比较
(A) UGT30033与罗汉果苷IIE和UDPG的结合模型。 (B) UGT30033的催化机制。His21使IIE的C24 6-羟基去质子化,使其成为亲核体,从而攻击糖供体UDPG。 (C) WT·UDPG·IIE复合物和M1-1·UDPG·IIE复合物的代表性结构。
分子对接分析显示,罗汉果苷IIE在UGT30033的受体结合口袋中与His21形成了氢键(图2A)。不可替代的催化二联体His21-Asp123(14,39−41)位于糖供体和受体附近。在SN2反应机制中,His21从罗汉果苷IIE的C24-O-葡萄糖基团中抽取一个质子,增强受体原子的亲核性,生成的亲核体攻击UDPG中葡萄糖的C1碳(39,42,43)。残基Asp123通过稳定催化构象并平衡电荷来支持该过程(图2B)。
为了理解M1-1对罗汉果苷IIE的高催化效率,通过分子对接生成了M1-1·UDPG·IIE的三维复合物。根据UGT的催化机制,当葡萄糖1-C24位的O6原子与催化残基His21的N22原子的距离小于4 Å时,糖基化反应发生(14)。M1-1·UDPG·IIE复合物的催化构象显示该距离为2.9 Å,显著小于WT·UDPG·IIE复合物的3.6 Å,表明HO6和N22之间的质子转移更容易发生(图2C)。
基于结构的UGT30033 M1-1催化活性改造
UGT30033 M1-1仅能催化低糖基化底物(如罗汉果苷IA1和IIE)的糖基化反应。然而,M1-1底物的狭窄谱范围限制了其工业应用。为了更好地了解关键氨基酸残基并提高M1-1的催化活性,我们基于其三维结构分析了底物结合口袋内的残基。在M1-1·UDPG·IIE复合物中,结合口袋内有10个氨基酸残基与IIE相互作用。His21、Thr182、Ile194和Asp376与IIE形成氢键,而Leu125、Leu198、Glu190、Thr188、Leu187和Tyr180则参与疏水相互作用。这些作用力固定了IIE并促进了催化反应(图3A)。UGTs的C端结构域通常具有高度保守的PSGD基序,决定了UDP-糖供体的识别和结合,而N端结构域则与糖受体相互作用。

图3. M1-1和M3的结构比较 M1-1·UDPG·IIE复合物的代表性结构 (A),M3·UDPG·IIE复合物 (B),M1-1·UDPG·IIIE复合物 (C),以及M3·UDPG·IIIE复合物 (D)。
为扩展M1-1的底物范围,选择N端结构域内的氨基酸残基进行进一步的定点突变。基于M1-1·UDPG·IIE复合物的三维结构分析,位于结合口袋中心的残基Ile194与IIE形成氢键,并具有长侧链的空间结构。这可能导致当IIE延伸进入活性口袋时产生显著的空间位阻。因此,将Ile194选为M1-1定向进化的突变位点之一。当Ile194被替换为Gly时,侧链长度缩短,降低了结合口袋内的空间位阻,使IIE的侧链能够延伸进入活性口袋(图3B)。同时,暴露在蛋白质表面的氨基酸残基的电性可能影响底物与酶的亲和力,从而影响IIE进入结合口袋的过程。位于结合口袋边缘的残基Thr181被选中。当Thr181被Asp取代时,蛋白质表面的负电荷增加,增强了酶与底物的亲和力,从而促进底物进入结合口袋。HPLC结果还显示,I194G(M2-1)和T181D(M2-2)的催化效率显著提高(图S11)。最终,结合突变位点产生了双突变体T181D/I194G(M3),其催化效率进一步提高。M3与罗汉果苷IIIE对接的结果显示His21与罗汉果苷IIIE的C24 6-羟基之间的距离显著缩短(图3C,D)。
分子动力学(MD)模拟结果表明,M3·UDPG·IIE复合物在整个模拟过程中保持较低的RMSF(均方根波动)值,并处于较小的波动范围内(图S12A)。M3在残基194处的降低的RMSF值表明突变使M3的局部结构更加稳定(图S12B)。而M3在残基181附近增加的RMSD(均方根偏差)值表明突变增强了M3的局部柔性,从而扩展了底物进入和产物释放的通道(图S12C)。这表明M3与底物的结合导致更稳定的构象,其结合自由能(−45.65 kcal/mol)低于M1-1·UDPG·IIIE复合物(−38.71 kcal/mol),进一步证实突变体M3更稳定,并因此具有更高的催化效率。
此外,对M3催化其他罗汉果苷(如罗汉果苷IIA、11-O-罗汉果苷IIA、11-O-罗汉果苷IIE、罗汉果苷IIIE、11-O-罗汉果苷IIIE及罗汉果苷IVE)的催化特性进行了研究。HPLC和LC-MS结果显示,突变体M3通过β-(1,6)-糖苷键将一个葡萄糖基特异性转移到罗汉果苷C24位的Glc-O(图4和图S13,表S7)。值得注意的是,突变体M3还对罗汉果苷III表现出催化活性,并在C3位形成了β-(1,6)-糖苷键,而这一反应未在M1-1和野生型(WT)中观察到(图S14)。这些结果表明,突变体M3在罗汉果苷分支糖基化方面相比野生型酶具有更大的潜力。

图4. M1-1/M3对8种罗汉果苷和UDP-Glc的体外验证实验的HPLC分析 蓝色的Glc代表β-d-糖苷基,绿色的Glc代表β-(1,6)-d-糖苷基。 (A) M1-1/M3在C24-O-Glc位催化IA1、IIA、IIE、IIIE和IVE的糖基化反应,分别生成IIA1、IIIA1、III、Sia I和V。 (B) M1-1/M3在C24-O-Glc位催化11-O-IIA、11-O-IIE和11-O-IIIE的糖基化反应,分别生成11-O-IIIA1、11-O-III和11-O-Sia I。
多酶催化优化罗汉果提取物的组成
为了在不同阶段优化罗汉果提取物的组成(减少苦味罗汉果苷,增加甜味罗汉果苷),采用了由UGT153033、M3和yojK1组成的多酶催化系统,将苦味罗汉果苷转化为甜味罗汉果苷。为降低或消除对昂贵的外源性UDPG供体的需求,引入了一个拟南芥(A. thaliana)的高效蔗糖合酶(AtSusy)构建的原位 UDPG再生系统(图5A)(20,46)。通过LC-QQQ-MS分析了各种罗汉果苷的相对含量,并测量了在花后不同发育阶段(15、30、45、70和90天)罗汉果经多酶系统催化前后的组成变化。

图5. UGTs催化苦味罗汉果苷生成甜味罗汉果苷 (A) 包含UGT153033、UGT30033 M3和yojK1的级联反应示意图,同时引入蔗糖合酶AtSuSy进行UDPG的循环再生。蓝色的Glc代表β-d-糖苷基,绿色的Glc代表β-(1,6)-d-糖苷基,黄色的Glc代表β-(1,2)-d-糖苷基。 (B) UGT153033、UGT30033 M3和yojK1对不同发育阶段罗汉果提取物的催化结果。MG1代表罗汉果苷IA1、IE1等,MG2代表罗汉果苷IIA1、IIA2、IIE、11-氧代罗汉果苷IIA等,MG3代表罗汉果苷IIIA1、III、IIIE、11-氧代罗汉果苷IIIA1、11-氧代罗汉果苷III、11-氧代罗汉果苷IIIE等,MG4代表罗汉果苷IVA、IVE、Sia I、11-氧代Sia I等,MG5代表罗汉果苷V、11-氧代罗汉果苷V等。
如图5B所示,在所有发育阶段的罗汉果提取物中,苦味罗汉果苷显著减少,而甜味罗汉果苷显著增加。在幼果阶段(15–30 DAA),以含两个葡萄糖基的罗汉果苷为主,这些化合物是苦味的主要来源。在这一阶段,由于果实苦味较重、缺乏甜味,且工业价值低,弃用率较高。通过引入多酶系统,单糖基(MG1)和双糖基化合物(MG2)的含量降低了68%至83%,同时转化为三糖基(MG3)和四糖基化合物(MG4),甜味罗汉果苷的总含量显著增加30%至40%。
这些结果表明,新的多酶系统具有良好的催化和UDPG再生性能,可高效去除苦味罗汉果苷,并在以蔗糖作为供糖体时使甜味罗汉果苷的最高含量达到40%。对于45 DAA的罗汉果提取物,甜味罗汉果苷(MG4和五糖基化合物[MG5])的含量原本仅为57%,这对以45 DAA果实为原料进行大规模工业化甜味剂生产仍是一个挑战。然而,通过多酶系统的催化,苦味罗汉果苷(MG2和MG3)的含量从43%降至5%,甜味罗汉果苷的含量增加至95%(12.97 mg/L),可用于生产甜味剂以及提取和纯化高价值的罗汉果苷V。此外,在70和90 DAA(成熟期)的罗汉果提取物中,甜味罗汉果苷MG5原本超过90%,因此多酶系统的催化效果相对较弱,但六糖基化合物(MG6)的积累趋势显著(表S8)。
研究结果表明,多酶系统能够有效增强不同罗汉果苷底物中糖基化罗汉果苷的生成能力。因此,该系统可进一步应用于果实生长过程中废弃或病害果实的转化,实现“变废为宝”。总的来说,多酶系统在幼果中苦味成分的转化中发挥了不可忽视的作用。该系统极大缩短了高纯度甜味罗汉果苷的提取和生产周期,为高附加值罗汉果苷的生产节省了时间和成本,并可能进一步推动罗汉果农业产业的发展。
工程化E. coli用于甜味罗汉果苷低热量甜味剂的酶促生物合成的贡献
如表S8所示,罗汉果苷的含量在果实发育和成熟过程中变化显著。成熟果实中甜味成分(MG4和MG5)占主导,而未成熟果实中以苦味成分(MG1和MG2)为主(10)。罗汉果在成熟过程中调控UGT的形成,以催化苦味罗汉果苷转化为甜味罗汉果苷(含有四个以上糖基)。然而,自然成熟过程耗时较长。在种植和提取过程中,由于苦味罗汉果苷含量高,大量掉落果实、病害果实及冻害果实被丢弃。然而,从成熟果实中提取甜味罗汉果苷的成本较高,不利于农业生产中的成本节约和利润增长。
受到上述背景的启发,为促进罗汉果农业发展,本研究旨在通过合成生物学手段缩短苦味罗汉果苷向甜味罗汉果苷的转化周期。首先,进行了UGT基因挖掘。鉴定出三个UGT基因(来自罗汉果的UGT153033和UGT30033,以及来自枯草芽孢杆菌的yojK1),它们能够高特异性地在罗汉果苷的C3和/或C24位形成糖苷键。这三个UGT基因被亚克隆到pET-32a或pET-28a载体中,并转化到E. coli中表达蛋白。通过HPLC和LC-MS分析这些UGT体外酶促活性的结果(图1和图S5),发现苦味罗汉果苷(罗汉果苷IA1)可以通过新的合成途径迅速转化为甜味罗汉果苷(罗汉果苷IVX)。具体而言,酶UGT153033高效催化罗汉果苷IA1在C3位形成新的β-d-糖苷键,生成罗汉果苷IIE;UGT30033通过选择性催化C24-O-Glc糖基化,将罗汉果苷IIE转化为罗汉果苷III;而yojK1将罗汉果苷III合成一种含有四个葡萄糖基的新罗汉果苷IVX。此外,yojK1还可催化Sia I生成含有五个葡萄糖基的罗汉果苷VX,在合成甜味罗汉果苷(含有四个以上葡萄糖基)的过程中发挥了重要作用。
本研究通过分子对接和突变改造优化了UGT30033的催化性能(图2),并构建了多酶催化系统,用于不同发育阶段罗汉果提取物的催化转化。结果表明,通过该多酶系统催化,45 DAA罗汉果提取物中的甜味罗汉果苷含量增加至95%,与70和90 DAA(自然成熟期)的甜味罗汉果苷含量(约99%)相当。
展望
通过酶促生物合成技术将未成熟罗汉果中的罗汉果苷转化为甜味罗汉果苷,相较于传统方法,具有种植周期短、成本低、产量高及环保性好等优势。本研究为未成熟罗汉果的高价值利用提供了新方向,可满足食品、饮料、制药及化妆品行业日益增长的需求。此外,该研究有助于推动罗汉果产业的发展,惠及当地农民和经济。未来需要进一步优化罗汉果苷酶促生物合成,例如提高酶的稳定性和特异性,减少副产物及副反应,并扩大生产规模。同时,需对酶促合成的罗汉果苷与天然提取物的安全性及功效进行对比,以确保其质量和适用于多种应用领域。



























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








