摘要:
转移是癌症患者死亡的主要原因,早期发现和干预转移可显著改善其临床预后。我们对透明细胞肾细胞癌(CCRCC)患者治疗前原发肿瘤(PT)、肿瘤扩展(TE)和淋巴转移(LM)部位的RNA(表达)和DNA(突变)进行了测序和分析。在这里,我们报告了Plk5 c区附近的一个与淋巴转移特异性相关的三个核苷酸缺失。这种突变在PT中无法检测到,在TE中可以检测到,并在LM组织中占主导地位。因此,虽然只有少数原发性癌细胞携带这种突变,但大多数转移性细胞都有这种突变。这种突变在转移组织中出现的频率越来越高,这表明这种Plk5缺失可以作为CCRCC转移的早期指标,并可以通过低成本PCR检测来识别。一项大规模的临床试验可以揭示在肾切除术时对这种突变进行简单的PCR检测是否可以识别和分层高危CCRCC患者进行治疗。
引言
肾细胞癌(RCC)约占所有癌症的2-3%,全球每年新发病例超过25万例。最常见的肾细胞癌是透明细胞肾细胞癌(clear cell renal cell carcinoma, CCRCC),起源于近曲小管上皮内层,占成人肾细胞癌的60% - 80%。手术切除是目前主要的治疗方法。然而,在诊断时,大约25-30%的患者已经出现转移,中位总生存期不到2年。超过40%的RCC患者在根治性肾切除术后发生转移,生存率较差。尽管治疗方法有所改善但无论采用何种治疗方案,转移性RCC患者的预后仍较差,自确诊起平均生存期仅为6 ~ 12个月。因此,与转移性CCRCC相关的生物标志物对于早期发现和选择合适的治疗策略非常重要。
在这里,我们采用了一种新策略,即下一代测序(NGS)来识别转移性CCRCC的特定突变作为生物标志物。我们比较了同一患者不同肿瘤组织的遗传谱(原发肿瘤、肿瘤扩展和淋巴转移),以确定转移特异性突变。肿瘤的基因组不稳定性在肿瘤群体中产生大规模的细胞异质性,这是罕见的变异通过达尔文选择过程进化,导致成功转移[6,7]。因此,如果这些基因变异(突变)提供生长优势,它们将在转移组织中富集。比较同一患者不同部位的基因表达和突变谱,我们消除了个体遗传变异和肿瘤特异性遗传改变,以便更好地检测转移特异性突变。通过这种方法,我们在Plk5 c端区域的polo box蛋白结合域(PBD)中发现了一个小的三个核苷酸缺失,Plk5是转移性CCRCC的一个有希望的遗传生物标志物。
polo - like激酶(Plk)最初在D. Melanogaster中发现,是一个进化保守的蛋白家族,其特征是在C端附近表达一个或多个polo box蛋白结合域(PBD),在n端附近表达一个丝氨酸/苏氨酸激酶[8]。Plk ' s是调控网络的一部分,控制Cdk1/ cyclin B复合物的激活和G2 /M过渡时进入有丝分裂[9]。在所有Plks (Plk 1-5)中,Plk5是一种DNA损伤诱导基因,Plk5的异位表达可导致小鼠细胞周期阻滞和凋亡。人类Plk5在星形细胞瘤和多形性胶质母细胞瘤中通过启动子超甲基化被显著沉默,但在正常脑组织中表达。这里报道的Plk5突变可能是转移性CCRCC中Plk5沉默的变异。鉴于Plk5在细胞周期中的调节作用,这一新发现的转移突变可能是已知转移相关基因[13]的新补充,作为CCRCC的干预靶点和生物标志物。
材料和方法
DNA和RNA制备
经IRB批准和患者同意,所有病例均在手术中获得原发肿瘤、肿瘤扩展和转移淋巴结的新鲜组织。手术标本的分离和处理符合临床护理标准。每个标本被切成两部分。一部分用于常规病理诊断,另一半冷冻于液氮中进行分子分析(提取DNA和RNA)。CCRCC的诊断及分期由独立病理医师确定。经病理学家鉴定肿瘤细胞后,使用TRIzol®试剂(Life technologies, USA)从含有80%或以上肿瘤细胞的载玻片中分离基因组DNA和mRNA。
文库建设与测序
每个样品制备1μg的gDNA和5μg的RNA并提交测序。利用文库构建试剂盒(Illumina, USA)构建文库,评估DNA和RNA质量。文库在Illumina HiSeq 2000平台(Illumina, USA)上测序。根据测序质量、适配器污染和重复读取对生成的原始读取进行过滤。因此,只有高质量的reads被保留下来并用于基因组组装。RNA-seq和Exome-seq数据均使用Partek Flow version 4 (Partek Inc., USA)进行分析。Phred评分低于20的碱基被从原始测序reads的两端修剪掉,短于25 nt的修剪reads被排除在下游分析之外。校准前和校准后的QA/QC都是使用默认设置作为Flow工作流的一部分进行的。
基因表达分析
对于RNA-seq样本,使用Tophat 2.0.8(默认设置)将修剪后的reads映射到人类基因组hg38上,并使用Gencode 20注释作为指导。使用Gencode 20注释(www.gencodegenes.org)使用Partek E/M方法定量对齐的reads到基因/转录本。使用上四分位数归一化方法对所有样本中每个基因的reads计数进行归一化,并使用Partek的基因特异性分析方法分析差异表达(排除任何样本中少于10个reads的基因)。为了产生同一患者不同组织间表达差异显著的基因,采用FDR调整p<0.05(泊松回归)和folder change >|2|截断。
突变分析
对于Exome-seq样本,使用默认设置在Flow中实现的BWA-MEM 0.7.9a将修剪后的reads映射到人类基因组hg38上。然后使用Samtools[21]使用Flow中实现的默认设置,使用每个样本的对齐读取来调用样本中的变量。使用整合基因组学查看器目视检查鉴定出的变异。我们利用BioBase识别出被认为是癌症风险基因的推定癌基因和变异,并将变异位点与公开可用的HGMD®(专业,2015)、COSMIC v71、GWAS(2015年2月17日)EVS中已知外显子变异(cESP6500)、ClinVar(2015-02)、药物基因组突变数据库2015.1(beta)、来自1000个基因组的等位基因频率(dbSNP141)和EVS进行比较用于非同义功能预测的dbNSFP (v2.9)。在构建分析集之前,我们删除了过滤参数产生的可疑的短阅读框和明显不相关的基因。
免疫组织化学
患者冰冻肿瘤标本用4% PFA固定24小时,石蜡块包埋切片。福尔马林固定切片在4um下切割,在60度下烘烤至少1小时,然后在二甲苯中脱胶。然后用100%乙醇洗涤,然后用95%乙醇复水化,每次5-10分钟。将载玻片放入3%过氧化氢和绝对甲醇中,以淬灭内源性过氧化物酶。在蒸馏水中洗涤载玻片后,用柠檬酸缓冲液(pH 6)和微波30分钟进行抗原提取。室温冷却20分钟后,用正常血清阻断载玻片20分钟以阻断非特异性结合。加入针对Plk5 N末端区的一抗(Abcam, USA),并在载玻片上放置30分钟。用PBS洗涤载玻片10分钟。0.03%二氨基联苯胺显色剂作用10分钟,苏木精作对照染色剂。在成像分析之前,将载玻片脱水并盖上滑片。Plk5蛋白表达的相对强度通过Imagej进行量化[23]。
靶向突变测序
利用NCBI引物设计工具设计Plk5外显子14的引物。用正向引物(CTTTGCAGGTGAGCTTCAGT)和反向引物(GGTTGAACAGTCATGCCACA)扩增出307个核苷酸序列。所得PCR产物用1.4%琼脂糖凝胶确认片段大小。然后对DNA进行柱纯化(美国的zymo®),在GENEWIZ测序之前,在纳米滴上检测所得DNA的质量和浓度。
结果
转移相关的基因改变
传统上,通过比较肿瘤和转移细胞之间的差异基因表达谱来鉴定转移相关基因。在这里,我们报告了一种新方法与下一代测序(NGS)。为了确定转移性RCC细胞特有的突变,我们从同一患者的原发肿瘤(PT)、肿瘤扩展(TE)和淋巴结转移(LM)的组织切片中收集DNA和RNA,用于HiSeq 2000 (Illumina, USA)的NGS。只有肿瘤细胞大于80%的组织切片(由病理学家检查)用于提取DNA和RNA。为了避免采样变化,提高NGS的可靠性,使用TRIzol (Thermofisher, USA)从同一管中提取样品的DNA和RNA。正如预期的那样,大多数遗传变异(70,968)对所有三个位点都是共同的,因为它们来自同一患者(图1)。然而,所有位点也有独特的遗传变异。TE有更独特的选择(30,256)比PT(26,081)和LM(29,821)多。这一数据强调了肿瘤样本的异质性。PT和LM都包含大部分已经适应当地环境的细胞。另一方面,TE具有最高的细胞异质性,癌细胞处于从PT向新环境过渡的选择压力状态。
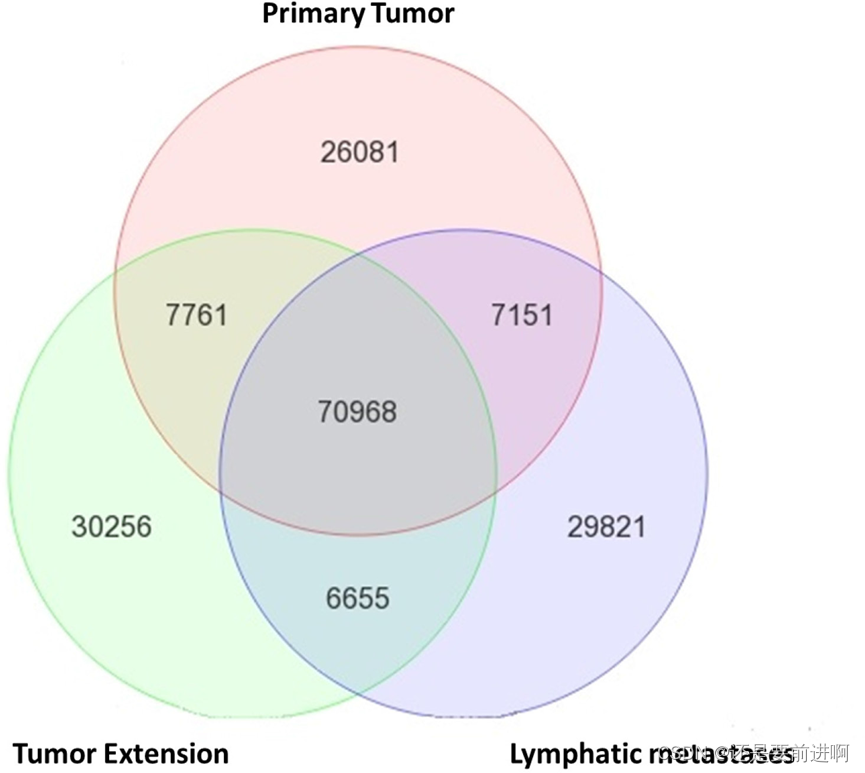
图1:同一患者肿瘤细胞的分子异质性。从4期CCRCC患者的原发肿瘤(PT)、肿瘤扩展(TE)和淋巴转移(LM)中提取DNA和RNA。比较各组织DNA外显子组测序和rna测序检测到的遗传变异。在同一患者的PT、TE和LM中检测到独特的遗传改变,提示同一患者不同部位CCRCC的细胞(肿瘤细胞数量)异质性和分子异质性(突变谱)。研究人员进一步分析了LM中独特的29,821个变异,以寻找转移性特异性突变。
基因在不同位点的差异表达
通过网络分析,我们从RNA-seq中检测了PT和LM之间差异表达的基因(图2A)。我们确定了在PT和LM之间表达差异的基因。在这些差异表达基因中,早期反应基因FosB(98倍,p = 1.55E-16)和Fos(36倍,p =1.48E- 60)的增加最为显著。在转移样本中,早期生长反应基因(EGR)也显著上调。与PT相比,LM的EGR1增加了23倍(p= 2.12E-62), EGR3增加了14倍(p=0.007.38)。匠心®通路分析(Ingenuity®Pathway Analysis, IPA®)表明,细胞周期蛋白和细胞周期蛋白依赖激酶(cyclin dependent kinase, Cdk)在差异表达基因中显著富集。这些差异表达基因涉及多种途径,包括Plk细胞分裂途径(图2B和图2C)。
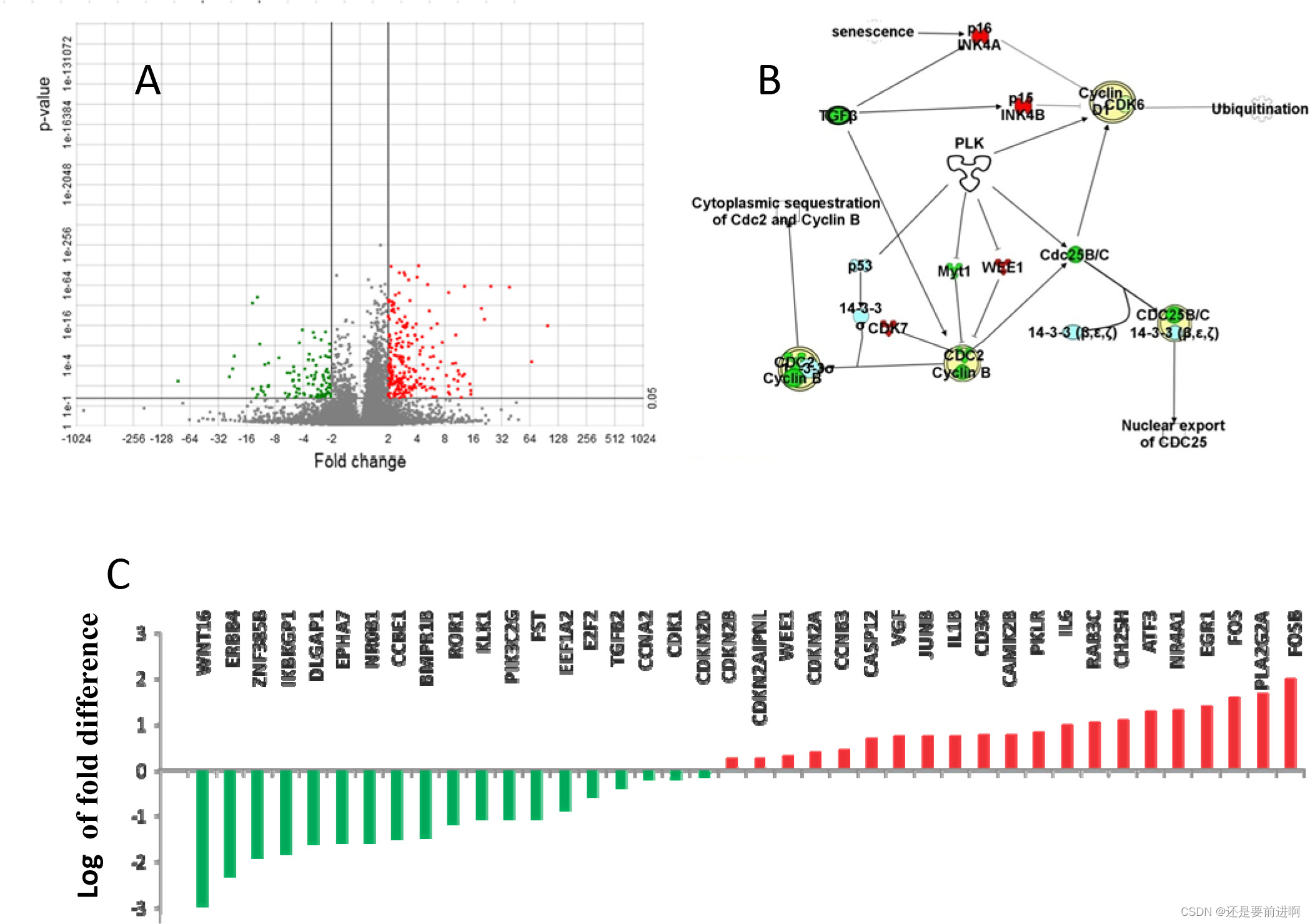
图2:原发肿瘤(PT)和淋巴转移瘤(LM)的基因表达差异。通路分析表明,PT和LM之间的差异表达基因涉及Polo激酶通路,该通路是通过染色体聚集和纺锤体形成的细胞分裂的关键调节因子。A. PT与LM有240个基因差异表达,其中111个基因在PT中显著下调(p <0.05)。B.大多数差异表达基因参与Plk5通路。C.许多细胞周期蛋白依赖激酶在LM中显著上调。在LM中,FosB、FOS、EGR1、IL6和VGF分别上调98倍、36倍、23倍、9倍和5倍(红柱)。LM中WNT和ERBB4分别下调16倍和197倍(绿色柱)。折叠变化以对数尺度绘制。红色:LM上调基因;绿色:LM中下调基因。
Plk5突变与淋巴结转移特异性相关
我们使用InterProScan进一步搜索落在功能蛋白结构域内的DNA突变坐标。我们在Plk5的外显子14中发现了一个小的框架内缺失,在转移的RCC样本中占主导地位,但在原发肿瘤中没有。具体来说,在LM中以显性频率检测到19号染色体1535177 (rs58035688, 320P)位置的三核苷酸(CCC)缺失(图3)。组织学切片显示,样品具有相当大的异质性,大多数细胞是癌细胞(图3)。在PT中未检测到缺失(只有一个读取)。在TE中,这种缺失被检测到,因为一些细胞携带这种突变。在LM中,删除频率最高,大多数读取都包含删除。这一结果表明,大多数转移性ccrcc携带这种在原发肿瘤中罕见的突变。
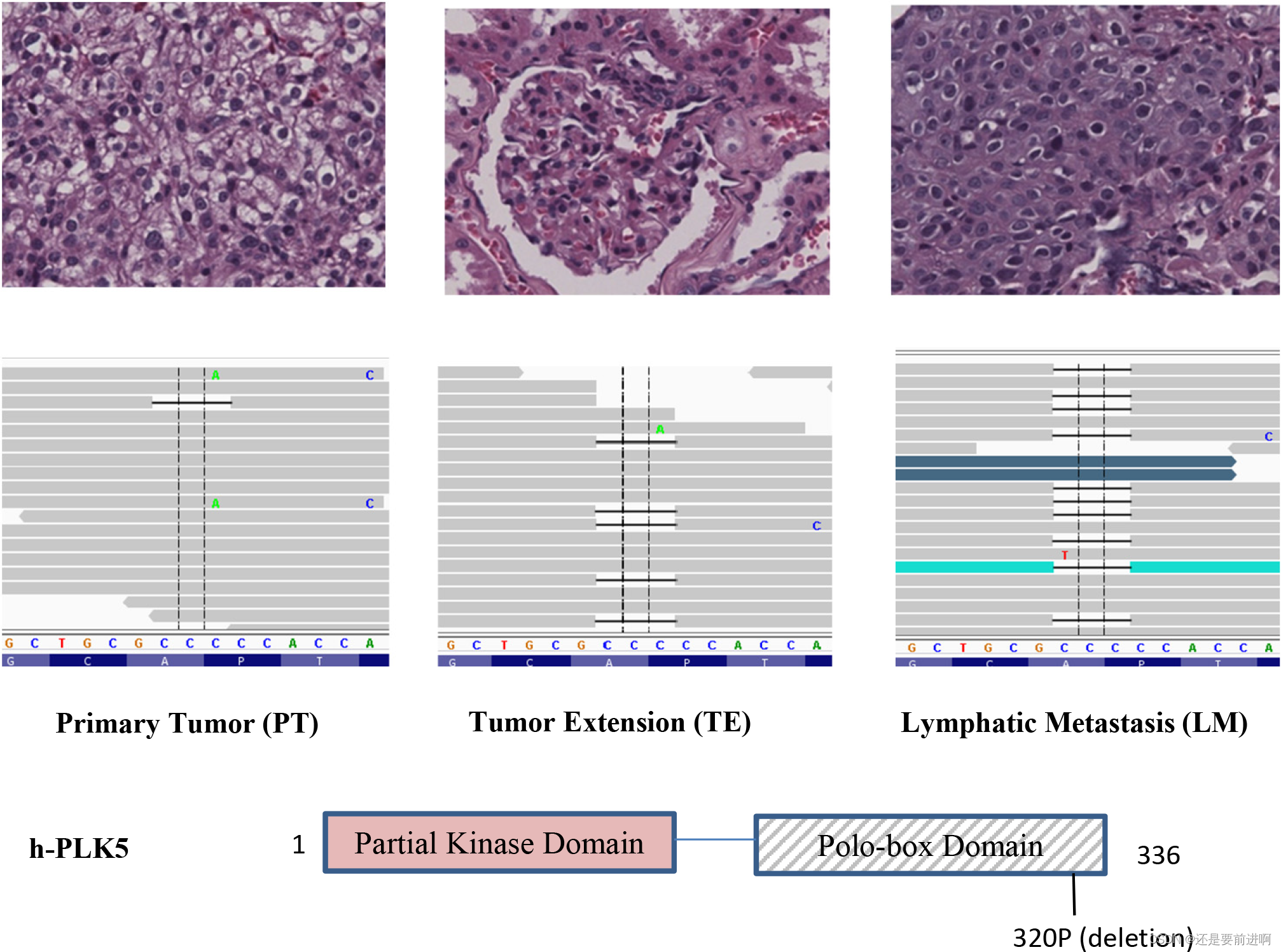
图3:淋巴转移(LM)中Plk5突变的频率增加。在LM中发现Plk5缺失的频率越来越高。这种缺失在原发肿瘤(左图)中未被检测到,在肿瘤扩展(TE,中图)中可见,在淋巴转移(LM,右图)中占主导地位。每个面板的顶部是CCRCC细胞的病理图像。这种突变在LM中出现的频率越来越高,这表明携带这种Plk5突变的癌细胞在转移组织中具有优势,大多数转移细胞携带这种突变。突变是Plk5中polo-box结构域脯氨酸的缺失。
Plk5蛋白的差异表达
该帧内Plk5缺失(rs58035688)在“1000基因组”计划中被报道,功能未知。此前已有研究报道了鼠和人Plk5蛋白的抗增殖作用,DNA损伤可诱导Plk5蛋白的表达。这些研究表明Plk5是一种肿瘤抑制因子。因此,我们首先研究了Hela细胞系中所有Plks的mRNA扰动谱。利用微流体技术,我们之前已经从处于不同细胞周期阶段的单个海拉细胞中获得了单细胞转录组。由于来自连续细胞周期阶段的转录组比来自不同细胞周期阶段的转录组更相似,通过相似性排列这些单细胞转录组揭示了细胞周期中所有基因的顺序扰动。绘制Hela细胞在细胞周期中Plks (Plk1-5) mRNA的表达情况(图4A)。Plk5的mRNA摄动谱与Plk1-4不同。与前人研究一致,Plk5 mRNA在进入S期前快速上调,然后快速下调。Plk5的mRNA扰动谱表明,Plk5是一个S期检查点基因。
Plk5蛋白在人胚胎肾细胞系HEK295中的表达已有报道。因此,我们采用免疫染色法检测不同收集的CCRCC组织中Plk5蛋白的表达。根据前人的研究,Plk5在PT的癌细胞中表达较高(图4B)。Plk5蛋白在转移性CCRCC中的表达水平较低,略高于正常肾组织。淋巴转移部位Plk5蛋白表达降低的结果表明,该突变降低了淋巴转移部位Plk5蛋白水平。
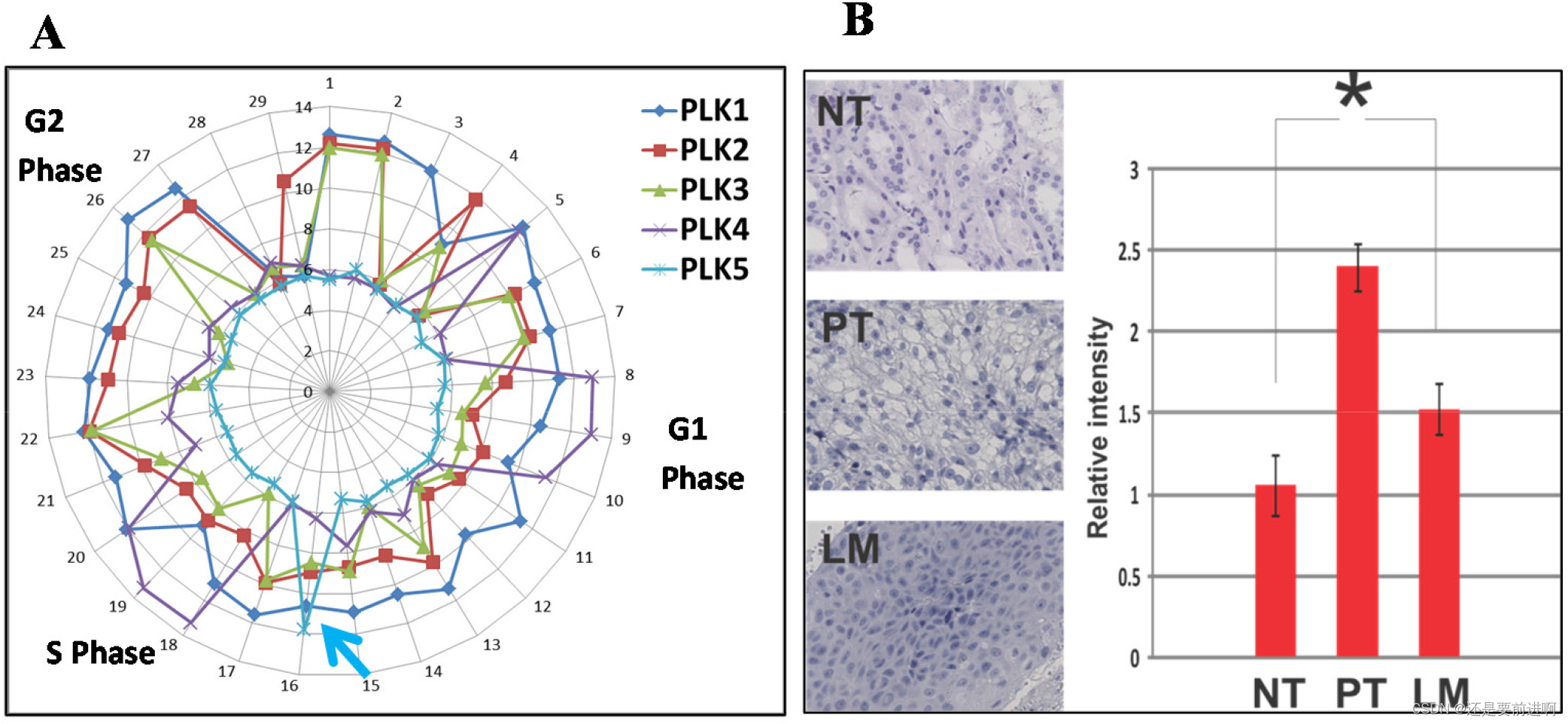
图4:细胞周期中Plk5 mRNA的扰动及其蛋白表达支持Plk5是肿瘤抑制因子。a .利用微流体装置,通过相似性排列单个Hela细胞的转录组,揭示细胞周期不同阶段单个基因的扰动。在细胞周期中Plks (Plk1-5)的mRNA扰动沿着细胞周期绘制。与Plk1-4不同,Plk5 mRNA在进入S期之前高表达并迅速下调(蓝色箭头)。这种扰动模式是典型的s期检查点基因。B.与以往研究一致,免疫染色表明,与正常组织(NT)相比,Plk5是由原发肿瘤(PT)中的DNA损伤诱导的。然而,Plk5蛋白在淋巴转移(LM)中较少,表明更多的细胞在进入S期之前失去了Plk5检查点。相对强度用Imagej量化
Plk5突变与多例转移性CCRCC的相关性
为了排除患者特异性的可能性,我们进一步用其他4期CCRCC患者的DNA对Plk5进行了靶测序。测序数据证实,Plk5突变(rs58035688)在转移性CCRCC中占主导地位,但在原发肿瘤中未检测到或几乎检测不到(图5)。这一结果表明,Plk5突变可作为检测转移性CCRCC的生物标志物。目前正在进行一项包含更多患者样本的更大规模研究,通过测量样本中Plk5缺失频率来确认转移性CCRCC的早期检测。
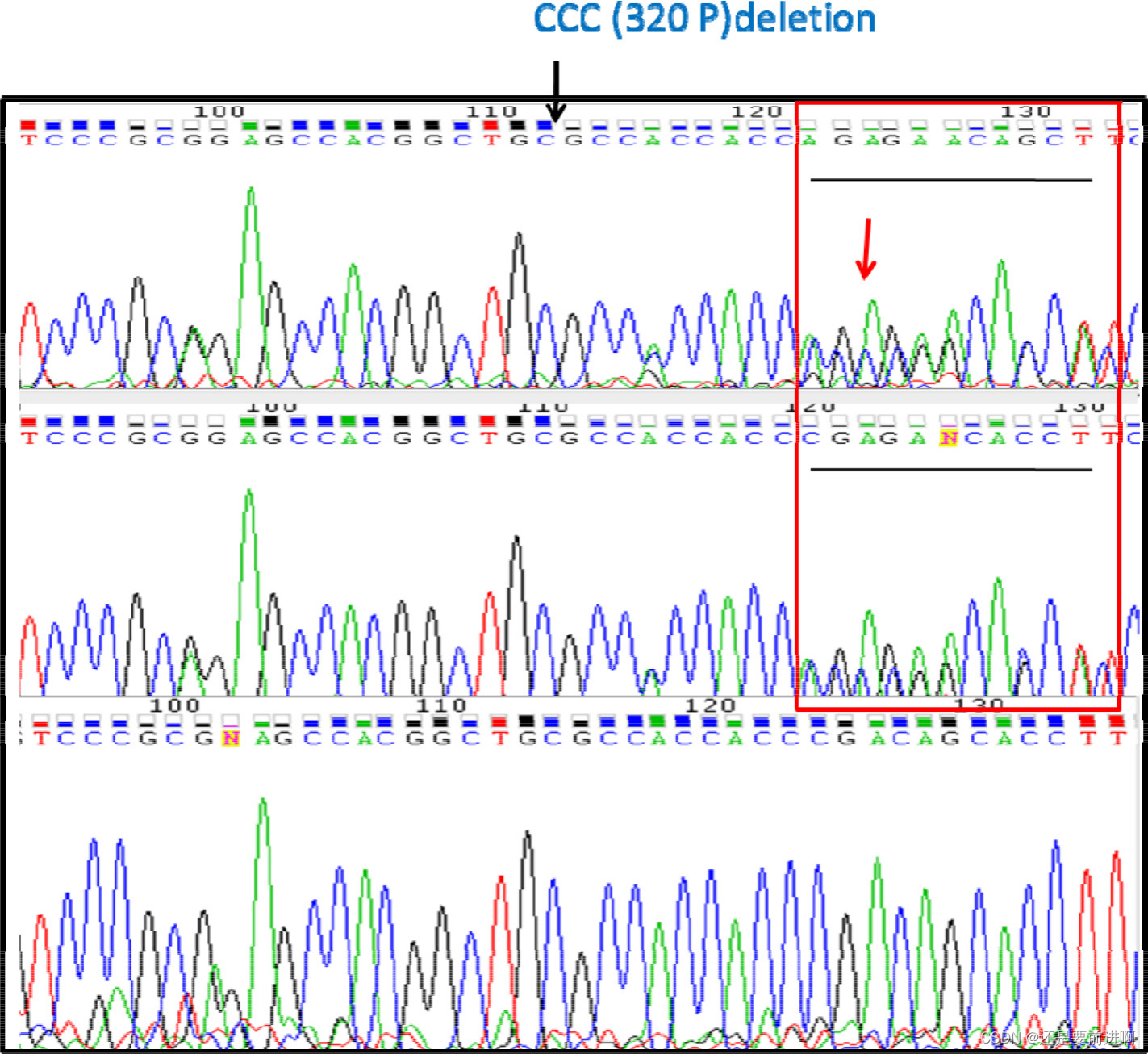
图5:CCRCC患者DNA的靶测序证实Plk5突变是转移特异性的。用PCR从5例4期CCRCC患者的基因组DNA中扩增出Plk5,并进行Sanger测序以确认rs58035688缺失。原发肿瘤部位(PT,上)、肿瘤延伸部位(TE,中)和淋巴转移部位(LM,下)的代表性色谱图显示了这种缺失的转移特异性模式。从图中125位(上、中)的序列重叠可以看出,PT和TE的缺失是杂合的。相比之下,LM的缺失是纯合的。这些数据表明,在PT和TE中,只有部分CCRCC细胞携带这种缺失,而在LM中,大多数CCRCC细胞携带这种缺失。
讨论
淋巴转移是癌细胞最常见的扩散方式。与淋巴转移相关的生物标志物可能是检测和干预转移的有价值和强大的工具,转移是癌症死亡的主要原因。肿瘤中多个转移相关基因(如VHL、G250、SETD2、BAP1、PBRM1、p53等)已被报道,靶向治疗在改善肿瘤治疗方面显示出良好的价值。虽然获得性突变在几种类型的肾癌中有记载,但突变与转移性有关肾脏疾病仍然难以捉摸。鉴别转移相关基因的主要障碍是肿瘤样本的异质性,这些样本通常含有正常细胞。在这里,我们使用NGS绕过了这一障碍,以确定在CCRCC患者的LM中富集的Plk5突变(rs58035688)的突变频率增加。与先前的研究一致,Plk5 mRNA的细胞周期扰动谱表明,Plk5在S期检查点是肿瘤抑制因子。随后的免疫分析和靶测序表明,这种Plk5突变也与其他患者的淋巴转移性CCRCC有独特的关联。
越来越多的文献将Plk功能异常与各种类型癌症的恶性肿瘤联系起来。与其他plk (Plk1,2,3和4)不同,Plk5在癌症发展中的功能尚不清楚,但最近发现它在DNA损伤时定位于细胞核,并且在脑肿瘤组织中沉默。我们的研究与这些研究一致,细胞周期中mRNA的扰动谱表明Plk5阻止细胞进入S期。Plk5在原发肿瘤中的高表达可能是对DNA损伤的反应,但通过启动子超甲基化沉默Plk5或PBD结构域突变破坏表达(如我们在这里报道的),使肿瘤细胞不顾DNA损伤进入S期增殖。最近报道的一项研究表明,这种Plk5缺失可能使癌细胞从转移部位的细胞周期阻滞中逃脱,从而可能诱导氧化应激和DNA损伤。本文报道的Plk5缺失(rs58035688)可作为早期检测CCRCC淋巴转移的生物标志物,并可作为预防CCRCC转移的干预靶点。尽管这种突变之前已经被发现(1000基因组计划:rs58035688),但这是第一次直接将其与RCC转移联系起来的研究,并提供了它在S期检查点中起作用的证据。筛选Plk5中的这种短缺失是一种潜在的快速和低成本的方法,可以显着改善当前对高风险CCRCC患者的诊断方法。
本文是文章的直接翻译,只为学习交流,不为获利。
经过,我在这些天的学习,我决定先学习一种方向,先把肿瘤突变方向的知识点和生信操作做深一些。






















 13万+
13万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








