点击蓝字 关注我们
葡甘露聚糖促进卵圆形拟杆菌改善肠屏障功能和胰岛素抵抗

iMeta主页:http://www.imeta.science
研究论文
● 原文链接DOI: https://doi.org/10.1002/imt2.163
● 2024年1月3日,南昌大学聂少平团队在iMeta在线联合发表了题为 “Glucomannan promotes Bacteroides ovatus to improve intestinal barrier function and ameliorate insulin resistance” 的研究文章。
● 本文研究结果表明,葡甘露聚糖干预显著降低了高脂饮食引起的小鼠胰岛素抵抗,并且其效果依赖于肠道菌群。
● 第一作者:聂启兴
● 通讯作者:聂少平(spnie@ncu.edu.cn)
● 合作作者:孙永敢, 胡文兵, 陈春华, 林琼妮
● 主要单位:南昌大学食品科学与资源挖掘全国重点实验室、中国-加拿大食品科学与技术联合实验室、江西省生物活性多糖重点实验室、江苏科技大学粮食学院
亮 点
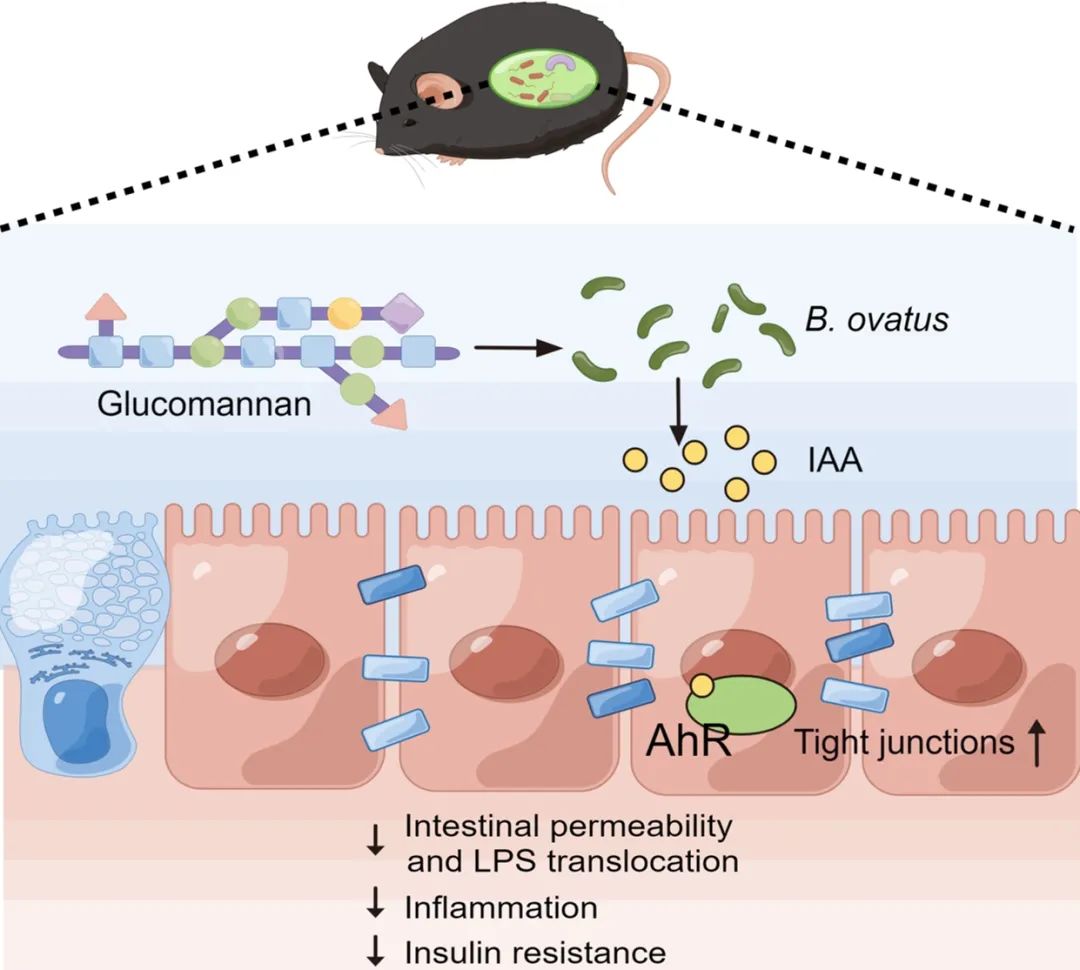
● 葡甘露聚糖能够缓解高脂诱导的胰岛素抵抗;
● 葡甘露聚糖促进卵圆形拟杆菌的生长,改善肠屏障功能和宿主炎症;
● 卵圆形拟杆菌产生的吲哚乙酸是一种重要的活性代谢物,通过激活肠AhR受体改善肠屏障功能。
摘 要
活性膳食纤维已经被证明能够通过调节肠道菌群改善宿主代谢。葡甘露聚糖的代谢保护效应已在动物实验和临床试验中报道。然而葡甘露聚糖干预影响的关键肠道微生物、活性代谢产物与宿主靶点仍不清楚。我们的研究结果表明,葡甘露聚糖干预显著降低了高脂饮食引起的小鼠胰岛素抵抗,并且其效果依赖于肠道菌群。葡甘露聚糖干预促进了B. ovatus的生长。进一步对高脂饮食诱导的肥胖小鼠进行B. ovatus干预,发现B. ovatus能够有效改善小鼠的胰岛素抵抗,以及肠道屏障功能和系统性炎症。B. ovatus产生的吲哚乙酸(indoleacetic acid,IAA)是其改善胰岛素抵抗的关键活性代谢物,通过激活肠道芳香烃受体(AhR)改善肠道屏障功能,从而缓解胰岛素抵抗。因此,本文主要发现魔芋葡甘露聚糖通过B. ovatus-IAA-肠AhR轴缓解胰岛素抵抗。
视频解读
Bilibili:https://www.bilibili.com/video/BV1b5411k7EP/
Youtube:https://youtu.be/iHFWkYqQEnA
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
胰岛素抵抗是宿主组织中胰岛素介导的葡萄糖代谢控制降低,主要受遗传和环境因素的影响。越来越多的证据表明,肠道微生物群失调参与了肥胖及相关并发症(如胰岛素抵抗和2型糖尿病)的发生和进展。肠道微生物群及其代谢产物可以通过多重途径影响宿主的胰岛素抵抗。例如,T2D患者的肠道微生物群具有较强的支链氨基酸(BCAA)合成能力,其中Segatella copri和Phocaeicola vulgatus是主要推动BCAA生物合成的细菌,并导致胰岛素抵抗。肠道细菌来源的丙酸咪唑能够通过激活p38γ-mTOR1-S6K1信号通路促进胰岛素抵抗。相反,通过补充Akkermansia muciniphila能够增加黏液层厚度并改善肠道屏障功能,从而改善代谢内毒素血症和胰岛素抵抗。此外,Bacteroides uniformis和Bacteroides acidifaciens也能够预防肥胖并改善小鼠的胰岛素敏感性,这可能与肠道免疫稳态调节有关。肠道微生物群失调与肠屏障功能破坏,以及代谢内毒素血症密切相关,通过调节肠道菌群改善肠屏障功能,可能是预防和改善胰岛素抵抗及相关代谢性疾病的重要手段。
动物实验和临床研究已经证实,靶向调节肠道共生菌是预防和缓解代谢性疾病的有效策略。例如,补充膳食纤维可以调节肠道微生物群以及改善肠道屏障功能,通过减少内毒素和改善慢性炎症来缓解胰岛素抵抗。葡甘露聚糖是一种常见的生物活性膳食纤维。其中魔芋葡甘露聚糖(KGM)是最广泛研究的葡甘露聚糖之一,其主链为β-(1→4)-连接的D-葡萄糖和D-甘露糖残基,并通过β-(1→6)-糖苷键连接葡萄糖残基。在许多欧洲国家,KGM已被广泛用于超重或肥胖管理。在一项安慰剂对照、饮食控制的试验中,KGM补充促进了便秘成年人的排便,改善了肠道微生态(增加双歧杆菌和乳酸杆菌的丰度以及粪便短链脂肪酸的水平)。此外,KGM干预还可以改善高危糖尿病患者的糖脂代谢和收缩压。我们前期研究发现,补充活性膳食纤维可以通过促进特定的抗肥胖肠道菌的生长和产生细菌来源的代谢产物改善葡萄糖稳态,同时有研究表明KGM可以改善HFD饲养的小鼠的肥胖和胰岛素抵抗,然而其对胰岛素抵抗的详细分子机制仍不清晰。
膳食纤维无法被宿主消化吸收,被肠道微生物群降解后进一步影响菌群组成。我们推测KGM通过调节肠道微生物群及其相关代谢产物改善胰岛素抵抗。在本研究中,我们通过生理学、代谢组学和基因组学分析,探讨了KGM缓解胰岛素抵抗的分子机制,并且证明了KGM通过促进Bacteroides ovatus改善肠道屏障功能并改善胰岛素抵抗。研究结果揭示了KGM通过肠道微生物群缓解胰岛素抵抗的机制,从而为活性膳食纤维缓解胰岛素抵抗提供了新的见解。
结 果
KGM缓解高脂诱导的胰岛素抵抗
我们首先使用HFD诱导胰岛素抵抗小鼠模型。与正常小鼠相比,HFD饲养小鼠的体重、附睾脂肪重量、空腹胰岛素水平、糖耐量受损和HOMA-IR显著增加。相反,在经过10周KGM处理后,KGM显著减轻了体重和附睾脂肪重量。补充KGM还改善了葡萄糖耐受性和胰岛素抵抗,同时降低了血清TNF-α和IL-1β水平。与此同时,KGM干预后血清甘油三酯(TG)、非酯化脂肪酸(NEFA)、丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)水显著降低,表明KGM对胰岛素抵抗小鼠还具有降脂和改善肝功能的作用。我们进一步研究了KGM对肥胖小鼠的影响。小鼠经过8周的HFD处理,然后给予KGM处理4周,KGM也能够改善小鼠的糖代谢和胰岛素抵抗。
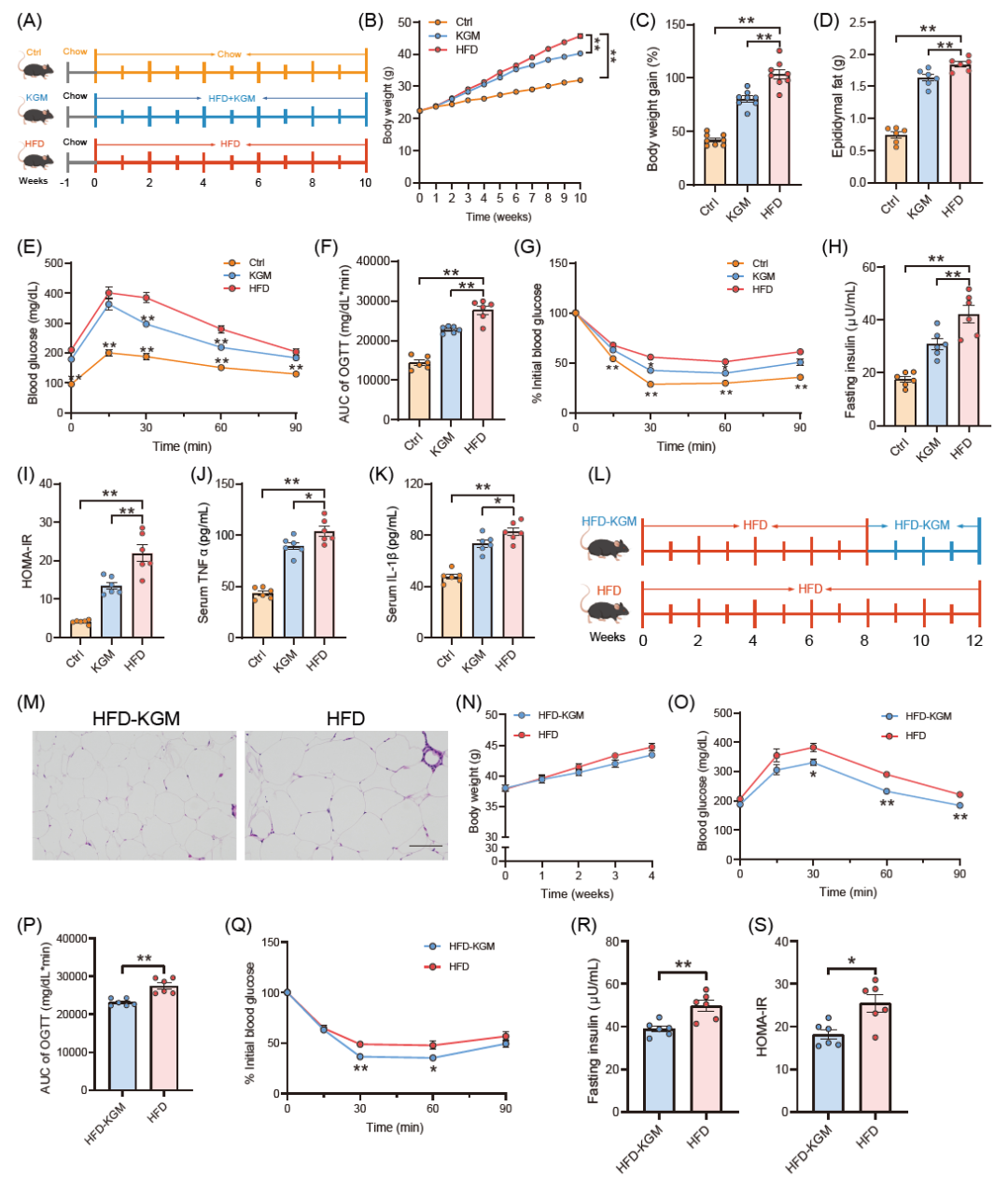
图1. 葡甘露聚糖改善高脂饮食诱导的胰岛素抵抗和代谢紊乱
(A)实验方案;(B)体重变化;(C)体重增加程度;(D)附睾脂肪重量;(E和F)OGTT和AUC值;(G-I)ITT、禁食胰岛素水平和HOMA-IR指数;(J和K)KGM干预后血清TNF-α和IL-1β水平;(L)实验方案;(M)小鼠附睾脂肪H&E染色:(N)体重;(O和P)OGTT和AUC值;(Q-S)KGM干预后的ITT、禁食胰岛素水平、HOMA-IR指数。
KGM改善肠道屏障功能和代谢内毒素血症
肠道屏障功能受损和低程度炎症是代谢性疾病的特征之一。与HFD对照小鼠相比,KGM干预显著降低了肠道通透性和血清内毒素水平,并且上调了肠道Zo1、Ocln、Cldn1和Muc2的基因表达。肠道黏液层是维持肠道健康的重要屏障之一,通过杯状细胞的分泌补充。KGM干预后显著增加了黏液层的厚度。这些结果表明,KGM可以改善肥胖小鼠的肠道屏障功能。

图2. 葡甘露聚糖改善肠道屏障功能和代谢内毒素血症
(A)肠道通透性;(B)血清内毒素水平;(C)肠屏障功能相关基因表达水平;(D)AB-PAS染色;(E)肠道黏液层厚度。
KGM影响肠道菌群组成并增加B. ovatus的丰度
膳食纤维无法被宿主消化吸收,经肠道细菌发酵能够影响肠道菌群的组成与功能。通过16SrRNA基因测序对结肠内容物的微生物组进行了分析,我们发现两组之间的α多样性没有显著性差异,但β多样性结果表明KGM干预后显著影响了胰岛素抵抗小鼠肠道菌群组成。在门水平上,KGM增加了Bacteroidetes的丰度并减少了Firmicutes的丰度。通过LEfSe分析,KGM组中显著增加了Bacteroides和Parabacteroides;而在HFD组中,Collinsella、Corynebacterium、Aerococcus、Dorea和Desulfovibrio显著增加。在种水平上,KGM显著增加了Bacteroides ovatus和Parabacteroides distasonis的丰度。此外,通过指示物种分析我们也发现KGM明显增加了B. ovatus的丰度。此外,B. ovatus的丰度与HOMA-IR、血清内毒素和TNF-α水平呈负相关。
Bacteroides是降解膳食纤维的主要肠道细菌之一。为了研究KGM对肠道细菌的影响,我们进一步进行了体外肠道菌筛选实验。我们首先制备了以KGM为唯一碳源的培养基,然后将其与胰岛素抵抗小鼠的粪便菌群共同孵育,发酵后的样品在无菌PBS中进行稀释,并在BHI琼脂板上涂布,最后收集单克隆菌落进行鉴定。体外筛菌的结果也表明KGM促进了B. ovatus的生长,并且B. ovatus也可以有效降解KGM并促进它们的生长。我们进一步使用mBodyMap数据库分析不同宿主状态下B. ovatus丰度的变化,也观察到在肥胖个体中B. ovatus的丰度显著减少。

图3. 葡甘露聚糖影响小鼠肠道菌群组成并增加B. ovatus丰度
(A)α多样性指数;(B)β多样性;(C)LEfSe分析比较HFD组和KGM组之间的肠道细菌结构组成变化;(D)指示分析确定KGM干预后关键OTUs变化;(E)B. ovatus丰度与HOMA-IR、TNF-α、IL-1β和内毒素水平相关性;(F)胰岛素抵抗相关指标与肠道菌的Spearman相关性;(G)体外发酵示意图;(H)KGM体外粪菌发酵后β多样性;(I)KGM体外粪菌发酵后属水平的相对丰度变化;(J)LEfSe分析比较KGM发酵前后关键变化细菌;(K)数据库分析肥胖患者体内B. ovatus丰度变化。
B. ovatus改善小鼠胰岛素抵抗和肠道屏障功能
由于体内外研究均表明KGM能够增加B. ovatus的丰度,我们进一步探究了B. ovatus与胰岛素抵抗改善之间的因果关系。我们对小鼠进行PBS、B. ovatus和热灭活的B. ovatus处理。与对照组相比,B. ovatus不影响小鼠的体重,但改善了HFD诱导的糖代谢障碍。B. ovatus显著降低了禁食血糖、胰岛素含量、HOMA-IR指数和血清TNF-α水平;而灭活的B. ovatus干预对小鼠无代谢保护作用。此外,灌胃B. ovatus(而非灭活B. ovatus)还显著降低了血清TG和AST水平。由于KGM干预后小鼠肠道屏障功能有明显的改善,我们进一步研究了B. ovatus对肠道屏障功能的影响。B. ovatus干预显著降低了肠道通透性和血清内毒素水平,同时提高了肠道Zo1和Muc2的基因表达水平。此外,B. ovatus干预还逆转了由HFD诱导的黏液层厚度降低的情况,表明B. ovatus对肠道屏障功能受损具有改善作用。

图4. B. ovatus缓解胰岛素抵抗
(A)体重变化;(B和C)OGTT和AUC值;(D-F)ITT、禁食胰岛素水平和HOMA-IR指数;(G和H)B. ovatus干预后血清TNF-α和IL-1β水平;(I)肠道通透性;(J)血清内毒素水平;(K)肠屏障功能相关基因表达水平;(L)AB-PAS染色;(M)肠道黏液层厚度。
B. ovatus产生的IAA通过激活AhR缓解胰岛素抵抗
肠道菌群通过产生各种代谢物来影响宿主代谢,这些代谢物能够作为功能信号分子与宿主器官进行互作。由于B. ovatus和热灭活B. ovatus组之间存在明显的代谢保护作用差异,我们推测这种现象可能是由B. ovatus产生的代谢物引起的。因此,我们将B. ovatus在GAM培养基中培养了48小时,并进行了非靶向代谢组学分析鉴定B. ovatus产生的活性代谢产物。与培养基对照相比,B. ovatus培养后显著改变了代谢谱,其中吲哚乙酸(IAA)水平显著增加。我们进一步构建了靶向代谢组方法进行检测,并证明了B. ovatus在体内体外均能够产生IAA。此外,抗生素干预显著降低了小鼠粪便中IAA的水平,而粪菌移植后IAA的水平也能够恢复。我们随后分析了KGM干预后胰岛素抵抗小鼠粪便中的代谢物水平。结果表明KGM干预改变了肠道微生物组的代谢谱,包括增加IAA,L-谷氨酰胺、和LysoPC 18:2水平,以及降低犬尿酸、苯丙氨酸、尿酸、9-decenoylcarnitine、 3-hydroxy-5-cholenoic acid、 2-hydroxycinnamic acid、和9,12-octadecadiynoic acid 的水平。基于差异代谢物,我们进行了代谢通路分析,发现色氨酸代谢通路受KGM干预调控。基于此,我们进一步对KGM和B. ovatus干预后的小鼠粪便进行色氨酸代谢相关代谢物的定量分析,发现KGM和B. ovatus干预后显著增加了IAA水平,并且IAA与HOMA-IR、血清内毒素和TNF-α水平呈负相关。
基于上述发现,我们认为IAA可能是介导KGM和B. ovatus改善胰岛素抵抗的关键活性代谢物。我们进一步对HFD小鼠进行IAA干预。IAA的补充不影响小鼠的体重,但是显著改善了葡萄糖耐受性和胰岛素抵抗。IAA降低了肠道通透性和血清内毒素水平,增加了肠道Zo1、Ocln、Cldn4和Muc2的基因表达水平,以及黏液层的厚度。色氨酸是人体必需氨基酸,能够被肠道微生物代谢产生吲哚类衍生物,包括吲哚-3-甲醛、吲哚丙烯酸、IAA等,它们是芳香烃受体(AhR)的激动剂。正如预期,IAA处理显著增加了Cyp1a1、Reg3g和Il-22的基因表达水平,并且KGM和B. ovatus干预后也激活了AhR信号通路。综上所述,我们的结果表明B. ovatus产生IAA激活AhR信号通路在KGM缓解胰岛素抵抗中发挥了关键作用。

图5. B. ovatus产生的IAA与胰岛素抵抗呈负相关
(A-C)B. ovatus在GAM培养基中进行培养后进行代谢组学分析。(A)PCA分析;(B)火山图分析;(C)镜像图分析;(D和E)LC-MS靶向检测验证B. ovatus产生IAA;(F)正常小鼠灌胃B. ovatus后检测粪便IAA含量;(G)KGM干预后粪便非靶代谢组PCA分析;(H)VIP分析;(I)代谢通路分析;(J和K)B. ovatus和KGM干预后粪便色氨酸代谢相关物质含量变化;(L-O)IAA含量与HOMA-IR、TNF-α、IL-1β和内毒素水平相关性。

图6. IAA激活AhR改善胰岛素抵抗
(A)体重变化;(B和C)OGTT和AUC值;(D-F)ITT、禁食胰岛素水平和HOMA-IR指数;(G)肠道通透性;(H)血清内毒素水平;(I)肠屏障功能相关基因表达水平;(J)AB-PAS染色;(K)肠道黏液层厚度;(L)AhR通路相关基因表达水平。
方 法
KGM的制备
干燥的魔芋粉末先后在无水乙醚和乙醇溶液中浸泡并不断搅拌24小时和1.5小时去除杂质。处理后的粉末与10倍蒸馏水混合,持续搅拌2小时后以4,800 rpm/min离心,收集上清液。浓缩后的水提物在4°C下添加4倍体积无水乙醇沉淀24小时获得粗多糖。KGM根据我们实验室先前的方法进行纯化。
动物处理
所有小鼠在22 ± 2°C、相对湿度55 ±10%和12/12小时的光/暗条件下进行饲养。所有小鼠组别随机分配,干预前体重无差异。为了研究KGM对小鼠在胰岛素抵抗发展过程中的影响,8周大的C57BL/6J SPF小鼠使用标准饲料或高脂饲料(D12492)饲养10周。小鼠每天通过灌胃给予PBS或KGM(200 mg/kg)。为了探究KGM对胰岛素抵抗小鼠的改善效果,6周大的雄性小鼠高脂饮食八周诱导胰岛素抵抗,然后用KGM处理4周。对于粪菌移植实验,从接受KGM或PBS干预的小鼠收集粪便样本。收集的粪便在无菌PBS中重悬,4°C条件下离心去除粪便残渣,收集粪菌液进行FMT。经过1周的Abx处理后,粪菌液每周三次灌胃HFD饲养的小鼠干预4周。为了研究B. ovatus对IAA产生的作用,8周龄的C57BL/6J SPF小鼠用2×108 CFUs的B. ovatus重悬在200 μL无菌PBS中灌胃2次,收集粪便检测IAA。为了测试B. ovatus对胰岛素抵抗小鼠的影响,8周龄C57BL/6J SPF小鼠使用高脂饮食喂养10周,同时小鼠分别接受PBS,B. ovatus和热灭活B. ovatus干预。为了研究IAA对小鼠胰岛素抵抗的影响,8周龄C57BL/6J SPF小鼠使用高脂饮食喂养10周,同时小鼠分别接受PBS和IAA干预,每周3次。
抗生素处理
小鼠在饮水中添加抗生素干预1周清除肠道菌群。混合抗生素浓度为万古霉素(0.5 mg/mL)、甲硝唑(1 mg/mL)、卡那霉素(1 mg/mL)和氨苄青霉素(1 mg/mL)。
OGTT和ITT
口服葡萄糖耐量试验(OGTT)在小鼠禁食6小时后进行。在葡萄糖(1.5 g/kg)灌胃后的0、15、30、60和90分钟,通过尾静脉血检测血糖浓度。对于胰岛素耐量试验(ITT),在禁食6小时后通过腹腔注射胰岛素(0.8 U/kg)并测定不同时间点血糖浓度。
非靶向代谢组学
对于非靶向代谢组学分析,粪便(50 mg)加入50%甲醇(0.5 mL)。使用组织破碎仪对样品进行裂解,随后在振荡器中振荡20分钟以提取代谢物。所有样品随后在4°C条件下以13,000 g离心20分钟。使用Shimadzu nexera x2 UPLC串联AB Sciex Triple TOF 5600质谱仪进行样品检测。使用Prognosis QI(Waters Corporation)处理原始质谱数据。QC样品用于仪器信号和数据处理的校正,数据矩阵经过80%规则进行进一步处理。将MS和MS/MS信息与HMDB数据库和METLIN数据库匹配进行代谢物注释。MS1和MS2的质量误差设置为5 ppm。
靶向代谢组学
采用Shimadzu Nexera X2高效液相色谱串联三重四极线性离子阱质谱仪(AB Sciex 4500)进行色氨酸代谢通路相关物质分析。采用ACQUITY UPLC CSH C18柱(2.1 × 100 mm,1.7 μm,Waters)进行色谱分离,流动相A为0.1%甲酸水,流动相B为0.1%甲酸乙腈。所有代谢物均在正离子条件下使用MRM模式检测。色谱分离采用以下梯度:0−4 min,5−40% B;4−6 min,40−80% B;6−8 min,80% B;8−10 min,80-5% B。使用MultiQuant软件进行定量分析。
粪便样本(10 mg)加入50%甲醇水溶液(0.3 mL),使用组织破碎仪进行裂解。随后样品在振荡器中振荡20分钟提取代谢物。所有样品均在4°C条件下以13,000 g离心20分钟。取上清液过0.22 μm有机滤膜后进行LC-MS/MS分析。对于B. ovatus培养上清中IAA的测定,培养基上清液用甲醇稀释(1:4,v/v),振荡10分钟,以13,000 g离心20分钟进行LC-MS分析。
细菌菌株和培养
对于体外发酵,从小鼠收集粪便进行培养发酵。粪便样本收集后在1小时内用于接种液的制备。100 mg粪便溶液于1 mL灭菌PBS中,然后使用涡旋器均质1分钟。粪便悬浮液离心去除较大的颗粒残渣(550 g离心5分钟)。上清液收集后稀释十倍接种于(5%接种量)KGM作为碳源的培养基中培养48小时。
对于细菌的分离和鉴定,发酵样品在无菌PBS中进行了梯度稀释,并在BHI琼脂板上涂布。在37°C条件下厌氧培养48小时后挑取菌落进行培养鉴定。
B. ovatus在50 mL的GAM培养基中培养,在37°C条件下厌氧培养24小时。随后在4°C下以8,000 × g离心10分钟获得菌体。菌体重悬于无菌厌氧PBS中进行后续干预实验。热灭活B. ovatus在115°C条件下加热30分钟制备获得。
粪便中SCFAs 检测
粪便中的短链脂肪酸的测定方法使用实验室已有方法。粪便使用去离子水稀释(1:9),稀释后的粪便进行涡旋,并在冰浴条件下超声处理提取SCFAs。重复此过程,收集上清液用于气相色谱分析。
血清生化分析
使用全自动生化分析仪(Mindray BS-380)测定了血清中的总胆固醇(TC)、甘油三脂(TG)、高密度脂蛋白胆固醇(HDL-c)和低密度脂蛋白胆固醇(LDL-c)水平。使用试剂盒检测血清中的非酯化脂肪酸(NEFA)浓度。
肠道通透性检测
通过灌胃FITC-dextran评估肠道通透性。小鼠禁食4小时灌胃FITC-dextran(200 mg/kg)。90分钟后,从尾静脉采集100 μL血液并避光保存,3000 g离心10分钟获得血清样品。血清样本(20 μL)加入到96孔板中,使用PBS稀释至200 μL,然后在485 nm的激发波长和520 nm的发射波长下检测。
讨 论
人类肠道微生物组在调节宿主免疫、营养代谢和维持肠道屏障结构完整性方面发挥着至关重要的作用。肠道屏障的完整性受许多内在和外在因素的影响,包括遗传、饮食、抗生素、昼夜节律、心理压力和衰老等。肠道屏障破坏会导致过量LPS进入血液循环,导致全身性低程度炎症,这种现象称为代谢内毒素血症。而通过益生元或益生菌改善屏障功能已经报道能够内毒素血症和胰岛素抵抗。我们发现KGM干预降低了肠道通透性,同时增加了黏液层的厚度和紧密连接蛋白的基因表达水平,表明KGM对宿主肠道稳态调节具有积极的作用。高脂饮食会降低小鼠的黏液层厚度,增加肠道通透性和促炎标志物水平,导致血清LPS水平升高,并通过组织中的Toll样受体-4(TLR-4)引起胰岛素抵抗。此外,KGM不仅降低了循环中的LPS和促炎因子水平,还减轻了胰岛素抵抗,因此我们推测其可能通过增强肠道屏障功能来减缓胰岛素抵抗。
饮食是决定肠道微生物组成的重要因素之一。补充活性膳食纤维能够调节肠道微生物组成并在各种代谢性疾病中产生有益效果。KGM干预显著增加了B. ovatus的丰度,并与HOMA-IR、血清内毒素和TNF-α水平呈负相关。有研究表明B. ovatus定殖能够促进结肠炎小鼠的杯状细胞分化并减轻炎症反应。我们的研究也发现B. ovatus干预改善了高脂饮食条件下小鼠的葡萄糖稳态和胰岛素抵抗,降低了血清内毒素水平,并上调了肠道Zo1、Ocln和Muc2的基因表达水平。这些结果表明B. ovatus可能是一种有益的细菌,有助于通过增强肠道屏障功能缓解胰岛素抵抗。
动物模型和体外发酵结果表明KGM显著增加了B. ovatus的丰度。已有研究报道,B. ovatus通过激活不同的多糖利用位点,如Bacova_03433、Bacova_03421和Bacova_02092利用复杂的多糖。KGM是一种以β-(1→4)-连接的D-葡萄糖和D-甘露糖残基为主链,支链为通过β-(1→6)-葡萄糖残基链接的葡甘露聚糖。研究表明B. ovatus能够降解并利用一些复杂的植物多糖,包括以β-甘露糖为主的膳食纤维。目前在B. ovatus ATCC 8483中已经鉴定了一个潜在的β-甘露糖PUL(bacova_02087–02097),当培养基中存在KGM时,这个PUL在转录水平显著上调。而其中由bacova_02092–93编码的两个β-甘露糖酶(BoMan26A和BoMan26B)对于KGM降解至关重要。我们发现B. ovatus在以KGM为唯一碳源的培养基上能够高效生长,表明KGM是促使B. ovatus生长的关键膳食因子。
肠道菌产生的活性代谢物对肠道屏障功能的改善已被广泛报道。我们发现B. ovatus产生的IAA是其中关键的活性代谢物。IAA是一种由肠道菌产生的色氨酸代谢物,并且是AhR的激动剂。AhR广泛表达于肠道环境中,激活后能够上调肠上皮细胞中的紧密连接蛋白来促进屏障完整性,并通过影响免疫细胞来改善肠道稳态。代谢综合症患者通常伴随肠道AhR活性降低,通过补充Lactobacillus菌产生AhR激动剂可以改善宿主代谢稳态,改善肥胖和胰岛素抵抗;同时AhR激动剂靛蓝也能够增强肠道屏障功能,改善肥胖及胰岛素抵抗。综上,我们的研究表明KGM能够促进B. ovatus增殖,通过产生IAA激活AhR改善肠屏障功能缓解胰岛素抵抗。
代码和数据可用性
16S rRNA测序的原始数据存储于中国国家微生物数据中心(https://nmdc.cn/resource/genomics/project/detail/NMDC10018595)。微生物组分析的代码存储于Github(https://github.com/qixingnie/Script)。
引文格式:
Qixing Nie, Yonggan Sun, Wenbing Hu, Chunhua Chen, Qiongni Lin, Shaoping Nie. 2023. Glucomannan promotes Bacteroides ovatus to improve intestinal barrier function and ameliorate insulin resistance. iMeta. 2024 e163. https://doi.org/10.1002/imt2.163
作者简介

聂启兴(第一作者)
● 博士,南昌大学食品科学与资源挖掘全国重点实验室特聘研究员,南昌大学全职引进高层次人才,担任eFood,食品研究与开发等杂志青年编委。
● 主要从事膳食纤维对肠道菌群的影响,菌源代谢产物在代谢性疾病中的作用机制及转化研究。以第一作者在Nature Communications,Annual Review of Food Science and Technology,Food Hydrocolloids,Food Chemistry等期刊发表SCI论文14篇;参与在Nature,Science,Cell Metabolism等杂志发表多篇高影响论文。主编英文著作1部,参编2部。主持国家自然科学基金青年基金1项,江西省赣鄱俊才支持计划·青年科技人才托举项目1项。获2022年度中国食品科技十大进展,北京大学博雅博士后等奖项。

聂少平(通讯作者)
● 中共党员,博士,教授,博士生导师。现任南昌大学党委常委、副校长。
● 国家高层次人才特殊支持计划领军人才,国家自然科学基金杰青、优青项目获得者,科技部创新人才推进计划中青年科技创新领军人才,教育部“新世纪优秀人才支持计划”入选者,江西省主要学科学术带头人,江西省百千万人才工程,享受国务院政府特殊津贴专家。兼任国务院第八届学位委员会食品科学与工程学科评议组成员,全国食品与营养专业学位研究生教育指导委员会委员,Journal of Agricultural and Food Chemistry副主编,Food Frontiers创刊主编,Carbohydrate Polymers、Scientific Report、Food Science and Human Wellness、《中国食品学报》等杂志的编委,中国食品科学技术学会理事会理事等。主要从事食品化学与营养学、食品安全与分析,特别是食品复杂碳水化合物(主要为生物活性多糖和膳食纤维)、食物组分与营养健康精准调控等领域的研究与新产品创制,主持国家自然科学基金、国家重点研发计划课题等各类项目30多项,以第一或通讯作者(含共同)发表高质量学术论文300多篇,h-index为73;主编中英文著作3部;授权发明专利41件,多次入选科睿唯安全球“高被引科学家”、爱思唯尔中国高被引学者等。获国家级科技进步二等奖1项、江西省自然科学一等奖2项、江西省科技进步一等奖2项、教育部自然科学二等奖1项、国家级教学成果二等奖2项、江西省教学成果一等奖1项等各类奖励10余项。
更多推荐
(▼ 点击跳转)
iMeta | 引用7000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 15)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、50万用户的社交媒体宣传等。2022年2月正式创刊发行!目前期刊已经被ESCI、Scopus等数据库收录。
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:office@imeta.science

































 1364
1364

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








