点击蓝字 关注我们
跨组织多组学分析揭示了肠道微生物群缺失对器官形态、免疫稳态、胆汁酸和脂质代谢的影响

iMeta主页:http://www.imeta.science
研究论文
● 原文: iMeta (IF 23.8)
● 原文链接DOI: https://doi.org/10.1002/imt2.272
● 2025年2月14日,华大生命科学研究院方晓东、康美华大韩丽娟、哥本哈根大学Kristiansen Karsten、华中农业大学动物科学技术学院魏泓等在iMeta在线发表了题为“Cross-tissue multi-omics analyses reveal the gut microbiota’s absence impacts organ morphology, immune homeostasis, bile acid and lipid metabolism”的文章。
● 本研究利用时空组学、单细胞RNA测序和靶向胆汁酸代谢组学方法,通过对比无菌小鼠(GF)和无特定病原体小鼠(SPF)之间的差异,揭示了肠道微生物群缺失对宿主免疫、代谢及器官形态的显著影响,尤其在B细胞、髓系细胞、T/NK细胞及胆汁酸代谢方面表现出异常。GF小鼠通过自噬驱动的脂滴降解和微生物群依赖性锌指和BTB结构域蛋白(ZBTB20)-脂蛋白脂肪酶(LPL)轴在肝脏中维持血浆脂质稳态,突显了微生物群与宿主间复杂的相互作用。
● 第一作者:沈娟、梁伟明、赵瑞珍、陈洋、刘艳敏、程伟
● 通讯作者:方晓东(fangxd@genomics.cn)、韩丽娟(hlj@kmhdgene.com)、Kristiansen Karsten(kk@bio.ku.dk)、魏泓(weihong63528@163.com)
● 合作作者:柴太梁、张银、陈思琏、刘加哲、陈雪婷、邓煜盛、张钊、杨焕杰、黄玉芬、逄丽、仇秦威、邓浩浩、潘珊珊、王琳瑛、叶晶晶、罗文、江烜霆、黄潇、黎万顺、梁丽娴、张璐、黄鹂、杨志敏、陈柔汐、梅俊谱、岳震
● 主要单位:华大生命科学研究院、康美华大、哥本哈根大学、华中农业大学动物科学技术学院
亮 点

● 构建无菌小鼠单细胞、时空转录组学和胆汁酸代谢组学图谱;
● 无菌小鼠的B细胞、髓系细胞及T/NK细胞出现显著的异常特征和广泛的组织异质性;
● 微生物群影响黏膜分区,调节小肠脂质动态;
● 无菌小鼠显示肝脏胆汁酸合成和回肠再吸收异常。
摘 要
肠道微生物群对宿主免疫和代谢具有重要影响,其组成和功能的变化与多种非传染性疾病相关。在本研究中,我们通过时空组学、单细胞RNA测序和靶向胆汁酸代谢组学,比较了无菌(GF)小鼠和无特定病原体(SPF)小鼠在多个器官中的差异,系统地评估了肠道微生物群缺失对器官形态、免疫稳态、胆汁酸和脂质代谢的影响。通过综合分析,我们发现GF小鼠在B细胞、髓系细胞、T细胞/自然杀伤(NK)细胞中出现明显的异常,粘膜分区和营养物质摄取发生改变,胆汁酸在粪便、肝脏和循环系统中的谱系发生显著变化,GF小鼠的胆汁酸合成路径转向替代性途径,胆汁酸的肠肝循环发生显著变化。尤其是,GF小鼠回肠上皮中的自噬驱动的脂滴降解和肝脏中锌指和BTB结构域蛋白(ZBTB20)-脂蛋白脂肪酶(LPL)(ZBTB20-LPL)轴在维持血浆脂质稳态中起到了关键作用。我们的结果揭示了肠道微生物群与宿主之间相互作用的复杂性,尤其是共生型肠道细菌与宿主之间的信号传递。
视频解读
Bilibili:https://www.bilibili.com/video/BV1ivKTe9EdV/
Youtube:https://youtu.be/FOLPtvynYss
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
胃肠道宿主栖息着多样的共生细菌群体,这些细菌群在宿主生理的多个方面发挥重要作用,并且具有显著的区室化特征,深刻影响宿主的生理功能,包括组织结构、免疫系统、昼夜节律、营养反应、能量及脂质代谢等方面。无菌(GF)动物,尤其是小鼠,已成为研究微生物群对宿主生理影响的重要工具。利用GF小鼠模型的研究揭示了肠道微生物群对宿主多个器官(如胃肠道、脾脏、淋巴结、肝脏、骨骼肌、胆囊和脂肪等)的发育和形态生成的调控作用。然而,大多数研究集中在解剖学层面及生化观察,缺乏在细胞、分子以及组织空间转录组层面上的综合研究。
肠道微生物群与宿主免疫的相互作用是动态的、多样的,并在不同组织中具有环境依赖性。近期研究表明,许多免疫器官与微生物之间存在相互作用。此外,微生物群显著影响葡萄糖和脂质代谢,在维持能量稳态中发挥重要作用,部分通过肝肠轴进行调节。尽管开创性的研究为理解微生物群与宿主免疫系统之间的相互作用奠定了坚实的基础,但免疫细胞在宿主全身分布的模式,特别是空间分布特征、细胞微环境以及免疫效应分子在不同器官间的交互作用方面的研究仍然匮乏。最后,肠道微生物群与肝肠轴如何影响宿主脂质代谢以及肠上皮和肝小叶功能分区的的机制和影响尚未得到全面的理解。
本研究采用单细胞RNA测序(scRNA-seq)、时空组学技术(Stereo-seq)以及靶向胆汁酸代谢的组学手段,对GF小鼠和SPF小鼠的不同组织器官进行了多组学数据对比分析。该研究设计旨在进一步阐明微生物群缺失如何干扰器官形态、细胞组成与功能、关键细胞因子的表达、胆汁酸肠肝轴的循环以及脂质代谢。总之,我们的研究为探索微生物群与宿主之间的相互作用提供了宝贵的参考图谱。
结 果
SPF与GF小鼠跨器官多组学整合图谱
通过对跨器官多组学数据的全面分析,我们探讨了微生物群缺失对免疫系统、脂质稳态、器官发育和细胞功能的影响(图1A)。GF和SPF小鼠在3周断奶后被喂食相同的低粗纤维(1%–4%)饲料,该饲料经过辐照灭菌处理,持续喂养7周(表S1)。研究者在这种饮食结构下获得了10只10周龄的雄性SPF小鼠的16S rRNA测序数据,其中Muribaculaceae bacterium DSM 103720、Bacteroides caecimuris, Bacteroides vulgatus, 和Muribaculum intestinale在样本中占比为35%–90% (图1A和S1)。进一步对10周龄雄性GF和SPF小鼠进行系统性研究,发现GF小鼠在免疫细胞、脂蛋白水平和生理表型等方面存在异常,且其小肠、盲肠、肝脏和脾脏等器官形态发生显著变化(图1B和表S2),提示微生物群缺失可能导致器官结构和免疫微环境的紊乱。
鉴于上述差异,本研究选取了八种组织进行单细胞RNA测序,包括初级淋巴器官(骨髓和胸腺)、次级淋巴器官(脾脏)、黏膜组织(肠道)、血液以及肝脏。质控后,共识别出17个主要细胞群体 (图1C),并观察到免疫细胞和上皮细胞占细胞组成的85.42% (图S3),且GF小鼠在各组织中免疫细胞的丰度存在显著差异 (图1D)。时空组学Stereo-seq分析进一步揭示,GF小鼠的肝脏、脾脏和肠道中的浆细胞比例显著减少,而胸腺中的浆细胞比例变化较小,说明微生物群对浆细胞的影响主要体现在肝脏,脾脏和肠道 (图1E)。此外,研究人员为量化免疫细胞空间分布特征定义了基于Bins连通性的聚集指数 (图1F)。结果显示,浆细胞倾向于形成密集簇群,这种现象在肠道中尤为明显。在结肠和回肠中,较大的浆细胞簇群可占细胞群体的~15%,这暗示微生物及其产物可能调节浆细胞的聚集行为。在GF小鼠中,结肠内的浆细胞簇群数量较SPF小鼠更少,且聚集规模也更小(图1E,G)在巨噬细胞方面,GF小鼠脾脏中聚集指数降低,表明以Macro基因为标志的边缘巨噬细胞区连通性较弱,可能存在不成熟或紊乱情况(图1E, G)时空组学通过对肝小叶分区统计揭示,在SPF小鼠中,Kupffer细胞在门静脉周围表现出微生物介导的显著富集现象,而GF小鼠中这种富集程度则相对较弱(图S4A, B)。在肠道上皮顶端层基因表达上,如大肠中的 Saa1基因,GF小鼠有表达增加的趋势,体现了微生物对上皮功能的影响 (图S4C)。
总体而言,微生物群在免疫细胞的成熟、器官结构的发育和肠上皮功能的维持中发挥着关键作用。
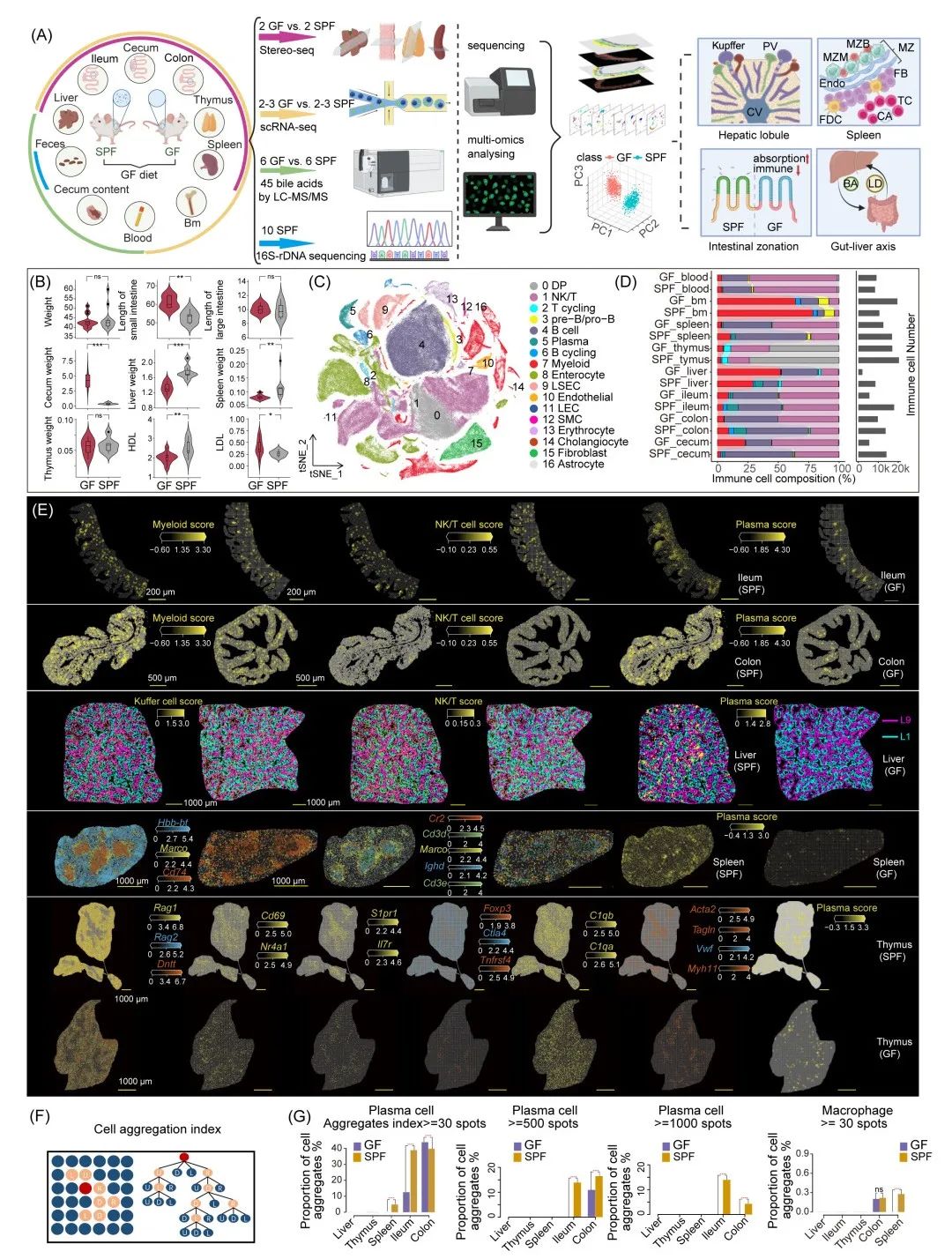
图1. 多组学研究设计及单细胞和时空组学数据概览
(A) 多组学图谱揭示微生物缺失条件下组织微环境、免疫和代谢稳态的破坏。(B)重要差异表型总结。(C)TSNE可视化,按主要细胞类型着色。右侧图例提供细胞类型注释。DP,双阳性T细胞;NK,自然杀伤细胞;LEC,淋巴管内皮细胞;SMC,平滑肌细胞;LSEC,肝窦内皮细胞;pre-B,B淋巴细胞前体;pro-B,B淋巴细胞祖细胞。(D)质控后,各组织免疫细胞的百分比和计数条形图。(E)可视化展示细胞空间分布及关键基因表达,反映器官的不同生理功能结构。对于胸腺,主要使用关键标记基因描绘T细胞从皮质到髓质的空间性发育过程,包括双阳性阶段(Dntt, Rag1和Rag2)、单阳性阶段(Nr4a1和Cd69)和成熟阶段(Il7r, S1pr1, Foxp3,Ctla4和Tnfrsf4)。对于脾脏,选择了红髓标记基因(Hbb-bt)、白髓标记基因(Cd74)和边缘巨噬细胞标记基因(Marco),以及白髓细微结构标记基因,包括边缘B细胞(Cr2)、滤泡B细胞(Ighd)和T细胞(Cd3d和Cd3e)。肝脏空间分布可视化展示了肝脏分区层1(近中央静脉,CV)和层9(近门静脉,PV)区域。(F)基于广度优先搜索(BFS)计算的细胞聚集指数示意图。(G)聚集指数大于30或大于500的Bin20的比例。
微生物群在B细胞发育和浆细胞组成的调节中表现出器官异质性
本研究通过Vpreb1、Igll1、Dntt等基因的表达,识别了不同发育阶段的B细胞,包括前体、未成熟、初始、激活和浆细胞(图2A和S5A),并通过其在骨髓和外周组织中的分布进行区分 (图S5B)。细胞周期分析显示,缺乏微生物群会显著扰动B细胞,尤其是亚型5和12,提示微生物群可能通过影响脾脏功能调节B细胞发育 (图2B和S5B)。亚型12为脾脏特有的边缘区(MZ)B细胞,表达高水平的Cr2和低水平的Ighd (图2C,D和S5C)。而成熟B细胞则按高表达Ighd和低表达Cr2的标准被分为9个亚型,反映不同的分化状态和组织异质性 (图S5D)。GF小鼠的MZ B细胞具有更多的差异表达基因,其中MZ B细胞特异上调的差异表达基因主要与淋巴细胞激活,B细胞分化和适应性免疫相关,而MZ B细胞特异下调的差异表达基因则与细胞稳态,免疫系统发育,凋亡信号和细胞周期有关 (图2E)。在脾脏中,成熟B细胞主要来源于脾小体,被称为滤泡(FC)B细胞 (亚型5,图2D)。通过scRNA-seq和Stereo-seq数据分析,研究发现GF小鼠脾脏中的B细胞总数显著减少(图2F、G)。同时,Cr2基因在GF小鼠的MZ B细胞和FC B细胞中均表现出上调表达(图2D和图S5D)。结合前人研究,研究者提出微生物可能通过Cr2基因调控FC和MZ B细胞的命运,进而影响脾脏B细胞的发育和免疫功能。此外,GF小鼠肠道中激活B细胞亚型(亚型7)的比例显著下降,未激活B细胞(亚型8)比例增加 (图2C)。这些结果进一步表明微生物群在B细胞发育中发挥着重要作用。
进一步分析浆细胞,识别出三种亚型。其中,IgA浆细胞在SPF小鼠中占主导地位,主要分布于血液、肝脏和肠道 (图2H,S5B和S6)。IgG浆细胞主要位于肝脏和脾脏,而IgM浆细胞则主要分布于脾脏。在微生物缺失的GF小鼠中,IgA浆细胞比例显著下降,而IgM浆细胞比例基本保持不变,这一结果与已有研究一致,表明IgA的产生依赖于微生物群,而IgM的产生则相对独立于微生物群,并可通过T细胞非依赖途径分化。

图2. 微生物群调节的B细胞组分在各组织中的异质性
(A)B细胞亚型的UMAP可视化。(B)B细胞亚型的比例与细胞周期。外圈表示每个亚群在细胞周期各阶段的细胞比例,内圈表示细胞总比例。(C)热图展示GF和SPF小鼠中B细胞亚型在各组织及所有组织间的分布。颜色渐变表示每个组织中细胞数的范围,每个圆圈的大小表示亚型的标准化比例,计算公式为(R-min(R))/(max(R)-min(R)),其中R为每个组织中亚型的实际比例。(D)MZ和FC B细胞中标记基因Cr2和Ighd 的表达。(E)MZ B细胞与非MZ B细胞的差异基因GO富集结果。内圈表示MZ B和非MZ B细胞中上下调差异基因的共性与特异性,外圈显示富集于通路中的关键基因。(F)通过scRNA-seq和Stereo-seq评估MZ B细胞与FC B细胞的细胞组成。(G)脾脏白髓区域核心基因的空间可视化。(H)GF和SPF小鼠中浆细胞亚型组成在各组织中的异质性分布,括号内为浆细胞计数。
微生物群在调节髓系细胞功能及T细胞发育与成熟方面表现出器官异质性
通过跨组织分析,我们鉴定出20种髓系细胞亚型(图3A-C和S7A,B)。其中,差异表达基因主要集中在大肠中的巨噬细胞亚型(亚型0,高表达Retnla,图S7C)。在SPF小鼠中,这些巨噬细胞主要参与抗原呈递、T细胞激活调节以及适应性免疫反应。相比之下,在GF小鼠中,这些巨噬细胞的功能特征发生了显著变化,主要富集于ERK1/2信号通路、内吞作用、伤口愈合、趋化作用和白细胞迁移等功能(图S7D)。GF小鼠盲肠中该巨噬细胞亚型的比例显著增加,这可能与其维持扩大的盲肠稳态有关(图3C)。此外,GF小鼠骨髓中性粒细胞上调的基因与蛋白质折叠和凋亡过程相关(图3D和S8A),揭示微生物群缺失可能导致骨髓中性粒细胞存活率降低,进而导致外周中性粒细胞显著减少(图3E-F,S7B,和S8B)。
在21种NK/T细胞亚型分析中(图3G和S9A,B),GF小鼠胸腺表现出早期T细胞周期失调(图3H),且差异基因显著富集T细胞激活和分化相关通路(图S9C和S10A-D),这表明肠道菌群的缺失会显著影响胸腺内T细胞的正常发育和成熟。在GF小鼠中,高表达Ccr7和Sell的Naive CD4⁺ T细胞(亚型3和4) 及Naive CD8⁺ T细胞(亚型5) 显著增加(GF小鼠占比42.3%,SPF小鼠占比23.4%),主要分布在肠道、脾脏、血液和胸腺(图3I和S9A,B)。而其他成熟的CD4⁺ T细胞亚群,包括表达Cxcr5的滤泡辅助性T细胞(Tfh),表达Foxp3和Ctla4的调节性T细胞(Tregs)以及表达Il17a和Il22的组织驻留型Th17细胞,在肠道(结肠和回肠)和脾脏中显著减少(图3I和S9A)。GF小鼠中这些特异性T细胞亚群的显著减少,突显了肠道菌群在塑造免疫系统成熟和维持免疫稳态中的关键作用(图3I,J)。研究者还鉴定了四类肠上皮内T细胞(IETs)亚型(图3G),由于缺乏肠道菌群来源的抗原刺激,高表达S1pr1的幼稚SP IETs(亚型3)在GF小鼠结肠中比例显著增加。相比之下,高表达整合素αEβ7的近期胸腺迁出细胞(Recent Thymic Emigrants, RTEs)RTEs主要迁移到小肠,并被诱导产生IFN-γ,形成IFN-γ⁺CD8⁺组织驻留记忆T细胞(Trm),其比例在GF小鼠中显著降低(图3I和S10E,F)。而表达整合素αEβ7的自然上皮内T细胞(IETs)具有Cd3d⁺Cd8a⁺Cd8b⁻Tcrg⁻C4⁺Trbc2⁺特征,被分别定义为CD8αα_1(亚型16)和CD8αα_2(亚型18)(图S9A)。其中,CD8αα_1表现出颗粒酶A(Gzma)和颗粒酶B(Gzmb)的高表达(图S9A),具有经典的细胞毒性T细胞特征,并在GF小鼠的回肠中比例显著增加(图3I)。且GF小鼠回肠中CD8αα_1细胞的脂质吸收和T细胞介导的细胞毒性功能也显著增强(图3K,L和表S5)。最后,通过Gata3、Il13、Il22和Rorc等标志物的表达,定义了ILC2和RORγt⁺ ILC3细胞群体(图3G和S9A)。GF小鼠的回肠中ILC3细胞减少,且缺乏Rorc和Il22的表达(图3I,M),这与肠道共生菌群对ILC3细胞发育的影响一致。GF小鼠中ILC3细胞的上调基因富集于白细胞介导的细胞毒性、细胞杀伤和对凝集素的响应等功能(表S5)。GF小鼠在巨噬细胞中Il1b和Tnf表达受损,同时Th17和RORγt⁺ ILC3细胞中Il17a和Il22的表达也显著降低(图3M),这表明共生菌群通过促进肠道巨噬细胞中Il1b和Tnf的稳态表达,调节肠道Th17细胞和RORγt⁺ ILC3细胞的IL-22和IL-17a产生。
为了研究微生物缺失对所有淋巴细胞亚群中关键因子基因表达的影响,我们从ImmPort数据库中下载了六份与免疫相关的基因列表,涵盖抗原处理与呈递、抗菌基因、趋化因子、细胞因子及其受体、干扰素、TNF和TGF-β家族成员、白细胞介素及其受体等。研究发现,GF小鼠中多种细胞类型的调节因子显著下调,例如B细胞/浆细胞中的抗菌基因Slpi、Th17细胞中的Il17a和Il22、T/NK细胞中的Ifng、T/NK/ILCs/巨噬细胞中的Isg15、Ccl5、Cxcl10和Ifih1,以及单核细胞/巨噬细胞中的Il1b。相反,GF小鼠中肝脏巨噬细胞中的抗菌基因Fabp4和Fabp5、单核细胞/中性粒细胞中的Cd14、盲肠巨噬细胞中的Ccr1和Ccl24、肝脏Kuffper细胞和骨髓中性粒细胞中的S100a8、S100a9和S100a6、以及cDC2/迁移性cDC中的Cd209a和Il6显著上调(图S11)。

图3. 微生物群调节的髓系和NK/T细胞亚型在各组织中的异质性
(A)髓系细胞亚型的UMAP可视化。(B)髓系亚型的比例与细胞周期。(C)热图展示GF和SPF小鼠中髓系细胞亚型在各组织及所有组织中的分布。(D)高表达Il1b的中性粒细胞的GO富集分析。(E)通过scRNA-seq和Stereo-seq数据展示中性粒细胞在GF和SPF小鼠脾脏中的比例分布。(F)脾脏中中性粒细胞标记基因的空间可视化。(G)NK/T细胞组分的UMAP可视化。(H)NK/T细胞亚型的比例与细胞周期。(I)热图展示GF和SPF小鼠中NK/T细胞亚型在各组织及所有组织中的分布。(J)T细胞在脾脏白髓区域Ctla4基因的空间可视化。(K-L)CD8αα_1差异表达基因的火山图(K)及前十大通路的功能富集分析(L)。(M)热图展示Il22、Il17a、Rorc、Ifng、Tnf和Il1b在淋巴亚型中的差异折叠变化(FC)。热图中的颜色渐变表示GF与SPF小鼠之间的平均FC值,FC>0表示GF小鼠中表达上调。简化示意图展示了巨噬细胞作为抗原呈递细胞(APC)激活Th17细胞的过程。
微生物群调控肠道黏膜分区、功能及营养吸收
本研究探讨了微生物对肠道各段的影响,重点分析了肠黏膜空间分区特征。通过对肠道单细胞亚型数据进行Cell2location解卷积和区域聚类注释(图S12),共识别出14个肠道邻域分区(图4A,B)。结果显示,GF小鼠与SPF小鼠的肠道黏膜分区存在显著差异:回肠、结肠和盲肠的吸收区厚度增加,而结肠分泌区变薄。这些结果揭示微生物群对肠道黏膜分区的严格调控作用(图4C)。进一步分析GF小鼠肠道上皮细胞亚型的差异基因富集情况,发现其适应性免疫功能不成熟,尤其是在结肠中表现出显著的免疫缺陷。GF小鼠回肠的三个上皮区域表现出能量代谢和营养吸收相关基因的显著上调(图4D和表S6)。这种现象与已有研究一致,即在免疫功能需求减少时,肠道上皮细胞将转向专注代谢功能。
通过scMetabolism分析,研究者揭示了不同肠道上皮细胞亚型在代谢活动上的异质性。小鼠肠道的营养吸收和代谢活动主要集中在回肠,尤其是肠黏膜的上部绒毛区。然而,GF小鼠的代谢活动在Reg3g富集的黏膜下层区域显著增强(图4E)。Reg3基因家族编码具有抗菌活性的肽段,但在GF小鼠中,Reg3(Reg3b和Reg3g)的表达显著降低,在黏膜底部呈现富集趋势(图4F)。
研究还发现GF小鼠肠道上皮细胞中与细菌、病毒、溶质载体转运蛋白、维生素吸收和水分吸收相关的340个调控基因或受体基因表达变化显著(表S7)。例如,GF小鼠回肠中与抗病毒相关的基因(如Dhx15、Dhx9等)表达上调,而与抗原处理和呈递相关的MHC II基因几乎不表达(图4G)。这表明GF小鼠在适应性免疫功能上存在缺陷,但与抗病毒相关的先天免疫激活得以维持。最后,研究还观察到GF小鼠所有肠段中Vdr基因的上调(图4G),这可能反映了在缺乏微生物群的情况下,机体试图增强肠道屏障功能。
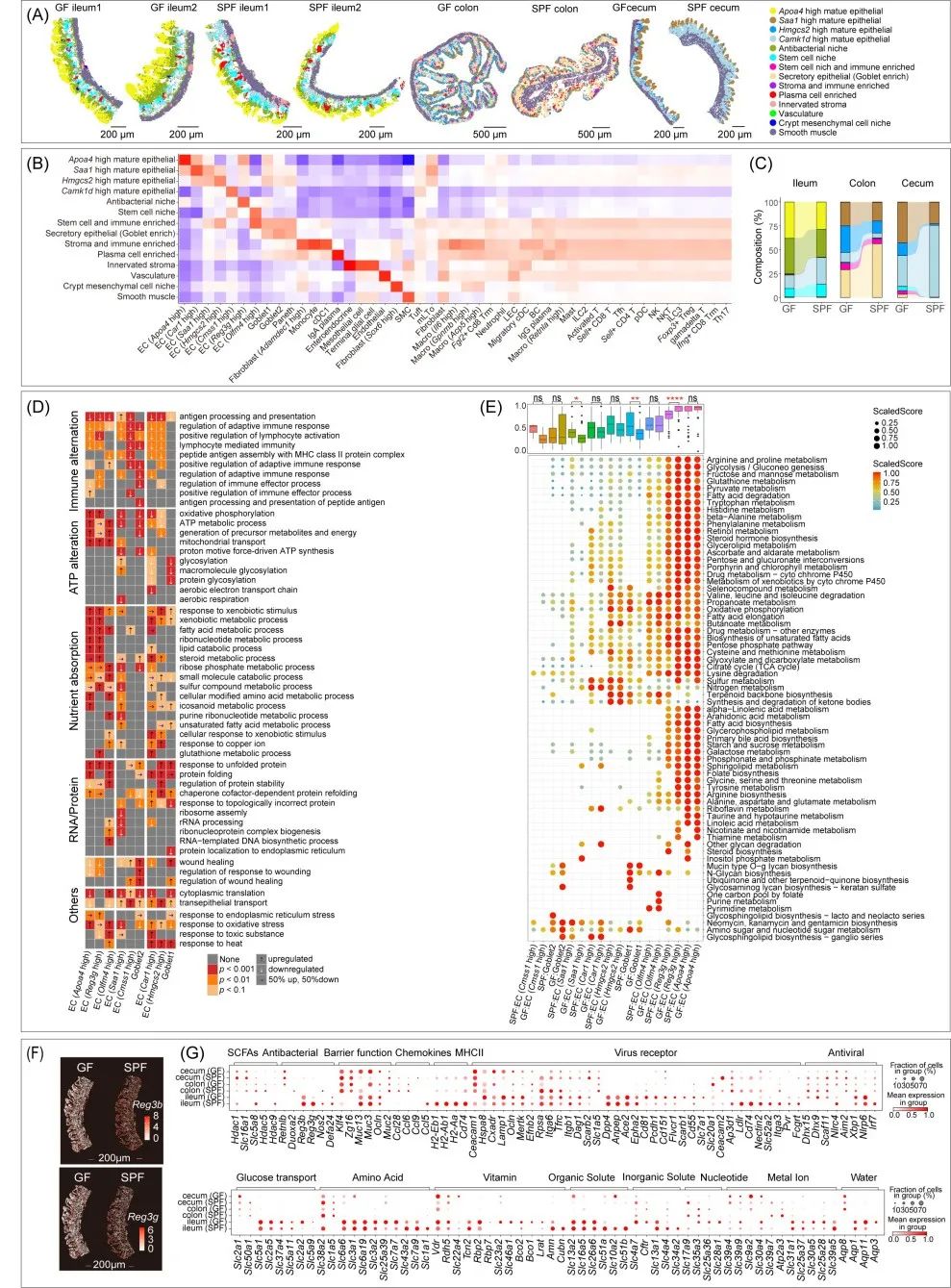
图4. 微生物群缺失导致肠上皮功能和分区的变化
(A)基于Stereo-seq的肠道区域分区。(B)热图展示了各组织区域细胞类型的log2转化富集得分,较高的得分表示较大的丰度。(C)基于空间数据的上皮组分的相对比例。柱状图前两个表示肠上皮顶部的区域。(D)展示不同肠段差异表达基因的GO富集分析热图。(E)展示不同亚型肠上皮细胞的代谢通路活性热图。活性得分使用scMetabolism包计算,并标准化为(Vcur-Vmin)/(Vmax-Vmin),其中Vcur为当前活性得分,Vmin为最低值,Vmax为最高值。统计分析通过Wilcoxon检验进行,ns p > 0.05, * p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001。(F)天然免疫防御基因Reg3β和Reg3γ的空间可视化表达。(G)展示肠道不同段落功能基因的表达特征的点图。每个点代表一个基因,颜色饱和度表示在特定肠段中的平均表达水平(按Z-score标准化),点的大小与该基因在对应肠段中表达细胞的比例成正比。
微生物群通过ZBTB20-LPL轴在肝脏调控膳食脂质代谢与血脂水平
GF小鼠的肠道黏膜区域化发生了显著改变,尤其是顶端营养吸收区增厚,这突显了肠道上皮在饮食介导的脂质吸收和代谢中的重要作用。同时,研究发现肠道上皮细胞的差异表达基因与人类基本生理特征(如血脂和BMI)密切相关(表S8)。鉴于这些结果,研究者进一步评估了69个与脂相关基因在不同肠段中的mRNA表达。这些基因涉及脂肪吸收、内质网中的前乳糜微粒处理以及高尔基体中的成熟等过程(表S9)。结果显示,在GF小鼠中,回肠上皮细胞的Cd36表达显著上调(图5A和S13),提示脂肪酸摄取能力增强,同时三酰甘油(TAG)合成相关基因(如Gpat3、Mgat2、Dgat2和Acat1)表达增加,表明肠道菌群可能调节内质网相关的脂质合成。在乳糜微粒包装过程中,载脂蛋白B(Apob)和Apoa4的mRNA水平升高,Sar1b、Fabp1、Bet1和Ykt6的表达上调,暗示内质网到高尔基体的运输机制发生改变(图S13)。脂滴的形成用于乳糜微粒储存,脂滴表面蛋白PLIN2和PLIN3调节脂滴的形成和代谢。GF小鼠中PLIN2表达增加,提示大脂滴可能增多。同时,脂肪分解相关基因(如ATGL、Pnpla2、HSL和Mgll)表达下调,而脂酶LAL(Lipa)mRNA表达增加,表明脂噬成为GF小鼠脂滴降解的主要方式(图5B)。蛋白质荧光染色进一步证实了脂滴储存和脂噬过程在GF和SPF小鼠间的差异(图5C)。此外,GF小鼠中中长链脂肪酸氧化相关基因(如Ppara、Fabp1、Acadl、Acadm、Acox1、Hadha和Hadhb)表达上调,而短链脂肪酸氧化相关基因(如Acads)表达下调,这与微生物缺失短链脂肪酸的减少密切相关(图5B)。上述结果表明在缺乏肠道菌群的情况下,脂质代谢途径发生改变,可能是GF小鼠对脂质环境变化的适应性反应。这些变化可能共同导致GF小鼠对高脂饮食诱导的肥胖具有抵抗力。
在肠道菌群缺失的情况下,小肠的脂质代谢被破坏。这种变化是否会影响肝脏代谢,或者是否受到肝脏关键因素的调节,目前尚不清楚。为了探究这一问题,研究者首先分析了肝脏不同区域(门静脉周围、中门静脉和中央静脉)的差异基因表达,发现这些差异基因在脂质合成、运输、稳态、乳糜微粒残余清除以及三酰甘油代谢调控通路富集(图S14A,B)。随后,研究者测量了肝细胞中75种参与脂肪酸合成和氧化、三酰甘油合成以及脂肪分解的酶编码基因的RNA水平(表S9)。结果显示,这些基因在GF小鼠肝脏中的表达水平普遍下调(图S14C)。具体而言,GF小鼠肝脏中与脂肪酸和三酰甘油合成相关的基因(如Scd1、Elovl3、Dgat2、Agpat2、Agpat3、Gpat4和Plin2)以及脂肪酸氧化相关基因(如Ppara、Acadl、Acadm、Acox1、Cpt1a、Acads、Eci2、Aadac、Acot1、Cyp4a10、Hadha、Hadhb和Ehhadh)的表达显著下调。根据以往的研究,法尼酯X受体(FXR)通过激活PPARα促进线粒体β-氧化,通过诱导LDLR和syndecan-1增强胆固醇摄取,并在肠道中触发Fgf15合成以激活肝细胞中的ERK1/2通路,从而抑制Cyp7a1和胆汁酸合成。本研究中这些基因的表达水平与以往报道一致(图S14D)。然而,验证源头上的这种调控关系仍需进一步的实验验证。
此外,我们观察到GF小鼠肝脏中锌指转录因子(Zbtb20)的表达显著下调,同时脂蛋白脂肪酶(Lpl)表达增加。既往研究表明,Zbtb20能够通过直接结合Lpl基因的启动子来抑制其转录,从而调节脂蛋白脂肪酶的表达(图S14E),本研究的空间转录组结果进一步证实了这个结论。LPL是脂质代谢中的关键酶,能够水解循环中的甘油三酯。它通过GPIHBP1迅速运输到内皮细胞表面,从而促进三酰甘油(TAG)的水解(图S14E)。由于成年肝脏中Lpl的表达量较低,其作用常被忽视。本研究发现,在SPF小鼠中,Lpl的表达主要集中在中央静脉区域,且在微生物缺失后显著增加,但不表现出肝脏区域化分布特征(图5D,E)。有趣的是,既往研究报道特异性敲除肝脏Lpl会导致血浆中LPL含量和活性显著下降,餐后TAG清除受损,血浆TAG和胆固醇水平升高,但不影响肝脏脂质或血糖稳态。因此本研究中的Ldlr表达下调和Lpl表达上调可能是GF小鼠血液中低密度脂蛋白水平升高的因素(图1B和图S14E)。
肝脏脂肪生成和脂质氧化基因表达的同时改变,以及GF小鼠中脂肪酸氧化和回肠脂噬的增强,可能是其对高脂饮食诱导的肥胖具有抵抗力的原因。

图5.微生物缺失后,肠上皮细胞和肝脏中血脂调节轴(ZBTB20-LPL)的空间分区特征及脂质吸收和代谢景观变化
(A)与脂质吸收和代谢相关的表达特征点图。CT,胆固醇转运;CET,乳糜微粒转运;FAT,脂肪酸转运;COPII,蛋白复合物II;SNAREs,溶解性N-乙基马来酰亚胺敏感因子(NSF)附着蛋白受体;FAO,脂肪酸氧化;TGS,TAG合成;LD,脂滴;LP,脂解;LIP/R,脂蛋白与受体。(B)简化图示说明SPF和GF小鼠之间的脂滴储存、脂解与脂肪自噬过程。(C)回肠的免疫荧光染色。(D)展示GF和SPF小鼠各层次中表达Lpl和Zbtb20基因的比例。(E)肝脏中Lpl基因表达的空间可视化,背景显示肝脏分区。
整合分析揭示微生物群的缺失改变了胆汁酸的合成途径和重吸收能力
肠道微生物群在胆汁酸代谢中扮演着关键角色,它们不仅影响胆汁酸的组成,还参与调节葡萄糖、脂质代谢和能量平衡。为了研究微生物缺失对胆汁酸组成的影响,研究者重点关注了胆汁酸的整体水平(图6A),并提供了不同部位胆汁酸的详细信息(图S15A)。总体而言,GF小鼠在多个器官(包括肝脏和盲肠)以及粪便和血浆中胆汁酸水平降低,并且肝脏中胆汁酸的类型也有所不同,GF小鼠肝脏主要含有游离的初级胆汁酸,而SPF小鼠则主要含有结合型胆汁酸(图6B)。值得注意的是,GF小鼠肝脏中非12-OH胆汁酸比例显著增加(图6C),特别是CDCA和β-MCA,同时肝脏中CDCA/CA和β-MCA/CA的比例也显著升高(图6D和图S15B),这表明微生物群的缺失改变了胆汁酸的合成途径,从经典途径转向替代途径。进一步的基因表达分析显示,GF小鼠肝脏中与胆汁酸合成相关的几个关键基因表达发生变化,特别是Cyp7b1和Cyp2c70表达上调(图6E和图S15C),而Cyp8b1表达下调(图6E),这也进一步证实了GF小鼠肝脏中胆汁酸合成主要通过替代途径进行(图6F)。
肠道菌群的缺失不仅影响胆汁酸的产生,还通过与关键重吸收转运蛋白的相互作用调节胆汁酸的循环。在GF小鼠中,可以观察到负责运输结合型胆汁酸并促进其在胆囊中储存的两个关键基因Bsep和Mrp2的表达显著降低(图6E)。大多数胆汁酸转运蛋白编码基因在GF小鼠肝脏中的表达降低,尤其是在受微生物缺失影响最大的肝门静脉周围区域(图6E)。此外,在GF小鼠的回肠中可以观察到胆汁酸转运蛋白编码基因的表达发生变化。例如,Asbt(负责从肠腔重吸收去结合胆汁酸)在GF小鼠的回肠中表达降低,OSTα/β(编码将胆汁酸从肠道通过肝门静脉运输回肝脏的关键转运蛋白)在回肠中的表达也降低(图6F)。有趣的是,与SPF小鼠相比,GF小鼠肝脏中胆管细胞的比例增加,这一结果通过Stereo-seq、scRNA-seq数据和HE染色得到证实(图S16A-F)。这一现象与先前关于GF小鼠血管化面积增加的研究结果一致。对胆管细胞差异基因进行富集分析发现,GF小鼠中上调的基因与氧化应激、伤口愈合和凋亡信号通路相关(图S16G)。这种现象可能是由于肠道菌群缺失导致的代谢和生理变化,从而影响胆汁系统的结构和功能。无菌小鼠胆管和胆汁酸之间有怎样的联系有待进一步验证。

图6. 微生物群缺失改变胆汁酸合成途径和再吸收能力
(A)各部位总胆汁酸(BA)水平的分布直方图。(B)柱状图显示不同样本中胆汁酸(BAs)的比例,包括肝脏、盲肠、粪便和血浆,比较GF和SPF小鼠。每个彩色区域代表一种胆汁酸,沿x轴堆叠展示其在两组小鼠间的变化,通过不同颜色区域的高度和厚度变化以及流线突出显示这些变化。CA,胆酸;NorCA,去胆酸;APCA,脱胆酸;CDCA,鹅去氧胆酸;MCA,小鼠胆酸;HCA,去氢胆酸;UCA,尿胆酸;UDCA,熊去氧胆酸;DCA,脱氧胆酸;NorDCA,去脱氧胆酸;LCA,石胆酸;3-oxoCA,3-脱氢胆酸;Dio-LCA,7,12-二酮石胆酸;Iso-LCA,异石胆酸;HDCA,氢脱氧胆酸;7-KetoLCA,7-酮石胆酸;T,牛磺;G,甘氨。(C)柱状图显示不同样本中非12-OH和12-OH胆汁酸的绝对含量。12-OH胆汁酸包括CA、DCA及其他来自经典途径的BAs,而非12-OH胆汁酸包括CDCA、MCA及来自替代途径的BAs。(D)箱线图展示肝脏中CDCA/CA和β-MCA/CA的比值。点表示每个样本,水平线表示中位数,箱体显示25%-75%分位数。通过Wilcoxon检验分析组间差异,* p < 0.05, ** p < 0.001。(E)展示与肝脏胆汁酸代谢和肠道胆汁酸吸收相关的基因表达点图。(F)示意图展示肝肠轴中胆汁酸循环的分子过程,蓝色基因表示GF小鼠中下调,红色基因表示SPF小鼠中上调。
讨 论
本研究通过GF和SPF小鼠的组学数据的比较,系统分析了微生物缺失对GF小鼠免疫系统和脂质代谢的影响。微生物缺失显著改变了免疫细胞的发育与功能,导致免疫细胞的比例和分布异常,特别是B细胞、T细胞及髓系细胞的发育受阻,影响免疫细胞周期进程、激活和分化,以及免疫细胞和组织的异质性。此外,GF小鼠中免疫应答能力减弱,适应性免疫细胞的比例下降,并且关键免疫基因的表达显著下调。微生物群的缺失还导致了胆汁酸代谢途径的改变,从经典合成途径转向替代途径。胆汁酸转运蛋白的表达也显著下降,进一步影响胆汁酸的吸收、回收与分布。回肠和肝脏的脂质代谢发生显著变化,回肠中涉及脂肪酸吸收和脂滴形成的基因表达增强,而肝脏中脂肪生成与氧化相关基因表达减少,反映了GF小鼠维持脂质代谢平衡的调控机制。尽管本研究未涵盖所有胃肠道区域及其他器官的数据,但为研究宿主与微生物群之间复杂的相互作用提供了宝贵的资源,并为未来进一步探索微生物在免疫与代谢调控中的作用奠定了基础。
结 论
我们的研究呈现了SPF和GF小鼠的多器官单细胞、空间转录组学和胆汁酸代谢组学图谱。浆细胞聚集显示出显著的组织异质性,这与肠道微生物群的存在密切相关。GF小鼠的滤泡和边缘区B细胞发育受损,这与微生物群介导的Cr2基因表达调控密切相关。肠道微生物群调控骨髓中中性粒细胞的发育和存活,影响胸腺中T细胞的发育与分化,并调节小肠上皮内γδ T细胞的组成及脂质吸收。值得注意的是,肠道的空间转录组学首次揭示了GF小鼠肠道粘膜功能分区的显著变化,小肠吸收性肠细胞中的脂滴扩大,向脂肪自噬转变并增强脂肪酸氧化,突显了GF小鼠抵抗肥胖的关键通路。同时,肝脏的空间转录组学首次揭示了ZBTB20- LPL轴的梯度表达模式,这一轴调控血脂,并受到微生物的调节。
代码和数据可用性
论文结论所需的所有数据在论文和/或补充材料中。肝脏scRNA-seq数据的原始矩阵可在https://db.cngb.org/search/project/CNP0003996/获取,脾脏 scRNA-seq数据的原始矩阵已上传至https://db.cngb.org/search/project/CNP0003930/,血液、骨髓、回肠、盲肠、结肠和胸腺的scRNA-seq数据的原始矩阵可通过https://db.cngb.org/search/project/CNP0005580/获取,肝脏的stereo-seq数据的原始矩阵已上传至 https://db.cngb.org/search/project/STT0000034,脾脏的stereo-seq数据的原始矩阵可在https://db.cngb.org/search/project/STT0000034获取,回肠、盲肠、结肠和胸腺的stereo-seq数据的原始矩阵已上传至https://db.cngb.org/stomics/project/STT0000129。更详细的数据信息可联系通讯作者获取。补充材料(文本、图、表、中文翻译版本或视频)也可从线上(http://www.imeta.science/)获取。
引文格式:
Juan Shen, Weiming Liang, Ruizhen Zhao, Yang Chen, Yanmin Liu, Wei Cheng, Tailiang Chai, et al. 2025. Cross-tissue multi-omics analyses reveal the gut microbiota’s absence impacts organ morphology, immune homeostasis, bile acid and lipid metabolism. iMeta 4: e272. https://doi.org/10.1002/imt2.272
作者简介

沈娟(第一作者)
● 哥本哈根大学在读博士。
● 主要研究方向为心血管和代谢性疾病组学研究或微生物-宿主互作机制探究,以核心骨干参与两项十四五国家重点研发计划。在国内外期刊公开发表SCI学术论文25余篇,以第一或并列第一作者在iMeta、Signal Transduction and Targeted Therapy、National Science Review、Journal of the American Society of Nephrology等期刊发表SCI论文7篇。

梁伟明(第一作者)
● 北京理工大学珠海学院本科生。
● 研究方向为基于多组学挖掘宿主与微生物的互作,以第一作者在iMeta等期刊发表SCI论文1篇。

赵瑞珍(第一作者)
● 中国科学院大学博士研究生。
● 研究方向致力于深入探索肠-肝轴的互作机制,以及微生物在调节肝脏免疫应答与代谢稳态中的关键作用,共在iMeta、Computational and Structural Biotechnology Journal、Journal of Genetics and Genomics、Hepatology Communications等期刊发表SCI论文5篇。

陈洋(第一作者)
● 广东省中医院研究实习员。
● 研究方向为中医药与肠道菌群-宿主互作。主持国家自然科学基金青年项目、省部共建中医湿证国家重点实验室、广东省基础与应用基础研究基金项目等省部级课题3项。以第一或并列第一作者在The Journal of Clinical Investigation,Frontiers in Immunology,Frontiers in Nutrition等期刊发表SCI论文6篇。

刘艳敏(第一作者)
● 广州中医药大学第二附属医院 助理研究员。
● 主要研究方向为中药-菌群-宿主在代谢性疾病中互作的机制探究,目前主持省部级基金1项,参与国家自然科学基金等多项,在国内外期刊公开发表SCI学术论文10余篇,第一或并列第一作者在iMeta、Food and Medicine Homology、Journal of Genetics and Genomics等期刊发表SCI论文5篇。

程伟(第一作者)
● 华中农业大学动物科学技术学院、动物医学院博士后。
● 研究方向为肠道菌与宿主基因互作影响骨骼肌生长发育,以第一(含共同第一)作者在iMeta、Advanced Science、Science of The Total Environment、Frontiers in Nutrition期刊发表SCI论文4篇,主持中国博士后科学基金面上项目1项,参与国家重点研发计划2项。

魏泓(通讯作者)
● 华中农业大学动物科学技术学院、动物医学院特聘教授。
● 研究方向为疾病微生物组学,无菌动物与遗传工程动物模型以及微生物组与宿主基因组互作;主持完成973第1项无菌动物模型课题、第1项小型猪国家攻关项目,完成15项无菌动物与小型猪项目;在Science等期刊发表无菌动物与小型猪SCI论文162篇,总影响因子1283,其中以(共同)通讯作者在Cell等期刊发表SCI论文121篇,总影响因子778;主编“医学实验动物学”为国家教育部首批推荐全国研究生教学用书、主编《医学动物实验技术》 获国家科学技术学术著作出版基金资助;获小型猪研究获重庆市科技进步二等奖、军队教学成果一等奖;获无菌动物与小型猪合作研究获国家科技进步二等奖、中华医学会科学技术一等奖、中国实验动物学会科学技术一等奖;热心肠iMeta2024年度科学家奖获得者等。

Kristiansen Karsten (通讯作者)
● 哥本哈根大学教授,青岛华大生命科学研究院-哥本哈根大学联合培养导师。
● 研究方向主要集中在微生物组学、宿主-微生物相互作用以及基因组学在健康和疾病中的应用。其带领的研究团队致力于探索肠道微生物群与宿主代谢、免疫功能和疾病之间的关系,并通过宏基因组学技术挖掘微生物群落的潜在功能。Kristiansen教授的研究成果在国际上具有广泛影响力,其论文发表在Nature,Science等顶级期刊上,累计被引用超过61,000次。

韩丽娟(通讯作者)
● 北京理工大学及美国俄亥俄大学联合培养理学博士,康美药业股份有限公司研发中心总经理、研究院副院长、康美华大基因技术有限公司总经理。
● 研究方向为聚焦中医药与多组学技术的融合创新,开展中药质量研究、活性评价、机制研究,以及新型饮片和中药健康品开发等,在Nature Communications,ISME Journal等期刊发表论文30余篇,授权发明专利10余项。担任广东省药理学会第四届中药药理专委会常务委员、广东省中药标准化技术委员会(GD/TC36)委员兼秘书长等学术组织职务。

方晓东(通讯作者)
● 华大生命科学研究院副院长,哥本哈根大学生物信息学博士,中国科学院大学博士生导师,分子生物学研究员。
● 研究方向主要是通过对基因组、单细胞和时空等多组学数据进行分析和整合,探索生物的适应性演化分子机制及疾病发生发展的分子机理。熟悉多组学平台的技术特点和数据特征、分析思路和方法策略,重点关注中药-菌群-宿主互作及组织器官结构和功能微环境。先后参与多项合作项目,以共同一作或共同通讯身份在包括Nature,Science,Nature Biotechnology,Nature Genetics, Nature Communications,PNAS,Journal of Clinical Investigation,Microbiome,Bioinformatics等学术期刊发表40多篇文章。有丰富连接科研和产业的经验,带领团队进行多组学业务推广和科研合作,促进技术的普及和科研发展。
更多推荐
(▼ 点击跳转)
iMeta | 引用16000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 兰大张东组:使用PhyloSuite进行分子系统发育及系统发育树的统计分析
iMeta | 唐海宝/张兴坦-用于比较基因组学分析的多功能分析套件JCVI
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
3卷2期
3卷3期
3卷4期
3卷5期
3卷6期
1卷1期
1卷2期
期刊简介
“iMeta” 是由威立、宏科学和本领域数千名华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表所有领域高影响力的研究、方法和综述,重点关注微生物组、生物信息、大数据和多组学等前沿交叉学科。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括中英双语图文、双语视频、可重复分析、图片打磨、60万用户的社交媒体宣传等。2022年2月正式创刊!相继被Google Scholar、PubMed、SCIE、ESI、DOAJ、Scopus等数据库收录!2024年6月获得首个影响因子23.8,位列全球SCI期刊前千分之五(107/21848),微生物学科2/161,仅低于Nature Reviews,学科研究类期刊全球第一,中国大陆11/514!
“iMetaOmics” 是“iMeta” 子刊,主编由中国科学院北京生命科学研究院赵方庆研究员和香港中文大学于君教授担任,是定位IF>10的高水平综合期刊,欢迎投稿!
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science









































 515
515

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








