今天给同学们分享一篇实验文章“Radiation-induced circulating myeloid-derived suppressor cells induce systemic lymphopenia after chemoradiotherapy in patients with glioblastoma”,这篇文章发表在Sci Transl Med期刊上,影响因子为17.1。

结果解读:
化疗放疗后淋巴细胞减少与髓源性抑制细胞(MDSC)数量增加相关
为了阐明GBM淋巴细胞减少症的潜在机制,作者使用多种基因组和免疫监测技术,如RNA测序和流式细胞术,进行了一项前瞻性的相关临床研究。作者评估了20名接受标准RT和同时TMZ治疗6周的GBM患者(图第1A段)。作者在放化疗前(基线)和放化疗期间(第2周和第6周)收集GBM患者的外周血。在20名患者中,10名患者在完成放化疗期间或4周内出现系统性淋巴细胞减少症(淋巴细胞减少症患者;LP),10名未出现淋巴细胞减少症。在样本量相对较小的情况下,LP的无进展生存率和总生存率比非LP差。如图1B所示,基线时全血中LP和NLP的淋巴细胞计数没有显著差异。然而,在第2周和第6周,LP的淋巴细胞计数显著低于NLP(p=0.005&p<0.001)。LP的中性粒细胞计数在基线时显著高于NLP(p=0.02),并在第2和6周保持稳定升高,没有显著增加,而单核细胞计数在历史点上LP和NLP之间没有显著差异。对15名患者(7名NLP和8名LP)进行了外周血单核细胞(PBMC)的核糖核酸测序(RNA-seq)。图1C显示了与T细胞、单核细胞、髓源性抑制细胞(MDSC)和MHC II类相关的选定基因特征。在人类中,MDSC通常被定义为表达CD11b和常见骨髓标志物CD33但缺乏成熟骨髓和淋巴细胞的标志物以及MHC II类分子HLA-DR的表达的细胞(21,22)。与NLP相比,LP在基线时具有升高的MDSC调节基因表达,并且在RT后进一步增加。
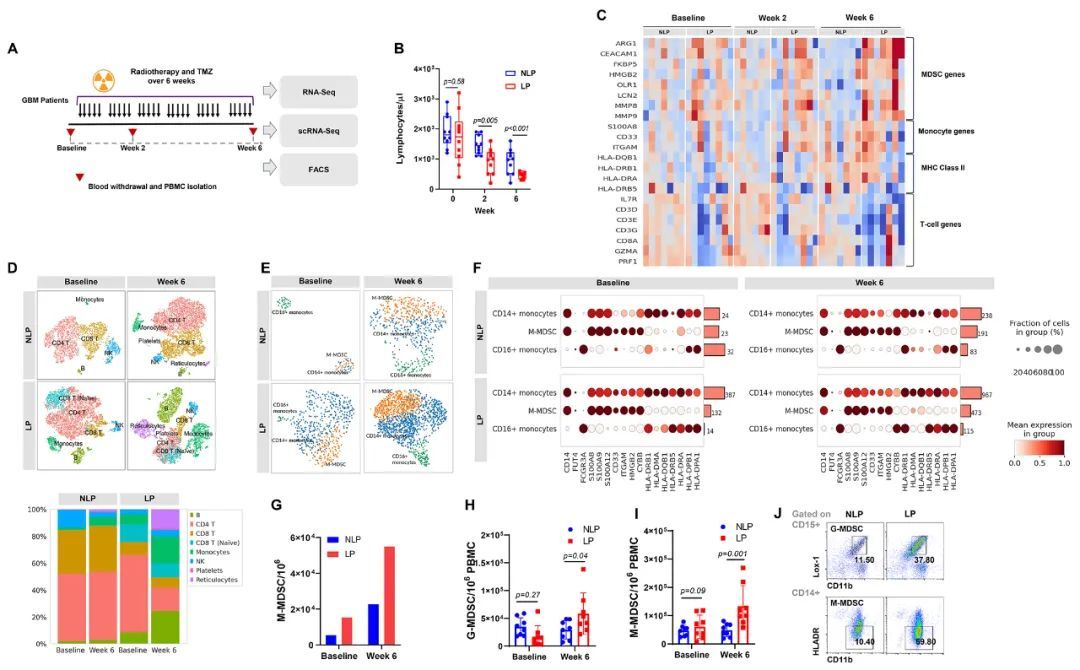
化疗放疗后淋巴细胞减少与T细胞数量减少相关
作者还使用作者的批量RNAseq和scRNA-seq数据集评估了化学放疗对不同亚型T细胞的影响。作者发现,在第6周放疗后,与T细胞、NK细胞和效应细胞相关的基因特征在LP中减少(图2A)。scRNA-seq还显示,在RT后,表型LP中不同的CD4和CD8 T细胞系谱,包括:天然、终末效应、中央记忆和效应记忆T细胞,显著减少,而在表型NLP中没有观察到这种情况(图2B和C)。流式细胞术分析证实,在RT后,LP中的CD4和CD8 T细胞出现了非显著性减少,而在NLP中没有观察到这种情况(图2D、E和F)。对于其他T细胞亚群,如效应细胞、天然、中央记忆、效应记忆CD4和CD8 T细胞,也观察到了类似的趋势。这些数据证实,化学放疗后GBM中的淋巴细胞减少影响了所有亚型的T细胞。

正位移植的GBM小鼠模型用于研究免疫抑制
随后,作者开发了一个临床前小鼠模型,以评估颅脑放射治疗、循环MDSC和淋巴细胞减少之间的关联。作者使用免疫能力正常的小鼠(C57BL/6)建立了一个同种异体的GBM小鼠模型,将GBM细胞系(GL261)正位植入小鼠体内。然后,对小鼠进行不同的放射治疗分割:每天2Gy x 5次、4Gy x 5次和10Gy x 3次。在临床相关的2Gy x 5次分割(RT,图3A)后,携带肿瘤的小鼠在第14天和第21天通过流式细胞术显示出CD4和CD8 T细胞显著减少(图3B:p=0.006和p=0.03,C:p=0.03,C:p=0.002和p=0.0001)。然而,只有在没有植入肿瘤的放射治疗对照小鼠中观察到CD4和CD8 T细胞轻微减少(图3B和C)。相应地,携带肿瘤的小鼠(而非无肿瘤小鼠)在放射治疗后的第14天和第21天显示出G-MDSC(CD11b + Ly6G + Ly6C − )和M-MDSC(CD11b + Ly6C + Ly6G − )显著增加(图3D:p<0.0001和p<0.0001,E:p<0.0001和p<0.0001)。其他的照射方案(4Gy x 5和10Gy x 3)对T细胞和MDSC也显示出类似的效果,因此选择了临床相关的2Gy x 5分割方式进行后续实验。如预期,与未接受放疗的肿瘤携带小鼠相比,接受放疗的肿瘤携带小鼠的肿瘤更小(图3F和G)。由于GBM患者接受放疗和同时使用TMZ治疗,作者还通过给小鼠进行放疗和TMZ治疗的实验。与仅接受放疗的小鼠相比,加入TMZ与放疗联合治疗对T细胞、G-MDSC和M-MDSC计数没有显著影响。因此,在作者后续的临床前实验中,作者仅给小鼠进行放疗治疗。为了测试远离肿瘤的正常组织是否会对MDSC产生类似的影响,作者用2Gy x 5照射了正交GBM携带小鼠的胸部,使包含GBM的大脑未受到照射。胸部放射对肿瘤携带小鼠的T细胞和MDSC影响较小。这些数据表明,作者的小鼠模型能够复制出在脑胶质瘤患者中观察到的辐射诱导的淋巴细胞减少和髓样抑制细胞现象,并且这种现象取决于肿瘤的环境和肿瘤的辐照。

RT增强了携带GBM肿瘤的小鼠的骨髓生成
为了测试一个假设,即辐射后血液中增加的循环MDSC可能是由于辐射引起骨髓或脾脏中髓系细胞异常产生,作者在肿瘤自由对照小鼠和携带肿瘤的小鼠的骨髓和脾脏组织上进行了采集,采集时间为RT(2Gy x 5)或假治疗后的第14天(图4A)。与其他组相比,携带GBM肿瘤并接受RT治疗的小鼠在骨髓(图4B和D)和脾脏中的总髓系细胞(CD11b + )、G-MDSC和M-MDSC明显增加。此外,与其他组相比,携带肿瘤并接受RT治疗的小鼠的粒-单祖细胞(GMP:p=0.001)、共同髓系祖细胞(CMP:p=0.03)和多能祖细胞(MPP:p=0.05)细胞数量显著增加(但短期造血干细胞或ST-HSC数量没有增加)(图4E、F、G、H和I)。作者的数据证实,辐照和肿瘤对骨髓和脾脏中异常髓系发育产生MDSC具有协同作用。

辐射诱导的MDSC的功能分析
为了评估辐射诱导的髓系抑制细胞(MDSC)是否能够在功能上抑制外周T细胞的增殖和激活,作者使用了Burger等人描述的体外功能性测定方法(23)。作者从之前描述的LP和NLP GBM组中分离出人类CD33髓系细胞,并与健康供体(人类)的T细胞一起孵育,同时加入T细胞刺激物CD3/CD28磁珠(图5A)。然后,通过测量Ki67阳性细胞来分析T细胞的增殖情况,并通过测量TCR zeta来分析T细胞的激活情况。与NLP中的CD33髓系细胞相比,LP中的CD33髓系细胞更有效地抑制了T细胞的增殖(图5B:p=0.02)和激活(图5C:p=0.02)。为了测试辐射诱导的循环MDSC是否能直接引起全身淋巴细胞减少,作者从接受放疗的肿瘤携带和无肿瘤小鼠中分离出G-MDSC(CD11b Ly6G Ly6C),并将其输注到未接受放疗的无肿瘤小鼠中(图5D)。来自受辐射的肿瘤携带小鼠的G-MDSC在输注后的第3天和第7天显著减少了天然小鼠中的CD4和CD8 T细胞,而来自受辐射的无肿瘤小鼠的G-MDSC则没有(图5E:p=0.01,p=0.01,F:F:p=0.01)。

辐射诱导的MDSC表达了Arg-1的增加
MDSC被认为通过表达Arg-1来抑制T细胞,因此作者评估了GBM患者和作者的肿瘤模型中MDSC中的Arg-1水平。患者PBMC样本的批量RNA测序显示,在化疗放疗后,LP中的Arg-1表达较NLP增加(图6A和B)。GBM患者的流式细胞术分析也证实了LP中G-MDSC和M-MDSC的Arg-1表达增加(图6C和D)。在作者的小鼠GBM模型中,颅脑放疗后循环中的G-MDSC和M-MDSC也观察到了Arg-1表达增加的类似模式(图6E和F)。这些数据表明,在GBM中,放疗后功能性抑制性MDSC与Arg-1表达增加相关。
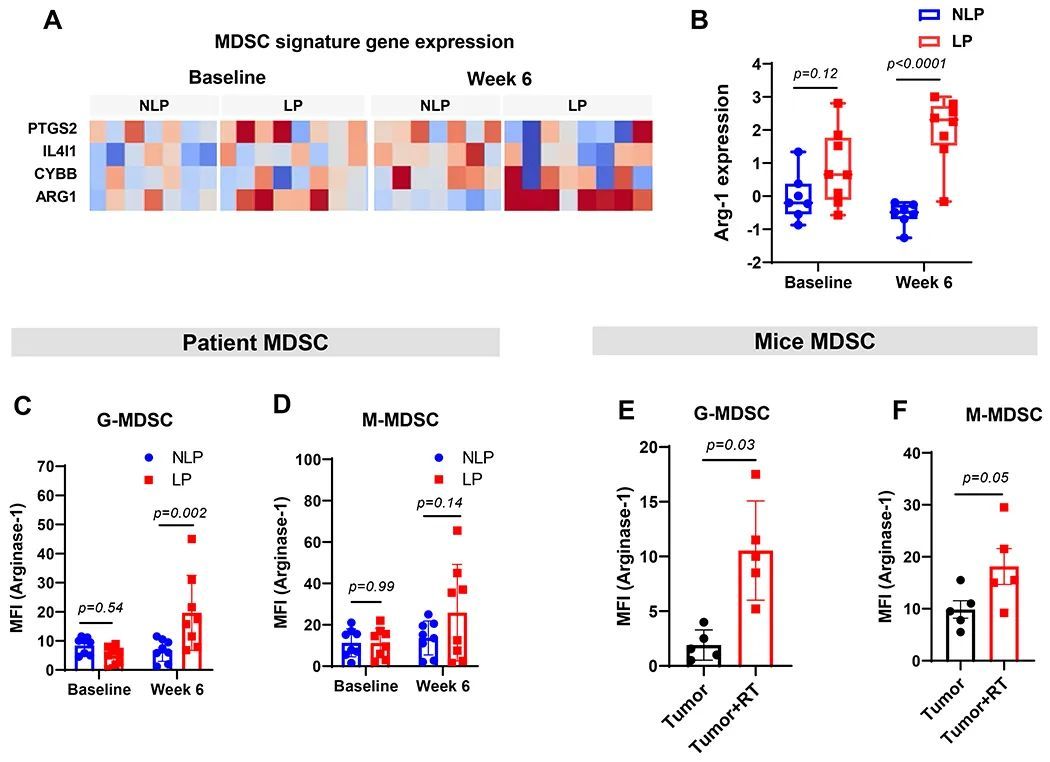
MDSC抑制剂改善了携带GBM肿瘤的小鼠的生存率和淋巴细胞减少症。
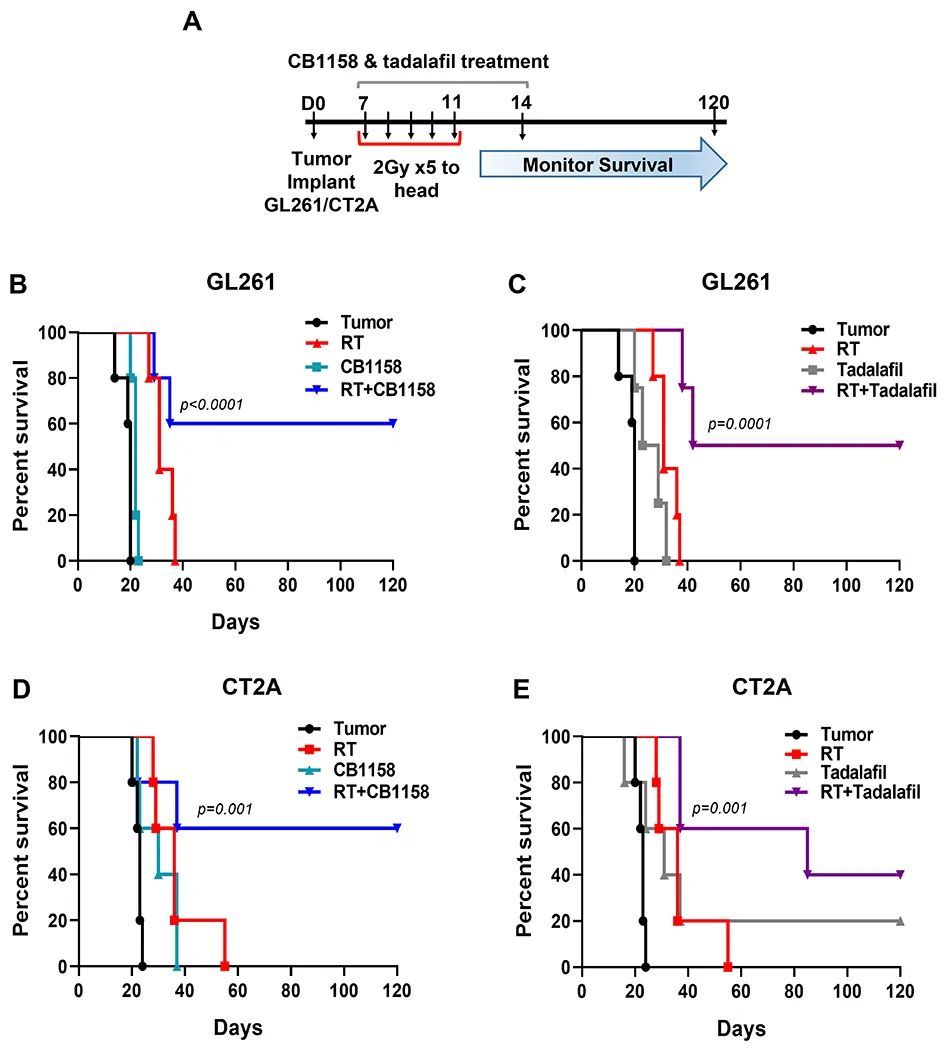
为了进一步研究辐射诱导的骨髓抑制细胞(MDSC)在淋巴细胞减少和肿瘤进展中的作用,作者进行了两种药物的体内实验来抑制MDSC的药理作用:CB1158和他达拉非。CB1158是一种口服小分子Arg-1抑制剂,已被证明可以抑制MDSC的功能(24)。他达拉非是一种口服通用PDE5抑制剂,已获得FDA批准用于治疗勃起功能障碍和肺动脉高压。PDE5抑制剂通过下调Arg-1和一氧化氮合酶(iNOS)的mRNA表达来抑制MDSC,并已在之前的临床试验中显示可以减少循环和肿瘤内MDSC(25-27)。
使用两种正位移同种系脑胶质瘤模型(GL261和CT2A)评估了CB1158和他达拉非药物抑制对其的影响。将携带肿瘤的小鼠分别用CB1158(100mg/kg)或他达拉非(2mg/kg)进行治疗,单独或与假手术或头部放射治疗(2Gy x 5)联合治疗10天,并对小鼠进行长达120天的生存观察(图7A)。与单独进行放射治疗相比,CB1158加放射治疗显著改善了GL261和CT2A模型的生存率(两个模型的中位生存期分别为89天,而单独进行放射治疗的中位生存期为36天;p=0.0028,图7B和D)。同样,他达拉非加放射治疗也改善了两个模型的生存率(两个模型的中位生存期分别为89天,而单独进行放射治疗的中位生存期为36天;p=0.0028,图7C和E)。然而,单独使用CB1158或他达拉非并没有改善生存率(图7B-E)。
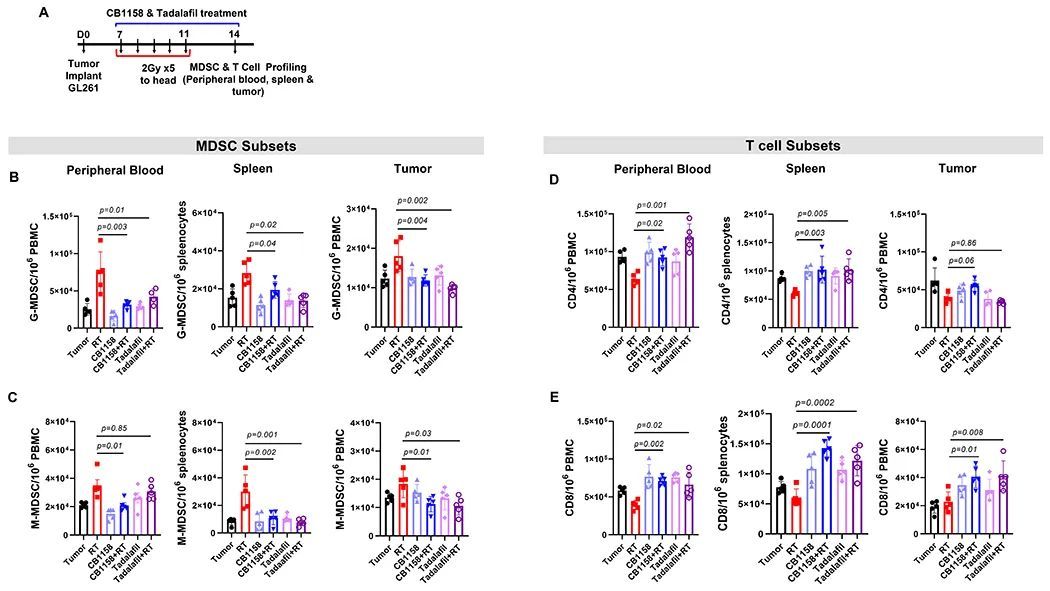
接下来,作者评估了肿瘤携带小鼠在放疗和药物治疗后的MDSC亚群水平(图8A)。CB1158或他达拉非与放疗的联合给药成功地消除了放射治疗引起的血液、脾脏和肿瘤中G-MDSC和M-MDSC的增加(图8B和C)。值得注意的是,放疗在脾脏中增加了MDSC的数量,而在肿瘤中增加的数量较少,这表明其效果更多是系统性的,而不仅仅是局部肿瘤微环境的影响。然而,CB1158或他达拉非单独使用并没有显著改变肿瘤携带小鼠的现有G-MDSC或M-MDSC在血液、脾脏和肿瘤中的数量,因此表明这些药物主要针对放射治疗引起的MDSC(图8B和C)。
总结
作者研究的主要局限性包括患者样本量小,并且并非所有患者都能获得大量RNAseq和流式细胞术的可评估数据。scRNAseq加工的技术限制也阻碍了G-MDSC的分析。此外,原位GBM小鼠模型不能反映人类GBM的复杂性,因此作者的临床前发现,抑制辐射诱导的MDSC可以改善淋巴细胞减少症和生存率,需要临床验证。根据作者的临床前数据,作者设计并启动了一项1B期研究,将他达拉非与标准放化疗相结合,用于新诊断的IDH野生型GBM患者(NCT04757662)。本研究旨在评估他达拉非与放化疗联合使用的安全性,并证实他达拉非阻断GBM患者辐射诱导的循环MDSC增加的靶向作用。






















 2744
2744











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










