
在肾脏生物学研究中,肾小球壁层上皮细胞(Parietal Epithelial Cells, PECs)因其多样性和在足细胞再生及新月体形成中的作用而受到广泛关注。近期,一项基于单细胞RNA测序(scRNA-seq)的研究揭示了PECs在健康与疾病状态下的分子特征及其动态变化,为理解肾脏疾病的病理机制提供了新的视角。
来自北京中医药大学生命科学学院的Wen-Bin Liu, Guang-Rui Huang, Bao-Li Liu等多名研究人员发表了题为《Single cell landscape of parietal epithelial cells in healthy and diseased states》的研究成果。
在该文章中,研究人员使用了购自AbMole的sotuletinib(目录号M5316)。
肾小球PECs位于鲍曼氏囊,是足细胞与肾小管上皮细胞(TECs)之间的过渡细胞群。尽管蛋白标志物揭示了PECs的形态异质性,但其分子特性尚不清楚。本研究旨在通过scRNA-seq技术全面解析PECs的亚群特征及其在疾病状态下的变化,特别是对新月体肾小球肾炎(crescentic glomerulonephritis)的贡献。
研究团队首先下载了来自Gene Expression Omnibus数据库的小鼠肾小球scRNA-seq数据集,并进行了系统的生物信息学分析,包括细胞聚类、轨迹分析和RNA速度分析等。此外,还通过动物实验验证了关键发现,在抗肾小球基底膜(GBM)肾炎小鼠模型中测试了特定信号通路的抑制剂效果。
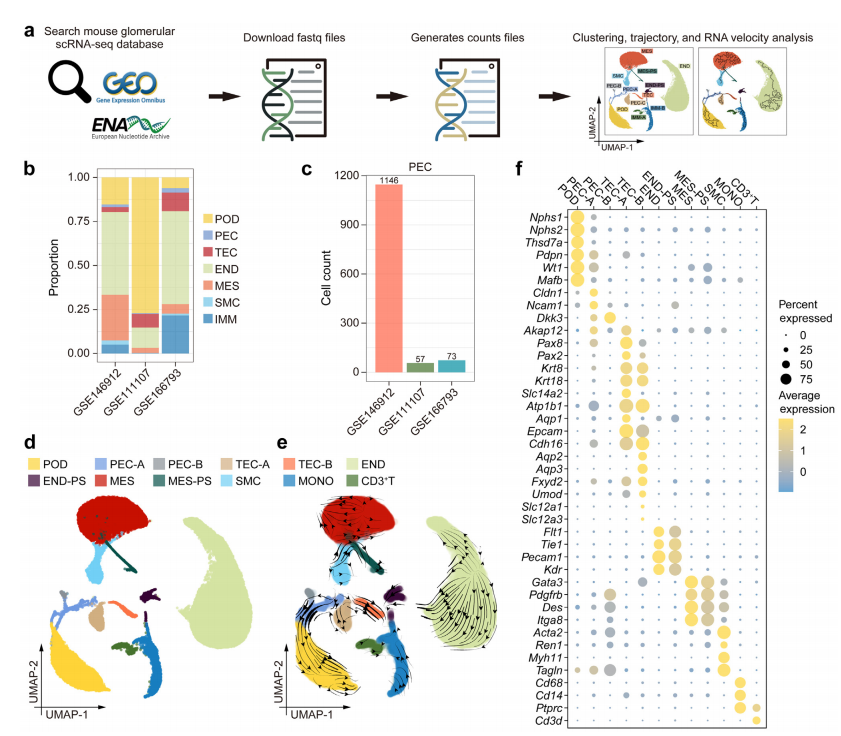
图 1 使用单细胞 RNA 测序 (scRNA-seq) 数据鉴定小鼠肾小球中的主要细胞类型。
PECs的亚群多样性:通过scRNA-seq分析,研究确定了五种PECs亚群:PEC-A1、PEC-A2、PEC-A3、PEC-A4和PEC-B。其中,PEC-A1和PEC-A2表现出足细胞祖细胞的特征,而PEC-A4则代表肾小管祖细胞。值得注意的是,PEC-A3仅在抗GBM肾炎中存在,并具有高增殖能力。
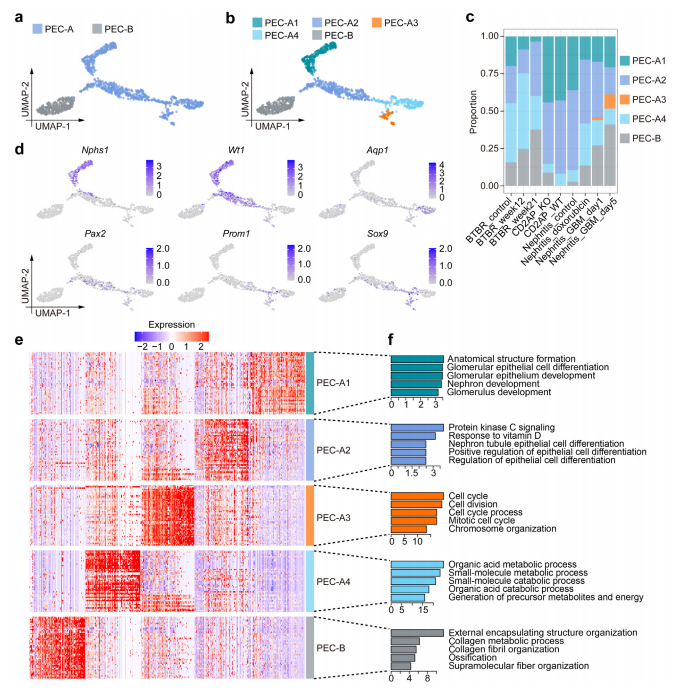
图 2 单细胞分辨率下壁层上皮细胞 (PEC) 的多样性。
新月体形成的关键机制:动态信号网络分析表明,PEC-A4的激活和PEC-A3的增殖在新月体形成中发挥了关键作用。上游信号如足细胞、免疫细胞、内皮细胞和系膜细胞释放的致病信号诱导了PEC-A4向PEC-A3的转变,从而促进了新月体的形成。
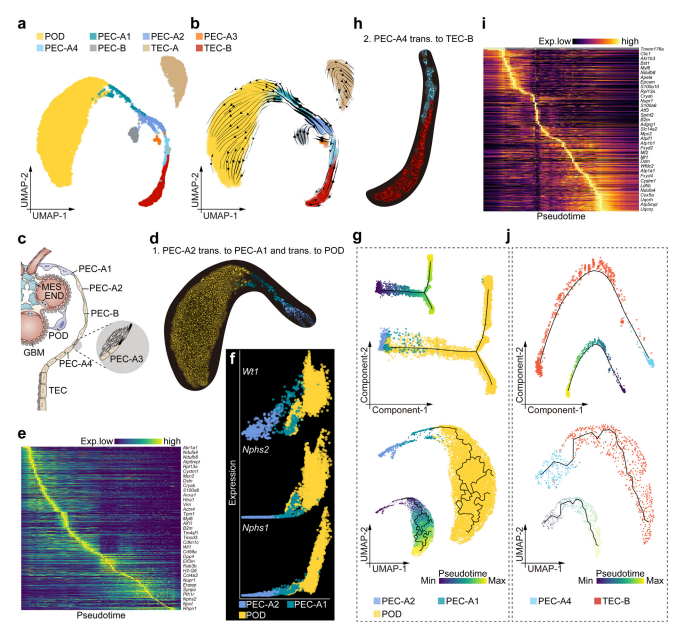
图 3 足细胞 (POD)、壁上皮细胞 (PEC) 亚群和肾小管上皮细胞 (TEC) 的过渡谱系表征。
致病信号通路的验证:研究选择了巨噬细胞迁移抑制因子(Mif)和集落刺激因子1受体(Csf1r)作为潜在的干预靶点,并在抗GBM肾炎小鼠模型中验证了这些靶点的有效性。通过抑制这些信号通路,成功减少了PECs的增生和新月体的形成,同时改善了肾功能。
PECs与足细胞及TECs的过渡关系:RNA速度和伪时间分析揭示了PEC-A2、PEC-A1和足细胞之间的过渡关系,以及PEC-A4与TECs之间的过渡关系。这表明PECs在肾脏发育和再生过程中具有重要作用,尤其是在足细胞和TECs的再生中。
疾病状态下的转录组变化:研究还比较了健康小鼠和疾病小鼠中PECs的转录组变化,发现PEC-A3在疾病状态下特异性出现并高度增殖,表达高水平的Cd44等标志物。此外,通过免疫组化分析进一步验证了这些发现,并揭示了Sox9等转录因子在PEC-A3形成过程中的关键作用。
本研究通过scRNA-seq技术深入解析了PECs的亚群多样性及其在疾病状态下的动态变化,为理解新月体肾小球肾炎的病理机制提供了新的视角。通过靶向特定的信号通路,成功减少了PECs的增生和新月体的形成,为肾脏疾病的治疗提供了新的策略。未来研究将进一步探索PECs在肾脏再生中的作用机制,以及开发更有效的干预手段以改善肾脏疾病的预后。
综上所述,本研究不仅揭示了PECs在健康与疾病状态下的复杂景观,还为肾脏疾病的治疗提供了新的思路和方法。随着单细胞测序技术的不断发展,我们有理由相信未来将有更多关于肾脏生物学和疾病机制的重要发现涌现出来。





















 720
720

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








