在基因表达调控的世界中,转录和翻译是两个至关重要的环节。尽管科学界对转录过程进行了深入探讨,但翻译过程的复杂性却鲜有深入研究。mRNA的丰度无法直接等同于蛋白质合成效率,且动态调控机制(如翻译启停、速率波动)难以捕捉。直到 Ribo-seq(Ribosome profile sequencing,核糖体印记测序) 技术的诞生,科学家首次以单碱基分辨率“窥见”核糖体在mRNA上的实时活动,揭示了翻译过程的复杂性与精密性,推动了分子生物学、医学及合成生物学的范式变革,也为我们理解基因表达提供了全新的视角。

图1 mRNA翻译与核糖体蛋白合成。
(图片来源于Wikimedia Commons / LadyofHats (PD))。
01 什么是Ribo-seq?
Ribo-seq是一种通过捕获核糖体保护的RNA片段,解析细胞内实时翻译活动的高通量测序技术。与传统的RNA分析方法(如微阵列和RNA测序)不同,Ribo-seq专注于核糖体结合的RNA片段,从而直接反映翻译的动态变化。其核心原理基于核糖体对与之结合的约30 nt的RNA片段具有保护作用,当利用RNA酶消化细胞中的RNA后,被核糖体保护、正在翻译的RNA片段可以被富集,这些片段又被称为核糖体足迹(ribosome protected fragments,RPFs)。经过一系列提取、分离、纯化、建库、深度测序和分析,就能获得全面的、高质量的蛋白质翻译效率信息。此外,结合表观转录组、转录组、蛋白组等进行关联分析,可以更精确地研究转录后调控、翻译调控机制。
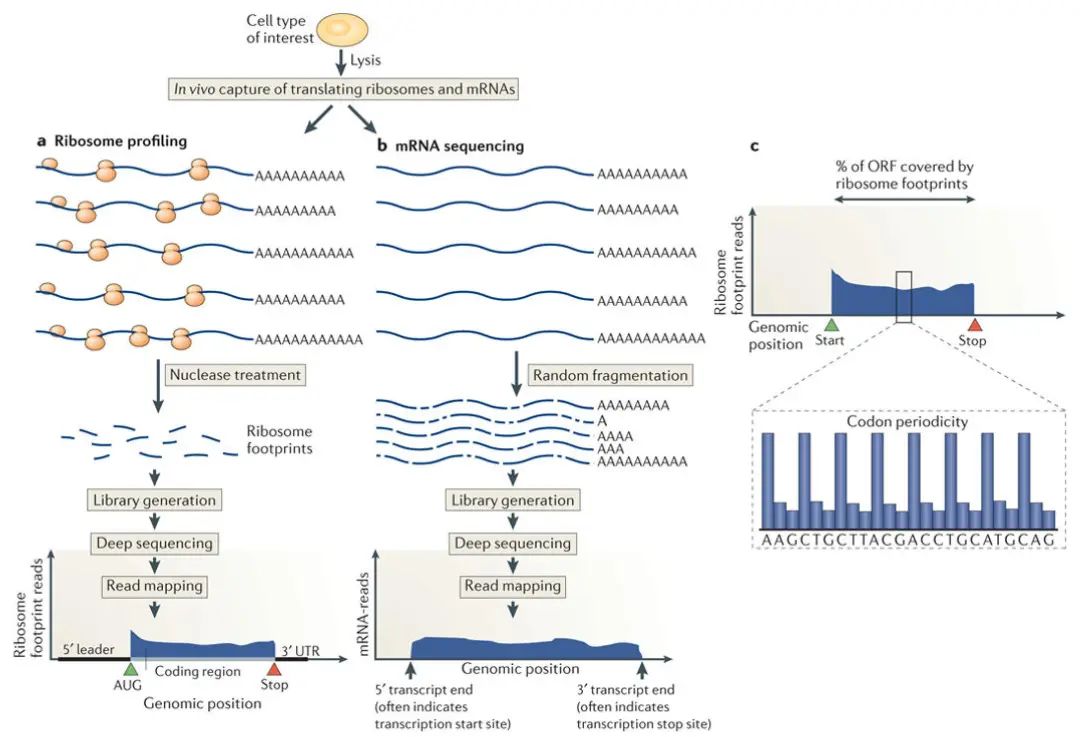
图2 核糖体足迹分析概述(Brar G A and Weissman J S., 2015)。
(a)Ribo-seq 流程图。(b)mRNA-seq流程图。(c)翻译的开放阅读框包含核糖体足迹。
02 Ribo-seq主要发现
1、翻译起始位点和终止位点的精准识别
传统方法(如生物信息学预测、体外报告系统)受限于动态调控、非经典起始密码子及核糖体扫描机制复杂性等难以精准定位体内翻译起始位点。且许多基因在翻译过程中可能存在多个起始位点,这种多样性可能与细胞状态和环境因素密切相关,Ribo-seq技术能够精确定位多种基因的翻译起始位点,为理解基因表达调控提供新的线索。另外Ribo-seq还能够精确识别翻译终止位点,揭示了许多提前或延后的终止现象。
技术优势
(1)高分辨率足迹:核糖体在起始位点滞留时间较长,形成密集的“起始峰”(Initiation Peaks),通过单碱基精度测序识别。
(2)周期信号分析:翻译起始后核糖体以3核苷酸为步长移动,起始位点下游呈现规律的周期性信号。
(3)序列上下文保守性:非经典起始密码子周围常存在保守的Kozak序列(如CUG起始常伴随“CCACCA”基序),辅助核糖体识别。
核心发现
(1)非经典起始密码子的广泛存在:除经典AUG起始密码子外,Ribo-seq揭示了CUG、GUG等近20种非经典起始密码子的功能活性。
(2)上游开放阅读框(uORF)的动态调控:uORF通过竞争核糖体调控主ORF的翻译起始,成为基因表达的关键“分子开关”。
(3)组织特异性与发育阶段依赖的起始位点:同一mRNA在不同细胞类型或发育阶段使用不同起始位点,产生功能迥异的蛋白异构体。
(4)疾病相关的异常起始位点激活:翻译起始失调与神经退行性疾病、癌症及代谢疾病密切相关(Kearse et al., 2019)。例如,富含亮氨酸重复激酶2(LRRK2)中的G2019S突变会导致家族性帕金森病,并且这种突变也存在于一些特发性病例中。研究表明G2019S LRRK2对mRNA翻译有显著影响,特别是促进了具有复杂5'端非AUG起始密码子的mRNA的翻译(Kim et al., 2021)。
应用案例

研究背景:真核生物基因的翻译过程受mRNA分子内特定结构特征的调控,尤其值得注意的是5'端前导序列中普遍存在的上游起始密码子(uAUGs)。这些uAUGs能够通过与翻译起始复合物的结合,替代主要起始密码子(mAUG)的功能,进而改变蛋白质合成的起始位点,最终导致下游mAUG的翻译受到抑制。
研究结果:研究揭示了一种新型翻译调控元件uAUG-ds,它能够调节uAUG与起始复合物的结合。在植物正常生长状态下,uAUG-ds通过促进起始复合物与uAUGs的结合,抑制下游主开放阅读框(mORF)的翻译进程,从而限制免疫相关蛋白的合成。然而,当植物遭遇免疫挑战时,RNA解旋酶会作用于uAUG-ds,使其双链结构发生解旋,这种结构变化导致uAUGs与起始复合物的结合被阻断,进而激活下游mORF的翻译机制,促进免疫蛋白的大量表达。
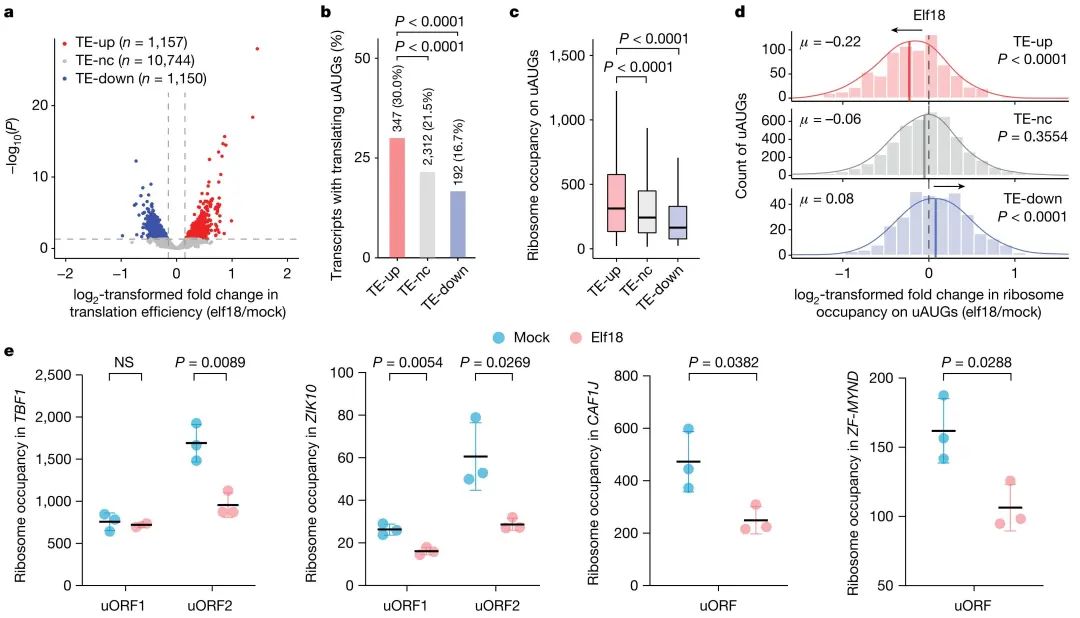
图3 含uORF的转录本的翻译动力学(Xiang et al., 2023)。
2、翻译速度的变化
Ribo-seq能够捕捉到翻译过程中的动态变化,如翻译暂停、翻译重启等事件,有助于研究翻译调控的新机制。
技术优势
(1)核糖体足迹密度分析:通过捕获核糖体保护的mRNA片段(称为“核糖体足迹”),生成核糖体在mRNA上的分布图谱。核糖体密度较高的区域通常表示翻译速度较慢,而密度较低的区域则表明翻译速度较快。
(2)识别核糖体在mRNA上的暂停位点,这些位点通常与翻译速度的降低相关。
(3)结合密码子使用分析揭示翻译速度与密码子使用偏好之间的关系。
核心发现
(1)Ribo-seq发现不同mRNA的翻译速度存在显著差异,即使在同一mRNA上,不同区域的翻译速度也可能不同。这种异质性可能与mRNA的序列特征(如密码子使用偏好)、二级结构或调控因子的结合有关(Tuller et al., 2010)。
——密码子使用对翻译速度的影响:稀有密码子(使用频率较低的密码子)往往会导致核糖体暂停,从而降低翻译速度。相反,高频密码子通常与更快的翻译速度相关。这种密码子使用偏好是调控翻译速度的重要机制。
——mRNA二级结构对翻译速度的调控:mRNA的二级结构(如茎环结构)可以显著影响翻译速度。核糖体在遇到复杂的二级结构时往往会暂停或减速。这种调控机制可能用于确保蛋白质的正确折叠或功能。
(2)Ribo-seq揭示了翻译速度在细胞内外环境变化时的动态性。例如,在应激条件下(如热休克或营养缺乏),某些mRNA的翻译速度会发生显著变化,这种动态调控是细胞适应环境变化的重要机制(Mir et al., 2024)。
(3)Ribo-seq发现翻译速度的变化可能影响蛋白质的功能。例如,缓慢的翻译速度可能有助于蛋白质的正确折叠,而快速的翻译速度可能导致错误折叠或功能缺失,表明翻译速度是基因表达调控的重要环节(Komar et al., 2024)。
分析示例

图4 起始密码子核糖体足迹分布
3、转录与翻译的复杂关系
技术优势
(1)翻译活性检测:Ribo-seq可以直接检测到正在被翻译的mRNA,通过分析这些mRNA的丰度和分布,能够了解细胞在特定条件下的翻译活性,即哪些基因在翻译水平上是活跃的。
(2)翻译效率计算:将Ribo-seq数据与RNA-seq数据联合分析,可以计算出每个基因的翻译效率,即单位转录本的翻译水平,有助于揭示转录和翻译之间的调控关系。
核心发现
(1)转录与翻译的协同调控网络:Ribo-seq揭示了转录与翻译的多层次交互机制,包括顺式元件、反式因子及表观遗传调控(Su et al., 2024)。
(2)转录与翻译的解耦:传统观点认为RNA丰度与蛋白质合成呈线性相关,Ribo-seq揭示了两者间的动态解耦机制,即使某些基因的转录水平相似,其翻译效率也可能显著不同。转录与翻译之间是存在独立的调控机制的,例如mRNA的稳定性、调控因子的结合或翻译起始的效率。
(3)疾病中的转录-翻译失调机制:Ribo-seq揭示了多种疾病中转录与翻译的异常交互,为精准治疗提供靶点。例如,于君团队通过Ribo-seq等多组学分析,发现YTHDF1在非酒精性脂肪性肝炎(NASH)-肝细胞癌(HCC)中通过促进EZH2的翻译,激活IL-6信号通路,从而促进肿瘤发生。靶向YTHDF1可提高抗单克隆抗体靶向程序性细胞死亡-1 (PD-1)免疫治疗的应答率,为NASH-HCC的精准治疗提供了新靶点(Wang et al., 2023)。
分析示例

图5 转录翻译九象限图
transcription only:基因仅在转录水平上存在差异,但它们的RPF水平没有显著差异;translation only:基因的两个等位基因仅在RPF水平上存在差异,但在转录水平上没有显著差异;opposite change:转录和翻译水平上出现反向变化;homodirectional:转录和翻译水平上出现同向变化;no change:剩下的无差异基因。
4、发现新的可翻译分子
Ribo-seq能够识别出一些传统方法无法发现的新的蛋白质编码基因,这些基因可能在特定的生物学过程中发挥重要作用,表明转录产物的功能可能比传统认知更加多样化,为基因表达调控和疾病研究提供了新的视角。
技术优势
(1)三碱基周期分析:对整个基因组进行三碱基周期性分析,识别出具有显著周期性的区域,这些区域可能是潜在的编码区。在翻译过程中的RNA序列,其三碱基周期图展现出“高-低-低”的显著分布模式,而普通RNA则不具备这种特征性的周期性规律。
(2)基于ORFfinder、Codon Usage Analyzer等工具评估编码能力。
核心发现
(1)短肽编码:Ribo-seq揭示了大量短开放阅读框(sORFs)的存在,这些sORFs编码功能性短肽,可能在细胞调控中发挥重要作用。
(2)长非编码RNA(lncRNA)的翻译:Ribo-seq发现某些lncRNA具有翻译潜力,可能编码功能性肽段或蛋白质,挑战了传统上对lncRNA非编码功能的认知。例如myoregulin(MLN)和mitoregulin等,它们在维持细胞稳态和参与病理过程(如癌症)中发挥着重要作用(Shiraishi T and Matsumoto A., 2024)。
(3)环状RNA(circRNA)的翻译:研究表明部分circRNA可以通过内部核糖体进入位点驱动翻译,扩展了对circRNA功能的理解(Lu et al., 2024)。
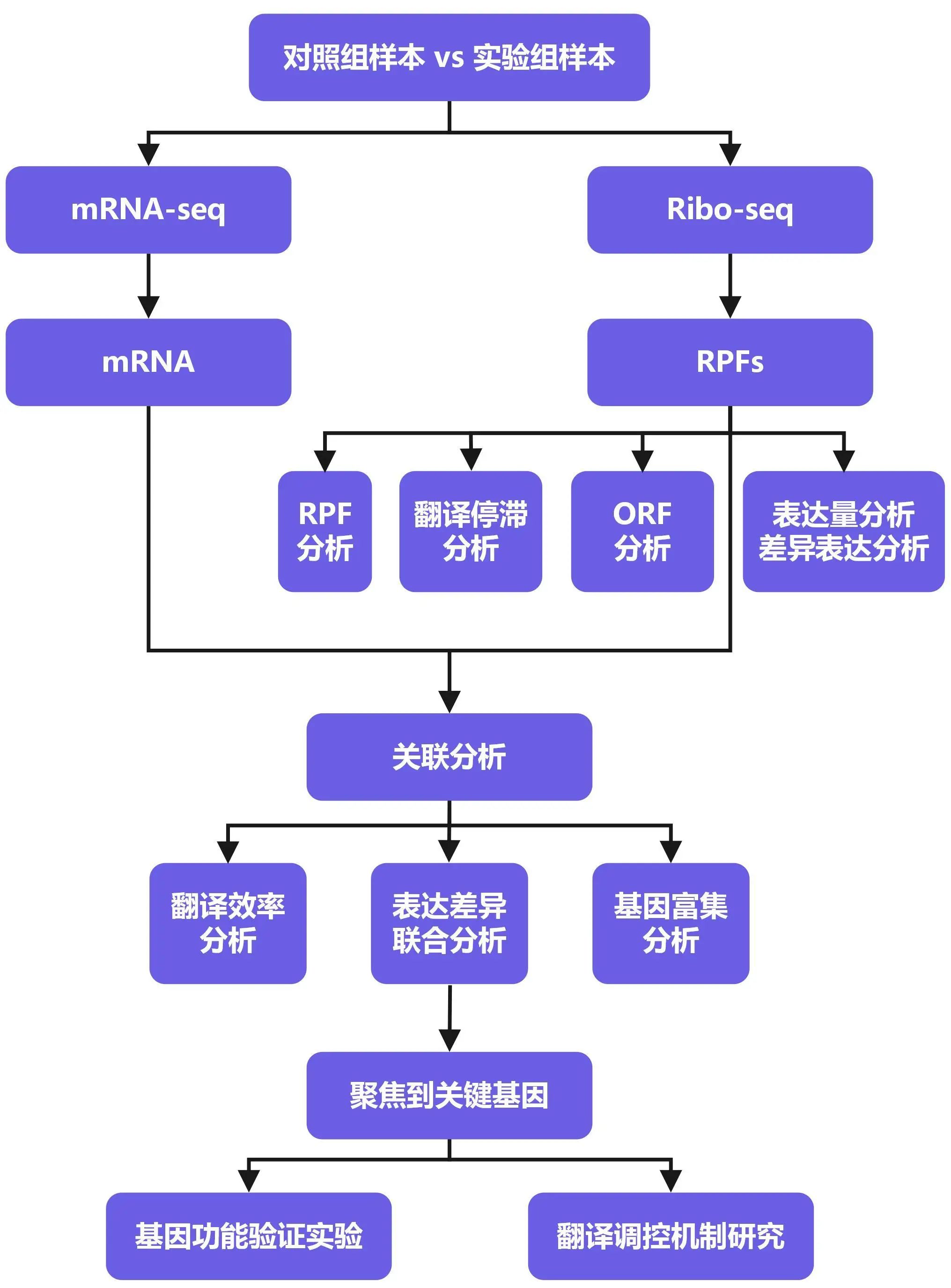
03 Ribo-seq研究思路
参考文献
[1] Brar G A, Weissman J S. Ribosome profiling reveals the what, when, where and how of protein synthesis[J]. Nature reviews Molecular cell biology, 2015, 16(11): 651-664.
[2] Xiang Y, Huang W, Tan L, et al. Pervasive downstream RNA hairpins dynamically dictate start-codon selection[J]. Nature, 2023, 621(7978): 423-430.
[3] Kim J W, Yin X, Martin I, et al. Dysregulated mRNA translation in the G2019S LRRK2 and LRRK2 knock-out mouse brains[J]. Eneuro, 2021, 8(6).
[4] Kearse M G, Goldman D H, Choi J, et al. Ribosome queuing enables non-AUG translation to be resistant to multiple protein synthesis inhibitors[J]. Genes & development, 2019, 33(13-14): 871-885.
[5] Tuller T, Carmi A, Vestsigian K, et al. An evolutionarily conserved mechanism for controlling the efficiency of protein translation. Cell, 2010, 141(2): 344-354.
[6] Mir D A, Ma Z, Horrocks J, et al. Stress-induced eukaryotic translational regulatory mechanisms[J]. ArXiv, 2024: arXiv: 2405.01664 v1.
[7] Komar A A, Samatova E, Rodnina M V. Translation rates and protein folding[J]. Journal of Molecular Biology, 2024, 436(14): 168384.
[8] Su D, Ding C, Qiu J, et al. Ribosome profiling: a powerful tool in oncological research[J]. Biomarker Research, 2024, 12(1): 11.
[9] Wang L, Zhu L, Liang C, et al. Targeting N6-methyladenosine reader YTHDF1 with siRNA boosts antitumor immunity in NASH-HCC by inhibiting EZH2-IL-6 axis[J]. Journal of hepatology, 2023, 79(5): 1185-1200.
[10] Shiraishi T, Matsumoto A. From non-coding to coding: The importance of long non-coding RNA translation in de novo gene birth[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2024: 130747.
[11] Lu Q, Wang S, Ye Y, et al. Systematic screen of RNA binding proteins that enhance circular RNA translation[J]. bioRxiv, 2024: 2024.11. 07.622558.
























 3526
3526

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








