基因编辑技术使科学家能够高效且精确地对生物体的基因组进行目标修饰,为研究基因功能、治疗遗传性疾病以及改良作物品种提供了强大的工具。其中 CRISPR/Cas9 系统是研究最深入,应用最成熟的一种高效的基因编辑工具。快来随小 M 一起盘点 CRISPR Cas9 基因编辑技术的发展和应用吧~

基因编辑 (Gene Editing) 是指通过基因编辑技术对生物体基因组特定目标进行修饰的过程。
基因编辑技术自问世以来,已经实现了从第一代锌指核酸酶 (Zinc finger nucleases, ZFNs) 到第二代转录激活样效应因子核酸酶 (Transcription activator-like effector nucleases, TALENs) 的跨越,并最终发展至当前的第三代 CRISPR/Cas 系统。CRISPR/Cas 技术以其卓越的编辑效率、简便的操作流程以及高度的精确度,成为基因编辑领域的主导技术,在基因筛选、模型构建、机制研究中发挥了不可替代的作用[1][2]。

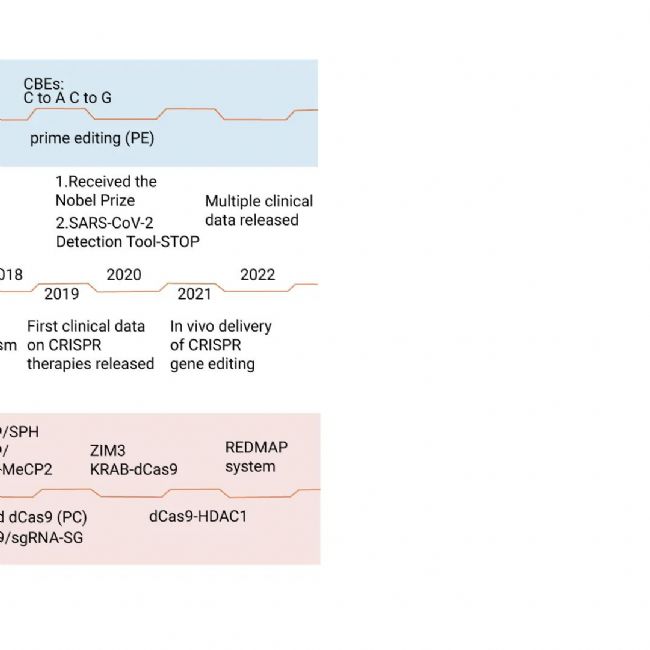
图 1. CRISPR/Cas 相关的基因编辑技术发展历程[3]。
CRISPR 位点和 Cas 基因分别于 1987 年和 2002 年被发现。2005 年,通过 RNA 测序发现,细菌的 CRISPR 基因座含有许多来自噬菌体和其他染色体外元素的间隔物。2007 年,CRISPR/Cas 系统被证实介导原核生物对噬菌体的适应性免疫。2012 年,证实了由 tracrRNA 和成熟 crRNA 形成的双 RNA 结构指示 Cas9 在靶位点切割 DNA。2013 年,Type II CRISPR/Cas 在哺乳动物细胞中实现了内源性基因组位点的精确编辑。在随后的几年中,几种基于 CRISPR/Cas9 的基因编辑工具的出现,极大地提高了基因组编辑的精度,扩大了其应用范围。2016 年,CRISPR/Cas9 基因编辑工具首次应用于临床治疗,随后的临床试验为人类探索癌症治疗提供了新的见解。
在基因编辑技术的快速发展中,Ⅱ 型 CRISPR-Cas9、CRISPR-Cas12a (Cpf1) 以及 CRISPR/Cas13 系统因其卓越的性能和特异性而成为研究的热点。这些系统不仅提高了基因编辑的效率和准确性,也为解决复杂的遗传问题提供了新的工具。
同时,基于 CRISPR/Cas 平台的单碱基编辑技术 (Base Editing, BE) 和先导编辑技术 (Prime Editing, PE),以其无需双链 DNA 断裂即可实现精确的基因组编辑的能力,为基因治疗和生物医学研究带来了革命性的变革[3]。

▐ CRISPR/Cas 基因编辑的工作原理:
(1) 原核生物获得入侵病毒或质粒的细胞记忆。感染后,入侵者的 DNA 序列以间隔阵列的形式整合到宿主 CRISPR 基因座中,间隔阵列两侧是重复序列,根据序列提供特定的噬菌体抗性。
(2) RNA 聚合酶从 CRISPR 位点的间隔区产生 RNA,称为前 CRISPR RNA (前 crRNA)。前 crRNA 转录同时,来自 CRISPR 基因座上游的反式激活 crRNA (tracrRNA) 被转录以实现两个基本功能:诱导 RNase III 酶的前 crRNA 成熟,以及激活 crRNA 引导的 DNA 裂解。
(3) tracrRNA&crRNA 复合物加载到 CRISPR 相关核酸酶 9 (Cas9) 上,形成活性核糖核蛋白 (RNP) 复合物。双链 RNA结构指示 Cas9 在与 crRNA 间隔序列互补的位点处引入 DNA 双链断裂 (DSB)。CRISPR 和 Cas9 共同在细菌抵抗噬菌体感染和质粒结合方面发挥协同作用(具体过程如图 2 所示)[4]。

图 2. Ⅱ 型 CRISPR/Cas9 基因编辑技术的工作原理[4]。
a. 在获取阶段,被噬菌体感染后,来自入侵者的 DNA 序列以间隔序列的形式整合到宿主 CRIPSPR 位点中,并以重复序列为间隔。b. 在转录阶段,转录出 pre-crRNA,随后 pre-crRNA 被切割产生成熟的 crRNA,每个 crRNA 由针对入侵者的重复序列和间隔序列组成。c. 在干扰阶段,Cas 蛋白直接在与 crRNA 间隔序列互补的位点切割外源核酸。
为了在靶细胞中实现精确的基因组编辑,CRISPR/Cas 系统的核心组件— Cas9 蛋白和导向 RNA (gRNA),必须有效地进入细胞核。
CRISPR/Cas9 系统的递送主要通过 3 种形式:
- 递送编码 Cas9 和 sgRNA 的质粒 DNA,如 pX330、pX458 和 pX459 等;
- 递送 mRNA 和 sgRNA 元件,mRNA 通过在细胞质中的翻译过程转化为 Cas9 核酸酶;
- 递送RNP (Ribonucleoprotein,Cas9 蛋白和 sgRNA 复合物) ,此方法绕过了转录和翻译的过程,可产生最快的基因编辑效果 (图 3)。
然而,mRNA 分子的不稳定性及易降解性限制了其在基因编辑中的应用。同时,将 Cas9 蛋白与效应蛋白协同递送以实现基因编辑的功能也面临挑战。
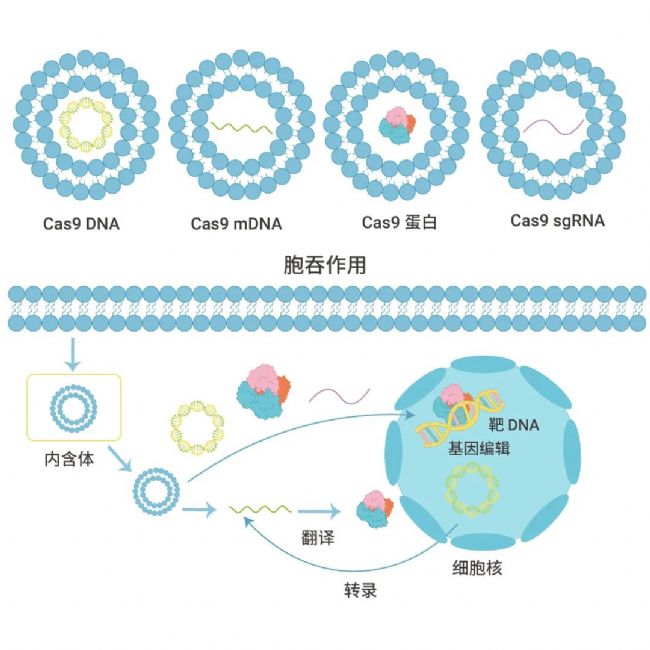
图 3. 不同纳米载体用于递送不同形式的 Cas9/gRNA 元件及其胞内工作原理示意图[5]。
递送系统的选择和优化是 CRISPR 技术的编辑效率提升的关键因素之一。有效、安全地将 CRISPR 组件递送到目标细胞中,是实现高效基因编辑的前提。
针对目前最热的 CRISPR/Cas9 系统,开发了很多递送系统,包括物理方法、病毒载体以及非病毒载体。
表 1. CRISPR/Cas9 递送的物理方法和生物方法[5]。

虽然病毒载体转染效率很高,但是安全性 (如致癌、插入突变和免疫原性) 仍值得注意,且不适用于大规模生产。同时,Cas9 质粒的大小通常约为 8 kb 或更大,而 AAV 病毒载体包裹质粒的大小约为 4.5 kb,LV 病毒载体包裹质粒的大小约为 8 kb,严重限制了 AAV 病毒载体的应用范围。此外,病毒载体不能准确定位病变部位,常造成正常组织器官损伤,甚至危及患者生命[5]。
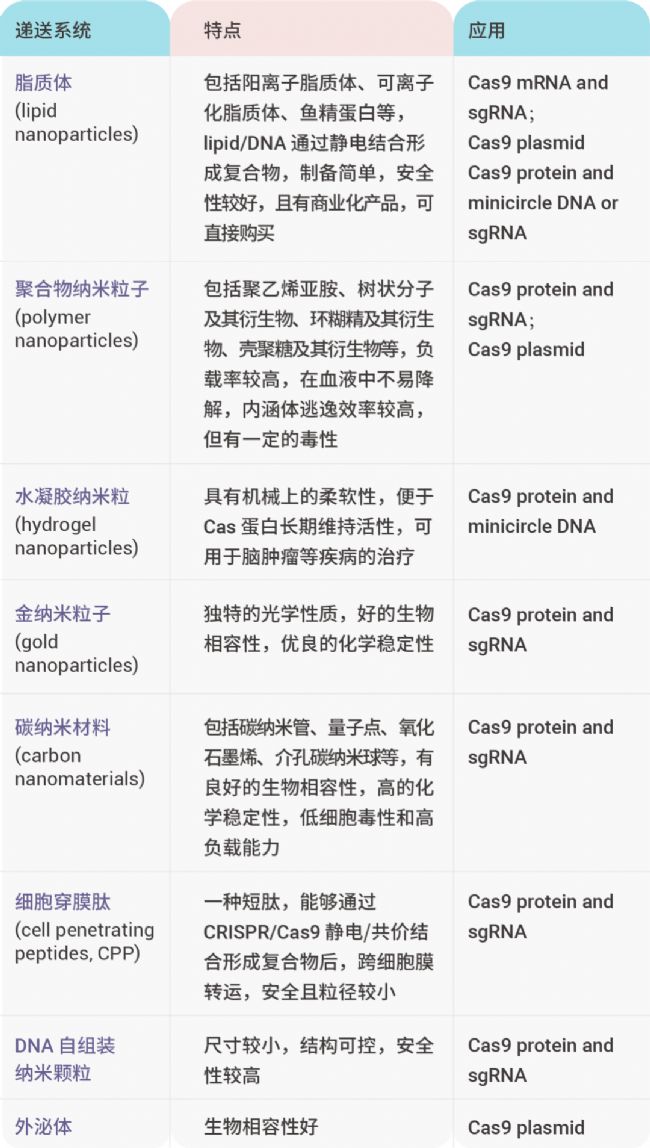
因此,基于纳米技术、生物材料、药剂学、生物医学等多学科交叉研究和发展的非病毒载体更具潜力。特别是在生物安全、装载和包裹能力方面,非病毒载体在 CRISPR/Cas9 的基因治疗研究中具有广阔的应用前景 (表 2)[5]。
表 2. 非病毒载体递送 CRISPR/Cas9 系统的特点及应用[5]。

▐ 癌症
癌症的进展往往伴随着关键基因表达模式的显著改变,如肿瘤抑制基因 P53、细胞信号通路关键分子 Notch 以及免疫检查点分子 PD-L1 等。这些基因的异常表达在肿瘤细胞的生长、侵袭和免疫逃逸中扮演着关键角色。同时,肿瘤微环境的异常变化也对肿瘤细胞的生物学行为产生深远影响。
鉴于此,CRISPR 技术提供了一种潜在的策略,通过基因沉默或过表达来调控肿瘤细胞中异常表达的基因。
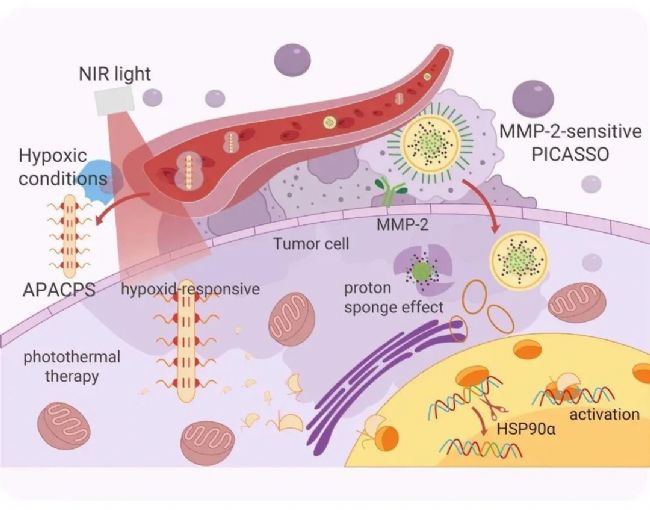
图 4. 外用 NIR 诱导的光热疗法杀死肿瘤细胞[3]。
Li 等人构建了一种基于金纳米棒的低氧响应纳米颗粒,该纳米颗粒携带 CRISPR/Cas9 系统靶向 HSP90α 进行敲除载体进入肿瘤细胞后,Cas9/sgRNA RNP 被释放到细细胞中,使 HSP90α 沉默,使细胞失去耐热性,随后使用 NIR light 进行肿瘤杀灭 (图 4)。
▐ 心血管疾病
心血管疾病,如动脉粥样硬化、心肌肥大、心肌梗死和主动脉夹层,构成了全球健康的主要威胁。心脏和血管系统具有快速的血流和较高的血压,这些生理特性要求我们在设计和开发针对心血管疾病的纳米药物递送系统时,必须考虑到血流动力学的影响,以确保药物的有效递送和治疗效率。
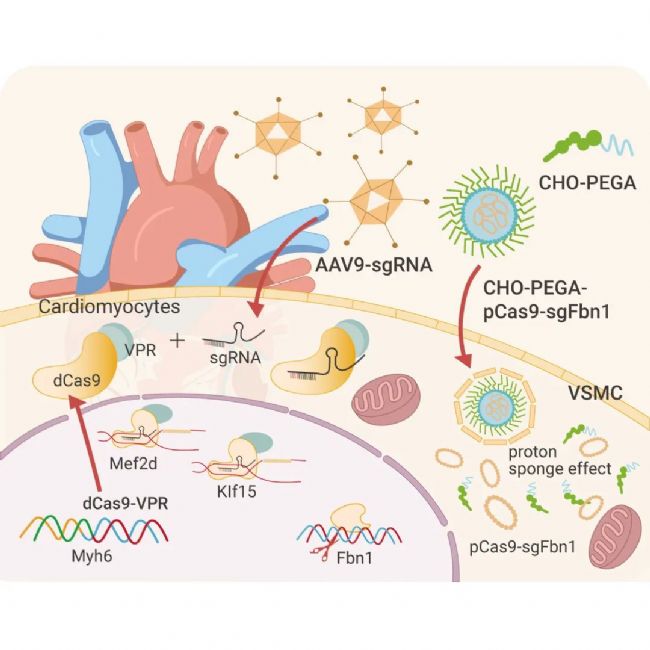
图 5. AAV9 将靶向 Mef2d 和 Klf15 的 sgRNA 传递到 dCas9-VPR 转基因小鼠中[3]。
Schoger 等首先构建了 dCas9/VPR 转基因小鼠,将此序列插入肌球蛋白重链 Myh6 启动子后,与 Myh6 协同转录。由于 Myh6 是心肌细胞特异性基因,dCas9/VPR 系统的表达只发生在心肌细胞中。随后注射携带 sgRNA 的 AAV9,激活细胞内心肌细胞增殖相关基因的转录[3]。
利用此方法获得了心肌细胞特异性的表达激活系统,并可控制转录激活的时机,为心血管研究或其他难以直接接触的器官或组织研究提供了重要参考。
▐ 镰状细胞病
镰状细胞病由成人血红蛋白 β-珠蛋白亚基的基因突变引起,导致产生镰状血红蛋白,这种血红蛋白在缺氧条件下聚合,使红细胞变形、变硬并易碎,导致微血管阻塞、溶血和炎症。胎儿血红蛋白水平的升高可以保护免受镰状细胞病并发症的影响 (HBG1 和 HBG2 基因编码 γ-珠蛋白,是胎儿血红蛋白的组成部分)。
研究人员分别将 72 种不同的 gRNA 分布在 HBG1 和 HBG2 基因的启动子区域上。然后,将 Cas9 蛋白与这些 gRNA 复合体转入健康供体的 CD34+ 细胞,并评估分化后的红细胞前体细胞中胎儿血红蛋白免疫染色的红细胞 (F 细胞) 的比例[2]。

图 6. Cas9-gRNA-68 组成的核糖核蛋白复合物的靶向位点[2]。
在筛选过程中,发现 gRNA-68 产生的 F 细胞水平最高。三名严重镰状细胞病患者在接受 CRISPR/Cas9 编辑的 CD34+ 造血干/祖细胞输注后,红细胞中胎儿血红蛋白的稳定诱导和疾病严重程度的临床改善。表明 CRISPR-Cas9 对 HBG1 和HBG2 基因启动子的编辑是一种有效的策略,用于诱导胎儿血红蛋白的产生[3]。
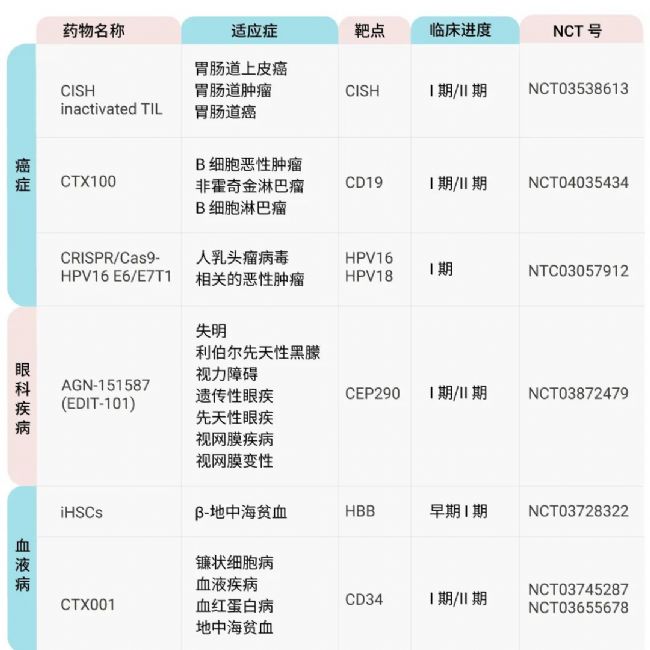
此外,目前已有多种 CRISPR/Cas 药物进入到临床研究 (表 3)[5]。
表 3. CRISPR/Cas 药物临床及临床前研究 (部分)[5]。


今天给大家盘点了 CRISPR/Cas 技术,以及各种递送载体的优缺点,主要给大家介绍了 CRISPR/Cas 在疾病中的应用,大家可以根据自己的研究领域选择合适的 CRISPR/Cas 相关技术!

| CL4F8-6 可电离的阳离子脂质, 可携带 Cas9 mRNA 和 sgRNA 诱导小鼠体内 CRISPR 介导的基因敲除。 |
| LZCap AG(3'Acm) Cas9 mRNA 与纯化的 sgRNA 一起使用,通过表达的 Cas9 蛋白与sgRNA 一起发挥切割功能。 |
| BRD0539 CRISPR/Cas9 小分子抑制剂,可有效抑制 SpCas9。 |
| TT3 一种可电离的类脂材料,用于 mRNA 和 CRISPR/Cas9 的递送。 |
| 80-O14B 一种用于 CRISPR/Cas9 递送的阳离子脂质样化合物。 |
参考文献:
[1] Liu Z, et al. Recent advances and applications of CRISPR-Cas9 in cancer immunotherapy[J]. Molecular Cancer, 2023, 22(1): 35.
[2] Sharma A, et al. CRISPR-Cas9 editing of the HBG1 and HBG2 promoters to treat sickle cell disease[J]. New England Journal of Medicine, 2023, 389(9): 820-832.
[3] Li T, et al. CRISPR/Cas9 therapeutics: progress and prospects[J]. Signal Transduction and Targeted Therapy, 2023, 8(1): 36.
[4] Wang S W, et al. Current applications and future perspective of CRISPR/Cas9 gene editing in cancer[J]. Molecular cancer, 2022, 21(1): 57.
[5] ZHAO ZX, et al. Delivery and application progresses of CRISPR/Cas gene editing system. Progress in Biochemistry and Biophysics, 2020, 47(4): 286-299 (in Chinese).





















 395
395











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








