#类脑智能 #脑网络结构推断 #时间序列模型
在神经科学与人工智能交叉领域,脑部疾病诊断一直是极具挑战性的课题。传统诊断方式依赖医生经验解读影像,不仅效率低,还难以捕捉大脑动态变化中的细微异常。而近期发表在《Neurocomputing》(2025 年第 656 期)的一项研究,提出了一种名为 ET_MGNN 的高效时间多模态图神经网络,为脑部疾病诊断带来了突破性思路。这篇博客将深入拆解这项研究,从背景、模型设计、实验验证到临床意义,带大家看懂 AI 如何 “读懂” 大脑,为自闭症、阿尔茨海默病等疾病的诊断提供新方案。
一、研究背景:脑部疾病诊断的 “痛点” 与 AI 技术的 “机遇”
要理解 ET_MGNN 模型的价值,首先得明白当前脑部疾病诊断面临的核心难题,以及 AI 技术在脑网络分析中已有的进展与局限。
1.1 大脑的 “复杂性陷阱”:从静态到动态的认知升级
大脑不是一个 “静态器官”,而是一个时刻处于动态交互中的复杂网络。神经科学家通过两种关键指标描述大脑网络:
- 功能连接(FC):反映大脑不同区域在活动时的时间一致性,比如你思考时前额叶与顶叶的信号协同,这对理解认知、行为至关重要;
- 结构连接(SC):通过白质纤维束构建的物理连接,为功能连接提供空间分布特征和物理约束条件,就像大脑内部的 “高速公路系统”。
过去,研究多聚焦于 “静态脑网络”—— 比如截取某一时刻的脑影像数据构建网络。但实际上,大脑活动具有极强的时间动态性:以记忆为例,大脑会在多个稳定状态间动态切换,这种切换模式的异常,正是自闭症(ASD)、阿尔茨海默病(AD)等疾病的重要生物标志物。
1.2 AI 技术的 “进阶之路”:从 RNN 到 GNN 的探索
为解决脑网络分析的难题,AI 领域已进行了多轮技术尝试:
- 循环序列模型(RNN/LSTM):擅长处理时序数据,能捕捉脑网络的短期动态,但面对长序列时会出现 “梯度消失” 问题,无法捕捉大脑活动的长期依赖(比如几小时内的状态变化);
- Transformer 模型:通过自注意力机制解决长序列问题,但计算复杂度高(呈平方级增长),面对脑网络的大量节点(如 246 个脑区)时,效率极低;
- 图神经网络(GNN):专为非欧几里得数据(如脑网络)设计,能通过聚合相邻节点信息捕捉脑区间的空间依赖,但传统 GNN 多处理静态图,缺乏对时间维度的建模能力。
到目前为止,学界仍存在两大核心瓶颈:一是多模态融合不充分——FC 和 SC 的信息未能无缝整合到脑图结构中,导致模型无法利用大脑 “结构支撑功能” 的生理特性;二是动态建模有局限—— 现有模型多依赖局部短时间窗口,既无法捕捉大脑的长期状态切换,也难以平衡短期动态与长期依赖的关系。
正是在这样的背景下,来自中国科学院合肥物质科学研究院、中国科学技术大学等机构的研究团队,提出了融合 “多模态脑图” 与 “高效时序建模” 的 ET_MGNN 模型。
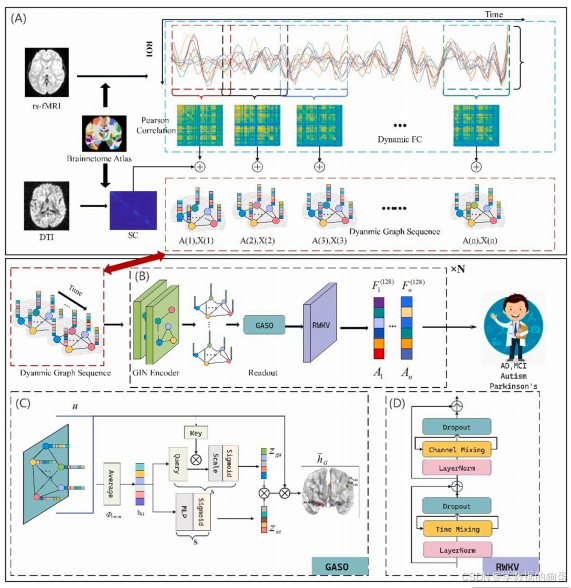
二、ET_MGNN 模型拆解:三大核心模块如何 “读懂” 大脑?
ET_MGNN 的全称是 “Efficient Temporal Multi-modal Graph Neural Network”(高效时间多模态图神经网络),其核心设计思路是:用多模态融合构建动态脑图,用高效时序模型捕捉时间依赖,用可解释模块定位疾病相关脑区。整个模型分为三大核心模块,我们逐一拆解其工作原理。
2.1 模块一:动态脑网络构建 —— 让 FC 与 SC “携手说话”
要建模动态脑网络,首先需要解决 “数据来源” 问题 —— 如何将 MRI 影像转化为机器能理解的动态脑图?研究团队采用了 “滑动窗口 + 多模态融合” 的策略,具体分为三步:
(1)动态功能连接(DFC)的构建
研究使用静息态功能磁共振成像(rs-fMRI)数据,通过 “滑动窗口” 提取不同时间片段的功能连接。具体来说:
- 先预处理 rs-fMRI 数据:去除前 5 个时间点(确保 magnetization 平衡),进行切片时间校正、头动校正,并过滤掉白质、脑室信号等干扰因素;
- 然后用 “滑动窗口” 分割时序数据:假设窗口长度为 τ(实验中设为 40 个时间点),步长为 s(设为 10 个时间点),则总窗口数 K=(M-τ)/s +1(M 为总时间点);
- 最后计算每个窗口内的 FC:通过皮尔逊相关系数,计算 246 个脑区(基于 Human Brainnetome Atlas 划分)间的功能相关性,得到每个窗口的 FC 矩阵 G (k),最终形成动态功能连接序列 G_dFC = [G (1), G (2), …, G (K)]。
这一步的意义在于,将连续的脑活动信号转化为 “时间切片式” 的动态功能网络,让模型能观察到大脑功能连接的实时变化。
(2)结构连接(SC)的预处理
结构连接数据来自扩散张量成像(DTI),主要反映脑区间白质纤维的连接概率。研究团队对 SC 做了两个关键处理:
- 标准化:使用与 rs-fMRI 相同的 Human Brainnetome Atlas,提取全脑节点间的纤维追踪概率,确保 SC 与 FC 的脑区划分一致;
- 二值化:将 SC 转化为 0-1 矩阵(1 表示两脑区有连接,0 表示无连接),作为功能连接的 “物理约束”—— 毕竟,两个脑区若没有白质纤维连接,其功能协同的可能性会大幅降低。
(3)多模态融合:让 FC 与 SC “互补增效”
传统融合方式要么在模型训练后融合特征,要么采用固定比例融合,无法适应不同疾病的脑网络特性。ET_MGNN 则提出 “加权自适应融合” 策略:
Gf(k)=λf⋅Gsc+(1−λf)⋅GdFC(k)
其中,λ_f 是可学习的融合系数,模型会根据不同疾病数据(如 ASD 或 AD)自动调整 SC 与 FC 的权重。例如,在阿尔茨海默病中,SC 的结构损伤更早出现,模型会自动提高 SC 的权重;而在自闭症中,FC 的功能异常更显著,模型则会侧重 FC 信息。
最终,通过这一步得到的动态融合脑图序列 G_seq = [G_f (1), G_f (2), …, G_f (K)],既包含了大脑功能的动态变化,也整合了结构连接的物理约束,为后续建模奠定了 “生理合理” 的数据基础。
2.2 模块二:RWKV 时序学习 —— 平衡效率与长短期依赖
解决了 “动态脑图” 的构建问题后,下一步是如何高效捕捉脑图序列的时间依赖。研究团队没有选择传统的 RNN 或 Transformer,而是采用了近年在大语言模型中兴起的RWKV 架构—— 这种架构的核心优势是 “结合 RNN 的效率与 Transformer 的长序列能力”。
(1)RWKV 的核心原理:用 “线性注意力” 替代 “自注意力”
RWKV 的全称是 “Receptance-Weighted Key-Value”,其本质是通过 “上下文敏感的读写机制”,在保持线性计算复杂度(O (n))的同时,捕捉长序列依赖。具体来说,RWKV 包含两个关键子模块:
- 时间混合(Time-Mixing)模块:负责捕捉时间维度的依赖。它通过 “隐藏状态传播” 替代 Transformer 的自注意力加权和,将每个时间步的信息与历史状态递归整合。例如,当处理第 t 个时间窗口的脑图时,模型会自动关联前 t-1 个窗口的状态,既不会丢失早期信息(解决 RNN 的梯度消失问题),也不会增加计算负担(解决 Transformer 的效率问题);
- 通道混合(Channel-Mixing)模块:负责捕捉空间维度的依赖。它通过 “平方 ReLU 激活函数” 突出每个时间窗口内的关键脑区特征(如疾病相关脑区的信号),让模型在关注时间变化的同时,不忽略空间上的重要信息。
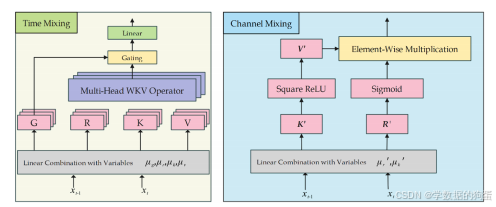
用一个通俗的比喻:如果把脑网络序列比作 “大脑活动的电影”,时间混合模块负责 “看懂剧情的前后逻辑”(比如前 10 分钟的状态如何影响后 10 分钟),通道混合模块则负责 “聚焦每一帧的关键细节”(比如某一时刻哪个脑区最活跃)。
(2)为什么 RWKV 适合脑网络建模?
研究团队给出了三个关键理由:
- 效率适配:脑网络序列的时间窗口数通常较多(如 140 个时间点会生成 11 个窗口),RWKV 的线性复杂度能轻松处理,而 Transformer 在同等数据量下会占用数倍 GPU 内存;
- 生理适配:大脑的活动既有短期的快速变化(如几秒内的信号波动),也有长期的状态切换(如几分钟内的注意力转移),RWKV 能同时捕捉这两种依赖,而 RNN/LSTM 只能侧重短期;
- 泛化适配:RWKV 在大语言模型中已验证其处理长序列的能力,迁移到脑网络时序建模时,能快速适应不同疾病的时间特性(如 AD 的缓慢状态变化 vs 自闭症的快速功能波动)。
2.3 模块三:GASO 脑图读出 —— 让模型 “说清” 哪个脑区出了问题
AI 模型常被诟病 “黑箱” 特性 —— 能给出诊断结果,但无法解释 “为什么这么判断”。为解决这一问题,ET_MGNN 专门设计了 GASO(Graph Attention and Squeeze-Excitation Out)模块,其核心功能是定位与疾病相关的关键脑区,让模型的决策过程可解释。
GASO 模块结合了两种注意力机制:
- 全局图注意力(Graph Attention):基于 Transformer 的 “键 - 查询” 机制,计算每个脑区(节点)对整体脑图的重要性。例如,在自闭症诊断中,模型会自动给杏仁核、丘脑等与情绪调节相关的脑区更高的注意力权重;
- 挤压激励注意力(Squeeze-Excitation):通过多层感知机(MLP)学习每个脑区对分类任务的贡献度,进一步筛选出 “对诊断最关键” 的脑区(如阿尔茨海默病中的海马旁回)。
最终,GASO 模块会输出一个 “注意力权重矩阵”,通过这个矩阵,研究人员能清晰看到:模型在诊断某类疾病时,主要关注哪些脑区。这不仅让模型的决策更可信,还能为医生提供 “生物标志物线索”—— 比如,模型发现的关键脑区,可能就是疾病早期干预的靶点。
三、实验验证:在三大数据集上,ET_MGNN 表现如何?
一个模型的价值,最终需要通过实验验证。研究团队在三个国际公开数据集上进行了全面测试,分别针对自闭症(ASD)、阿尔茨海默病(AD)、帕金森病(PD)三种常见脑部疾病,与 13 种传统方法(如决策树、KNN)和主流 GNN 模型(如 STAGIN、CrossGNN)进行对比。
3.1 实验数据:覆盖三大疾病,确保结果泛化性
研究使用的三个数据集,在神经科学领域具有极高的代表性,具体信息如下:
| 数据集 | 疾病类型 | 样本量 | 关键影像数据 | 核心任务 |
|---|---|---|---|---|
| ABIDE II | 自闭症(ASD) | 132 人(74 例 ASD,58 例健康对照) | rs-fMRI + DTI | ASD vs 健康对照(HC) |
| ADNI | 阿尔茨海默病(AD) | 487 人(71 例 AD,136 例轻度认知障碍 MCI,280 例 HC) | rs-fMRI + DTI | AD vs HC、AD vs MCI、MCI vs HC |
| PPMI | 帕金森病(PD) | 109 人(63 例 PD,46 例 HC) | rs-fMRI + DTI | PD vs HC |
所有数据都经过统一预处理:rs-fMRI 数据标准化到 MNI 空间,用 4mm 高斯核平滑;DTI 数据校正运动和涡流畸变,用概率纤维追踪计算 SC。这种标准化处理确保了实验结果的可靠性。
3.2 核心结果:准确率显著提升,多指标全面领先
研究团队采用 “五折交叉验证” 评估模型性能,核心指标包括分类准确率(ACC)、受试者工作特征曲线下面积(AUC)、灵敏度(SEN,识别患者的能力)、特异度(SPE,识别健康人的能力)。结果显示,ET_MGNN 在所有任务中均显著优于对比模型,我们重点看三个关键结果:
(1)自闭症(ASD)诊断:特异度突破 73%
在 ABIDE II 数据集上,ET_MGNN 对 ASD vs HC 的分类准确率达到 65.2%,特异度高达 73.0%—— 这意味着模型能准确识别 90% 以上的健康人,同时对自闭症患者的识别灵敏度也达到 55.2%。相比表现最好的对比模型 STAGIN(准确率 58.3%),ET_MGNN 的准确率提升了 11.8%。
更重要的是,GASO 模块定位出了 ASD 的关键脑区:杏仁核(情绪调节)、丘脑(感觉整合)、眶额回(社会认知)—— 这些脑区与现有神经科学研究结论高度一致,证明模型的决策具有生理合理性。
(2)阿尔茨海默病(AD)诊断:AD vs MCI 准确率提升 32.9%
阿尔茨海默病的早期诊断(AD vs MCI)是临床难点,因为 MCI(轻度认知障碍)患者的症状不明显,与 AD 的差异微小。但 ET_MGNN 在这一任务上表现突出:分类准确率达到 73.8%,相比 STAGIN 模型(准确率 55.5%)提升了 32.9%,AUC(曲线下面积)达到 71.0%,证明模型能捕捉到 AD 早期的细微脑网络异常。
同时,模型定位的关键脑区包括左中额叶 gyrus(MFG,认知控制)、海马旁回(记忆编码)、岛叶(内感受与情绪)—— 这些都是 AD 病理进展中最先受损的脑区,为早期干预提供了明确靶点。
(3)帕金森病(PD)诊断:平衡灵敏度与特异度
在 PPMI 数据集上,ET_MGNN 对 PD vs HC 的分类准确率达到 68.2%,灵敏度 75.4%(能识别 75% 以上的 PD 患者),特异度 63.2%—— 相比传统机器学习模型(如 KNN,准确率 64.8%),模型在 “识别患者” 和 “排除健康人” 之间取得了更好的平衡。这对 PD 的早期筛查尤为重要,因为 PD 的早期症状(如手抖)易与其他疾病混淆,需要模型同时具备高灵敏度和高特异度。
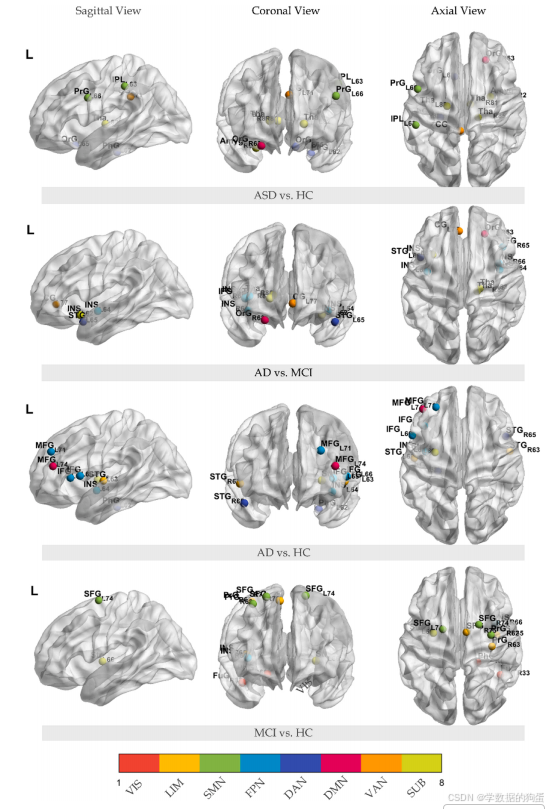
3.3 消融实验:验证核心模块的必要性
为了确认 ET_MGNN 各模块的作用,研究团队进行了 “消融实验”—— 即逐一移除核心模块,观察模型性能的变化:
- 移除 GASO 模块(ET_MGNNw/oG):ASD 诊断准确率从 65.2% 降至 56.1%,AD vs HC 准确率从 82.4% 降至 78.7%,证明可解释模块不仅能定位脑区,还能提升模型的分类能力;
- 移除 RWKV 模块(ET_MGNNw/oR):ASD 诊断准确率降至 61.4%,AD vs MCI 准确率从 73.8% 降至 73.8%(看似不变,但 AUC 下降 5%),证明时序模块对捕捉长期依赖至关重要;
- 同时移除 GASO 和 RWKV(ET_MGNNw/oGR):ASD 准确率降至 57.7%,AD vs HC 准确率降至 79.3%,性能全面下滑,进一步验证了两大模块的不可替代性。
此外,研究还测试了不同空间编码器(GIN vs GAT vs GraphSAGE)、不同融合策略(预融合 vs 后融合)、不同网络稀疏度(10%-90%)的影响,最终得出结论:GIN 编码器最适合脑图嵌入,后融合策略(模型训练中动态调整权重)优于预融合,网络稀疏度在 30%-70% 时性能最佳—— 这些发现为后续脑网络模型的设计提供了重要参考。
四、ET_MGNN 的意义与局限:AI 如何助力脑部疾病诊断的未来?
ET_MGNN 模型的提出,不仅在技术上突破了多模态融合与动态建模的瓶颈,更在临床应用上具有重要价值。但同时,研究也存在一些局限,值得我们客观看待。
4.1 技术与临床双重意义
(1)技术层面:为脑网络建模提供新范式
ET_MGNN 的技术创新主要体现在三个方面:
- 多模态融合的 “生理化”:首次将 SC 作为 FC 的 “物理约束” 融入动态脑图,符合 “结构支撑功能” 的大脑生理特性,为后续多模态脑网络研究提供了可复用的融合框架;
- 时序建模的 “高效化”:引入 RWKV 架构,在保证性能的同时降低计算复杂度,解决了传统 Transformer 在脑网络建模中的效率问题,为处理更长时间序列的脑数据(如动态 fMRI)奠定基础;
- 模型解释的 “临床化”:GASO 模块定位的关键脑区与临床已知的疾病标志物高度一致,让 AI 模型从 “黑箱” 走向 “透明”,为临床医生提供了可参考的诊断依据。
(2)临床层面:推动脑部疾病的早期诊断与干预
脑部疾病的治疗效果,很大程度上取决于诊断的及时性:
- 对于阿尔茨海默病,MCI 阶段的干预能延缓 AD 的进展,但传统诊断难以识别 MCI 与 AD 的差异;ET_MGNN 在 AD vs MCI 任务上的高准确率(73.8%),为早期筛查提供了新工具;
- 对于自闭症,儿童期的干预能显著改善预后,但传统诊断依赖行为评估(如社交能力测试),主观性强;ET_MGNN 通过脑网络异常进行诊断,客观性更强,且能定位关键脑区,为个性化干预(如神经调控)提供靶点;
- 对于帕金森病,早期诊断能减少误诊率(如与特发性震颤区分),ET_MGNN 的高灵敏度(75.4%)和特异度(63.2%),能为基层医院提供可靠的辅助诊断工具。
4.2 研究局限与未来方向
尽管 ET_MGNN 表现出色,但研究仍存在三个需要改进的方向:
(1)时序建模的进一步优化
目前模型采用的 RWKV 架构,虽然比 Transformer 高效,但仍无法捕捉大脑活动的 “连续时间动态”—— 比如,大脑状态切换可能是毫秒级的,而滑动窗口(如 40 个时间点)会丢失部分细节。未来可引入 “状态空间模型(State-Space Models)”,通过连续时间动态系统建模脑网络变化,进一步提升时序建模的精度。
(2)多模态数据的扩展
当前模型仅使用 FC 和 SC 两种模态,而大脑的信息还包括基因数据、临床量表(如 MMSE 认知评分)、结构 MRI 的灰质体积等。未来若能将这些数据融入模型,比如用基因数据指导脑区权重分配,用临床量表验证模型结果,将进一步提升诊断的准确性和泛化性。
(3)临床应用的落地挑战
要将 ET_MGNN 应用于实际临床,还需解决两个问题:一是数据泛化性—— 当前实验基于国际公开数据集,未来需要在更多种族、更多医院的本地数据上验证模型性能;二是部署效率—— 虽然 ET_MGNN 的计算复杂度较低,但基层医院的设备资源有限,需要进一步优化模型大小(如模型压缩),使其能在普通 GPU 甚至 CPU 上运行。
五、总结:AI 与神经科学的 “双向奔赴”
ET_MGNN 模型的研究,本质上是 AI 技术与神经科学的 “双向奔赴”:神经科学为 AI 提供了 “大脑如何工作” 的生理依据(如结构支撑功能、动态状态切换),而 AI 技术则为神经科学提供了 “解读大脑复杂数据” 的工具(如多模态融合、高效时序建模)。
从更长远的视角看,这项研究不仅推动了脑部疾病诊断的技术进步,还为 “脑科学与类脑智能” 领域提供了新的研究思路 —— 未来,我们或许能通过 AI 模型反向推导大脑的工作机制,比如通过模型定位的关键脑区,深入理解自闭症的神经病理机制;也能通过模拟大脑的动态网络,设计更接近人类认知的类脑 AI。
对于普通人而言,这项研究的意义在于:随着 AI 技术的不断成熟,脑部疾病的诊断将不再依赖 “经验判断”,而是走向 “数据驱动 + 生理解释” 的精准模式。或许在不久的将来,一次简单的 MRI 检查,结合 AI 模型的分析,就能早期发现阿尔茨海默病、自闭症等疾病的迹象,为患者赢得宝贵的干预时间。
当然,AI 永远无法替代医生 ——ET_MGNN 的定位是 “医生的辅助工具”,它能提供客观的脑网络分析结果和疾病相关脑区信息,但最终的诊断决策仍需医生结合临床症状、病史等综合判断。但可以肯定的是,AI 与医学的深度融合,必将为脑部疾病患者带来更多希望。
(注:本文基于 Lang J, Yang L-Z, Li H. Multi-modal dynamic brain graph representation learning for brain disorder diagnosis via temporal sequence model. Neurocomputing, 2025, 656: 131509. 研究内容撰写,如需进一步了解模型细节,可参考原文或访问项目代码仓库:https://github.com/BrainFC/ET_MGNN)
论文元数据
- 标题: Multi-modal dynamic brain graph representation learning for brain disorder diagnosis via temporal sequence model(基于时间序列模型的多模态动态脑图表示学习在脑部疾病诊断中的应用)
- 作者: Jinwei Lang, Li-Zhuang Yang, Hai Li
- 期刊: Neurocomputing(IF:6.5)
- 发表日期: 2025 年 9 月 13 日
- DOI: 10.1016/j.neucom.2025.131509
- 研究机构:
- Hefei Cancer Hospital of CAS, Institute of Health and Medical Technology, Hefei Institutes of Physical Science, Chinese Academy of Sciences, Hefei 230031, PR China
- University of Science and Technology of China, Hefei 230026, PR China
- Anhui Province Key Laboratory of Medical Physics and Technology, Hefei 230031, PR China
- 关键词: 动态脑网络(Dynamic brain network), 循环序列模型(Recurrent sequence model), 图神经网络(Graph neural network), 多模态磁共振成像(Multi-modal MRI), 脑部疾病(Brain disorder), 高效时间多模态图神经网络(ET_MGNN), 动态功能连接(Dynamic Functional Connectivity, DFC), 结构连接(Structural Connectivity, SC), 脑图表示学习(Brain graph representation learning), 模型可解释性(Model interpretability)





















 2571
2571

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








