传统中医在治疗多种疾病方面得到了广泛应用。随着现代药物化学与药学研究的不断进步,我们得以揭示在疾病治疗过程中发挥作用的活性天然产物。在这些产物中,萜类化合物是传统中药中极为重要的天然生物活性成分之一。在传统方法中,这些具有生物活性的萜类化合物是从中药植物中提取的。然而,植物中这些萜类化合物的产量较低且质量波动较大,无法满足市场对萜类化合物日益增长的需求。因此,一种可持续的活性萜类化合物供应方式受到了广泛关注。随着合成生物学的发展,酵母作为一种理想的微生物细胞工厂,被用于生产植物源性天然产物。在近年的研究中,包括青蒿酸、稀有人参皂苷、稀有甘草三萜以及其他具有增值潜力的萜类化合物在内的多种典型活性萜类化合物已在酵母中成功生产。
1. 关于萜类化合物及其在中国传统药用植物中的提取介绍
萜烯类化合物,也被称为异戊二烯类化合物,是一系列结构极为多样的天然有机化合物。它们的应用范围广泛,涉及化妆品、制药、食品等多个工业领域。这类化合物在植物界中分布极为广泛,是植物中最常见的天然产物之一,且表现出丰富的结构多样性。据估计,源自植物的萜烯化合物种类超过了五万五千种。萜烯化合物的基本结构单元是异戊二烯,根据异戊二烯单元的数量,它们可以被划分为不同的类别。通常,萜烯化合物可以被分为半萜类,例如异戊二烯;单萜类,包括薄荷醇、薄荷酮、樟脑和桉树脑等;倍半萜类,如青蒿素、蛇床子素、丁香烯和姜黄烯等;二萜类,例如雷公藤甲素、紫杉醇等;三萜类,如人参皂苷、甘草酸等;以及四萜类,包括番茄红素、玉米黄质和虾青素等。
在传统中药领域,众多的萜类化合物被发现,它们展现了显著的药用价值。这些化合物在临床应用及其他药理作用方面表现出广泛的潜力,包括抗肿瘤、抗炎、抗病毒、抗疟疾等功效,以及在预防和治疗心血管疾病方面的应用,还有针对多种代谢性疾病的活性。在众多萜类化合物中,青蒿素尤为著名,它在治疗疟疾方面发挥了重要作用,并挽救了无数生命。药用植物是萜类化合物的重要来源。随着现代药学科学的进步,对萜类化合物的需求日益增长。传统提取方法主要依赖于植物,尤其是草本植物。这些植物往往需要数月甚至数年的生长周期才能用于提取活性萜类化合物,例如人参需五至七年,甘草需数年,而青蒿则需数月(见图1)。此外,植物中萜类化合物的含量相对较低;例如,青蒿中的青蒿素在生物质中的含量仅为0.01-2%,而人参中的稀有人参皂苷成分不足0.1%。植物生长周期及其中萜类化合物的含量还受到气候、土壤类型及其他环境因素的影响(见图1)。由于这些结构复杂的萜类化合物化学合成成本高昂且产率低下,因此,寻找其他可持续的萜类化合物供应途径成为了研究的热点。
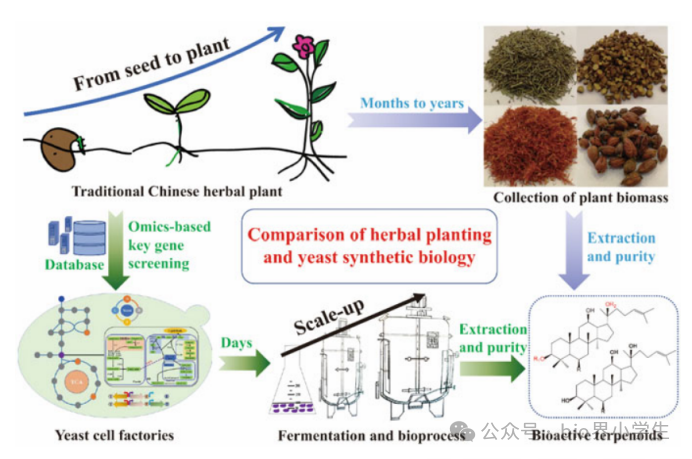
图1展示了植物生产和酵母合成生物学在生产萜类物质方面的对比研究。传统方法中,中国药用植物的生产周期往往需要数月甚至数年,而获取萜类物质则涉及复杂的植物生物质采集、提取和纯化步骤。借助组学技术和数据库的支持,研究者能够识别出关键的萜类生物合成基因,并将这些基因应用于构建酵母细胞工厂。相比之下,发酵过程仅需数天即可完成。尽管酵母产生的天然产物种类相对较少且结构简单,但这也使得从酵母生物质中提取目标生物活性萜类物质的过程相对简化。
合成生物学技术已成功应用于生产具有高附加值的萜烯类化合物,为商业领域提供了光明的前景。在这一领域,酿酒酵母(Saccharomyces cerevisiae)作为模式微生物,因其在低成本底物上的快速生长能力以及对多种不良发酵条件的强适应性而备受青睐。此外,酿酒酵母的遗传操作简便,使其成为新型非天然自然产物生物合成的理想选择。其他非模式酵母,例如解脂耶罗威亚酵母(Yarrowia lipolytica)和红冬孢酵母(Rhodosporidium toruloides),亦被证明在萜烯及其他自然产物的生物合成中具有潜力。这些酵母被认为是萜烯生物合成的优选宿主,相较于大肠杆菌,它们在表达萜烯生物合成途径中的某些基因,如细胞色素P450,方面表现更为优异。为了使工程酵母在萜烯生产中达到高产量、高效率和高产率,必须构建萜烯前体底盘细胞,识别并理解萜烯生物合成途径,以及植物和酵母中的代谢网络。在酵母萜烯生物合成基因前体底盘细胞中引入异源萜烯生物合成基因,强化萜烯生物合成途径,抑制竞争途径,减轻目标萜烯的毒性,增强辅因子供应,并采取其他策略以重排整个代谢网络,是实现目标萜烯高效生产的必要措施。
2. 自然界中的萜类生物合成途径
类萜化合物的碳骨架及其构建单元源自异戊烯基焦磷酸(IPP),而IPP的前体底物包括乙酰辅酶A、丙酮酸和甘油-3-磷酸。在自然界中,存在两种主要的IPP合成途径:甲羟戊酸(MVA)途径和2-C-甲基-D-赤藻糖醇-4-磷酸(MEP)途径。通常情况下,高等真核生物的细胞质主要通过MVA途径进行IPP的合成;相比之下,植物细胞的质体、原生动物以及大多数微生物则偏好利用MEP途径来合成IPP(参见图2)。值得注意的是,在植物体内,MVA和MEP途径的中间体可以相互交换和作用。
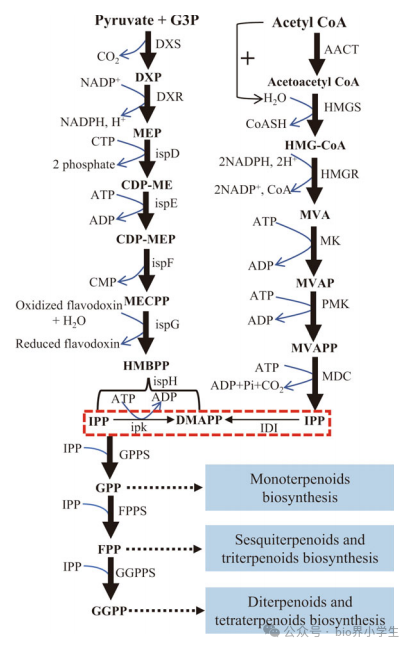
图2 描述了倍半萜生物合成途径,包括MVA途径和MEP途径。
G3P,甘油醛-3-磷酸;DXP,1-脱氧-D-木酮糖-5-磷酸;MEP,2-C-甲基-D-赤藓糖醇-4-磷酸;CDP-ME,4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇;CDP-MEP,4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇-2-磷酸;MECPP,2-C-甲基-D-赤藓糖醇-2,4-环焦磷酸;HMBPP,1-羟基-2-甲基-2-(E)-丁烯基-4-焦磷酸;HMG-CoA,3-羟基-3-甲基戊二酰辅酶A;MVA,甲羟戊酸;MVAP,甲羟戊酸磷酸;MVAPP,甲羟戊酸二磷酸;IPP,异戊烯基焦磷酸;DMAPP,二甲基烯丙基焦磷酸;GPP,香叶基二磷酸;FPP,法尼基二磷酸;GGPP,香叶基香叶基焦磷酸。DXS,D-木酮糖-5-磷酸合酶;DXR,D-木酮糖-5-磷酸还原异构酶;ispD,2-C-甲基-D-赤藓糖醇-4-磷酸胞苷转移酶;ispE,4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇激酶;ispF,2-C-甲基-D-赤藓糖醇-2,4-环二磷酸合酶;ispG,(E)-4-羟基-3-甲基丁-2-烯基二磷酸合酶;ispH,4-羟基-3-甲基丁-2-烯-1-基二磷酸还原酶;ipk,异戊烯基磷酸激酶;AACT,乙酰辅酶A C-乙酰转移酶;HMGS,3-羟基-3-甲基戊二酰辅酶A合酶;HMGR,3-羟基-3-甲基戊二酰辅酶A还原酶;MK,甲羟戊酸激酶;PMK,磷酸甲羟戊酸激酶;MDC,甲羟戊酸二磷酸脱羧酶;IDI,异戊烯基焦磷酸δ异构酶;GPPS,香叶基焦磷酸合酶;FPPS,法尼基焦磷酸合酶;GGPPS,香叶基香叶基焦磷酸合酶。
在MVA途径中,乙酰辅酶A经由乙酰辅酶A乙酰转移酶(AACT)的催化作用,转化为乙酰乙酰辅酶A。随后,乙酰乙酰辅酶A在3-羟基-3-甲基戊二酰辅酶A合酶(HMGS)的作用下,进一步转化为3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)。HMG-CoA在HMG还原酶(HMGR)的催化下,生成甲羟戊酸(MVA)。在MVA激酶和磷酸甲羟戊酸激酶的多步骤催化反应中,甲羟戊酸二磷酸酯(MVAPP)得以合成。接着,MVAPP在甲羟戊酸二磷酸酯脱羧酶的作用下脱羧,形成异戊烯基焦磷酸(IPP)。IPP在异戊烯基焦磷酸二磷酸异构酶(IDI)的催化下,用于合成二甲基烯丙基焦磷酸酯(DMAPP)。至于MEP途径,其起始步骤是DXP合酶催化D-木酮糖-5-磷酸酯(DXP)的形成,以丙酮酸和甘油醛-3-磷酸酯(G3P)作为底物。接下来,DXP在DXP还原异构酶的作用下被还原为甲基赤藓醇磷酸(MEP)。MEP随后在一系列酶反应的辅助下,进一步转化为包括4-二磷酸胞苷-2-C-甲基-D-赤藓醇(CDP-ME)、4-二磷酸胞苷-2-C-甲基-D-赤藓醇2-磷酸酯(CDP-MEP)、2-C-甲基-D-赤藓醇2,4-环焦磷酸酯(MECPP)以及1-羟基-2-甲基-2-(E)-丁烯基4-焦磷酸酯(HMBPP)等产物(参见Liu等,2014年)。最终,HMBPP通过4-羟基-3-甲基丁-2-烯-1-基二磷酸还原酶(ispH)转化为IPP和DMAPP(参见图2)。
萜烯类化合物的生物合成过程涉及异戊二烯类化合物作为共同的五碳底物。首先,异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)的生成为合成过程奠定了基础。随后,香叶基焦磷酸合酶(GPPS)将IPP与DMAPP转化为香叶基焦磷酸(GPP),该化合物是单萜生物合成的关键前体。法尼基焦磷酸合酶进一步利用IPP和GPP合成法尼基焦磷酸(FPP),后者是倍半萜和三萜生物合成的必要前体。此外,GPPS还能将IPP与FPP结合生成香叶基香叶基焦磷酸(GGPP),作为二萜和四萜生物合成的前体。为了完成萜烯类化合物的合成,识别并理解核心结构修饰酶的作用至关重要,这些酶包括萜烯合酶、P450及其还原伙伴NADPH-细胞色素P450还原酶(CPRs)以及糖基转移酶。
3. 传统中药植物中参与倍半萜类化合物生产的关键基因鉴定
新一代测序技术已经在公共数据库中积累了大量的基因组和转录组数据(最全植物基因组数据平台 IMP中文教程( 核基因组更新到 1000 个植物))。随着测序成本的下降,众多实验室现在能够对多种植物和微生物的多个组织进行测序。序列数据的组装和注释能够揭示测序物种的主要代谢途径以及大多数已知的次生代谢途径。然而,植物往往对同一生化反应具有多种相似的酶。特别是在次生代谢方面,众多相似或高度同源的酶促进了植物代谢产物的多样性。多组学数据有助于识别关键基因在倍半萜生物合成途径中的作用。大麻(Cannabis sativa)的基因组和组织特异性表达数据对于其倍半萜合酶基因家族的全面特征化具有重要意义。利用L. odoratus转录组数据,成功鉴定了香豌豆花中的倍半萜合酶基因。尽管如此,准确识别出能够产生多样化倍半萜的修饰酶仍是一项挑战。因此,开发有效的策略以识别这些关键基因显得尤为必要。
在基因组学和转录组学数据分析的领域内,已经开发出多种注释和筛选策略,这些策略在关键基因的识别过程中发挥了至关重要的作用。三萜皂苷构成了甘草的主要生物活性成分。合成三萜皂苷甘草酸的最后阶段涉及将两个葡萄糖醛酸分子连接至甘草酸分子上。通常情况下,糖基化反应发生在细胞质内,而3-O-葡萄糖醛酸化被认为是由细胞质中的糖基转移酶所介导。最近,研究者发现了一种与纤维素合酶相似的酶,该酶位于内质网膜上,能够对特定植物代谢物三萜皂苷进行葡萄糖醛酸化修饰。几乎与此同时,通过基因共表达分析,确认了一种源自纤维素合酶的酶在甘草酸生物合成中催化3-O-葡萄糖醛酸化反应。这两项研究均利用了不同植物组织的转录组数据来识别类固醇生物合成过程中的关键基因,这表明多组学数据在关键基因识别方面提供了一种高效的方法。
系统发育分析、序列相似性网络、基于同源性的模型预测以及其它生物信息学辅助方法已被运用于关键基因的识别。同属植物的关键基因往往表现出较高的序列相似性,这为利用序列相似性网络和系统发育分析来识别倍半萜生物合成中的关键基因提供了可能。为了识别生产三萜皂苷人参皂苷的关键糖基转移酶基因,采用了微生物OTU分类策略,从人参cDNA和EST数据库中整合了所有潜在的糖基转移酶基因。经过分类的糖基转移酶基因随后进行了序列比对,并构建了系统发育树。基于系统发育分析的结果,挑选了若干糖基转移酶基因进行微生物特征描述,并鉴定了参与CK、Rh2和Rg3人参皂苷合成的糖基转移酶。序列相似性网络已被应用于倍半萜合成酶样蛋白的分类。利用隐马尔可夫模型,从Marchantia polymorpha中鉴定出若干假定的倍半萜合成酶基因。近期,提出了一种简化的计算流程,用于探索天然产物生物合成基因簇,该流程在未来倍半萜生物合成基因的鉴定中具有潜在的应用价值。
4. 工程酵母用于生产萜类前体
酵母,包括模型生物如酿酒酵母(S. cerevisiae)和解脂耶罗威亚酵母(Y. lipolytica),在微生物类萜生产领域引起了广泛关注。为了实现类萜的高产量、高效率和高产率(TRY),研究人员增强了酵母中类萜前体的生物合成能力。通用的代谢工程方法以及新近开发的合成生物学策略已被运用于解决酵母类萜前体生物合成过程中所面临的前体限制问题。鉴于酵母并非类萜生产的天然宿主,因此必须重新设计其细胞代谢并引导代谢通量,以促进类萜前体的生物合成。酵母仅具备用于类萜生物合成的甲羟戊酸(MVA)途径。基于酵母中的MVA途径(见图3),通过过表达该途径中的某些基因以及引入外源高效基因来优化类萜前体生物合成途径,已成为普遍采用的策略。实际上,已有多种基因被选用于促进类萜前体的生产(见图3)。
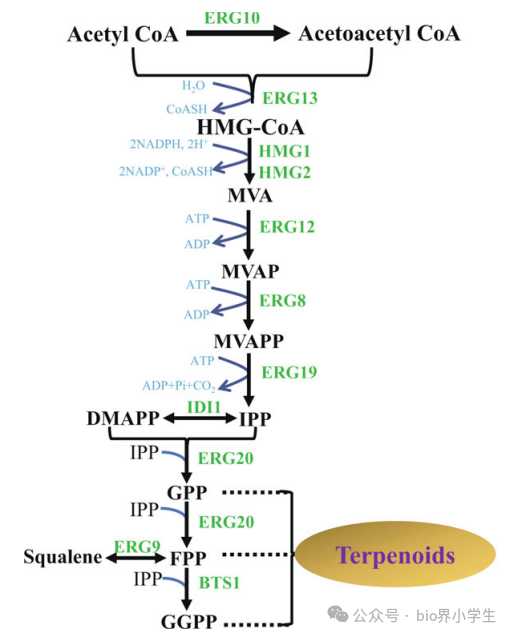
图3. 在酿酒酵母中生产萜类化合物的工程目标。HMG-CoA,3-羟基-3-甲基戊二酰辅酶A;MVA,甲羟戊酸;MVAP,甲羟戊酸磷酸;MVAPP,甲羟戊酸二磷酸;IPP,异戊烯基焦磷酸;DMAPP,二甲基烯丙基焦磷酸;GPP,香叶基二磷酸;FPP,法尼基二磷酸;GGPP,香叶基香叶基焦磷酸。
甲羟戊酸途径中的限速酶常常被选用来提高酵母类异戊二烯前体的合成。HMGR是甲羟戊酸途径中的第一个限速酶。为了增强HMGR的活性,酵母中的tHMG1(编码酵母HMGR的催化域)被过表达,从而增加了甲羟戊酸途径中的代谢通量,并提高了类异戊二烯的最终产量(图3)。tHMG1的过表达通常会导致类异戊二烯产量的提高,例如使用工程化的酿酒酵母生产柠檬烯。HMG2是HMG1的同工酶,在低氧环境下是主要的HMGR同工酶。过表达HMG2变体(K6R)和IDI1可以提高单萜的产量。实际上,过表达tHMG1、IDI1和MAF1增加了酿酒酵母中的乙酸香叶酯产量。
ERG20和ERG9酶在合成萜类前体物质中扮演着至关重要的角色(参见图3)。通过工程化方法对ERG20进行优化,显著提高了sclareol及其他萜类化合物的产量。ERG20与BTS1融合基因的过量表达同样促进了萜类化合物的产出。最近的研究表明,ERG20及其突变体mERG20(在ERG20中引入F96C突变,可能增强了其作为香叶基二磷酸合酶的功能)的过量表达,显著增加了酿酒酵母(S. cerevisiae)中香叶基二磷酸的含量。通过动态调控ERG20的表达水平,有可能进一步提高酵母中萜类前体物质的产量。将ERG20的动态调控与最小化内源下游代谢相结合,有效提升了香叶醇的产量;同时,动态调控ERG20和ERG9的表达,也促进了酿酒酵母中二萜类物质casbene的产出。降低ERG9的表达水平,可导致法尼基焦磷酸(FPP)的高产出,常用策略包括用HXT1或其他启动子替换原生ERG9启动子。此外,将外源性MVA途径的限速基因引入酵母,亦可提高萜类化合物的产量,例如PaGGPPS和SaGGPPS基因的引入。脂质的产生会影响通过脂质体储存角鲨烯合成萜类前体的过程,tHMG1和DGA1的共同过量表达导致角鲨烯的积累超过对照菌株250倍以上。在酵母中,转录激活因子调节萜类前体的合成。UPC2转录因子的过量表达导致萜类化合物产量的增加,而其他转录因子,如Rox1和Mot3,则抑制了酵母中的麦角固醇生物合成。
5. 从青蒿中衍生的青蒿酸前体在酵母中的生产
黄花蒿的萃取物,传统上作为中药用于治疗疟疾。在20世纪70年代,屠呦呦女士发现了黄花蒿萃取物中的有效成分——青蒿素。此后,青蒿素被广泛应用于治疗疟疾,成为一种高效的抗疟药物。最近的研究揭示,青蒿素及其衍生物不仅具有免疫调节功能,还展现出抗肿瘤活性。青蒿素属于倍半萜内过氧化物,主要通过从黄花蒿的叶片及其他生物质中提取获得。黄花蒿需数月生长后方可收割,而野生黄花蒿中的青蒿素含量较低。此外,黄花蒿的种植需占用大量耕地,且其青蒿素含量受气候条件影响。因此,青蒿素的供应存在不确定性与不稳定性,导致价格波动。利用微生物生产青蒿素引起了广泛关注,因为这可能在有限的空间和较短时间内大量生产青蒿素。
研究人员已开发出用于生产倍半萜类化合物的细菌底盘,成功构建了能够合成多种倍半萜类化合物前体的大肠杆菌菌株。在大肠杆菌中表达细胞色素P450存在难度,因此选择了酿酒酵母(Saccharomyces cerevisiae)作为生产高水平青蒿素的宿主。通过过表达tHMGR、UPC2-1和ERGs基因,以及下调ERG9基因,对法尼基焦磷酸(FPP)生物合成途径进行了工程化改造,旨在提高FPP产量并减少固醇的合成。研究人员将从青蒿(Artemisia annua)中提取的青蒿二烯合酶基因引入酿酒酵母,构建了一个能够产生青蒿二烯的菌株。此外,还鉴定出一种新型细胞色素P450(CYP71AV1),它具备进行三步氧化的能力,能够将青蒿二烯转化为青蒿酸。CYP71AV1及其来自青蒿的氧化还原伴侣的表达,导致了青蒿酸的产生。鉴于青蒿酸可以通过化学过程轻松转化为青蒿素,青蒿酸的生产成为了一个概念验证,证明了利用酵母作为微生物细胞工厂合成植物天然产物的可能性。经过工程改造的酵母菌株能够在短时间内(4-5天)生产青蒿酸。与种植青蒿需数月或数年相比,这些合成生物学策略显著节省了时间和劳动力(见图1)。
在进一步研究中,通过过表达MVA途径中的每个基因,青蒿酸的产量翻倍;然而,青蒿二烯的产量是青蒿酸的十倍。因此,研究者们开发了一种优化过程,将青蒿二烯转化为二氢青蒿酸。二氢青蒿酸可进一步转化为青蒿素。为了实现酵母生产可负担的青蒿酸,通过使用适当的启动子对基因进行优化,并引入高效的青蒿酸生物合成基因,优化了青蒿酸的生物合成途径。青蒿酸的发酵产量达到了25g/l,并建立了一种低成本的化学过程,将青蒿酸转化为青蒿素,这为独立于植物生产的第二种半合成青蒿素来源提供了可能。利用酵母生产青蒿酸的成功,为从传统中国药用植物衍生的青蒿素的工业规模生产铺平了道路。
6. 源自人参植物的稀有人参皂苷在酵母中的生产过程
人参皂苷是人参(Panax ginseng C. A. Meyer)的主要药理活性成分,这种在东亚地区广受欢迎的传统药材,其药用价值备受推崇。人参皂苷属于三萜类化合物,主要存在于人参属植物中,可以分为达玛烷型和齐墩果烷型两大类,其中达玛烷型三萜类人参皂苷占多数。人参皂苷展现出了多种生物活性,包括抗肿瘤、抗炎、抗氧化及抗衰老等功效。然而,人参中皂苷的含量相对较低,通常不超过4%。此外,具有重要功能的人参皂苷在天然人参中较为罕见。化合物K(CK),一种具有潜在抗炎和抗糖尿病活性的三萜类化合物,仅在动物或人体血液中被检测到。尽管CK被归类为人参皂苷,并且已证实是由天然人参皂苷转化而来,但在人参植物中尚未发现CK的存在。获取人参皂苷通常需要五到七年的人参生长周期。同时,人参皂苷的结构复杂,至今无法实现大规模的全新化学合成。合成生物学策略已被应用于微生物生产人参皂苷。
人参皂苷的核心结构包括原人参二醇(PPD)和原人参三醇(PPT)。PPD和PPT的前体物质通过酵母中的甲羟戊酸(MVA)途径合成。野生型酵母能够合成2,3-环氧鲨烯。为了在酵母中生产人参皂苷,必须引入外源基因。2,3-环氧鲨烯化合物可以进一步通过达玛烯二醇-II合酶转化为达玛烯二醇-II。研究发现,细胞色素P450酶CYP716A47负责将达玛烯二醇-II转化为PPD,而来自拟南芥的同源P450酶也具备相同功能。随后,CYP716A53v2细胞色素P450酶能够以PPD为底物合成PPT。
多种UDP-糖基转移酶(UGTs)参与PPD、PPT及其糖基化产物的糖基化过程。UGTPg1被鉴定出能够糖基化PPD并产生CK。CK的合成途径有两种可能:一种是从达玛烯二醇-II到PPD,然后到CK;另一种是从达玛烯二醇-II到20S-O-β-(D-葡萄糖基)-达玛烯二醇II,然后到CK。UGTPg1还能够将Rg3转化为Rd,将Rh2转化为F2,表明UGTPg1可能参与多种人参皂苷的合成。此外,与人参UGTs氨基酸序列高度同源(>84%)的其他UGTs也显示出其功能的多样性,它们能够将PPT和PPT型化合物转化为多种人参皂苷。在人参植物中对UGT94家族基因的研究揭示了一组具有高氨基酸同源性的UGT94s,它们在人参植物中具有多样化的催化活性。这些UGT94酶负责合成多种人参皂苷。此外,还研究了人参植物中的UGT多样性,并鉴定了两种UGTs,即UGTPg45和UGTPg29,它们参与了人参皂苷Rh2和Rg3的生物合成。通过合成生物学策略在工程酵母中生产Rh2和Rg3。还证明了从酵母中设计的半理性UGT51具有合成Rh2的能力,显示了合成生物学策略在酵母中生产萜类化合物的巨大潜力。通过在PPD产生底盘中表达多个UGTPg45的副本,Rh2的产量增加到2.25 g/L,这为在酵母中大规模生产人参皂苷提供了可能。此外,非传统酵母Y. lipolytica已被工程化用于CK的生产,在5升发酵罐中通过分批发酵,最终CK的产量达到了161.8 mg/L。
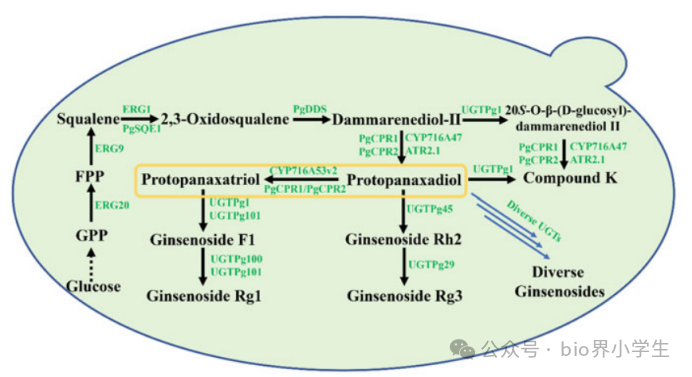
图4. 在酿酒酵母中生产人参皂苷的工程。GPP,香叶基二磷酸;FPP,法尼基二磷酸。
7. 从甘草植物中提取的甘草三萜的生产
甘草属植物,如甘草(Glycyrrhiza uralensis Fisch.)、光果甘草(Glycyrrhiza glabra L.)和胀果甘草(Glycyrrhiza flata Bat.),在传统中药领域中得到了广泛应用。该属植物的一个关键生物活性成分是甘草酸(GA),它展现了抗炎、抗肿瘤和免疫调节等多种生物活性。甘草酸的产生可以通过水解甘草酸来实现。作为一种从甘草植物根部提取的三萜类化合物,甘草酸主要用作饮料、糖果、口香糖以及苦味药物的甜味剂和调味剂。然而,野生和栽培的甘草植物已无法满足市场对甘草酸及其活性成分的需求。此外,从甘草植物中提取甘草酸的过程对环境造成了污染。鉴于甘草酸化学结构的复杂性,其化学合成的产率低且成本高昂,因此寻找一种可持续的甘草酸供应方式变得极为重要。
与人参皂苷的生物合成途径相比,赤霉素(GA)的生物合成途径存在显著差异。其前体物质是通过MVA途径合成的,但2,3-环氧鲨烯被β-香树脂醇合酶转化为β-香树脂醇。随后,β-香树脂醇经由甘草β-香树脂醇11-氧化酶(一种细胞色素P450酶)氧化成11-氧代-β-香树脂醇。甘草细胞色素P450酶CYP72A154催化11-氧代-β-香树脂醇在C-30位置的三个连续氧化步骤,从而生成GA。在催化反应中,CPRs为细胞色素P450s提供电子。UGTs(GuGT14和UGT73P12)则负责甘草酸的生物合成。为了在酵母中实现高水平的GA生产,研究人员加强了MVA途径,并破坏了与乙酰辅酶A竞争的途径。最终,β-香树脂醇的产量达到了279 mg/L。通过引入高效的β-香树脂醇合酶和P450酶,并优化代谢通量以合成GA,最终在摇瓶中的11-氧代-β-香树脂醇和GA的产量分别达到了80 mg/L和8.78 mg/L。
8. 从传统中药植物中衍生的其他萜类化合物在酵母中的生产
除了倍半萜和三萜之外,许多单萜和二萜也具有抗肿瘤及其他活性。合成生物学和代谢工程策略已被用于酵母生物合成单萜和二萜(表1)。猫薄荷(Nepeta cataria)在中国传统医学中广泛使用,其主要生物活性成分是单萜的薄荷酮和胡薄荷酮。由于酵母中的Erg20p可以作为GPPS和FPPS,通过催化GPP转化为FPP来限制单萜的生产。为了克服这一限制,增强了Erg20p的GPP功能,这导致单萜产量显著增加。通过进一步工程化Erg20p以降低其FPPS活性,并将工程化的ERG20基因与萜烯合酶融合,获得的工程菌株产量比起始菌株增加了340倍。天然的萜烯前体GPP与酵母固醇生物合成紧密耦合,这对酵母的生存至关重要;因此,工程化天然途径无法将GPP代谢通量导向FPP。Ignea等人在酿酒酵母(S. cerevisiae)中建立了一个合成的正交单萜生物合成途径。他们识别了单萜合酶的选择性机制,并对酶进行工程化以接受香叶基二磷酸作为底物。通过结合工程化的单萜合酶和动态控制FPP和香叶基二磷酸的生物合成,使用正交单萜生物合成途径生产的单萜产量比使用酵母典型途径增加了七倍。
名称 | 传统中药植物来源 | 酵母底盘 | 产量 | 类型 | 参考文献 |
香叶醇 | 各种植物 | Saccharomyces cerevisiae CEN.PK2-1C | 1.68 g/L | 单萜 | https://doi.org/10.1016/j.ymben.2017.03.005 |
α-松油醇 | 松柏类植物 | Saccharomyces cerevisiae LCB08 | 21.88 mg/L | 单萜 | https://doi.org/10.1186/s12934- 019-1211-0 |
柠檬烯 | 柑橘类水果 | Saccharomyces cerevisiae BY4741 | 166 mg/L | 单萜 | https://doi.org/10.1038/s41467-019-11290-x |
次丹参酮二烯 | 丹参提取物 | Saccharomyces cerevisiae S288C | 3.5 g/L | 双萜 | https://doi.org/10.1016/j.ymben.2020.03.011 |
雷公藤内酯 | 雷公藤 | Saccharomyces cerevisiae BY-HZ16 | 酵母生物量30.5 μg/g | 双萜 | https://doi.org/10.1038/s41467-020-14776-1 |
(-)-β-榄香烯 | 温郁金二萜类化合物 | Saccharomyces cerevisiae SCIGS22a | 190.7 mg/L | 倍半萜化合物 | https://doi.org/10.1007/s10295-017-1934-z |
青蒿素 | 黄花嵩 | Saccharomyces cerevisiae Y1284 | 25 g/L | 倍半萜化合物 | High-level semi-synthetic production of the potent antimalarial artemisinin. |
甘草次酸 | 光果甘草 | Saccharomyces cerevisiae Y7 | 8.78 mg/L | 三萜系化合物 | https://doi.org/10.1186/s12934- 019-1138-5 |
人参皂苷化合物K ( CK ) | 人参属植物 | Saccharomyces cerevisiae WLN-3 | 1.7 g/L | 三萜系化合物 | https://doi.org/10.1186/s12934- 020-01306-3 |
人参皂苷F1 | 人参属植物 | Saccharomyces cerevisiae BY-F1 | 450. 5 mg/L | 三萜系化合物 | https://doi.org/10.19540/j.cnki.cjcmm.20190829.101 |
人参皂苷Rh2 | 人参属植物 | Saccharomyces cerevisiae ZWDRH2-10 | 2.25 g/L | 三萜系化合物 | https:// doi.org/10.1038/s41421-018-0075-5 |
人参皂苷Rh1 | 人参属植物 | Saccharomyces cerevisiae ZW-Rh1-20 | 92.8 mg/L | 三萜系化合物 | https://doi.org/10.1016/j.molp.2015.05.010 |
人参皂苷 Rg3 | 人参属植物 | Saccharomyces cerevisiae D20RG1 | 3.49 μmol/g 干细胞重量 | 三萜系化合物 | https://doi.org/10.1016/j.ymben.2015.03.003 |
原人参萜二醇(PPD) | 人参属植物 | Saccharomyces cerevisiae GW10 | 152.37 mg/L | 三萜系化合物 | https://doi.org/10.1021/acs.jafc.8b04916 |
源自中国传统药用植物的生物活性成分中,二萜类化合物占据一席之地,例如雷公藤中的雷公藤内酯和红景天中的冬凌草素。雷公藤内酯表现出抗炎、抗肿瘤等多种生物活性,但其在雷公藤中的含量极为稀少,介于0.0001%至0.002%之间。通过综合分析雷公藤的基因组、转录组和代谢组数据,科学家们成功重建了雷公藤内酯中间体脱氢松香酸的细胞色素P450(CYP728B70)。将CYP728B70基因引入工程酵母,实现了二萜醇和酸的生产,为在酵母中合成雷公藤内酯奠定了坚实的基础。至于冬凌草素的生物合成途径,目前其关键基因尚未被明确揭示。
尽管紫杉醇并非源自传统中国药用植物,它却是广为人知的植物二萜之一,并作为有效的抗癌药物广泛使用。紫杉醇主要从红豆杉树皮中提取,而为了生产紫杉醇,大多数红豆杉物种的利用对这些古老树种的存续构成了威胁。虽然已在红豆杉悬浮培养和烟草(Nicotiana benthamiana)中实现了紫杉醇的生物合成,但其产量较低。在酵母中生产紫杉醇仍面临挑战,需要鉴定多种关键酶。二萜的生物合成涉及多个氧化步骤,需要识别细胞色素P450酶,而完全在酵母中合成二萜仍是一项艰巨的任务。
获取多组学数据可以通过检索现有的数据库或对植物在不同生长阶段或不同部位的新鲜组织进行测序来完成。通过比较和对照这些多组学数据,并构建它们之间的关联网络,研究者能够识别出参与倍半萜生物合成途径的关键基因。利用结构生物学和蛋白质工程的技术,可以提升这些关键酶的活性,并调整它们以适应酵母宿主环境。这些关键基因随后可用于在工程酵母中重建异源途径,进而设计出具有增强倍半萜生产能力的酵母菌株。合成生物学与代谢工程的策略能够引导酵母的代谢通量,使其更高效地朝向倍半萜的生物合成方向。最终,有望获得具有高产量、高合成速率和高产率的倍半萜酵母菌株。通过适当的放大发酵策略和生物过程的优化,可以在酵母中实现倍半萜的大规模生产(见图1)。
9. 总结与张望
通过应用组学技术,我们能够精准地从传统中药植物的组学数据中识别出关键基因,这些基因对于构建酵母细胞工厂具有决定性作用。我们采取了一系列策略,包括构建高效的酵母倍半萜前体生产平台、引入外源性倍半萜合成途径、提高关键基因的表达水平、通过抑制竞争途径来调控代谢流以合成倍半萜、增强MVA合成的辅因子供应,以及对亚细胞器进行工程化改造以生产倍半萜。这些措施有望显著提高酵母倍半萜的产量、合成速率和产率。
随着基因组规模模型和高通量自动化筛选技术的不断进步,开发高效生产倍半萜的工程酵母将得到加速。通过优化发酵和生物过程,我们能够进一步降低酵母倍半萜的生产成本。此外,为了实现可负担或商业化的倍半萜生产,开发低成本、智能化且连续的生物制造流程将为工业规模的倍半萜生产提供坚实的基础。在不久的将来,许多源自传统中药植物的珍贵倍半萜的生产将得以实现。
高颜值免费 SCI 在线绘图(点击图片直达)
最全植物基因组数据库IMP (点击图片直达)
往期精品(点击图片直达文字对应教程)





















































 1314
1314

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








