小罗碎碎念
2024-08-07
今天这期推文的主题是——人工智能在肿瘤免疫微环境领域的研究进展。
第三、五、六篇文献在06-02的推文中介绍过,但是考虑到知识体系的完整性,同时方便大家补充这一部分的临床知识,所以再次把这三篇文章收纳进来。
我重点推荐第二、四篇文献,适合研究基因组学、转录组学和病理组学的老师/同学阅读。其中,第二篇文献涉及乳腺癌、肺癌、结直肠癌和肝转移癌,第四篇文献涉及结直肠癌和乳腺癌。大家各取所需,下期见!!

一、肿瘤免疫微环境的多维组学分析及其对CAR-T细胞疗效的影响

一作&通讯
| 角色 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | 周朝凯(Zhaokai Zhou) | 中南大学湘雅二医院药学部 |
| 第一作者 | 汪家辉(Jiahui Wang) | 中国医学科学院北京协和医学院医院肾内科 |
| 第一作者 | 王娇娇(Jiaojiao Wang) | 中南大学湘雅二医院药学部 |
| 第一作者 | 杨帅(Shuai Yang) | 中南大学湘雅二医院药学部 |
| 通讯作者 | 陆琼(Qiong Lu) | 中南大学湘雅二医院药学部 |
文献概述
这篇文章综合运用多组学技术和机器学习手段,深入解析肿瘤免疫微环境(TIME)的复杂性,并探索了提高CAR-T细胞免疫疗法在实体瘤中疗效的潜在策略。
TIME的角色与重要性:
肿瘤免疫微环境(TIME)由肿瘤内部的免疫细胞和相应组分构成,对肿瘤的启动、发展、转移以及对治疗的反应起着至关重要的作用。
TIME的免疫细胞多样性和其与肿瘤细胞的相互作用对癌症治疗尤为关键。
CAR-T细胞疗法的挑战与进展:
CAR-T细胞疗法在血液恶性肿瘤治疗中取得了显著成功,但在实体瘤治疗中仍面临诸多挑战。
TIME的异质性被认为是影响CAR-T细胞疗法效果的主要因素。
多组学技术的应用:
随着单细胞RNA测序、流式细胞术和分子成像等技术的发展,研究者能够更精细地探究TIME的细胞亚群和空间定位,为个性化精准医疗提供了新的视角。
TIME的分类与空间结构:
TIME可以根据免疫细胞的组成和炎症反应的特点被分为不同的类型,包括:
- 免疫细胞排除型(I-E)
- 免疫细胞浸润型(I-I)
- 具有三级淋巴结构的TIME(TLS)
这些不同类型的TIME对癌症治疗和预后有重要影响。
多组学特征对TIME的影响:
肿瘤和宿主的多种特征,如基因突变、遗传背景和微生物组,共同塑造了TIME的特性,并影响了免疫反应的程度。
这些因素对TIME的组成和功能定位有深远的影响。
优化CAR-T细胞疗法的策略:
文章讨论了如何利用多组学数据来优化CAR-T细胞疗法,包括选择最佳靶点、维持T细胞的代谢活性、抵抗免疫抑制、增强T细胞的浸润能力以及预防T细胞耗竭。
机器学习在解码TIME中的应用:
机器学习方法有助于更好地理解TIME的时空异质性,预测免疫疗法的反应,并为CAR-T细胞疗法的设计提供指导。
结论与未来方向:
文章最后强调了多组学分析在癌症免疫疗法研究中的重要性,并展望了通过结合单细胞技术和多组学数据实现个性化医疗的潜力。尽管取得了进展,但仍需进一步研究以克服现有挑战,特别是在整合和解释大量复杂的多维数据方面。
这篇文章为癌症免疫疗法的发展提供了宝贵的见解,并指出了未来研究的方向。
重点关注
Fig. 1 描述了 CAR-T 细胞疗法的设计以及对肿瘤免疫微环境(TIME)的分类基础。
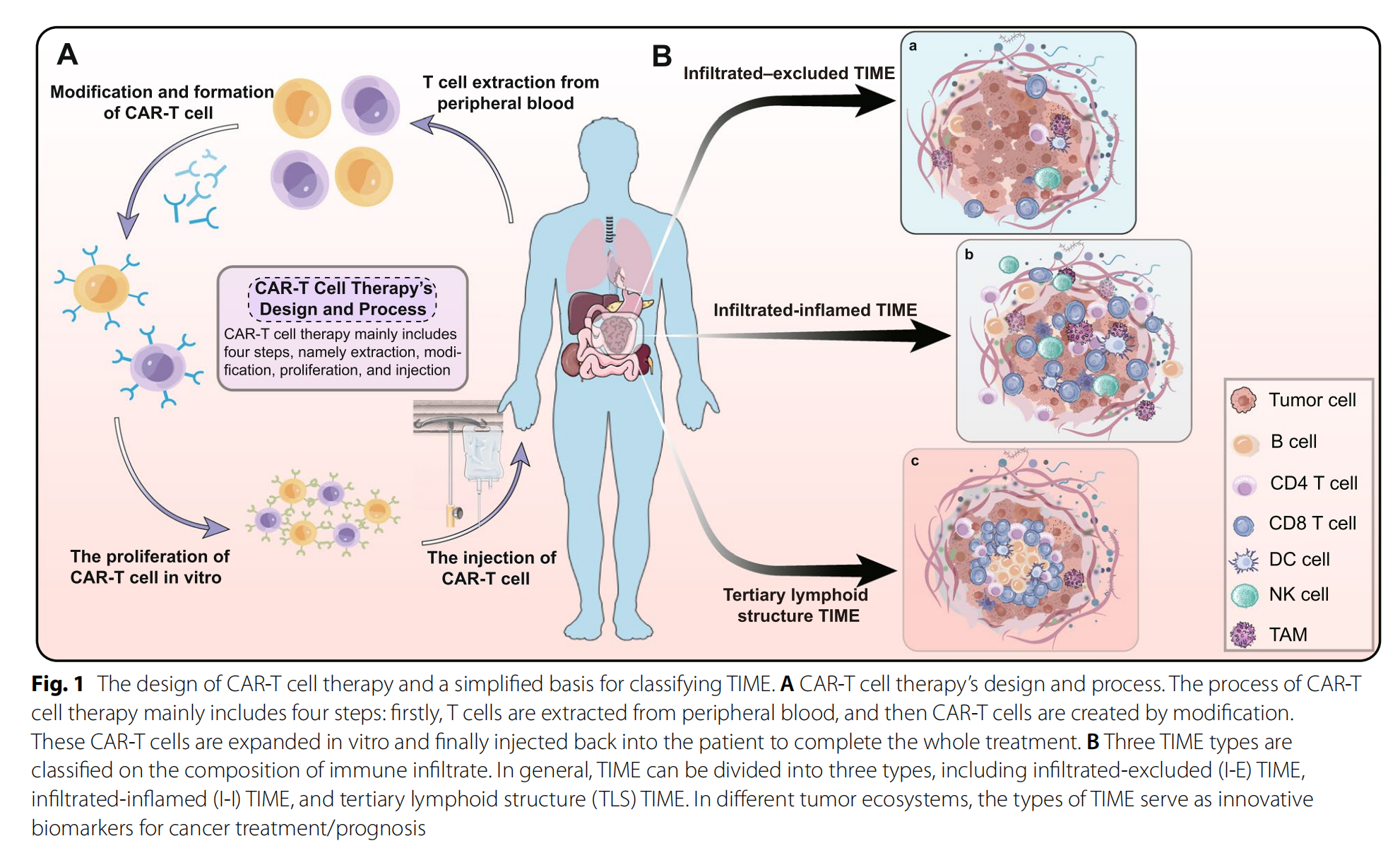
A. CAR-T 细胞疗法的设计和流程:
- 该流程主要包括四个步骤:
- 首先,从外周血中提取 T 细胞。
- 然后,通过改造创建 CAR-T 细胞。
- 接着,在体外扩增这些 CAR-T 细胞。
- 最后,将扩增后的 CAR-T 细胞重新注射回患者体内,完成整个治疗过程。
B. TIME 的分类:
- TIME 可以根据免疫细胞的浸润特征被分为三种类型:
- 浸润排除型(Infiltrated-Excluded,I-E)TIME:这类 TIME 中,免疫细胞在肿瘤基质中较多,但在肿瘤实质中缺乏细胞毒性 T 细胞(CTLs),这些 CTLs 主要分布在肿瘤的边缘,被认为是“冷”或免疫原性较差的。
- 浸润炎症型(Infiltrated-Inflamed,I-I)TIME:这类 TIME 特征是各种免疫细胞(如 CTLs、B 细胞和 T 细胞)高度浸润,被认为是免疫学上的“热”肿瘤,允许更强大的免疫反应,适合免疫检查点抑制剂(ICIs)治疗。
- 三级淋巴结构(Tertiary Lymphoid Structures,TLS)TIME:作为 I-I TIME 的一个亚类,具有包含 TLS 的组织学证据。TLS 通常与良好的预后相关,但并不总是如此。
在不同的肿瘤生态系统中,TIME 的这些类型作为创新的生物标记物,对癌症治疗和预后具有重要意义。这种分类有助于理解免疫细胞组成和状态对患者总体生存期的影响,预测和指导免疫治疗的响应性,并揭示新的治疗靶点。
二、stKeep:一种用于肿瘤生态系统多模态数据融合的计算模型

一作&通讯
| 作者角色 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | 祖春满 | 东华大学人工智能研究所,工业大数据与智能系统上海工程研究中心,中国上海 |
| 通讯作者 | 陈洛南 | 中国科学院上海生物化学与细胞生物学研究所系统生物学重点实验室,浙江省系统健康科学重点实验室,杭州高等研究院生命科学学院,中国科学技术大学,中国四川大学西部生物医学大数据中心,信息医学中心,中国成都 |
文献概述
这篇文章是关于一种名为stKeep的新型异构图学习方法,它被开发用于分析空间分辨的转录组学(Spatially Resolved Transcriptomics, SRT)数据,以精确地解析肿瘤微环境(Tumor Microenvironment, TME)。
stKeep通过整合多模态数据和基因-基因相互作用,能够识别TME中的细胞模块和基因模块,以及细胞间的通信(Cell-Cell Communication, CCC)。
该方法利用异构图学习来捕捉细胞、基因和组织区域之间复杂的关系,进而识别出更精细的细胞状态和细胞状态特异性的基因-基因关系。此外,stKeep还使用对比学习来推断每个细胞的CCC模式,确保学习到的CCC模式在不同细胞状态之间具有可比性。
研究结果表明,stKeep在多种癌症样本中,如乳腺癌、肺癌、结直肠癌和肝转移癌中,都能超越其他工具,准确识别TME中的细胞状态,例如双潜能基底细胞群、肿瘤性肌上皮细胞和转移细胞。值得注意的是,stKeep能够识别与疾病进展相关的关键转录因子、配体和受体,这些发现通过独立临床数据的功能和生存分析得到了进一步验证,突出了其在临床预后和免疫治疗应用中的潜力。
文章还讨论了stKeep在分析人类背外侧前额叶皮层(DLPFC)数据集时的性能,以及如何通过细胞模块、基因模块和CCC来提高对异质细胞群的解析能力。此外,stKeep在分析三阴性乳腺癌(TNBC)样本时,能够识别出其他方法未能检测到的癌症细胞状态,并揭示了调节内部基因程序的机制,为临床靶向治疗和预后应用提供了可能。
最后,文章讨论了stKeep的灵活性和扩展性,包括将其应用于多组学数据分析,以及如何通过结合SRT数据和单细胞RNA测序(scRNA-seq)数据来提供对TME异质性的全面理解。
尽管存在一些局限性,如在识别基因-基因相互作用和组织区域划分方面可能需要进一步改进,但stKeep作为一种强大的工具,有助于深入理解肿瘤生态系统,并为癌症治疗提供新的视角。
重点关注
Fig. 6 展示了 stKeep 如何通过分析原发性结直肠癌 (P1) 和配对的肝脏转移样本 (LM1) 来识别转移细胞。
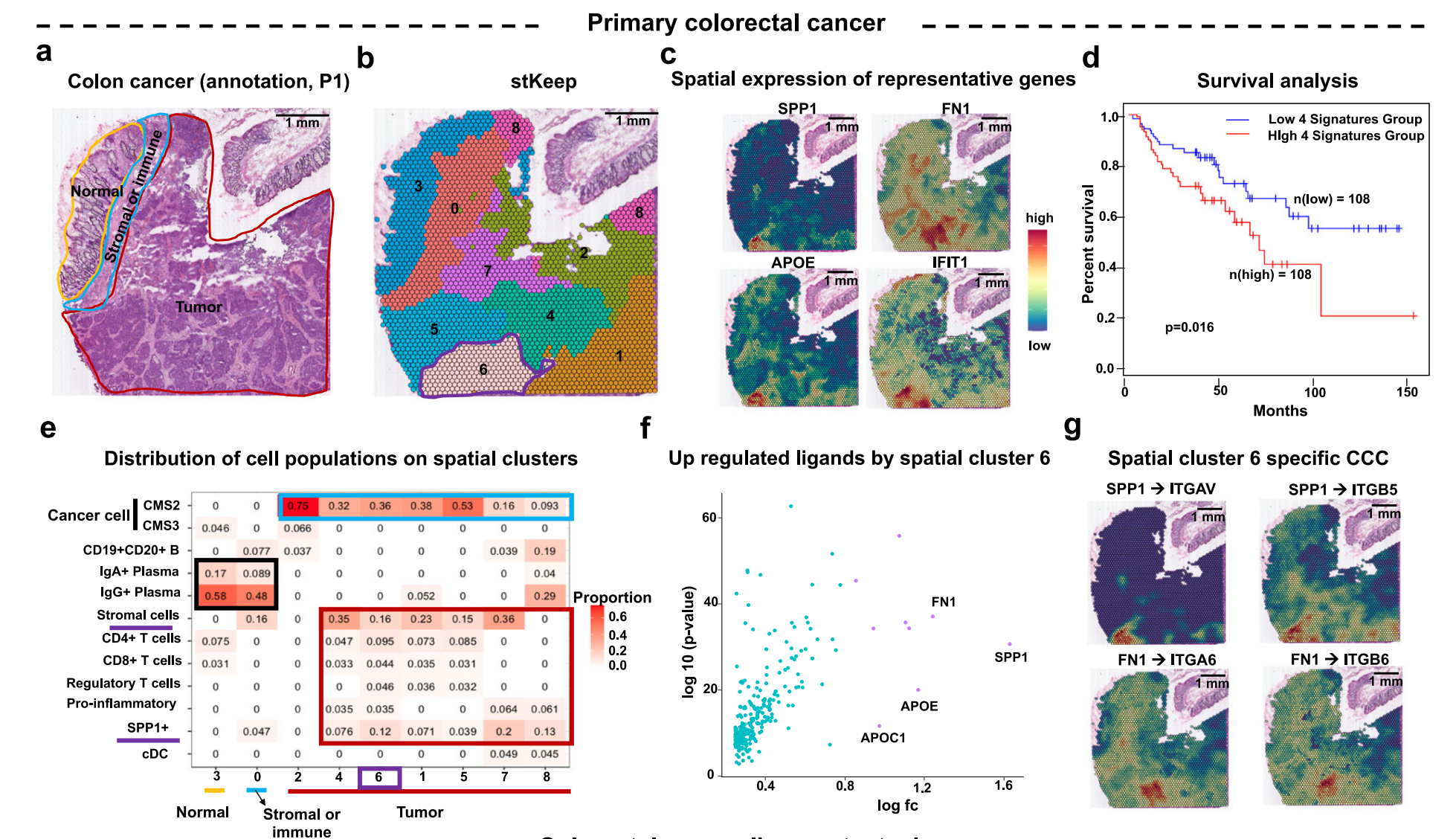
- a: 展示了 P1 组织的 H&E 染色图,手动标注了三个区域:癌症(红色)、基质和免疫(蓝色)以及正常组织(黄色)。
- b: stKeep 在 P1 样本上的空间聚类分析。
- c: 展示了代表性基因 SPP1、FN1、APOE 和 IFIT1 的空间表达。
- d: 基于 TCGA 数据库中 COAD 患者四种代表性基因的平均表达,使用 GEPIA2 进行的总体生存率分析,以及未调整的单侧 Log-rank 检验。
- e: 展示了不同空间聚类中细胞亚型比例的热图。
- f: 展示了空间聚类 6 中过表达配体的散点图,使用了未调整的双尾 Wilcoxon 检验。
- g: 展示了 LRPs(配体-受体对)的空间作用强度,包括 SPP1 → ITGAV、SPP1 → ITGB5、FN1 → ITGA6 和 FN1 → ITGB6。
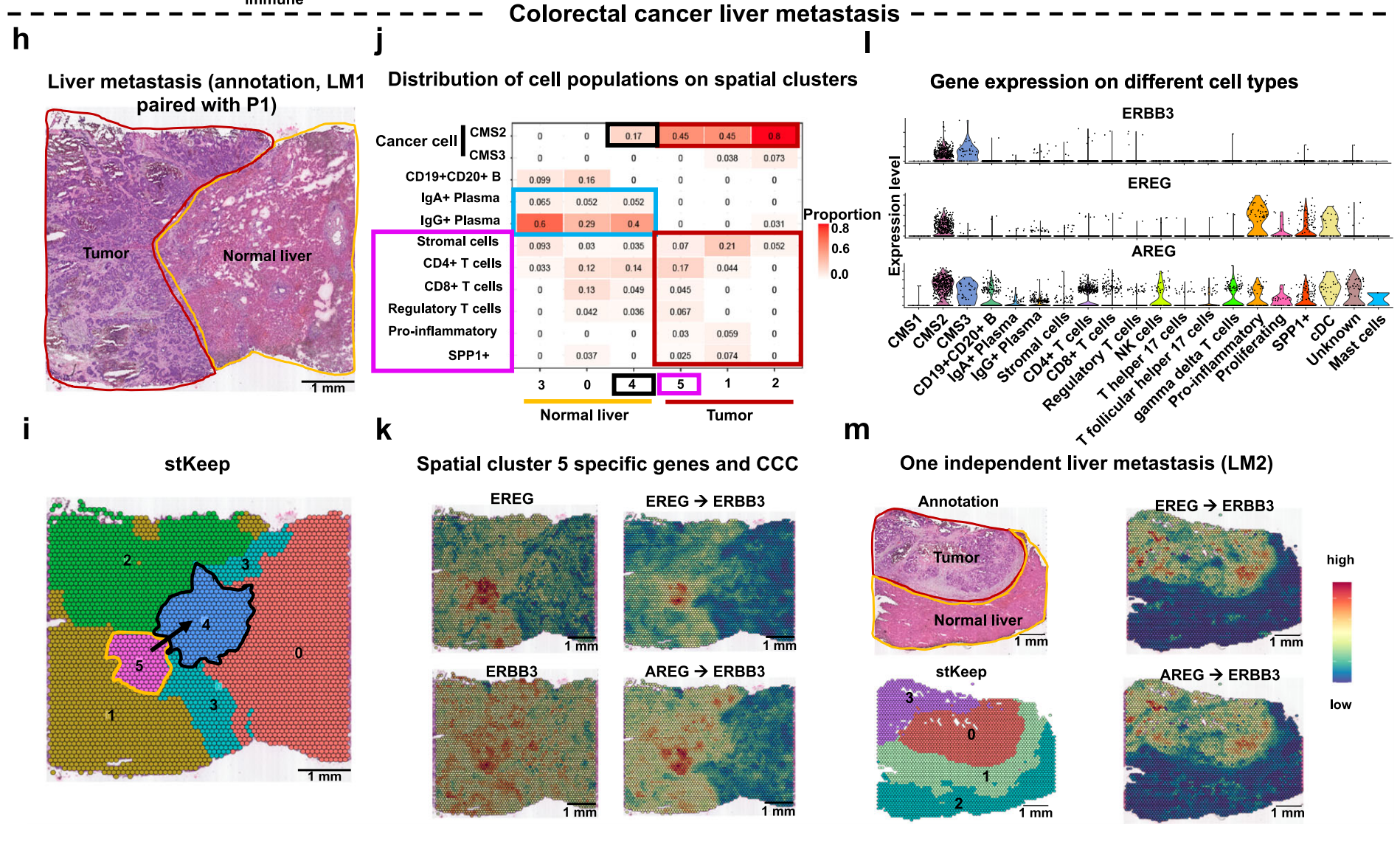
- h: 展示了 LM1 组织的 H&E 染色图,手动标注了两个区域,颜色与 a 中的一致。
- i: stKeep 在 LM1 样本上的空间聚类分析。
- j: 展示了不同空间聚类中细胞亚型比例的热图。
- k: 展示了高度表达的配体和受体的空间表达,以及它们相应 CCC(细胞间通信)的交互作用强度。
- l: 展示了不同细胞亚型中 ERBB3、EREG 和 AREG 基因表达的小提琴图。
- m: 展示了 LM2 组织的 H&E 染色图,手动标注了两个区域,并在左上角的小图中提供了空间聚类分析。stKeep 在 LM2 样本上的空间聚类分析,以及包括 EREG → ERBB3 和 AREG → ERBB3 在内的空间作用强度的 LRPs。
这些图表综合反映了 stKeep 在识别和分析癌症细胞转移方面的能力,特别是在结直肠癌及其肝脏转移中识别关键基因表达和细胞间通信模式方面。
三、放疗后脑肿瘤微环境的多维度空间重构分析

一作&通讯
| 角色 | 姓名 | 单位(中文) | 单位(英文) |
|---|---|---|---|
| 第一作者 | Spencer S. Watson | 洛桑大学肿瘤系 洛桑大学路德维希癌症研究所 洛桑Agora癌症研究中心 洛桑L. Lundin和家庭脑肿瘤研究中心 | Department of Oncology, University of Lausanne Ludwig Institute for Cancer Research, University of Lausanne Agora Cancer Research Center, Lausanne L. Lundin and Family Brain Tumor Research Center, Departments of Oncology and Clinical Neurosciences, Centre Hospitalier Universitaire Vaudois |
| 通讯作者 | Johanna A. Joyce | 洛桑大学肿瘤系 洛桑大学路德维希癌症研究所 Cancer Research UK, Cancer Grand Challenges iMAXT Consortium | Department of Oncology, University of Lausanne Ludwig Institute for Cancer Research, University of Lausanne Cancer Research UK, Cancer Grand Challenges iMAXT Consortium |
文献概述
这篇文章是关于一项研究,介绍了一种名为Hyperplexed Immunofluorescence Imaging (HIFI) 的空间蛋白质组学工作流程,该技术克服了现有高维成像技术在空间分辨率和组织异质性方面的限制。
HIFI 允许在高倍镜下同时分析超过45个标记物的脆弱组织切片,使用成本效益高的高通量工作流程。研究人员将HIFI与机器学习特征检测、基于图的网络分析和基于聚类的邻域分析相结合,分析了胶质母细胞瘤(glioblastoma)的临床前模型对放射治疗的反应,并将其与脑转移癌模型进行了比较。
研究表明,胶质母细胞瘤在治疗后会在免疫细胞群体和结构架构上进行广泛的空间重组,而脑转移癌则没有显示出类似的重组。尽管两种肿瘤模型从放射治疗中获得了等效的生存益处,但它们对放射治疗的反应高度不同。
胶质母细胞瘤是成人最常见的也是最具侵袭性的原发性脑肿瘤,其标准治疗包括手术切除、电离辐射(IR)和基于替莫唑胺的化疗,但这些治疗只会导致短暂的反应。因此,中位生存期仅略超过14个月,5年生存率小于5%。这种预后不佳主要是由于几乎所有情况下的肿瘤复发,这强调了需要更深入地了解推动治疗抵抗性的机制。
文章还讨论了肿瘤微环境(TME)如何响应IR,以及这如何通过几种机制调节IR的效力。研究揭示了不同治疗方式如何引起小鼠胶质母细胞瘤模型中免疫细胞群体的实质性变化,这些变化与最终的肿瘤复发有关。
然而,由于TME中细胞和细胞外相互作用的数量庞大,以及之前研究的高度专注性,许多推动这些促生存角色的一般机制仍然不确定。因此,越来越明显的是,需要将TME作为一个整体进行研究,以探究所有主要细胞类型之间的相互作用以及它们与肿瘤生态系统中结构特征的相互作用。
HIFI工作流程的设计旨在易于实施,使用开源软件,无需特殊实验室设备。所有免疫荧光(IF)染色都是使用标准台式方法和试剂手动完成的,所有成像都是使用传统的商业幻灯片扫描显微镜完成的。HIFI工作流程包括循环免疫荧光成像、全幻灯片图像对齐和注册、机器学习结构注释、深度学习细胞分割,以及基于聚类的细胞分类,以生成用于空间分析的高注释数字病理图像。
此外,文章还讨论了HIFI在不同类型的肿瘤样本中的有效性,包括在标准FFPE样本中的有效性。研究结果表明,HIFI是一种强大的工具,可以用于癌症组织以及任何其他类型的组织分析。HIFI方法的非破坏性、高通量和低成本特性使其对广泛的科学界具有吸引力和可访问性。
重点关注
图1展示了Hyperplexed Immunofluorescence Imaging(HIFI)工作流程的概览。
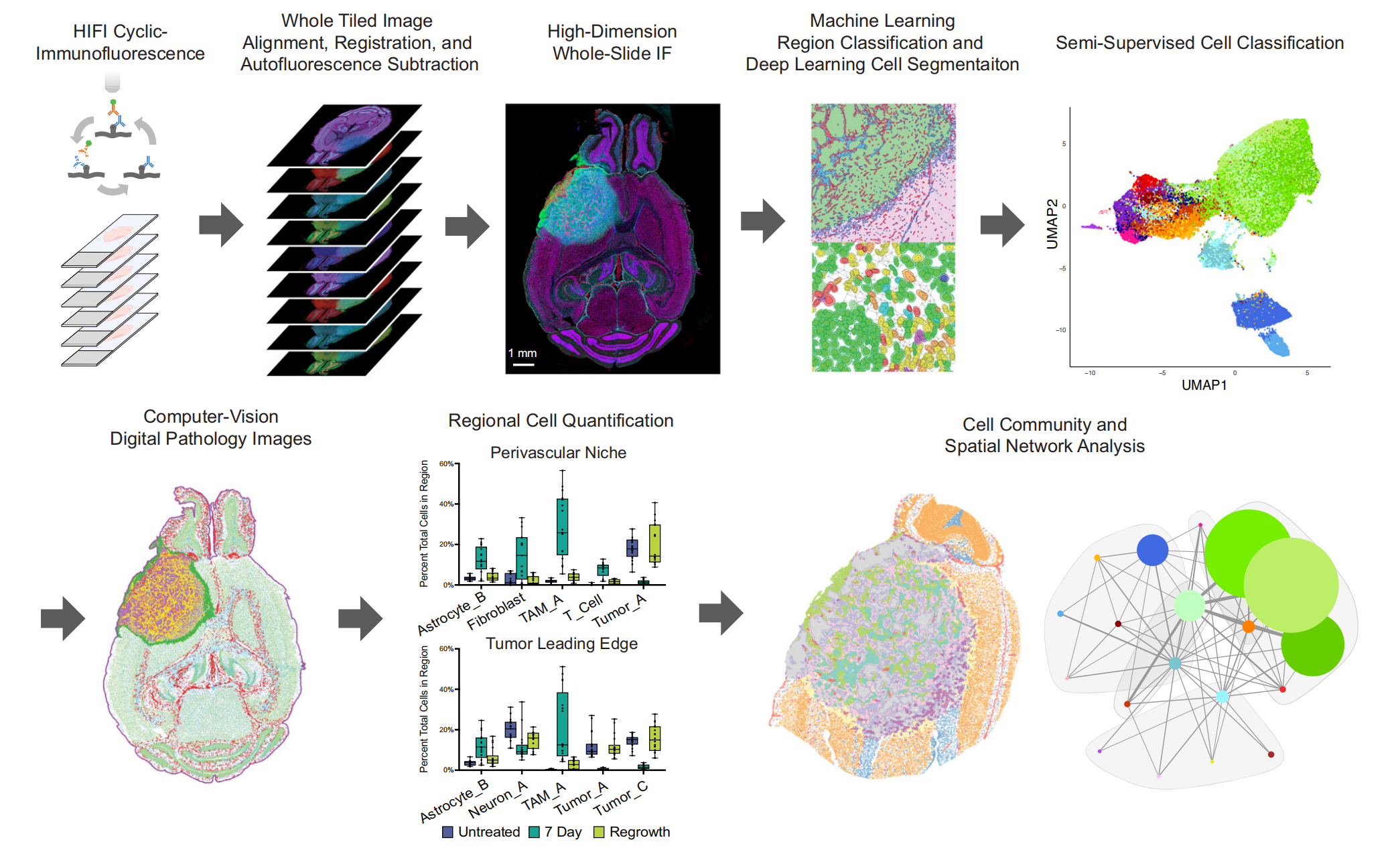
该流程首先进行循环免疫荧光染色,然后通过图像处理、对齐和注册来创建覆盖整个幻灯片切片的45维以上图像。
在HIFI图像的肿瘤特定区域内,使用训练有素的机器学习分类器自动进行注释,并且使用深度学习的目标检测技术对单个细胞进行分割。单细胞对象通过半监督分类被注释为个别的细胞类型,并重新映射回图像上,以创建高度注释的数字病理图像。
这些图像被用于分析区域性细胞组成和空间组织结构。HIFI工作流程可以扩展到超过100个同时进行的切片,适用于高通量的空间实验。
HIFI工作流程的关键步骤包括:
- 循环免疫荧光染色:使用多种标记物对组织切片进行多轮染色。
- 图像处理:包括平铺图像的拼接和背景校正。
- 图像对齐和注册:将多轮成像的数据对齐,创建无缝的全切片图像。
- 机器学习注释:使用训练好的分类器自动识别图像中的特定结构和区域。
- 深度学习细胞分割:利用深度学习算法对单个细胞进行分割。
- 半监督细胞分类:基于标记物的表达对细胞进行类型分类。
- 数字病理图像生成:将注释信息映射回图像,形成高度注释的数字病理图像。
- 区域性细胞分析:评估不同区域的细胞组成和空间组织。
- 高通量扩展性:该流程可扩展至同时处理超过100个切片,适用于大规模空间实验。
这种工作流程提供了一种强大的工具,可以在亚细胞分辨率下对肿瘤微环境中的细胞异质性和空间组织进行深入分析。
四、结合多实例学习和视觉变换器的组织病理学亚型预测方法
一作&通讯
| 角色 | 姓名 | 单位 |
|---|---|---|
| 第一作者 | 赵荣昌 (Rongchang Zhao) | 中南大学计算机科学与工程学院 |
| 通讯作者 | 李硕 (Shuo Li) | 凯斯西储大学计算机与数据科学系,生物医学工程系 |
文献概述
这篇文章提出了一种新型的多实例选择变换器(MIST)框架,通过结合多实例学习和视觉变换器,实现了对组织病理学亚型的准确预测,为癌症诊断和治疗提供了一种新的细粒度表示学习方法。
这项研究的动机是提高癌症诊断和肿瘤微环境分析的准确性。MIST框架通过结合多实例学习(MIL)和视觉变换器(ViT),设计了一种有效的选择性自注意力机制,以适应性地识别信息丰富的实例,进行细粒度的表示学习。
主要贡献包括:
- 提出一种新颖的选择性实例变换器(SiT),通过自注意力学习范式选择代表性实例,以学习组织病理学亚型预测中的实例级细粒度表示。
- 提出多实例特征解耦(MIFD),利用信息瓶颈将细粒度表示学习与组织病理学图像的判别表示相结合,进行准确的组织病理学亚型预测。
- 在五个临床基准测试中,MIST展示了其在组织病理学亚型预测中取得最先进的性能,准确率达到0.936。
研究还探讨了MIST的不同组件,包括选择性多头部自注意力(S-MSA)和基于信息瓶颈的损失函数,以及它们如何共同工作以提高模型的性能。此外,文章还讨论了MIST在处理具有挑战性的临床数据集时的有效性,并通过与其他最新技术方法的比较,证明了MIST的优越性。
最后,文章指出MIST的潜在应用前景,并讨论了其在全切片图像(WSI)分类问题中的局限性和未来工作的方向。
重点关注
图 1 描述了三个阻碍准确进行组织病理学亚型预测的挑战:
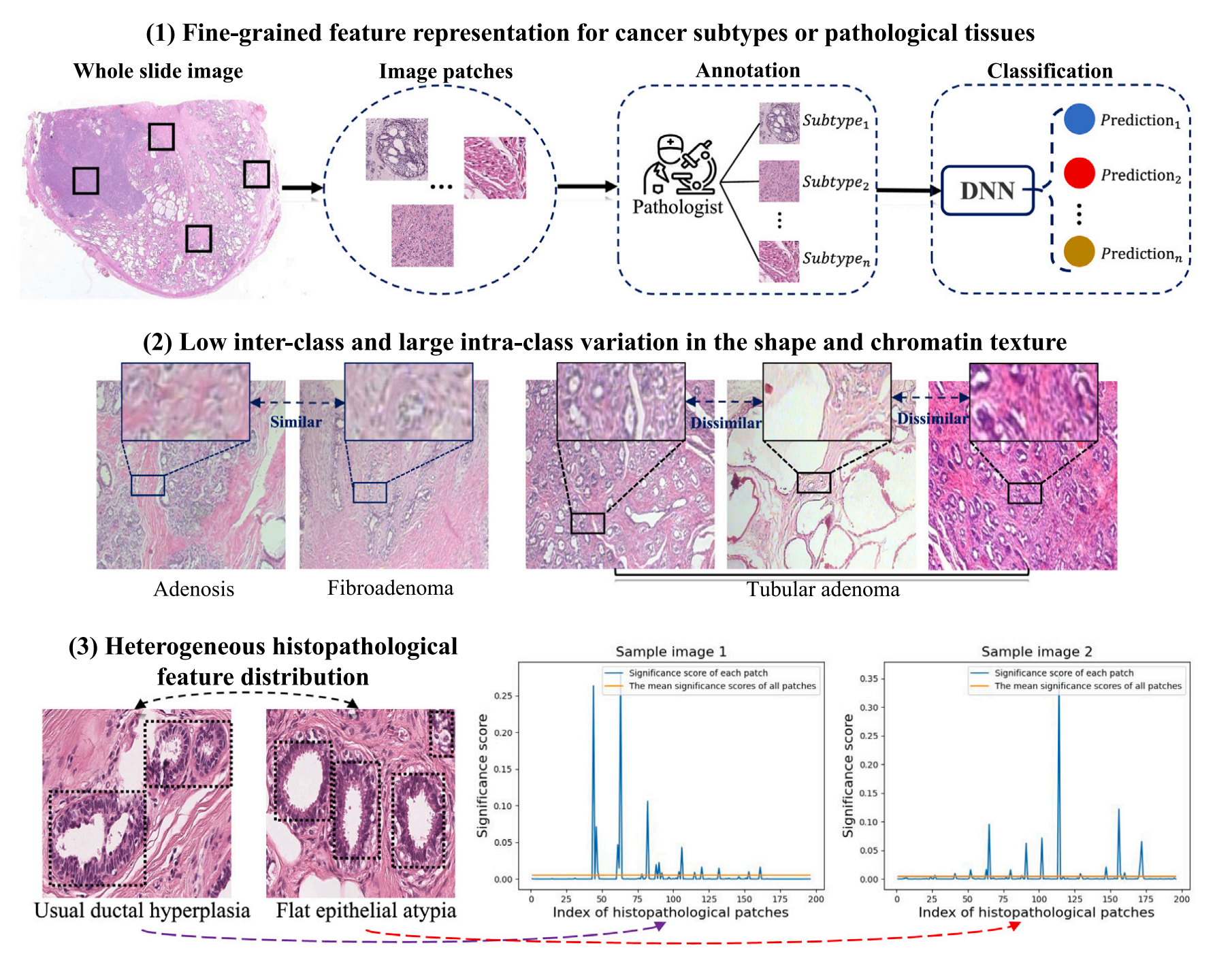
-
细粒度特征表示:对于癌症亚型或病理组织的细粒度特征表示是一个挑战。这意味着需要在组织病理学图像中区分非常微妙的特征,以便能够识别出不同的癌症亚型或病理组织。
-
类间差异小,类内差异大:组织病理学图像在形状和染色质纹理上具有低类间差异和大类内差异,这使得它们非常难以识别。换句话说,不同癌症亚型或病理组织之间的外观特征可能非常相似,而同一亚型内部的差异可能非常大,这给准确分类带来了困难。
-
异质性的组织病理学特征分布:不同图像中组织病理学特征的分布是不均匀的。如果使用统一的特征提取方法,可能会导致预测性能下降。因此,需要根据不同的组织病理学图像自适应地选择高度显著的病理区域,以提高预测的准确性。
这些挑战强调了在组织病理学图像分析中,需要开发能够识别和区分微妙特征、处理类内和类间差异以及适应不同图像特征分布的高级方法。MIST 框架正是为了应对这些挑战而设计的,它通过选择性地关注图像中的代表性实例,并结合多实例学习和视觉变换器,来提高组织病理学亚型预测的准确性。
五、乳腺导管原位癌向浸润性导管癌进展的分子机制与临床治疗策略

一作&通讯
| 角色 | 姓名 | 单位名称(英文) | 单位名称(中文) |
|---|---|---|---|
| 第一作者 | Jing Wang | The Key Laboratory of Cancer Prevention and Intervention, China National Ministry of Education, the Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou, China | 浙江大学医学院附属第二医院,中国教育部癌症预防与干预重点实验室,中国杭州 |
| 通讯作者 | Suzhan Zhang | Department of Pathology, the Fourth Affiliated Hospital, Zhejiang University School of Medicine, Yiwu, China | 浙江大学医学院附属第四医院病理科,中国义乌 |
| 通讯作者 | Jiaojiao Zhou | Cancer Center, Zhejiang University, Hangzhou, China | 浙江大学癌症中心,中国杭州 |
文献概述
这篇文章综述了乳腺导管原位癌(DCIS)向浸润性导管癌(IDC)的进展过程,探讨了其分子特征、临床意义,并讨论了个性化治疗策略的重要性。
DCIS的定义与分类
DCIS是乳腺癌的一种前期形式,特征是乳腺导管内上皮细胞的异常增殖。
它约占新诊断乳腺癌的20%,根据其结构模式和组织病理学核特征被分为不同的亚型。
进展挑战
DCIS到IDC的进展存在挑战,因为并非所有DCIS都会发展成为IDC,这导致了在治疗上的过度或不足。文章强调了区分非进展性和进展性DCIS的重要性。
分子特征与信号通路
DCIS和IDC在分子特征上存在差异,包括它们的固有亚型。文章讨论了乳腺癌中的关键信号通路,如ER途径、HER2信号途径、PI3K/AKT/mTOR途径等,这些通路可能在DCIS的起始和进展中起作用。
研究工具与技术
为了更好地理解DCIS到IDC的转变,文章总结了用于研究DCIS的有价值的工具和技术,包括单细胞测序、空间转录组学和人工智能等先进技术。
临床进展与治疗策略
文章讨论了DCIS和IDC的临床进展,包括预后生物标志物和临床管理。治疗策略包括手术、放疗、内分泌治疗等,但由于对DCIS进展风险的不确定性,这些治疗策略存在争议。
结论与未来方向
文章最后总结了DCIS研究的进展,并提出了未来研究的方向,强调了深入理解DCIS的生物学特性和其向IDC转变过程的重要性,以改善临床治疗和管理。
整体而言,这篇文章提供了对DCIS向IDC进展过程的全面了解,包括其分子机制、影响因素和当前的治疗挑战,同时指出了未来研究和临床应用的潜在方向。
重点关注
图4描述了肿瘤微环境(TME)在DCIS进展中的作用。
肿瘤微环境由多种组分构成,包括肌上皮细胞(MECs)、免疫细胞、成纤维细胞、血管、基底膜和细胞外基质(ECM)。
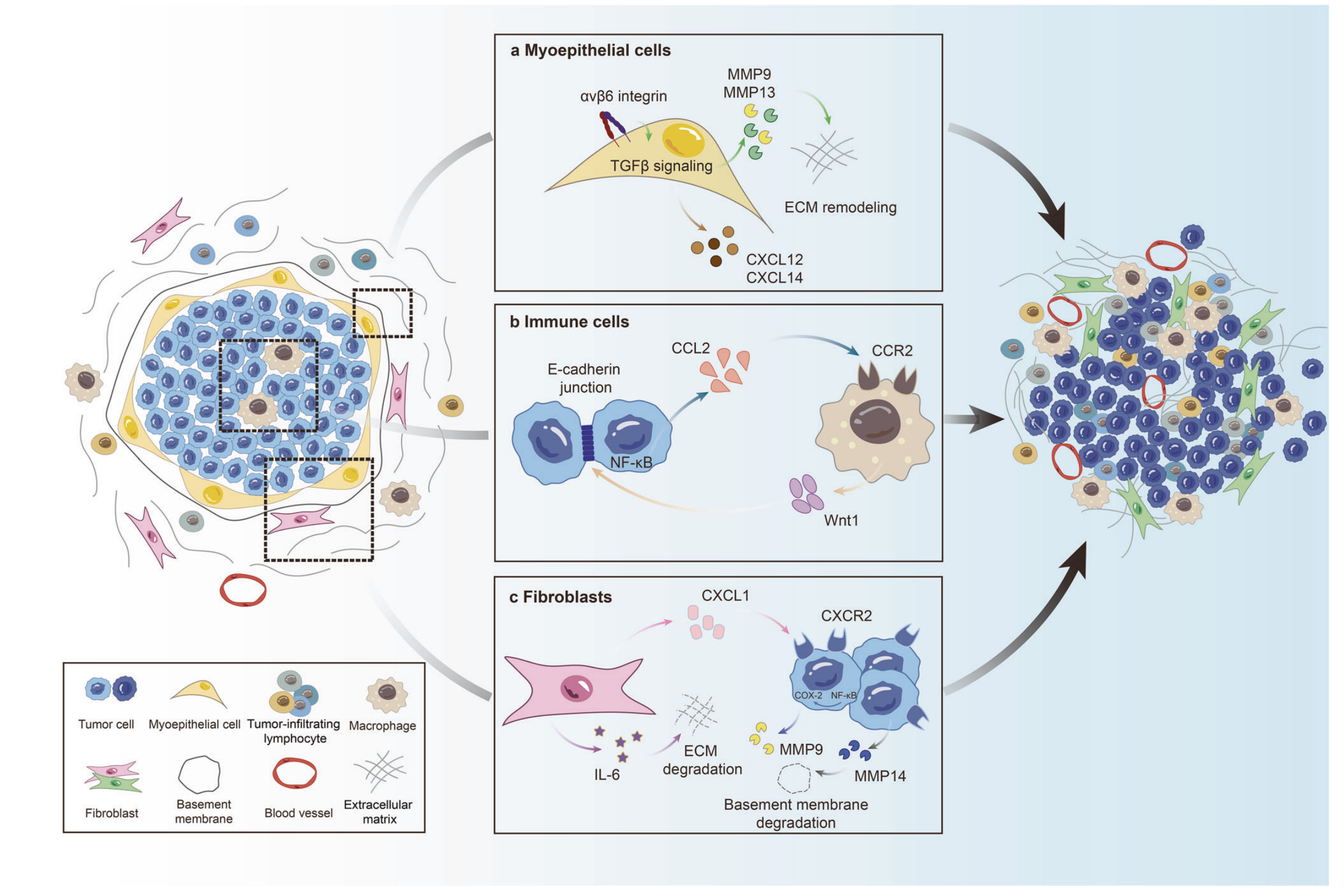
a. 肌上皮细胞(MECs)的作用:
- MECs在正常乳腺导管中起到物理屏障的作用,但在DCIS进展中,它们的功能可能发生变化。
- MECs中αvβ6整合素的上调激活了TGFβ信号通路,这导致基质金属蛋白酶9(MMP9)和MMP13的表达上调,进而促进ECM重塑。
- MECs分泌的CXCL12和CXCL14增加,这些趋化因子促进DCIS肿瘤细胞的侵袭。
b. 免疫细胞的作用:
- DCIS细胞产生的CCL2能够吸引巨噬细胞进入肿瘤,这增加了巨噬细胞分泌Wnt-1,有助于肌上皮层的破坏和E-钙粘蛋白连接的解体。
- 这种免疫细胞与肿瘤细胞的相互作用可能促进DCIS向IDC的进展。
c. 成纤维细胞的作用:
- 肿瘤相关成纤维细胞(CAFs)分泌的CXCL1和IL-6增加,这些因子激活了DCIS细胞中的NF-κB和COX-2。
- 这些信号通路的激活导致DCIS细胞中MMP9和MMP14的表达上调,进而导致ECM重塑和基底膜降解。
总结来说,图4展示了肿瘤微环境中不同细胞类型如何通过分泌信号分子和激活特定信号通路来促进DCIS的进展和侵袭。这些相互作用表明,肿瘤微环境不仅为肿瘤细胞提供了支持,还可能直接参与了肿瘤的侵袭和进展过程。
六、探索肿瘤微环境中的三级淋巴结构及其在免疫治疗中的作用

一作&通讯
| 角色 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Yuyuan Zhang | 郑州大学第一附属医院放射介入科 |
| 第一作者(共同) | Mengjun Xu | 郑州大学医学院 |
| 第一作者(共同) | Yuqing Ren | 郑州大学第一附属医院呼吸与危重症医学科 |
| 通讯作者 | Xinwei Han | 郑州大学第一附属医院放射介入科;郑州大学介入研究所 |
| 通讯作者 | Zaoqu Liu | 郑州大学第一附属医院放射介入科;河南省介入治疗与临床研究中心 |
文献概述
这篇文章综述了三级淋巴结构(Tertiary Lymphoid Structures, TLS)在肿瘤免疫中的异质性、功能及其在免疫检查点阻断治疗中的潜在应用。
TLS是类似于二级淋巴器官(Secondary Lymphoid Organs, SLOs)的免疫细胞聚集体,具有相似的功能。TLS通常与大多数癌症类型中的抗肿瘤免疫反应相关,但也观察到它在某些情况下会促进肿瘤免疫反应。
文章强调了TLS功能的异质性主要由肿瘤浸润性淋巴细胞(Tumor-Infiltrating Lymphocytes, TILs)的组成以及肿瘤相关TLS(Tumor-Associated Tertiary Lymphoid Structures, TA-TLS)中细胞亚群的平衡来决定。不同成熟度、密度和位置的TA-TLS可能对肿瘤免疫产生相反的效果。通常,成熟度和/或密度较高的TLS与有利的临床结果和免疫治疗反应相关,这主要是由于TA-TLS中不同免疫细胞亚群之间的相互作用。
此外,文章还讨论了TLS作为预测免疫检查点阻断(Immune Checkpoint Blockade, ICB)疗效的标记物的潜力。为了增强抗肿瘤免疫,开发有效的TLS成像和诱导方法至关重要。文章探讨了将成像技术与生物材料(包括纳米探针和水凝胶)以及人工智能(AI)相结合,实现TLS的非侵入性体内可视化。
文章还详细讨论了TLS的形成和成熟过程,以及免疫细胞在TLS内的相互作用如何促进抗肿瘤免疫。此外,还总结了TLS的当前诱导策略,并讨论了其未来发展的困境和解决方案。
最后,文章强调了TLS在肿瘤免疫中的关键作用,并提出了新的治疗策略,旨在通过增加ICB治疗的疗效和预测预后来探索TLS的潜力。
重点关注
Fig. 3 描述了用于定量分析三级淋巴结构(TLS)的策略。
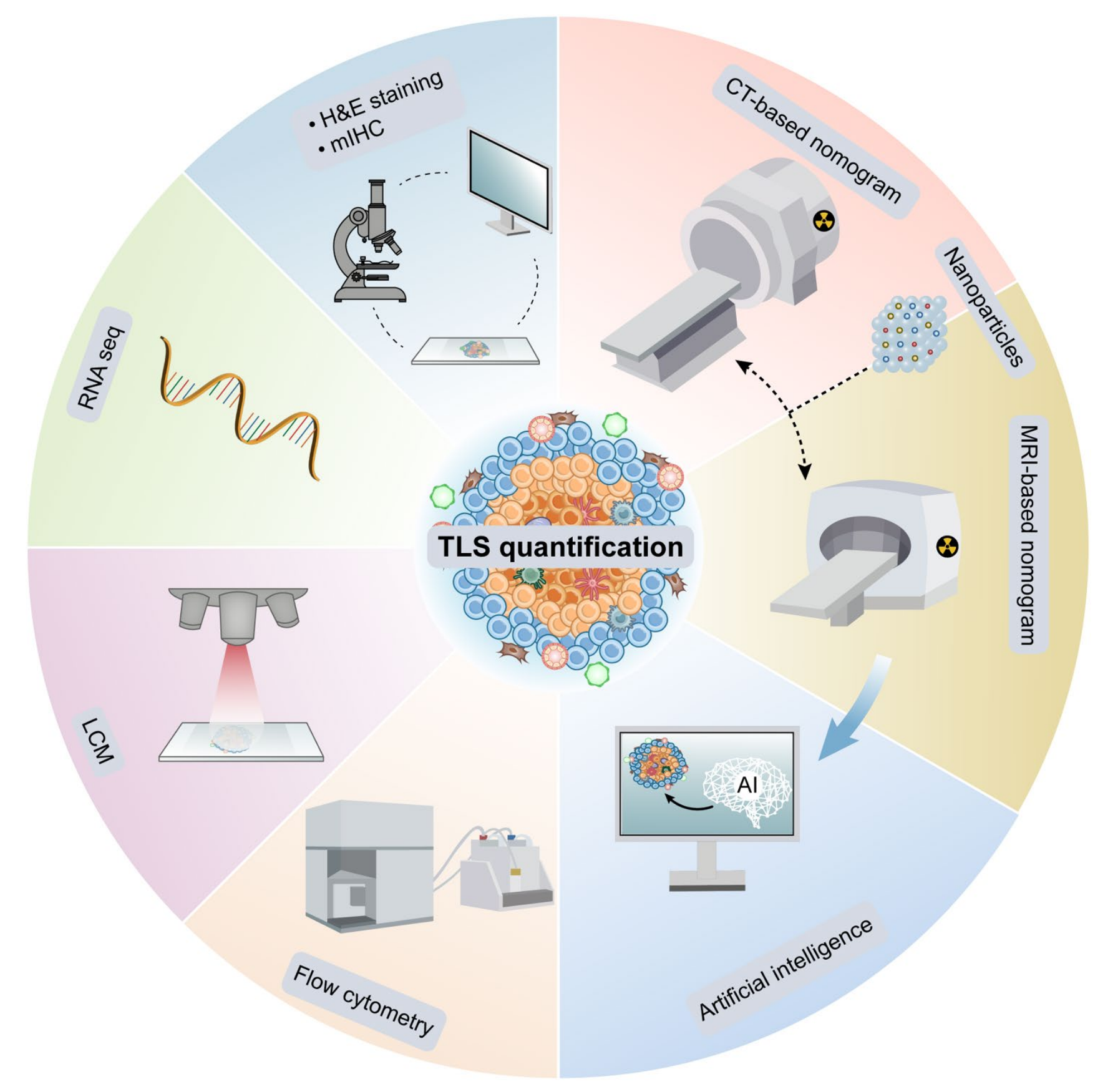
TLS作为预测癌症检测和免疫反应的标记物,可以通过多种方法进行检测和定量:
- H&E染色:利用传统的Hematoxylin和Eosin染色技术在组织切片上观察和识别TLS。
- 多重免疫组化(mIHC):使用多种抗体对组织切片进行染色,以识别不同类型的细胞和结构。
- 激光捕获显微切割(LCM):一种技术,允许研究人员从组织切片中精确地切取特定细胞群或结构,以便进一步分析。
- 空间转录组学:一种高通量技术,可以在单细胞水平上分析细胞的空间分布和基因表达。
- 流式细胞术:一种用于快速测量和分析细胞特性(如大小、复杂性和表面标志物)的技术。
此外,图3还强调了纳米材料和人工智能(AI)在TLS检测中的应用:
- 纳米探针:利用纳米技术制造的探针,可以特异性地结合到TLS或其他生物标记物上,并通过各种成像技术进行检测。
- 基于CT的纳米探针成像:结合了纳米技术和计算机断层扫描(CT)的成像方法,可以在体内无创地检测TLS。
- AI算法:应用人工智能算法分析成像数据,提高TLS检测的效率和特异性。
总之,Fig. 3 展示了一个多技术平台,这些技术结合使用可以提高TLS的检测能力,为癌症的早期诊断和免疫治疗反应的评估提供支持。通过这些方法,研究人员可以更深入地了解TLS在肿瘤免疫中的作用,并为癌症治疗提供新的策略。























 863
863

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








