Nat Neurosci :大脑奖赏系统的核心 — 伏隔核内壳和腹侧苍白球的新发现
2021 年 03 月 11 日 07:35 新浪网 作者 脑科学世界
文献解读
作者:杨奔
单位:美国西北大学
饮食不仅仅受体内稳态需求(homeostatic need)的调控,还受奖赏享乐需求(hedonic need)的调控,并受环境、学习、记忆、情绪等影响。比如在面对可口的食物的时候,动物会摄入更多的食物来储存能量。
对饮食调控的研究有助于我们了解暴饮暴食、肥胖症、厌食症等进食障碍的神经学机制,并为治疗提供更好的方案。
大脑中有个叫纹状体(striatum)的脑区。纹状体分背侧(dorsal)和腹侧(ventral)。通常所说的纹状体指的是背侧纹状体,在灵长类中又分尾状核(caudate) 和壳核(putamen),腹侧纹状体通常又称为伏隔核(nucleus accumbens,NAc)。背腹侧纹状体均接收来自中脑的多巴胺信号。
背侧纹状体和其他一些脑区构成基底核(basal ganglia)结构,主要负责由多巴胺介导的运动的调控和学习,习惯的形成等。腹侧纹状体,也就是伏隔核与另外一些脑区连接,包括大脑中被称为边缘系统(limbic system)的脑区,故伏隔核也称边缘纹状体(limbic striatum)。边缘系统主要调控情绪,记忆等功能,而伏隔核主要参与由多巴胺介导的奖赏、愉悦等行为,和饮食(尤其是享乐性饮食)、成瘾等相关。
伏隔核在结构上分为中间的核心(core)和两边的壳(shell),壳再分为内侧壳(medial shell)和外侧壳(lateral shell)。在功能上,不同区有差异。伏隔核对奖赏和饮食调控的研究大多关注内侧壳(medial shell of NAc,mNAcSh),包括今天要介绍的这篇文章。
已去世的 Ann Kelley 在上世纪经过几十年的对大脑编码 “喜欢”(liking)研究提出伏隔核壳(the nucleus accumbens shell,NAcSh)在饮食调控中起到 “感官哨兵”(sensory sentinel)的作用,即伏隔核壳神经元通过感知外界坏境变化来调控奖赏和饮食行为 (Kelley et al., 2005; Richard et al., 2013)(这两篇综述中第一篇是 Ann Kelley 等人所写,第二篇是 Ann Kelley 的追随者们为纪念去世的 Ann Kelley 所写)。
Kelley 等人通过药理学的方法激活伏隔核内壳(mNAcSh)可抑制饮食,而抑制伏隔核内壳可促进饮食 (Kelley et al., 2005)。在体记录也证实饮食的起始和持续都需要先暂停伏隔核内壳神经活性 (Krause et al., 2010),支持伏隔核内壳的 “感官哨兵” 的功能。虽然整个伏隔核都参与饮食调控,但享乐性饮食和奖赏行为主要由伏隔核内壳调控 (Peciña and Berridge, 2005)。
伏隔核内壳下游主要投射到腹侧苍白球(ventral pallidum,VP),外侧下丘脑(lateral hypothalamus, LH),和中脑腹侧被盖区(ventral tegmental area,VTA)等。腹侧苍白球也参与奖赏、愉悦等行为,和饮食(尤其是享乐性饮食)、成瘾等相关。
伏隔核内壳和腹侧苍白球一起被认为是大脑奖赏系统的核心。但近两三年美国巴尔的摩约翰・霍普金斯大学的 Patricia Janak 团队的研究发现腹侧苍白球对奖赏信号的编码比伏隔核内壳更早且更强,并且也编码奖赏预测误差(reward prediction error,RPE),且也比伏隔核内壳更早 (Ottenheimer et al., 2018; 2020),提示腹侧苍白球是重要的奖赏中心,而不仅仅是伏隔核下游信号的中转站。
而另一边对伏隔核内壳到外侧下丘脑和中脑腹侧被盖区的投射的研究指出伏隔核内壳在饮食上的 “感官哨兵” 的功能主要通过到这两个脑区的投射来执行 (Bond et al., 2020; O’Connor et al., 2015)。当然,这些投射的更多细节以及伏隔核内壳的其他投射是否也调控饮食仍有待研究(详见作者写的一篇短评 (Yang, 2021))。
那么伏隔核内壳上游接收来自那些脑区的投射呢?也就是伏隔核内壳自身的活性是如何受调控的?
伏隔核内壳主要接收来自前额叶皮层(Prefrontal cortex,PFC),海马体(hippocampus),丘脑(thalamus),和杏仁核之底側核(basolateral amygdala,BLA)的兴奋性投射,和来自中脑腹侧被盖区(VTA)的多巴胺投射。但对伏隔核内壳接收的抑制性投射了解甚少。
上文提到的腹侧苍白球是伏隔核的主要下游,但也有神经通路示踪研究指出腹侧苍白球可能也会投射回伏隔核。更重要的是上文提到的 Patricia Janak 团队的研究发现腹侧苍白球对奖赏信号的编码比伏隔核内壳更早,提示腹侧苍白球在奖赏编码上可能是伏隔核内壳的上游。因腹侧苍白球神经元主要是 GABAergic(释放抑制性的 γ- 氨基丁酸),那么腹侧苍白球会不会是通过抑制伏隔核,从而促进奖赏行为,包括享乐性饮食?
近日,来自圣路易斯华盛顿大学(Washington University in St. Louis)医学院的 Meaghan Creed 团队在 Nature Neuroscience 上发表 Ventral Arkypallidal Neurons inhibit Accumbal Firing to Promote Reward Consumption 的文章(Yvan M. Vachez 博士和 Jessica R. Tooley 博士生为并列一作),证实腹侧苍白球神经元中存在一个亚群 arkypallidal 神经元投射回伏隔核内壳,通过抑制伏隔核内壳促进奖赏行为。

Meaghan Creed 在瑞士著名神经科学家 Christian Lüscher 实验室做博后的时候就对腹侧苍白球神经元非常感兴趣,并用电生理学的方法记录了伏隔核到腹侧苍白球的投射 (Creed et al., 2016)。Creed 说(作者译,源自作者和 Creed 交流,下同):“在做这些实验的时候,我立刻就注意到很明显的腹侧苍白球神经元非常多元,不管是形态上还是电生理活性上。所以在成立自己的实验后我就接着研究腹侧苍白球。”
三年前,Creed 实验室第一篇文章就鉴定了腹侧苍白球存在一个兴奋性(glutamatergic)亚群的功能 (Tooley et al., 2018)。同年,加州大学圣地亚哥分校的 Thomas Hnasko 团队 (Faget et al., 2018),以及去年初冷泉港实验室的华人学者李博团队 (Stephenson-Jones et al., 2020) 也发文研究了腹侧苍白球兴奋性(glutamatergic)神经元,三文均指出其与经典的抑制性(GABAergic)神经元功能相反。
Creed 说:“我们知道伏隔核壳活性在饮食时被抑制,但对这个抑制的来源我们一直不太清楚。而另一边我们知道腹侧苍白球编码奖赏,促进饮食。所以我们提出假设,腹侧苍白球可能是伏隔核壳的主要抑制来源。” 通过研究,Creed 等人证明了他们的假设是对的,腹侧苍白球对伏隔核壳的抑制来自一个新鉴定的 arkypallidal 亚群神经元。
首先解释一下这个亚群的命名。整个纹状体,包括背腹侧,主要的投射神经元是多刺投射神经元(spiny projection neurons,SPNs,过去也称中型多棘神经元 medium spiny neurons,MSNs,但中型的称呼并不十分准确,故现在多称 SPNs),占纹状体细胞 95%以上。
SPNs 根据多巴胺受体表达分为两类:表达 D1 类受体的 D1-SPNs 和表达 D2 类受体的 D2-SPNs(见图一)。背侧纹状体 D1-SPNs 直接投射到基底核的出口脑区,故 D1-SPNs 也称直接通道 SPNs(direct pathway SPNs,dSPNs)。背侧纹状体 D2-SPNs 通过外侧苍白球 (external globus pallidus, GPe) 和丘脑底核 (subthalamic nucleus, STN) 再投射到基底核出口,故 D2-SPNs 也称间接通道 SPNs(indirect pathway SPNs,iSPNs)。
对应背侧纹状体,伏隔核最初也被认为存在着 dSPNs 直接投射到中脑和 iSPNs 经腹侧苍白球到中脑。但后来的研究发现直接和间接通道并不适用于伏隔核,D1-SPNs 也大量投射到腹侧苍白球 (Kupchik et al., 2015)。故伏隔核 SPNs 不再用直接和间接的称呼,再加上历史原因,伏隔核领域科学家多用 D1-MSNs 和 D2-MSNs。
基底核领域科学家后来发现在间接通道上外侧苍白球 (GPe) 里还存在着一个亚群投射回背侧纹状体,为区分典型的只投射到下游的亚群,他们将这个投射回纹状体的亚群称为 arkypallidal GPe 神经元,对应的典型的下游投射的神经元称为 prototypical GPe 神经元 (Mallet et al., 2012)。于是,对应 GPe,Meaghan Creed 等人将投射回伏隔核内壳的腹侧苍白球亚群称为 arkypallidal VP(简称 vArky)神经元。

图一:作者画的简图
上半部分为背侧纹状体(dorsal striatum)投射通道,所有核团构成基底核(basal ganglia)结构,D2-SPNs 投射出来的通道称为间接通道(indirect pathway),间接投射到基底核出口核团,D1-SPNs 投射出来的通道称为直接通道(direct pathway),直接投射到基底核出口核团;下半部分为伏隔核(NAc)投射通道,直接间接并不适用伏隔核投射。从 GPe 投回纹状体的细胞称为 arkypallidal GPe 神经元,从 VP 投回伏隔核的细胞称为 arkypallidal VP 神经元,简称 vArky。STN 到 GPi/SNr 为激活(glutamatergic),其它均为抑制(GABAergic)。
首先研究人员在体记录了伏隔核内壳神经元,证实在小鼠饮用可口的雀巢可可水时,伏隔核内壳神经元活性约 36% 被抑制,11% 被激活,53%不变。另外在小鼠饮水时闭环抑制伏隔核内壳神经元可延长饮水时间。这些发现与以往的研究都是一致的,证实抑制伏隔核内壳神经元可促进奖赏性行为。
为证实腹侧苍白球投射到伏隔核内壳,研究人员将逆向珠(retrobeads,带荧光的可逆向传输的珠子)注入伏隔核内壳,发现腹侧苍白球被标记。标记的腹侧苍白球神经元大多只表达囊泡抑制性氨基酸转运蛋白(vesicular inhibitory amino acid transporter,VIAAT),而不表达 2 型囊泡谷氨酸转运蛋白 (vesicular glutamate transporter 2, vGluT2),证实腹侧苍白球到伏隔核内壳的投射是抑制性的 GABAergic。
研究人员接着在 D1-cre, A2A-cre(标记 D2 神经元),PV-cre(标记快速放电中间神经元 fast-spiking interneurons, FSIs)和 ChAT-cre(标记胆碱能 cholinergic interneurons)小鼠中用单突触狂犬病病毒(monosynaptic rabies virus)示踪技术证实腹侧苍白球主要投射到伏隔核内壳的 D1-MSNs 和 D2-MSNs 上,较少投射到中间神经元上。
研究人员接着又结合光遗传(ChR2 光感离子通道蛋白)和电生理的方法证实腹侧苍白球到伏隔核内壳的投射是单突触抑制性投射。
结合光遗传和在体记录也证实激活腹侧苍白球的这些 arkypallidal terminals 抑制伏隔核内壳神经元活性。Creed 说:“该研究最让人意外的就是腹侧苍白球到伏隔核内壳的投射,也就是 vArky 的投射,竟然会这么强且这么广。这些投射事实上是非常精细的。如果你在腹侧苍白球表达 ChR2,你会看到经典的腹侧苍白球下游,如中脑(midbrain)、丘脑(thalamus)、外侧缰核(lateral habenula)有很明显的投射,但在伏隔核你可能都看不到投射。我们用免疫荧光的方法放大信号后才看到 vArky 的投射竟然覆盖了整个伏隔核。电生理记录显示 70% 以上的 MSNs 都接收来自腹侧苍白球的投射。”
文章中显示研究人员共记录了 118 个 D1-MSNs,84% 接收来自腹侧苍白球的投射, 117 个 D2-MSNs,79% 接收来自腹侧苍白球的投射。
因抑制伏隔核内壳神经元会促进奖赏行为,那么这些抑制伏隔核内壳神经元活性的 vArky 神经元活性应该和奖赏行为正相关。
为记录 vArky 神经元,研究人员在伏隔核内壳注射逆向 AAV-cre 病毒,在腹侧苍白球注射 cre 依赖的 GCaMP6s 钙荧光指示蛋白,从而特异性标记投射回伏隔核内壳的 vArky 神经元,通过光纤光度记录(fiber photometry)vArky 活性。
研究人员发现 vArky 活性越高时小鼠饮可可水的时间也越久,两者呈正相关性。另外 vArky 活性在饮水之前上升,在饮水起始后达到最高值,而伏隔核内壳神经元活性在饮水后下降,稍滞后于 vArky 活性变化,这与 vArky 通过抑制伏隔核内壳神经元促进奖赏行为的假设是一致的。
之前的闭环抑制伏隔核内壳神经元活性实验证实抑制伏隔核内壳可延长饮水时间,那么激活 vArky 应该也可以延长饮水时间。
为证明该假设,研究人员在腹侧苍白球表达 ChR2 光感离子通道蛋白,在伏隔核内壳做终端激活,在小鼠饮水时闭环激活腹侧苍白球到伏隔核内壳的投射延长了饮水时间,但不影响饮水次数。另外小鼠不在饮水时的开环刺激,出水口不出水的时候的刺激,均不能影响饮水行为,说明 vArky 只能促进奖赏行为,而不能诱导奖赏行为。激活 vArky 也不影响小鼠运动,不影响条件性位置偏爱,说明 vArky 不调控运动也不直接诱导奖赏效应。
激活 vArky 到伏隔核内壳的投射能促进奖赏行为,那么抑制 vArky 到伏隔核内壳的投射,从而减少了伏隔核内壳的抑制,是否会增强伏隔核内壳活性并抑制奖赏行为?
为了特异性抑制投射到伏隔核内壳 vArky 神经元,研究人员再次在伏隔核内壳注射逆向 AAV-cre 病毒,在腹侧苍白球注射 cre 依赖的抑制性的光感离子通道蛋白 Arch3.0。在小鼠饮水时闭环抑制 vArky 神经元部分阻断了饮水时伏隔核内壳活性的降低,同时饮水时长也降低了,但饮水次数不变,再次证明 vArky 促进和维持奖赏行为,而不能诱导奖赏行为。
Creed 说:“这个研究中最难的可能就是上面这个实验,因为要在伏隔核内壳注射 AAV-cre 病毒,然后再插入一个记录电极记录伏隔核内壳神经元活性,然后在腹侧苍白球也要注射 AAV-DIO-Arch3.0,然后再插入光纤抑制腹侧苍白球神经元活性。也就是在脑的同一侧要进行多次操作,每次都要高度精准才能得到有效的实验结果。”
奖赏行为在理论上可以分为两部分:“想要”(wanting,对奖赏的动机)和 “喜欢”(liking,奖赏的享乐价值 hedonic value)。“想要” 可以诱导奖赏行为,“喜欢” 一般不直接诱导奖赏行为,但可以增强奖赏行为。vArky 增强奖赏行为,而不直接诱导奖赏行为说明 vArky 编码 “喜欢” 而不编码 “想要”。
为进一步区分两者的差别,研究人员最后设计了以下几个实验:
1)在小鼠饮水(这里改用 10% 糖水)之后用光遗传的方法刺激 vArky 到伏隔核内壳的投射,发现小鼠饮水后的舔舌头动作(间接指示对饮水的喜欢程度)增加了;
2)给小鼠两瓶一样的巧克力奶,但在饮其中一瓶的时候同时光刺激 vArky 到伏隔核内壳的投射,结合光刺激的那瓶巧克力奶饮用时间更长,饮用量更大,说明光刺激增强的喜欢程度;
3)最后给小鼠口腔直接注射三种饮水:糖水,白水,苦水(奎宁),同时光纤光度记录(fiber photometry)vArky 活性(伏隔核内壳逆向 AAV-cre 表达 cre 依赖的 GCaMP6s),vArky 活性在注射糖水时升高最快最高,白水其次,苦水最低,而当小鼠拒绝饮用苦水时 vArky 活性下降了,证实 vArky 活性跟喜欢程度成正相关。
综上,虽然之前有报告腹侧苍白球可能会投射回伏隔核内壳,但该文章首次系统地研究了腹侧苍白球到伏隔核内壳的投射。沿用外侧苍白球投射回纹状体的亚群命名(arkypallidal GPe 神经元),研究人员将这群投射回伏隔核内壳的腹侧苍白球神经元命名为 arkypallidal VP 神经元,简称 vArky。研究证实 vArky 是伏隔核内壳的主要抑制性输入,通过抑制伏隔核内壳从而促进奖赏性行为(该文主要用了享乐性饮水行为)。进一步的研究证实 vArky 编码 “喜欢” 但不编码 “想要”,vArky 的活性和喜欢程度呈正相关,但不能直接诱导奖赏行为。
作者短评:伏隔核和腹侧苍白球组成大脑的奖赏中心。
对伏隔核,神经科学家已经研究多年。对腹侧苍白球的研究相对少一点。近几年,神经科学家将神经科学研究新的方法重新应用到对腹侧苍白球(如本文解读的 vArky 研究、上面提到的 Janak 的研究和华人学者李博的研究等),让我们对腹侧苍白球有了新的认识,但仍有更多的问题尚待解决。
-
比如 Janak 的研究指出腹侧苍白球神经元中部分编码即时奖赏,部分编码奖赏预测误差(reward prediction error,RPE),那么两者的电生理活性、神经通路投射、神经标示表达是否有差异?vArky 是否也编码奖赏预测误差?如果是的话,其对奖赏预测误差的编码是在早于(上游)还是晚于(下游)伏隔核?
-
该研究显示 vArky 投射到 D1-MSNs 和 D2-MSNs,那 vArky 是否接收伏隔核的投射,如果是又是来自哪些神经元,是 D1 - 和/或 D2-MSNs?
-
根据该文结果,在小鼠饮水时,我们预计 vArky 激活,同时抑制 D1 - 和 D2-MSNs,那么 D1 - 和 D2-MSNs 活性应该都下降。而 Christian Lüscher 之前的一篇研究指出在小鼠饮水时 D1-MSNs 活性显著下降,而 D2-MSNs 活性没有显著下降 (O’Connor et al., 2015)。但如果细看结果,Lüscher 等人其实只记录了 4 个 D2-MSNs,其中 3 个活性没下降,1 个有下降,所以伏隔核内壳 D1 - 和 D2-MSNs 活性在饮水时的变化和功能或许还需要重新更细致的研究,尤其是 D2-MSNs,他们主要的投射就是腹侧苍白球,而他们在饮食中的作用研究很少。
-
在基底核中,prototypical GPe 神经元中大部分只投射到下游,但少部分投射到下游同时也投射回纹状体 (Mallet et al., 2012)。那么腹侧苍白球经典的神经元(对应 GPe 的命名,应该也称为 prototypical VP 神经元)是否也有两部分,主要的一部分神经元只投射到下游中脑,但另小部分投射到下游中脑同时也投射回伏隔核?如果是,那么这部分两边都投射的腹侧苍白球神经元,和只投射回伏隔核的 vArky 在电生理活性、神经标示表达、和奖赏编码上有何不同?vArky 和 prototypical VP 神经元两者之间是否互相抑制?如果是,那么激活伏隔核到腹侧苍白球的投射对 vArky 的净活性调控是否是激活,就像激活背侧纹状体 iSPNs 到外侧苍白球的投射通过抑制 prototypical GPe 神经元从而去抑制(净激活)arkypallidal GPe 神经元 (Aristieta et al., 2021)?
-
Ann Kelley 提出的伏隔核内壳的 “感官哨兵” 的功能,vArky 是否会抑制该功能?如果会,那么是在怎样的生理条件下,动物和人在感知危险时仍要继续饮食而无视眼前的危险?还是说在暴饮暴食、肥胖症等病理条件下,vArky 的活性异常增强,使人们失去了正常的对饮食的抑制的生理功能?
奖赏、饮食、成瘾是热门的神经科学研究领域,更多的研究将有助于我们更好的理解进食障碍、肥胖症、毒品成瘾、精神病(包括抑郁,焦虑,双相障碍)等问题,并为治疗提供新方案。
Meaghan Creed 回应作者短评(作者译)
-
我们没有设计实验去验证 vArky 是否编码奖赏预测误差。不过在给小鼠口腔直接注射饮水的实验中,我们用了类似随机地给水的设计,这样小鼠不能预测接下来给的是什么水。我们发现即使当小鼠意外得到苦水(奎宁)的时候,vArky 也没有显示出奖赏预测误差信息。所以我们认为 vArky 应该编码即时奖赏。
-
我们正在做实验来回答这个问题。
-
我同意。O’connor 等人的文章强调 D1-MSNs 的饮食中的作用,但他们确实也看到在 4 个 D2-MSNs 中也有 1 个在小鼠饮甜水时活性被抑制。这个过去几十年对伏隔核内壳的研究是一致。过去虽然不能区分 D1 和 D2-MSNs,但在饮食时超过 70% 的伏隔核内壳神经元活性被抑制,这么高的百分比说明肯定不是 D1-MSNs 特异性。O’connor 等人的研究的关键是 D1-MSNs 到外侧下丘脑(lateral hypothalamus)投射的作用,D2-MSNs 基本上不投射到外侧下丘脑。所以他们对 D1-MSNs 到外侧下丘脑投射对饮食起始的作用的结论是正确的(作者注:该结论也还有待商榷,详情参考作者写的短评 (Yang, 2021)),虽然 D2-MSNs 可能也重要,只是不是通过投射到外侧下丘脑来执行功能。
-
这些正是我们现在在研究的问题,我们的示踪实验显示 vArky 很少投射到 prototypical VP 投射的脑区,比如外侧缰核(lateral habenula)、丘脑(thalamus)和中脑腹侧被盖区(VTA)。
-
这些都是非常重要的问题。现在科学家已经越来越重视腹侧苍白球在感知危机和厌恶刺激中的作用。vArky 是怎么参与到这些功能中,相关通路的功能异常如何导致饮食障碍和药物滥用,这些都是我们感兴趣和正在研究的问题。
Meaghan Creed 回应作者短评原文(黑色为作者提问,蓝色为 Creed 回复):

作者期待在不久的将来看到更多来自 MeaghanCreed 团队的研究。
参考文献
- Aristieta, A., Barresi, M., Lindi, S.A., Barrière, G., Courtand, G., la Crompe, de, B., Guilhemsang, L., Gauthier, S., Fioramonti, S., Baufreton, J., Mallet, N.P., 2021. A Disynaptic Circuit in the Globus Pallidus Controls Locomotion Inhibition. Current Biology 31, 707–721.e7. doi:10.1016/j.cub.2020.11.019
- Bond, C.W., Trinko, R., Foscue, E., Furman, K., Groman, S.M., Taylor, J.R., DiLeone, R.J., 2020. Medial Nucleus Accumbens Projections to the Ventral Tegmental Area Control Food Consumption. Journal of Neuroscience 40, 4727–4738. doi:10.1523/JNEUROSCI.3054-18.2020
- Creed, M., Ntamati, N.R., Chandra, R., Lobo, M.K., Lüscher, C., 2016. Convergence of Reinforcing and Anhedonic Cocaine Effects in the Ventral Pallidum. Neuron 92, 214–226. doi:10.1016/j.neuron.2016.09.001
- Faget, L., Zell, V., Souter, E., McPherson, A., Ressler, R., Gutierrez-Reed, N., Yoo, J.H., Dulcis, D., Hnasko, T.S., 2018. Opponent control of behavioral reinforcement by inhibitory and excitatory projections from the ventral pallidum. Nat Commun 9, 849. doi:10.1038/s41467-018-03125-y
- Kelley, A.E., Baldo, B.A., Pratt, W.E., Will, M.J., 2005. Corticostriatal-hypothalamic circuitry and food motivation: Integration of energy, action and reward. Physiol. Behav. 86, 773–795. doi:10.1016/j.physbeh.2005.08.066
- Krause, M., German, P.W., Taha, S.A., Fields, H.L., 2010. A pause in nucleus accumbens neuron firing is required to initiate and maintain feeding. Journal of Neuroscience 30, 4746–4756. doi:10.1523/JNEUROSCI.0197-10.2010
- Kupchik, Y.M., Brown, R.M., Heinsbroek, J.A., Lobo, M.K., Schwartz, D.J., Kalivas, P.W., 2015. Coding the direct/indirect pathways by D1 and D2 receptors is not valid for accumbens projections. Nature Neuroscience 18, 1230–1232. doi:10.1038/nn.4068
- Mallet, N., Micklem, B.R., Henny, P., Brown, M.T., Williams, C., Bolam, J.P., Nakamura, K.C., Magill, P.J., 2012. Dichotomous Organization of the External Globus Pallidus. Neuron 74, 1075–1086. doi:10.1016/j.neuron.2012.04.027
- O’Connor, E.C., Kremer, Y., Lefort, S., Harada, M., Pascoli, V., Rohner, C., Lüscher, C., 2015. Accumbal D1R Neurons Projecting to Lateral Hypothalamus Authorize Feeding. Neuron 88, 553–564. doi:10.1016/j.neuron.2015.09.038
- Ottenheimer, D., Richard, J.M., Janak, P.H., 2018. Ventral pallidum encodes relative reward value earlier and more robustly than nucleus accumbens. Nat Commun 9. doi:10.1038/s41467-018-06849-z
- Ottenheimer, D.J., Bari, B.A., Sutlief, E., Fraser, K.M., Kim, T.H., Richard, J.M., Cohen, J.Y., Janak, P.H., 2020. A quantitative reward prediction error signal in the ventral pallidum. Nature Neuroscience 23, 1267–. doi:10.1038/s41593-020-0688-5
- Pecina, S., Berridge, K.C., 2005. Hedonic hot spot in nucleus accumbens shell: where do mu-opioids cause increased hedonic impact of sweetness? Journal of Neuroscience 25, 11777–11786. doi:10.1523/JNEUROSCI.2329-05.2005
- Richard, J.M., Castro, D.C., DiFeliceantonio, A.G., Robinson, M.J.F., Berridge, K.C., 2013. Mapping brain circuits of reward and motivation: In the footsteps of Ann Kelley. Neurosci Biobehav Rev 37, 1919–1931. doi:10.1016/j.neubiorev.2012.12.008
- Stephenson-Jones, M., Bravo-Rivera, C., Ahrens, S., Furlan, A., Xiao, X., Fernandes-Henriques, C., Li, B., 2020. Opposing Contributions of GABAergic and Glutamatergic Ventral Pallidal Neurons to Motivational Behaviors. Neuron 105, 921–933.e5. doi:10.1016/j.neuron.2019.12.006
- Tooley, J., Marconi, L., Alipio, J.B., Matikainen-Ankney, B., Georgiou, P., Kravitz, A.V., Creed, M.C., 2018. Glutamatergic Ventral Pallidal Neurons Modulate Activity of the Habenula-Tegmental Circuitry and Constrain Reward Seeking. BPS 83, 1012–1023. doi:10.1016/j.biopsych.2018.01.003
- Yang, B., 2021. When to Stop Eating: An Auxiliary Brake on Food Consumption from the Nucleus Accumbens. J. Neurosci. 41, 1847–1849. doi:10.1523/JNEUROSCI.1666-20.2020
via:Nat Neurosci 超长文解析:大脑奖赏系统的核心 — 伏隔核内壳和腹侧苍白球的新发现 | 美国_新浪新闻 brainnews_11
https://k.sina.com.cn/article_5803416260_159e91ac401900t3qj.html
大脑享乐系统
文 | 生物流
享乐,林林总总。
音乐、爱情、药物、美食,每一种体验看起来都独一无二。
然而,科学家却发现,不同的享乐激活了许多相同的脑区。从大脑底层的脑干,一直到顶层的新皮层,都有享乐的影子。这些分散于大脑的享乐热点,共同构成了大脑享乐系统,被所有愉悦体验所共用。

享乐,可以划分为内在体验和外观表达。在一般情况下,内在体验和外观表达是一致的,特定的内在体验会引发固定的外在表现。但在某些情景下,例如喜极而涕、强颜欢笑,内在感受也会脱离外观表现。
因此,科学中最靠谱的研究对象应该是享乐的内在体验,最理想的实验对象是人类,因为人类可以将内在的愉悦感相对客观地报告给科学家。

然而,由于伦理原因,人体实验只能做相关性研究,不能做因果性研究。即,科学家只能用脑成像等手段观察哪些脑区会跟随享乐变得活跃,但无法损毁或者激活某一个脑区,证明该脑区可以改变享乐的主观体验。
因此,对于享乐的研究,科学家一方面在人脑内寻找享乐相关位点,另一方面在实验动物脑内做损毁和激活的因果性实验。
此外,由于动物无法报告内在的享乐体验,科学家只能观察享乐的外观表现,例如,享乐的表情和行为等。这也是动物实验的一个缺陷。
我们先来看一下人脑功能核磁共振的实验发现。

来自功能核磁共振人脑成像的实验结果
利用功能核磁共振脑成像,科学家发现,食物、性、成瘾药物、喜欢的人、音乐、艺术都可以在几个固定脑区产生兴奋。这些脑区可分为两部分,一部分位于大脑皮层,包括 ** 眶额叶 (OFC)、 岛叶 **(insula)和 ** 前扣带皮层 **(anterior cingulate cortex)。另一部分位于皮层之下,包括 ** 伏隔核 (NAc)、 腹侧苍白球 (VP,vental pallidum) 等 **。
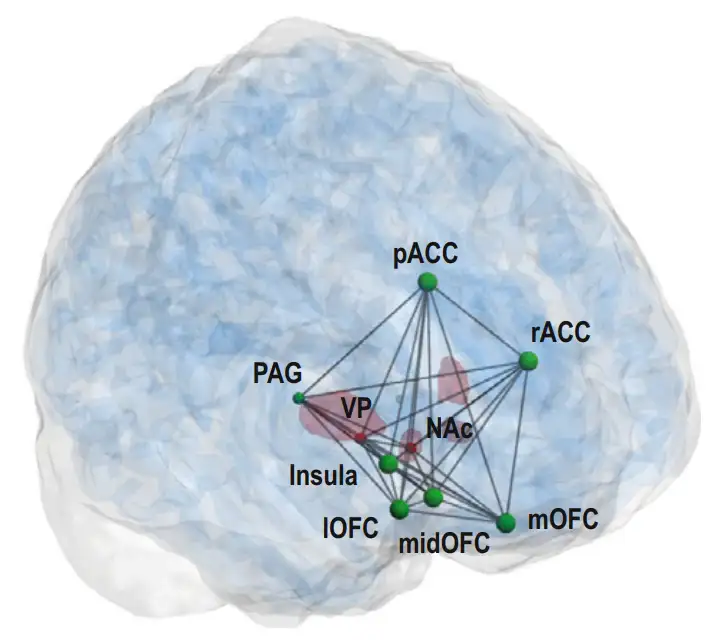
人脑享乐系统
正如前面所诉,脑成像实验只能说明相关性,即愉悦时,这一脑区也处于活跃状态。相关性的背后机制很复杂。我们执行一个愉悦相关的任务时,会调用相当多的认知功能,例如记忆、注意力、抉择等,在我们体验愉悦时,那些脑区之所以活跃,可能只是因为它在回忆以往的愉悦记忆,也可能它在帮助我们把注意力集中于味蕾传递的信息,以更好地品味愉悦。
也有可能,活跃的脑区和真正的享乐中心有投射连接,当享乐中心激活时,这些脑区可能也会跟着活跃起来。但这里的活跃,可能只是被动的跟随,也可能只是激活该脑区真正功能所必经的一小步。还有很多其他的可能性,都跟愉悦的产生和调控无关。
但特别值得一提的是眶额叶的中前部(mid-anterior orbitofrontal cortex),它是皮层里最能反映主观愉悦的地方。

橘红色部分为眶额叶内能最好地编码愉悦感觉的位置
当你饥肠辘辘,品尝第一口炸鸡时,愉悦感最强烈。而当你吃完一大桶炸鸡,打着饱嗝时,你对炸鸡的愉悦感下降到最低点,甚至会觉得有些腻味。中前部的眶额叶能够完美地反映这一愉悦体验的变化,而眶额叶内的其他脑区却不能。
虽然大多数的人脑数据都是基于相关性的,但科学家还是在一些特殊的病人身上,拿到了一部分因果性的证据。
来自脑损伤病人的数据
在神经科学以及诺贝尔奖的历史上,有一段特别的黑暗。成千上万名精神错乱患者为了减轻症状,接受了前额叶损毁的手术。这一非常野蛮粗鲁、不科学的手术居然还得了诺贝尔奖。
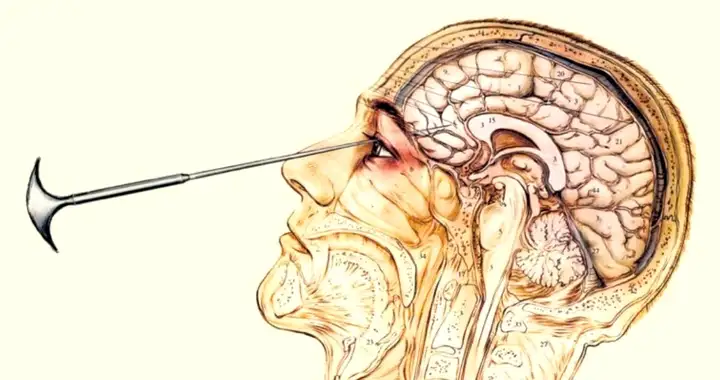
前额叶损毁术
虽然这些病人的整个前额叶都没有了,包括眶额叶,但他们仍然具有和正常人类似的愉悦体验。
更彻底的损毁来自近几年报道的一位病人,他的眶额叶、前岛叶、前扣带皮层以及颞叶的海马和杏仁核都被损坏了,但他仍然能体验到社交过程中的乐趣。
更极端的例子来自于脑积水儿童(hydranencephalic children )。这些儿童在子宫发育时期,由于意外伤害或者遗传因素,神经系统发育不正常。这些儿童先天就没有可见的大脑皮层,颅腔内被脑脊液充斥着。科学家发现,即便是这些儿童,也能在脸上表达各种情绪。玩耍时,他们会咯咯地笑。伤心时,他们也会哭泣。

脑积水儿童几乎没有大脑
这些来自人类病人数据都表明,也许大脑皮层并不是愉悦的最初产生之地,皮层下的古老脑结构才是。但即便这一结论成立,也不能说明大脑皮层和愉悦没有因果性的关系。因为即使大脑皮层不生产愉悦,它依旧可以放大或抑制皮层下脑结构产生的愉悦,即大脑皮层可以调节愉悦感。
更加精细和严密的因果实验,只能在实验动物上进一步验证。
两种因果性操作
在分子生物学领域,科学家经常用两种手法来研究某一基因的功能。
一种为功能缺失(loss of function),是指将基因敲低或敲除,让基因的表达产物减少或消失,然后观察细胞或生命体出现哪些变化。
另一种为功能获取(gain of function),是指将基因敲入或过表达,让基因的产生从无到有,或从有到过量,然后观察细胞或生命体的变化。
类似的,当脑科学家研究某一个脑区的功能时,也会采用这两种方法。
我们回到大脑的享乐功能。要弄清楚某一个脑区是否和享乐有因果性联系,科学家也会做两类实验。一类实验称为功能缺失实验,即不可逆或可逆地失活目标脑区,然后观察动物的享乐表达是否受影响。另一类实验为功能获取实验,激活脑区,然后看享乐表达是否增加。
有的脑区对于享乐是必须的,即失活这一脑区,动物无法再表现出享乐。而有些脑区并不是享乐所必须,失活它们,享乐照样可以产生,但它们激活时却可以增强享乐。可以推测,产生享乐所必须的脑区要少,而锦上添花的脑区相对来说会很多。
还有些脑区可能更少,它们既是享乐所必须的,激活时又可以增强享乐体验。这些脑区更像是享乐之源、之根。

我们先来看能增强享乐的热点,下面的实验都是在啮齿类动物上进行的。
享乐增强热点
科学家发现,大脑内存在许多个享乐热点(hot spot),激活这些热点,啮齿类动物的享乐表达更加强烈。
这些热点分散于大脑边缘系统内,位于伏隔核、腹侧苍白球、岛叶、眶额叶以及脑干的臂旁核。它们体积很小,在小鼠脑内,只有 1 立方毫米左右。如果按大脑体积换算到人脑,也只有 1 立方厘米。

小鼠脑内的享乐热点和冷点
我们着重来介绍下研究最多的伏隔核热点和腹侧苍白球热点,以及享乐冷点(cold spot)。
- ** 伏隔核享乐热点和冷点 **
伏隔核是腹侧基底神经节的一部分,具体来说是腹侧纹状体的一部分,分为核心和外壳两部分。
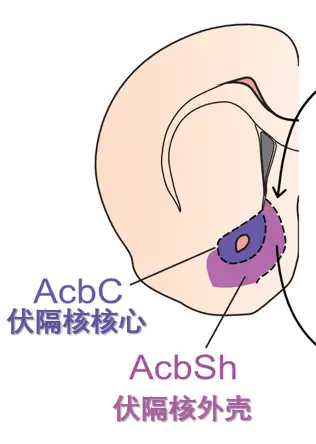
小鼠伏隔核的外壳和核心
而伏隔核内的享乐热点就位于外壳的前背侧(rostrodorsal )。享乐热点只占伏隔核很小的一部分,约 10%。

伏隔核内的享乐热点和冷点
当阿片肽(opiod)或内源性大麻素(endocannabinoid )注射进伏隔核享乐热点,激活其中神经元后,小鼠对糖水表现出更多的享乐反应。而阿片肽在伏隔核内其他位置则不能增强小鼠的享乐反应。实际上,伏隔核外壳后部,紧挨着享乐热点的区域,是一片阴冷的享乐抑制区。在这里注射阿片肽,非但不能增强享乐,反而会减少享乐表达。科学家称这些区域为享乐冷点。
享乐冷点并不是享乐的产生之地。冷点激活时会抑制享乐,给享乐降温。而真正的享乐之源激活时享乐会增加,抑制时享乐会消失。享乐冷点更像是一个享乐调控位点,类似于热点。
伏隔核会投射至腹侧苍白球(VP, ventral pallidum),科学家发现,腹侧苍白球内也存在类似的享乐热点和冷点。
- ** 腹侧苍白球享乐热点和冷点 **
腹侧苍白球是基底神经节的一部分,大致是大脑前联合下方的苍白球核团,前联合是连接左右半球颞叶。腹侧苍白球是伏隔核的主要投射目标之一。
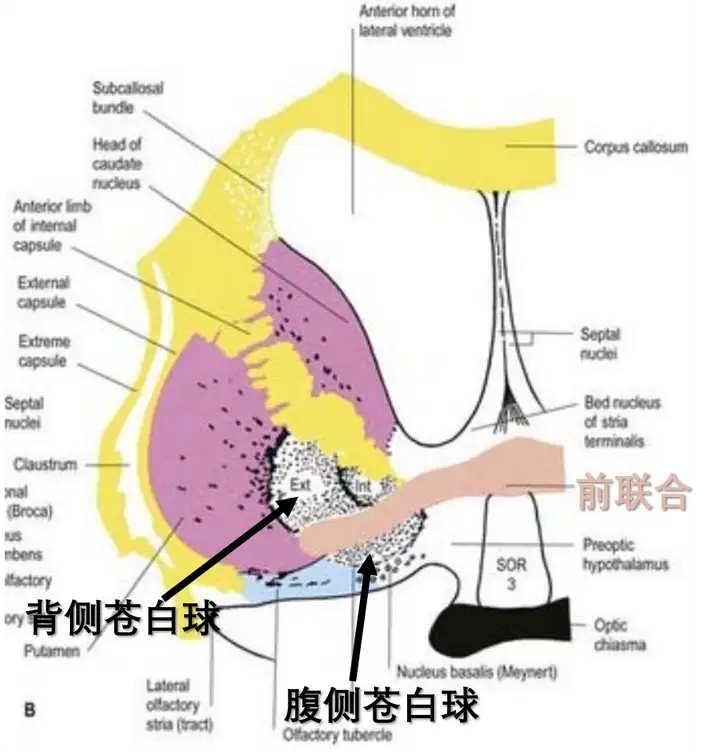
灵长类腹侧苍白球
小鼠腹侧苍白球内的享乐热点也很小,大约只有 1 立方毫米,跟伏隔核热点差不多大小。但它的位置却跟和伏隔核热点相反,位于后部。类似于伏隔核,紧邻热点的区域是享乐冷点。
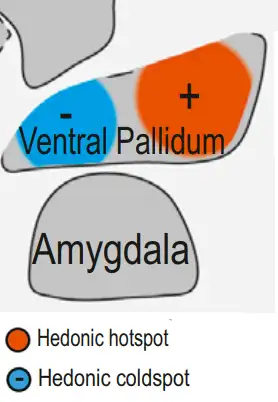
阿片肽药物注射进腹侧苍白球热点区域,小鼠对甜味的享乐表达增强。相反注射进冷点区域,小鼠享乐表达受抑制。
腹侧苍白球和伏隔核内的享乐热点之间是否有直接的连接,科学家目前并不确定。但两者在功能上确确实实地紧密联系在一起。激活其中一个热点,另外一个热点也会跟着活跃。抑制一个热点,阿片肽也无法在另一个热点起作用。两者相互依赖。
除了位于基底神经节内的享乐热点,科学家在小鼠的大脑边缘皮层眶额叶和岛叶内,发现了类似的享乐热点。尤其是小鼠眶额叶的享乐热点,很可能对应着人脑内跟愉悦紧密相关的中前部眶额叶。
伏隔核、眶额叶和岛叶内的享乐热点激活时虽然可以增加享乐,但并不是享乐所必须的。损毁它们,并不会抑制享乐,也不会产生享乐的反面 —— 厌恶。
而位于腹侧苍白球后部的享乐热点却与众不同。
腹侧苍白球:享乐最关键的脑结构
激活苍白球热点能增强享乐,让老鼠在品尝糖水时表现出更多的愉悦行为,例如,有节奏地伸出舌头,舔爪子等。而永久地损毁,或暂时地抑制它,都会让老鼠对糖水的享乐行为消失,反而表现出厌恶,例如摇头、洗脸、甩前肢和揉下巴等。

老鼠喜欢和厌恶时的表情
腹侧苍白球后部的享乐热点,集 loss of function 和 gain of function 于一身,对于享乐的行为表达来说,是极其关键的脑结构。
这一热点的关键性还体现在它的不可替代性。其实,如果只是暂时地抑制伏隔核享乐热点,老鼠对糖水也会变成厌恶,效果类似于腹侧苍白球享乐热点。但如果永久性地损毁伏隔核享乐热点,便没有效果了。
这是因为,永久损毁伏隔核享乐热点后,大脑会找其他脑结构来替代它的功能。而短暂失活时,大脑没有足够的时间找它的替身,这才会导致享乐缺失,厌恶涌现。
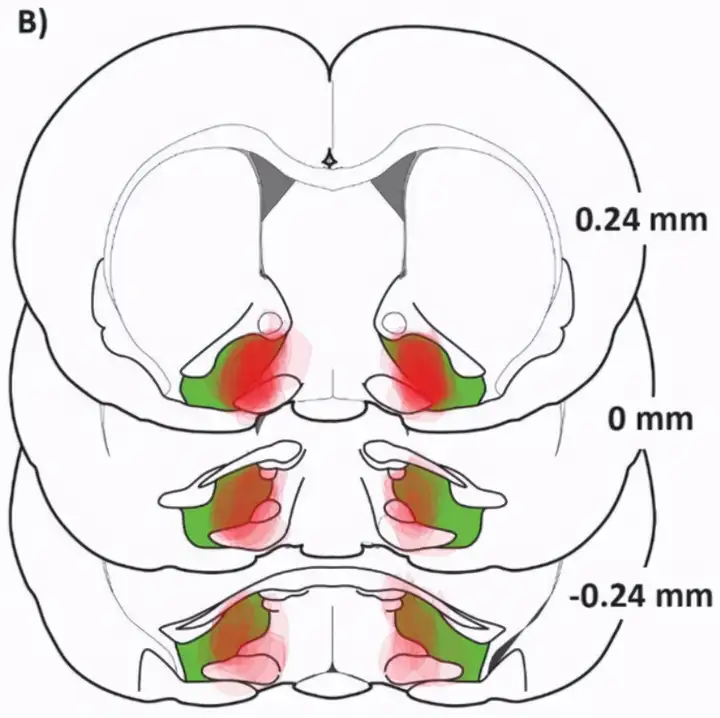
小鼠脑片中的腹侧苍白球,绿色部分
而对于腹侧苍白球热点,无论是永久损毁还是短暂失活,都会导致享乐消失、厌恶出现。这说明,腹侧苍白球享乐热点在享乐的表达过程中的作用,是无可替代的。大脑无法找到其他脑结构替换它。
为什么损毁腹侧苍白球享乐热点会让厌恶肆意表达呢?
科学家认为,腹侧苍白球享乐热点的一个作用可能是抑制,抑制掌管厌恶等负面情绪的神经回路。当腹侧苍白球享乐热点被损毁后,再也没人抑制负面情绪的表达,因此,老鼠才会对糖水表现得厌恶、反感。

还有一点值得注意的是,对于老鼠的实验,科学家只是观察统计享乐的行为表现,并没有办法衡量老鼠内心的享乐体验。有可能,上述的享乐热点只作用于享乐的外观表现,和内在体验无关。损毁腹侧苍白球热点以后,虽然老鼠喝糖水时呈现出来的是厌恶的表情,但也有可能,老鼠的内在体验仍然是愉悦。科学家对鼠脑的人为操纵,可能导致享乐内在体验和外观表达的错位、分离。
接下来,我们再来看一看诱发享乐的神经递质。
享乐的产生,化学递质和脑位点的正确匹配是关键
脑内享乐热点想要增强享乐的表达,必须要有特定神经递质的配合。
最常见的增强享乐的化学递质是脑内的内啡肽(endorphin)。与之结构相似的药物是阿片类药物。
阿片类药物是广泛应用的止痛剂,同时还被用于腹泻、咳嗽、麻醉等。
人们用鸦片(Opiates)来镇痛已有几千年的历史,但一直到上世纪,科学家才从天然鸦片中提取并发展了阿片类药物。

常见的阿片类药物有羟考酮(oxycodone)、氢可酮(hydrocodone)、吗啡(morphine)和美沙酮(methadone)。这些阿片类药物通过作用于神经元上的阿片受体起作用,常见的三种阿片受体是 mu, delta, 和 kappa 受体。不同受体有着不同作用,所以,科学家在研究阿片类药物的作用时,通常会利用特异的阿片受体激活剂,单一地激活一种阿片受体,以理清每个受体的功能。

吗啡结构式
我们回到享乐的话题。当科学家注射 mu, delta, 或 kappa 阿片受体的激动剂到伏隔核享乐热点后,老鼠品尝糖水时的享乐行为会增加。而在该位点注射多巴胺,并不会增加享乐行为,这也再一次证明了多巴胺不是 “快乐递质”。
在享乐位点之外的区域注射阿片受体激活剂,并不会增加老鼠吃糖时的享乐表现。在伏隔核内的享乐冷点,注射阿片肽不但不会增加享乐,反而会抑制老鼠的享乐。
这些实验结果表明,对于享乐的行为表达,化学递质和大脑位点同样重要,两者缺一不可。
此外,伏隔核作为中脑多巴胺最主要的投射位点,是动机产生的最重要脑区。无论是在享乐热点还是在冷点注射阿片肽、多巴胺,无论老鼠最终的享乐表达是增加还是减少,老鼠的动机都会增加。即老鼠有更强的欲望去获得奖励,会吃掉更多的食物,即便在享乐降低时也是如此。这也再次证明了享乐和动机是两个不同的概念、不同的实体。
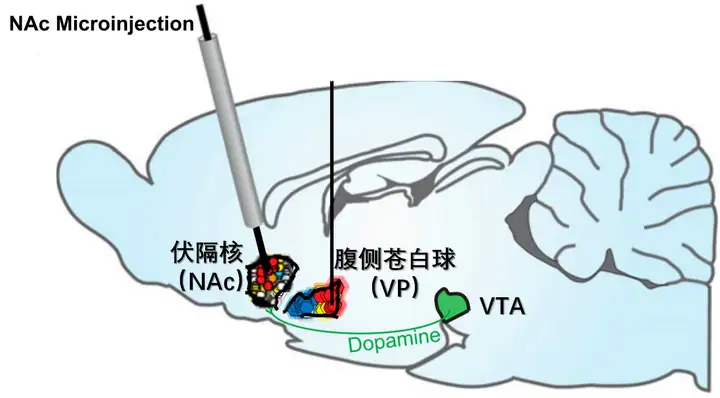
小鼠伏隔核、腹侧苍白球、VTA 示意图
总结
虽然不同享乐的体验各不相同,但驱动它们的最底层神经机制很可能是一样的。而不同的享乐体验,以及不同个体之间的体验差异,背后也很可能都有其独特的脑区在起作用。
此外,老鼠大脑的享乐热点,只是通过享乐行为发现的。至于这些热点中,哪些参与享乐的内在体验,目前还不清楚。也许不久的将来,科学家有机会在人脑上实验。
大脑享乐系统 - 知乎 生物流 BioStream 发布于 2020-10-26 22:42
























 2849
2849

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








