文章目录
酶 enzyme
酶 (Enzyme),又称酵素,是一类大分子生物催化剂。酶能加快化学反应的速度(即具有催化作用)。
由酶催化的反应中,反应物称为底物 (substrate),生成的物质称为产物 (product)。几乎所有细胞内的代谢过程都离不开酶。
酶能大大加快这些过程中各化学反应进行的速率,使代谢产生的物质和能量能满足生物体的需求。细胞中酶的类型对可在该细胞中发生的代谢 (metabolism) 途径的类型起决定作用。对酶进行研究的学科称为酶学(enzymology)。
目前已知酶可以催化超过5000种生化反应。大部分酶是蛋白质,有少部分酶是具有催化活性的RNA分子,这些酶被称为核酶。
酶的特异性是由其独特的三级结构决定的。
酶 (enzyme) 是由活细胞产生的、对其底物 (substrate) 具有高度特异性 (specificity)和高度催化效能的蛋白质或RNA。酶的催化作用 (catalysis) 有赖于酶分子的一级结构 (primary structure) 及空间结构的完整。若酶分子变性 (denaturation) 或亚基解聚均可导致酶活性丧失。酶属生物大分子,分子质量至少在1万以上,大的可达百万。
酶是一类极为重要的生物催化剂(biocatalyst)。由于酶的作用,生物体内的化学反应在极为温和的条件下也能高效和特异地进行。
酶的化学本质是蛋白质(protein)或RNA(Ribonucleic Acid),因此它也具有一级、二级、三级,乃至四级结构。按其分子组成的不同,可分为单纯酶和结合酶。
仅含有蛋白质的称为单纯酶 (simple enzyme);结合酶则由酶蛋白和辅助因子组成。例如,大多数水解酶单纯由蛋白质组成;黄素单核苷酸酶则由酶蛋白和辅助因子组成。结合酶中的酶蛋白为蛋白质部分,辅助因子为非蛋白质部分,只有两者结合成全酶才具有催化活性。
人体和哺乳动物体内含有至少5000种酶。它们或是溶解于细胞质中,或是与各种膜结构结合在一起,或是位于细胞内其他结构的特定位置上,只有在被需要时才被激活,这些酶统称胞内酶 (endoenzyme);另外,还有一些在细胞内合成后再分泌至细胞外的酶──胞外酶 (ectoenzyme)。
酶具有不同于一般催化剂的显著特点:酶对底物具有高度特异性,高度催化效率。酶具有可调节性及不稳定性。
特异性 specificity
酶-底物、抗原-抗体、配基-受体之间的相互辨别和选择性结合反应,从立体结构角度上说就是相应的反应物之间构象的对应性。
酶的特异性是指一种酶能在两种或多种不同底物之间作出辨别,并与其中构象最合适的一种底物结合,催化该底物进行化学反应,表现出酶对其底物具有严格的选择性。这种现象可用诱导楔合学说来解释,即酶与底物接近时诱导酶蛋白变构。在此基础上酶与底物互补楔合进行反应。通过X射线衍射分析证明,酶与底物结合时有显著的构象变化。
催化作用 catalysis
底物结合
酶在催化化学反应前必须要与底物结合。酶具有很强的专一性,通常仅能与寥寥数种底物结合,催化一种或几种反应。专一性通过结合区的形状、电荷、疏水/亲水性与底物互补实现。因此,酶可以用来区分化学选择性上、区域选择性上、立体专一性上有所不同的结构相似的分子。

在与底物发生诱导契合后,酶改变形状,生成酶—底物复合物。己糖激酶的诱导契合运动较大,能包覆住底物ATP和木糖。上图中结合位点用蓝色表示,底物用黑色表示,Mg2+辅助因子用黄色表示。
催化机理 catalysis
酶可以通过多种方式加快化学反应的进行速度,基本机理都是降低反应的激活能 (activation energy),即吉布斯自由能 (Gibbs free energy) , Δ G \Delta G ΔG。
在热力学里,吉布斯能又称吉布斯自由能、吉布斯函数、自由焓。吉布斯能是国际化学联会建议采用的名称。吉布斯能是描述系统的热力性质的一种热力势,定义为
G ≜ U − T S + p V = H − T S \begin{aligned} G &\triangleq U - T S + p V \\ &= H - T S \end{aligned} G≜U−TS+pV=H−TS
其中, U U U 是系统的内能, T T T 是绝对温度, S S S 是熵, p p p 是压强, V V V 是体积, H H H 是焓。
催化机制包括:
-
稳定过度态:
产生一个与过度态所带电荷互补的环境,以降低其能量。 -
提供不同的反应途径:
先和底物发生初步反应,与底物形成共价键连接,产生一个能量较低的中间态。 -
降低底物基态的稳定性:
结合底物后引起底物扭曲,从而降低底物基态与过渡态之间的能差。
通过改变底物的排列方式,减少反应的熵变,此机制对催化的贡献较小。
酶可以同时使用以上多种催化机制来催化反应。比如,胰蛋白酶先通过一个催化三联体进行共价催化产生中间态,再借助氧负离子洞稳定过渡态的电荷排布,水解过程的完成则依赖有序排列的水分子底物。
热力学 thermodynamics
与其他催化剂一样,酶并不改变反应的平衡常数,而是通过降低反应的激活能来加快反应速率(见右图)。通常情况下,反应在酶存在或不存在的两种条件下,其反应方向是相同的,只是前者的反应速度更快一些。但必须指出的是,在酶不存在的情况下,底物可以通过其他不受催化的“自由”反应生成不同的产物,原因是这些不同产物的形成速度更快。

上图为有酶或无酶催化反应体系中反应进程与能量关系图示。可以看出,当反应没有酶的催化时,底物通常需要获得较高的激活能才能到达过渡态,然后才能生成产物;而当反应体系中有酶催化时,通过酶对过渡态的稳定作用,降低了达到过渡态所需能量,从而降低了整个反应所需的能量。
酶可以连接两个或多个反应,因此可以用一个热力学上更容易发生的反应去“驱动”另一个热力学上不容易发生的反应。例如,细胞常常通过ATP被酶水解所产生的能量来驱动其他化学反应。
动力学 dynamics
酶动力学是研究酶结合底物能力和催化反应速率的科学。
研究者通过酶反应分析法 (enzyme assay) 来获得用于酶动力学分析的反应速率数据。
酶催化反应由两步组成:首先,底物可逆地结合到酶上,形成酶-底物复合物;然后,酶完成对对应化学反应的催化,并释放生成的产物(见下图)。

单一底物的酶催化反应机理:酶 (表示为“E”) 结合底物 (表示为“S”),并通过催化反应生成产物 (表示为“P”)。
酶催化速率依赖于反应条件和底物浓度。如果反应条件中存在能够将蛋白解链的因素,如高温、极端的pH和高的盐浓度,都会破坏酶的活性;而提高反应体系中的底物浓度则会增加酶的活性。
在酶浓度固定的情况下,随着底物浓度的不断升高,酶催化的反应速率也不断加快并趋向于最大反应速率 ( V max V_{\max} Vmax,见下图的饱和曲线)。出现这种现象的原因是,当反应体系中底物的浓度升高,越来越多自由状态下的酶分子结合底物形成酶-底物复合物;当所有酶分子的活性位点都被底物饱和结合,即所有酶分子形成酶-底物复合物时,催化的反应速率达到最大。
当然, V max V_{\max} Vmax 并不是酶唯一的动力学常数,要达到一定反应速率所需的底物浓度也是一个重要的动力学指标。这一动力学指标即米氏常数 ( K m K_{m} Km),指的是达到 V max V_{\max} Vmax 值一半的反应速率所需的底物浓度 (见下图)。对于特定的底物,每一种酶都有其特征 K m K_m Km 值,表示底物与酶之间的结合强度 ( K m K_m Km 值越低,结合越牢固,亲和力越高)。
另一个重要的动力学指标是 k c a t k_{cat} kcat,定义为一个酶活性位点在一秒钟内催化底物的数量,用于表示酶催化特定底物的能力。

酶初始反应速率 (表示为“ V V V”) 与底物浓度 (表示为“[S]”) 的关系曲线。随着底物浓度不断提高,酶的反应速率也趋向于最大反应速率 (表示为“ V max V_{\max} Vmax”)。
代谢 metabolism
代谢,亦称新陈代谢,是生物体维持生命的化学反应总称。这些反应使得生物体能够生长、繁殖、保持它们的结构以及对环境作出反应。
代谢通常被分为两类:
分解代谢 (catabolic) 可以对大的分子进行分解以获得能量 (如细胞呼吸);
合成代谢 (anabolic) 则可以利用能量来合成细胞中的各个组分,如蛋白质和核酸等。
代谢是生物体不断进行物质和能量的交换过程,一旦物质和能量交换停止,则生物体的生命就会结束。
代谢中的化学反应可以归纳为代谢途径,通过酶的作用将一种化学物质转化成另一种化学物质。酶可以通过一个热力学上易于发生的反应来驱动另一个难以进行的反应,使其变得可行;如利用ATP的水解所产生的能量来驱动其他化学反应。
一个生物体的代谢机制决定了哪些物质对于此生物体是有营养的,而哪些是有毒的。如部分原核生物利用硫化氢作为营养物质,但这种气体对于部分生物来说却是致命的。[1]代谢速度,亦称代谢率也影响了一个生物体对于食物的需求量。
淀粉、蛋白质和纤维素等大分子多聚体不能很快被细胞所吸收,需要先被分解为小分子单体然后才能被用于细胞代谢。有多种消化性酶能够降解这些多聚体,如蛋白酶可以将但蛋白质降解为多肽片断或氨基酸,糖苷水解酶可以将多糖分解为单糖。
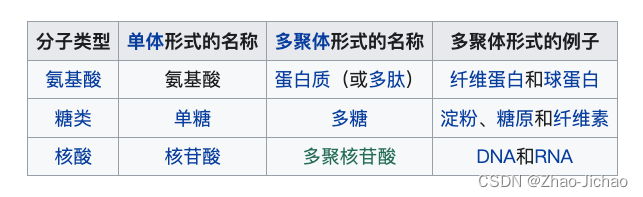
分解代谢 catabolism
异化作用 (catabolism),又称作分解代谢,是生物的新陈代谢途径,将分子分解成更小的单位,并被氧化释放能量的过程,或用于其他合成代谢反应释放能量的过程。 异化作用将大分子 (例如多糖、脂类、核酸和蛋白质) 分解成更小的单元 (例如分别为单糖、脂肪酸、核苷酸和氨基酸)。
细胞使用从分解聚合物释放的单体来构建新的聚合物分子,或进一步将单体降解为简单的废物产物,释放能量 (exergonic reaction)。 细胞废物包括乳酸、乙酸、二氧化碳、氨和尿素。
呼吸作用是异化作用中重要的过程。根据生物的呼吸作用是否需要氧气,可将生物分为需氧生物、厌氧生物和兼性生物。
异化作用的实质是生物体内的大分子,包括蛋白质、脂类和糖类被氧化并在氧化过程中放出能量。能量中的部分为ADP转化为ATP的反应吸收,并由ATP作为储能物质供其他需要。
有氧的异化作用中,糖、脂类、蛋白质等变为含羧基的化合物并进行了脱羧的酶促反应,生成二氧化碳;而氢则由脱氢酶激活在线粒体内经过呼吸链的传递将底物还原逐步释放能量,自身被氧化生成水。
合成代谢 anabolism
同化作用,又称为合成代谢,是指生物体利用能量将小分子合成为大分子的一系列代谢途径。这些反应需要能量,也被称为吸能过程(endergonic process)。
将代谢过程分类的一种方式,无论是在细胞的,器官的或生物体的水平,都是“同化作用的”或“异化作用的”,这是相反的,进而分离大分子。同化作用由异化作用驱动,大分子被分解成更小的部分,然后被用于细胞呼吸。
许多合成代谢过程由三磷酸腺苷(ATP)的水解提供动力。








 酶是一种生物催化剂,具有高度特异性和催化效率。它们通过降低化学反应的激活能来加速生物体内的代谢过程,包括分解代谢和合成代谢。酶的特异性由其三维结构决定,催化机制涉及稳定过渡态和提供能量较低的中间路径。热力学上,酶不改变反应的平衡常数,但加快反应速率。动力学研究关注酶结合底物的能力和反应速率。代谢是生物体维持生命所需能量和物质转化的总称,包括分解大分子获取能量的分解代谢和利用能量合成细胞组件的合成代谢。
酶是一种生物催化剂,具有高度特异性和催化效率。它们通过降低化学反应的激活能来加速生物体内的代谢过程,包括分解代谢和合成代谢。酶的特异性由其三维结构决定,催化机制涉及稳定过渡态和提供能量较低的中间路径。热力学上,酶不改变反应的平衡常数,但加快反应速率。动力学研究关注酶结合底物的能力和反应速率。代谢是生物体维持生命所需能量和物质转化的总称,包括分解大分子获取能量的分解代谢和利用能量合成细胞组件的合成代谢。


















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










