摘要:目前以单细胞分辨率记录行为小鼠的大规模神经元活动的方法,要么需要将小鼠头部固定在显微镜下,要么需要将记录设备附着在动物的头骨上。这两种选择都会显著影响动物的行为,因此也会影响记录的大脑活动模式。在这里,我们介绍了一种不同的方法,利用一种叫做CaMPARI的钙传感器,从自由运动的小鼠身上获取单细胞皮层活动图的快照。CaMPARI具有一种独特的特性,当400nm的光照射时,它在活动神经元内的颜色会不可逆地从绿色变为红色。我们利用这一特性来展示在没有任何头部固定、捆绑或微型设备连接到鼠标头部的情况下,大脑皮质范围内的活动记录。当老鼠进行一系列行为和认知测试时,多个皮层区域被记录下来。我们在运动皮层和体感觉皮层中确定了任务依赖的活动模式,在运动皮层的亚区域之间存在显著差异,在几个活动模式和任务参数之间存在相关性。这种基于campari的记录方法扩展了在最小限制实验条件下记录自由运动和行为小鼠神经元活动的能力,并提供了目前无法获得的大规模体积数据。
1. 引言
哺乳动物的大脑通过连接到局部回路的全脑分布神经元的同步活动来处理感觉信息,这强调了开发能够捕捉这些复杂激活模式的记录方法的必要性。为了应对这一挑战,之前的努力主要集中在提高传感器捕捉单细胞活动的灵敏度,以及提高记录系统追踪大大脑区域神经元的能力。
与此同时,科学范式已经转向分析行为动物在处理感官线索以完成任务时的神经元活动,其中大部分工作都是以老鼠为模型进行的。这种方法使识别特定细胞类型的功能角色,大脑区域。和/或大脑区域之间的投影,以及确定神经系统疾病或神经退行性疾病模型后正常活动模式的改变目前,对行为小鼠中跨越多个大脑区域的许多神经元进行单细胞分辨率记录,主要是使用遗传编码钙指标(GECls)进行的。这些实验范例包括使用双光子激光扫描显微镜(TPLSM)监测头部固定的小鼠,或将微型成像设备连接到自由移动的小鼠的头骨上以记录单光子或双光子。重要的是,这两种方法都有固有的局限性。例如,记录行为的啮齿动物的TPLSM需要在显微镜下固定小鼠的头部,这可能导致与自然自由移动行为相比不同的神经元回路的激活。此外,大多数最先进的TPLSM系统能够从一个跨越几毫米的大平面或从几个较小的轴向移动平面进行记录,这些显微镜通常受到激光扫描系统力学的限制,这限制了可以动态监测的有效视场(FOV)尺寸。获取的信息被限制在视场内部,因此视场外附近神经元的活动视场,即使它们被标记为GECls,也不能同时被检测到。当使用植入的微型成像设备记录大脑活动时,它允许小鼠在记录过程中头部运动,但它在头骨上施加了相当大的重量。这种额外的重量可能会影响老鼠的自然行为,因此也会影响记录的神经元激活模式。此外,与TPLSM记录相比,空间分辨率和体积记录能力受到损害。
钙调制光激活比例积分器(CaMPARI)是一种钙和光依赖的荧光活性标记物,它可能使GECls的组合相对简单。在高钙环境下400nm光照射后,CaMPARI发生不可逆的构象变化,其荧光发射从绿色变为红色,这一过程称为光转换(PC)。CaMPARI之前被证明可以根据它们的调谐特性,用红色荧光标记小鼠视觉皮层中的活跃神经元,而这种传感器的最新版本CaMPARI2显示出更亮的信号,并且在红色和绿色成分之间具有更好的对比度。
CaMPARI独特的钙依赖性PC功能使我们能够设计一个独特的实验范例,其中实验记录和信号读出过程是分开的。在这项研究中,我们表明,这种范式转变有助于在更大的脑容量上记录神经元活动,而不是使用最先进的TPLSM系统。基于CaMPARI的大规模记录是通过在动物及其实验环境上照射PC灯来进行的,该灯以非瞬时的方式在小鼠大脑的活跃神经元中诱导红色荧光。在使用标准TPLSM系统完成实验后,进行光转换CaMPARI荧光的读出。这种记录模式与以前的TPLSM系统的记录有根本的不同,两个记录输出过程是同时进行的,不能分开。在这项研究中,我们揭示了基于CaMPARI的记录在单细胞分辨率下检测大于6毫米脑容量的活动方面的优势。我们通过将结果与广泛使用的GECl,jGCaMP7s的记录结果进行比较,验证了基于CaMPARI的记录方法的准确性。我们发现,当小鼠受到视觉刺激时,兴奋性和pv阳性抑制神经元的活动模式存在功能差异。最后,我们展示了基于CaMPARI的记录方法的能力,在记录阶段,在没有任何机械装置的情况下,在自由移动的小鼠的大皮质体积上监测单个神经元的活动,以便比较五个躯体运动皮质区域的活动水平模式,并将这些模式与小鼠执行一系列行为任务时的行为参数联系起来。
2. 结果
2.1 基于CaMPARI的记录功能的表征
虽然据报道,绿变红的PC在单蛋白水平上是永久性的10,但在PC后的几天里,体内的光转化红绿比(RGR)下降,其中97%在一周内腐烂(图la),可能是由于红色蛋白的降解和新(绿色)蛋白的产生。为了计算RGR的衰减速率,我们对2只小鼠的73个VI神经元进行了纵向监测,并测量了PC后的RGR。结果符合半衰期1.04天的指数衰减模型(R2=0.99;图1b)。同一大脑区域和神经元的多个pc通过两个额外的记录来证明,每个记录间隔10天,并产生类似的活动模式(图1)。因此,我们得出结论,CaMPARI可以多次用于顺序记录会话。
接下来,我们将CaMPARI识别活跃大脑区域的能力描述为照射在小鼠大脑上的PC光量(光剂量)的函数。将携带CaMPARI2序列的腺相关病毒(AAV)注射到小鼠的初级视觉和体感皮层。在向对侧眼睛播放漂移光栅电影期间,在PC光照射后,比较每个区域所有神经元记录的RGR中值。通过在开颅口周围照射5-7mm直径的横截面,并使用高达200 mW的PC灯照射1s,然后使用11s不照明以使组织冷却,可提供高达6/mm的光量子。在所有测试的光剂量下,VI的平均RGR水平都高于SI,量化VI和SI RGR分布之间分离的灵敏度指数(见“方法”)随着光剂量的增加而增加,在300J/mm2处达到峰值(图1d上图)。随着使用更多的PC光,绿色CaMPARI荧光下降到初始发射水平的60%,红色荧光增加(图1d,下图)。根据这些发现,选择150-300J/mm的光剂量范围用于随后的视觉刺激实验(记录来自一个或两个半球的神经元),以平衡灵敏度和PC照明时间。最佳的300 /mm剂量水平可以很容易地达到照亮一个半球,但需要4倍的照明时间,当两个半球被照亮。如此长的记录时间可能会导致记录过程中小鼠状态的变化,因此本实验使用较低的光剂量。
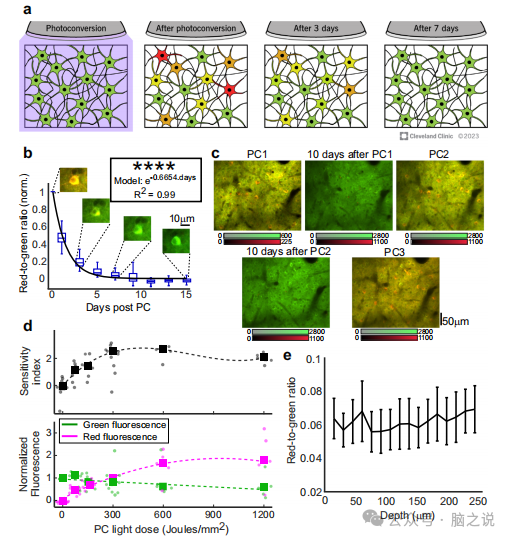
图1 基于CaMPARI记录的表征。a. PC后CaMPARI绿色和红色荧光的变化示意图。b. 光转化神经元的RGR在PC后立即归一化为每个细胞的RGR水平,并监测15天。中位数符合指数曲线拟合。同一单元的示例图像在各自的日期上方显示。c. 同一神经元中三个重复pc的样例图像。d. 在视觉刺激期间,区分VI和S1活性水平的敏感性指数(d值)随着光剂量的增加而增加,并在300 /mm'附近达到最佳值。圆形圆点表示所有鉴定细胞单次光剂量记录的中值,大方块表示所有单次实验中值的平均值。e. 所有小鼠和脑区在每个视场中记录的所有细胞的RGR中值在pia下的240 um深度下没有明显差异。
在另一组实验中,测量了pia下不同组织深度至240 um的RGR值。在不同深度下,RGR值没有明显变化(图 le),这表明在监测Layer II/Ill神经元时,基于pc的记录水平不受组织深度的影响。通过测量表达mEOS的神经元的RGR深度衰减,这些结果得到了支持。mEOS是一种钙不敏感的光转化蛋白,用于开发CaMPARI。在第II/III层深度上,RGR值衰减了20-30%,这可能对记录数据的可变性贡献了微不足道的一部分。在第II/III层和第V层神经元中,RGR水平的光衰减更为明显。
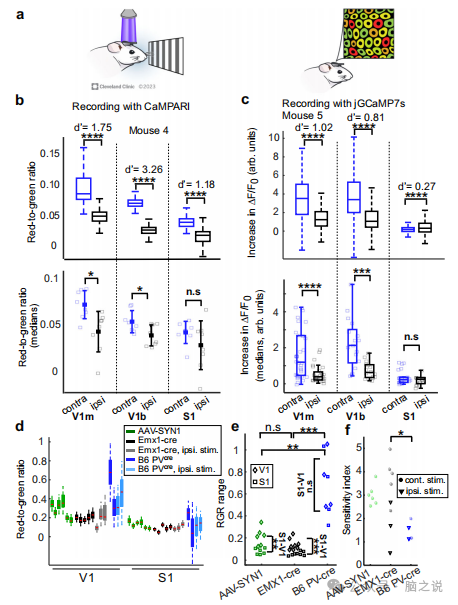
图2 多脑区同时记录。
2.2 多个大脑区域的神经元活动
通过在小鼠的单眼和双眼视觉皮层以及两个半球的体感皮层(S1)中表达CaMPARI2,实现了在大皮质区域上的同时体积记录。在轻度麻醉小鼠的右眼或左眼上呈现一个漂移光栅电影,并与PC照明同步,该照明照亮了两个半球,覆盖了每个半球窗口6毫米(-10毫米)的皮质表面。一旦PC记录完成,使用TPLSM记录神经元RGR(图2a)。对照组在一个半球的Vib, VIm和S1中表达jGCaMP7s,我们记录了视觉刺激对每只眼睛引起的荧光变化,正如之前所做的那样。CaMPARI2和jGCaMP7s表达神经元都显示出类似的活动模式,其中视觉区域比体感区域更活跃,并且与同侧视觉区域相比,对侧视觉区域的活动增加(图2b和c)。值得注意的是,基于CaMPARI的数据同时记录了所有6个大脑区域。基于jGCaMP7s的数据需要更长的记录过程。在每个脑区的3-5个fov中依次记录视觉活动,因此需要结合142个单独时间点的记录。
2.3 记录基因目标神经元群
通过在Emxl-cre或B6 PV小鼠的V区和Sl区注射cre依赖的CaMPAR 2 AAV,在兴奋或PV剂量的初始神经元中表达CaMPARI2,可以实现对遗传靶向细胞群体的选择性记录。所有小鼠都在左半球顶部植入颅窗。用300J/mm光剂量的PC,记录小鼠在轻度麻醉时对侧或同侧眼睛呈现漂移光栅电影时的VI和Sl活性。三组小鼠的VI RGR水平均高于SI,其中B6 PV小鼠的RGR水平最高,其次是AAV-SYNI小鼠,Emxl-cre小鼠的RGR水平最低,这表明三组小鼠的活性水平范围不同(图2d)。此外,B6 PV - VI神经元测得的rgr范围明显大于其他两组(图2e)。有趣的是,虽然AAV-SYNI和Emx1-cre组的VI神经元的RGR范围明显大于SI神经元,但B6 PVoe组的RGR范围没有明显差异(图2e)。我们发现,对于对侧眼刺激,Emxl-cre的d'值显著高于B6 PV,而非显著高于AAV-SYNI(图2f)。
2.4 对自由活动小鼠的脑活动进行大规模体积记录
接下来,我们通过在同一半球的5个运动和体感觉区域表达CaMPARI2来记录自由运动小鼠的神经元活动。同样的小鼠接受了三项任务的训练和测试(开放领域的新物体识别,NOR),旋转杆(RR)和恐惧调节(FC),每两周在配备PC光源的舞台上执行一项新任务(图3a)。在所有的实验中,老鼠首先接受特定行为任务的训练。训练阶段结束后,下一阶段进行PC灯光转换细胞记录15分钟(图3b)。一组对照实验发现,颅窗植入或400 nm PC光照明对小鼠NOR、RR和FC任务的测试性能参数均无显著影响。记录后24h进行读出会话(图3c)。从枕状表面到深度-300 um测量所有识别的神经元的RGR。在同一只小鼠中评估不同皮质区域和任务的细胞rgr(图3d),以及不同小鼠,结果显示,与RR和FC相比,NOR中位活性水平显著增加2.5倍(图3e)。在三个行为任务中,体感区比运动区更活跃(图3f)。当比较不同运动区域的活动时,McFa明显比MREA和MN更活跃,尽管McEA和MREA投射到同一肢体33(图3g)。两个体感觉区Se和SpL之间的活动水平没有显著差异,皮质层I和Il/ III之间的活动水平也没有显著差异。
有趣的是,所有小鼠在FC记忆测试期间测量的平均皮层活动与任务第1天恐惧记忆学习期间的平均刺激间隔(ISIs)相关(图4a)。此外,个体大脑区域的活动与四个个体中的至少两个显示出显著的相关性(图4b),这表明记忆测试期间躯体运动皮层的活动反映了恐惧学习过程的各个方面。在记录的脑区中,Sle与所有ISIs均有相关性。有趣的是,我们在旋转杆测试中看到了类似的模式,其中Sla与测试学习阶段的平均跌倒潜伏期相关(图4c),在NOR测试中,Sln活性与与新物体相处的时间相关(图4d)。
最后,在另一组实验中,两名研究人员证实了活性的非生产性。小鼠在接下来的两周内接受新物体识别任务的测试,每周使用两个新物体,并在新物体识别阶段记录它们的大脑活动。在这两周内,小鼠对新物体表现出预期的偏好,但没有表现出预期的偏好行为参数的明显差异,如与新物体在一起的总时间或百分比,或辨别指数(图4e)。体感觉区和运动区中位rgr无显著差异(图4f)。
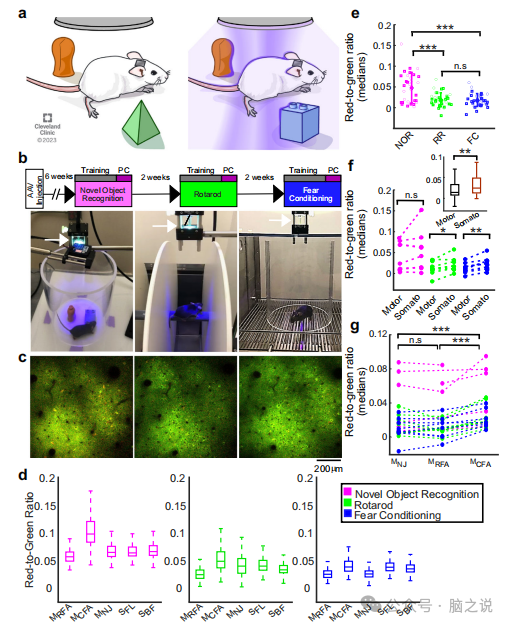
图3 在行为和认知任务中记录自由移动小鼠的大规模单细胞活动。
3. 讨论
这项工作介绍了一种新的方法,可以从自由移动的啮齿动物身上获取同时的体积神经元活动模式,而不需要将动物的头部放在显微镜下,拴住它,或者在它的头骨上附着一个微型成像设备。这种方法能够以单细胞分辨率在多个大脑区域进行大规模记录。因此,这种模式克服了基于tplsm的记录和基于小型化设备的记录方法(在体积采集、图像质量和视场大小方面的挑战)各自的局限性。这种方法尤其适用于研究行为小鼠的全脑皮质活动模式,因为在这种情况下,对动物的自然表现要求最小限度的限制。重要的是,基于CaMPARI的记录是在整个pc照亮的体积上同时进行的,因此可以突出显示在特定行为中活跃的大脑区域和/或特定细胞类型。这种大规模的映射可以作为识别活跃大脑区域的第一步(图2c和图3d-g),然后使用CaMPARI的动态记录功能或通过在目标大脑区域表达更敏感的GECI来更详细地研究动态动作电位放电模式。基于CaMPARI的记录也与脑皮层活动模式的映射兼容,以响应不同的刺激,包括感觉、化学遗传学或光遗传学。
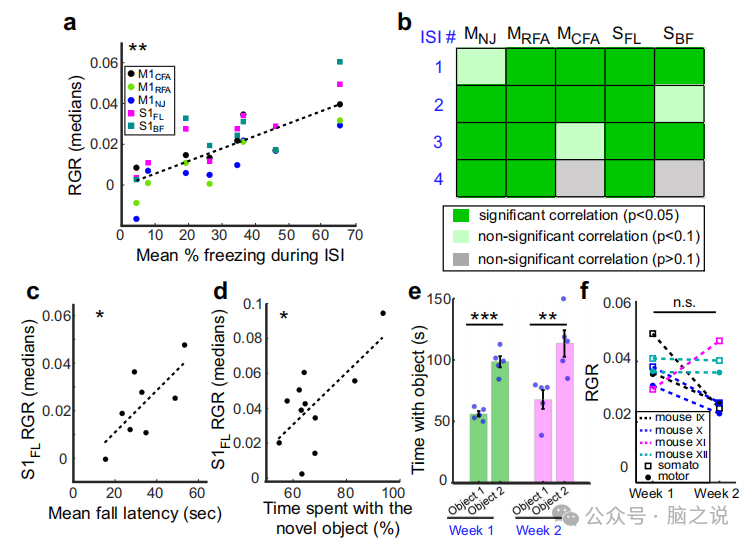
图4 脑活动记录与行为参数的相关性及CaMPARI记录的可重复性。
研究选择了三种行为任务:NOR、RR和FC,以研究三种不同类型的行为及其相关的神经回路。NOR是一个以躯体感觉为中心的任务,包含一个记忆成分;RR是一个以运动为中心的任务;FC任务是一个以记忆为中心的任务,包括主要的皮层下成分,而躯体运动区域被认为是次要的。我们选择记录初级躯体运动区域的大脑活动,以依赖于现有的关于感觉刺激与这些区域的神经元活动之间关系的文献。值得注意的是,所有小鼠都按照一定的顺序进行了测试:首先是NOR,然后是RR,最后是FC。理由是,与FC相关的恐惧可能会影响接下来的任何任务,因此这个任务是最后一个。在RR过程中,小鼠可能会摔倒并有可能受伤,因此我们将此任务放在NOR之后,认为NOR是安全的。由于这些考虑,没有随机化小鼠测试顺序。尽管对小鼠进行了两次连续的NOR任务测试(图4e, f)和多达三次的视觉刺激实验(数据未显示),但结果没有明显变化。这种影响不能完全排除。
使用基于CaMPARI的记录进行同一动物纵向监测的能力将这种方法与常用的即时早期基于基因的方法区分开来,后者需要牺牲动物才能读取活动数据。有趣的是,最近的一项工作提出了一种基于海马细胞中直接早期基因Fos的转基因表达来鉴定活性细胞的体内方法。我们注意到,这种方法也允许在概念上类似的记录和读出过程分离。然而,由于它依赖于一个更复杂的,部分未知的机制,将神经元放电与直接早期基因的表达联系起来,目前的实施可以将细胞分类为fos -高和Foslow组,其时间分辨率以小时为单位测量。CaMPARI的PC率与神经元动作电位的中低放电率呈近似线性关系30,我们的数据(图2b、d、3e-g)支持记录不同脑区、不同任务和不同细胞类型的不同活动水平。我们还注意到,未来的工作可能包括使用最近发表的可逆CaMPARI,它将允许在读出会话后立即删除CaMPARI活动信号,从而消除当前CaMPARI2在记录间隔时间方面的限制。
所提出的方法仅限于获取大规模活动模式的快照。本研究中使用的CaMPARI2传感器需要相对较长的PC照明时间才能在自由移动的小鼠中实现高质量的记录(在本研究中可达15分钟)。缩短记录时间将进一步增强该方法监测大脑活动的能力,并在更短的时间尺度上突出共同活跃的大脑区域。这种改进可以通过使用较早一代CaMPARI传感器CaMPARIl来实现,CaMPARIl最近被证明在体内具有比CaMPARI25更好的PC特性,或者通过开发新一代CaMPARI结构来解决这一特定挑战。此外,在本研究中,我们通过颅内AAV注射在特定皮质区域表达CaMPARI。因此,我们只能监测到有限数量的大脑区域。通过系统注射AAv或开发转基因CaMPARI小鼠品系,可以最大限度地提高CaMPARI的全皮质记录能力。这两种选择都可以在大多数小鼠皮层上表达CaMPARI,这将在不实质性改变现有记录协议的情况下获得大约100万个神经元。
最后,我们建立了同一只小鼠执行三种不同行为和认知任务的记录,并显示了不同任务和大脑区域的大脑活动模式的变化,以及活动和行为模式之间的相关性(图3和4)。这类数据表明,基于campari的记录有助于在同一只动物中进行最低限制行为期间的纵向体内神经元活动研究。随着最近对大规模大脑活动模式的研究兴趣的增加,特别是分布式神经元回路的特征,所提出的方法增加了独特的功能,并补充了神经科学界可用的工具。
参考文献:Large-scale recording of neuronal activity in freely-moving mice at cellular resolution.





















 850
850

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








