写在前面
在读这篇文献之前:
期初看到这篇文献的时候,感觉这不是把我想做的做了嘛,开个玩笑,只是这个问题在做植物根系分泌物中是很重要的。
算是一个小领域的基础问题。
所以我十分迫切的想看看作者究竟做了写什么,能回答什么样的问题。
在读完这篇文献之后:
作者测定了接近200个代谢组,按照国内价格的话,差不多是10万块。
但这可能是他们自己测得,其次注释数据库比较小,我个人觉得可以用好几个库再次进行注释一遍。
现在这个时代,一百多个代谢物看样子是比较少了。
不过可能也是作者注释的比较精准,反观现在有些国内公司,为了让注释的代谢物过多,把一些可有可无的也加上了,或者不准确的也加上了。
这篇文章关注根系分泌物研究的一些基础问题,这其实可以标志着根系分泌物元年来到了(终于有人关注这些基础问题了)。
文献题目:三种系统发育不同植物的核心代谢组和根系分泌物动态
DOI:
10.1038/s41467-023-37164-x
第一作者:
Sarah McLaughlin
通讯作者:
Trent R. Northen & Joelle Sasse
摘要:
根系分泌物是植物来源的输出代谢物,可能通过充当营养和信号来塑造根相关的微生物组。然而,根系分泌动态尚不清楚,因此也不清楚分泌的变化是否反映在微生物组结构的变化中。本研究评估了不同植物物种的分泌物、昼夜分泌动态以及分泌物采样的伴随方法方面的共性和差异。由于许多代谢物的丰度会随着时间的推移而饱和,所以应该收集几个小时而不是几天的分泌物。植物在无菌、非无菌或补充糖的环境中生长会显著改变分泌物特征。拟南芥、二穗短柄草和蒺藜苜蓿的茎、根和根分泌代谢物谱的比较揭示了这些物种之间的明显差异,但也存在组织和分泌物的核心代谢组。分泌物剖面还表现出昼夜特征。这些发现增加了未来分泌物研究的方法学和概念基础,以提高对植物-微生物相互作用的理解。
研究背景:
植物根部向根际分泌大量化合物。分泌物影响碳和养分循环,塑造土壤的理化特性,并作为根系相关微生物群落的养分和信号。根系分泌物被认为是植物生态学和研究的一个重要功能性状,因为它们与植物养分利用策略相关。
根系分泌物被认为是影响植物微生物组相互作用形成的一个因素。这方面的证据来自微生物组和分泌物研究中的许多观察结果:微生物组和分泌物概况在植物物种、栽培品种、野生和现代品种之间是不同的。微生物组组成和分泌物随植物发育阶段、昼夜时间点以及非生物和生物胁迫而变化。例如,在几种单子叶植物和双子叶植物物种中,糖分泌减少而有机酸分泌沿着发育梯度增加。此外,还观察到一些分泌物的昼夜波动,例如某些脂质、单一有机酸(例如柠檬酸和麦根酸)以及类黄酮和芥子油苷。单一研究将微生物组的变化与分泌的改变联系起来:在拟南芥中,三萜分泌的变化改变了微生物组组成,叶病原体感染改变了苹果酸分泌,吸引了地下生物控制微生物,分泌的酚酸被植物相关微生物选择性代谢。
随着植物生长,糖类的分泌逐渐减少,有机酸的分泌逐渐增多。
一系列的方法被开发出来用于分泌物分析。植物可以在无菌或非无菌环境、土壤或水培中生长,分泌物可以收集在各种溶液中,例如去离子水、营养培养基或土壤清洗液。大多数实验因素会改变植物环境,因此有可能改变植物的新陈代谢,并随之改变分泌。例如,与生长培养基相比,在去离子水中收集的分泌物通常含有更高水平的碳和氨基酸,这可能是由于根和溶剂之间强烈的渗透不平衡。
渗透不平衡导致分泌物会产生什么变化呢?
分泌物收集持续时间也会影响代谢曲线。收集水稻分泌物2小时,总有机碳分泌率(碳水化合物和有机酸)估计高于4小时或6小时,与植物发育阶段无关。各种植物物种的外部氨基酸浓度在分泌的最初几个小时内增加,直到24小时,然后保持稳定。检测分泌物的另一个主要决定因素是无菌或非无菌生长环境。对于在非无菌条件下生长的番茄,在分泌物中无法测量到糖或有机酸,这可能是由于微生物活动,而无菌番茄在数小时内表现出µM级别的有机酸分泌。在非无菌设置中,可以添加灭菌剂来阻止微生物代谢,但它们也可能会改变植物的分泌曲线。然而,大多数化学类别的分泌动态仍未得到探索。
这里注意分泌的浓度问题?微摩尔是一个常见的浓度。
很少有研究分析土壤种植植物的分泌物,这通常是通过使用膜或渗滤液收集,或通过用水或有机溶剂清洗花盆来实现空间分辨率。在非无菌环境或土壤基质中存在的微生物会导致检测出复杂的代谢物概况。在此类实验装置中鉴定分泌物代谢物并非易事。总而言之,多项研究表明,分泌是一个动态过程,取决于许多环境和实验因素。
土壤中,也就是原位,检测根系分泌物研究我们一直在做,但是由于复杂程度,所以都称之为根际代谢物。
虽然很明显分泌是一个动态过程,但大多数影响分泌的参数尚未被系统地探索。大多数研究关注少量实验或生物学参数如何改变一种或几种化学类别的分泌。缺乏系统分析大量分泌代谢物动态的综合研究,如分泌物收集持续时间或生长培养基对分泌的影响等实验因素的影响,以及对不同植物物种分泌物异同的综合分析。本研究表明实验因素和生物学因素都会影响根系分泌物。我们系统地评估了两个技术和两个生物学方面:(i)收集持续时间对分泌物的影响,(ii)生长环境(无菌,非无菌,加糖)对分泌曲线的影响,(iii)多个系统发育较远的植物物种的分泌物和组织代谢特征的异同,以及 (iv)与植物组织和分泌物的代谢特征相关的昼夜特征。
我们发现几个小时的收集时间最适合捕捉许多分泌物的动态化合物,但低丰度化合物可能需要几天的时间。此外,与对照条件相比,在补充蔗糖的条件下的分泌物中检测到更高水平的碳水化合物。分泌曲线和根形态在无菌和非无菌条件下显著变化。双子叶植物拟南芥、单子叶植物二穗短柄草和豆科植物苜蓿的根和分泌物的大约三分之二的化合物在所有三个物种中都被检测到。其余三分之一的化合物对一个或两个物种具有特异性。此外,我们发现7-32%的分泌代谢物具有昼夜特征(取决于物种)。本研究介绍了核心代谢组的概念:核心代谢组包含存在于大多数植物物种中的代谢物,类似于与植物组织相关的核心微生物组。我们假设核心分泌物负责将核心微生物组募集到根部。相比之下,特定于物种或植物家族的分泌物会导致更特定的植物微生物关联。
我们在2022年的Microbiome中提到了核心代谢物,认为这与植物状态有关联,这里的作者也有相同的思考,这表明了一种系统性的适应性。
研究结果:
结果一:大多数代谢物可通过较短的分泌物收集时间检测到,但较长的收集时间会增加信号
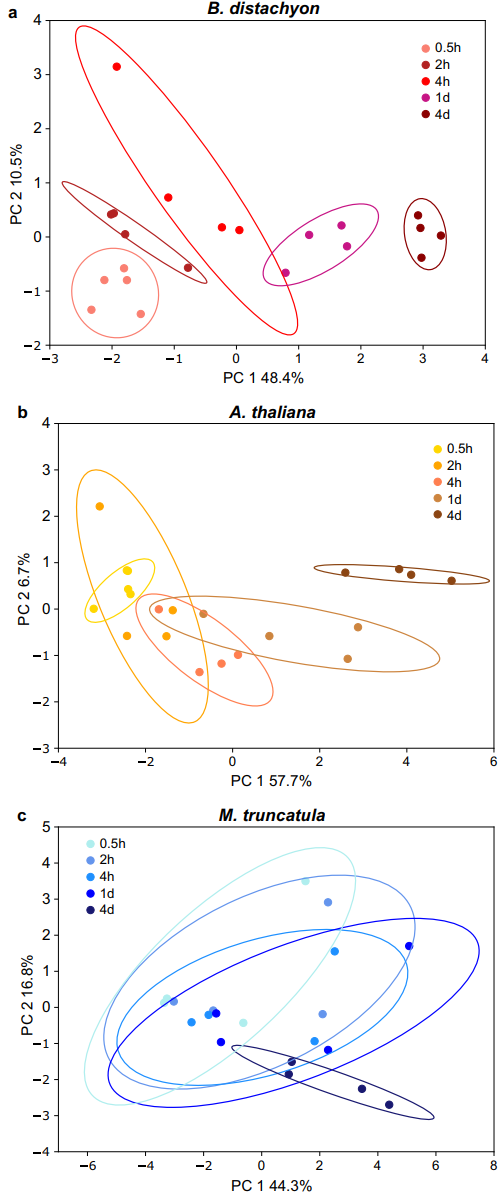
图1 三个物种的根系分泌动态
我们首先评估了技术问题,以确定此处介绍的其余实验的分泌物收集参数。在第一个实验中,我们旨在确定分泌代谢物的时间动态,以确定最佳分泌物收集持续时间,即分泌物收集的最短的时间点,仍然能确保一个良好的信号,以及分泌物信号在以后的时间点可能的饱和度。为此,模式单子叶植物(二穗短柄草)、模型双子叶植物(拟南芥)和模型豆类植物(蒺藜苜蓿)在无菌水培装置中生长三周。在收集期开始时更换生长培养基,并在生长培养基中收集分泌物五种不同的持续时间,从0.5小时、2小时、4小时、1天到4天。对于这三种植物,总共检测到63种分泌代谢物。在已鉴定的化合物中,有氨基酸和其他有机酸、碳水化合物、核苷、核苷酸和衍生物,以及苯类化合物。在任何配对比较中,发现16%(蒺藜苜蓿)、37%(二穗短柄草)和52%(拟南芥)化合物有时间上的动态变化,其他代谢物在整个实验过程中保持相似水平。
主成分分析(PCA)显示三个物种中的两个随着时间的推移收集的分泌物剖面有连续变化。蒺藜苜蓿总体上显示出更多的差异,并且时间点的分离不太清楚,可能是因为用于该物种的种子的遗传多样性更高(图1)。在最早和最晚时间点(0.5小时和4天)之间发现了较大差异。对这些时间点之间不同的二穗短柄草代谢物的时间模式的深入分析揭示了各种时间行为,从线性、指数或对数增加到钟形动态。大多数代谢物强度随时间增加。仅在1天和4天之间的少数情况下观察到减少。此外,所有研究的代谢物类别都显示出相似的时间动态。因此,收集时间的选择不会使检测偏向特定的化学类别。
为了选择最佳分泌物收集持续时间,将代谢 物丰度数据转换为存在-不存在(在50%以上的样本中高于背景),从而可以比较特定时间点存在的代谢物数量。将最新时间点(4天)设置为100%,我们在0.5小时检测到16%的化合物,在2小时检测到32%,在4小时检测到61%,在1天检测到84%。我们得出结论,对于时间不敏感的实验,例如生态型或突变体的比较,较长的收集时间可使化合物数量和强度最大化。然而,较长的收集时间可能会掩盖较早时间点存在的差异,并且代谢物再摄取等因素在较高的代谢物浓度下可能更相关,从而使情况复杂化。对于高温解决方案的实验,我们建议收集窗口为几个小时。对于此处介绍的所有进一步实验,选择了2小时的分泌物收集窗口。
短时间收集的代谢物会有较大差异,持续一段时间后收集的可能会让低丰度的代谢物出现积累性质的差异。在之前我们发现高丰度和低丰度的代谢物可能是决定微生物的重要因素。结合这里的观点可能低丰度代谢物就是信号物质,通过信号影响微生物,高丰度的通过养分影响微生物。其次中间的这些代谢物,也就是说丰度不高不低的,做什么用呢,这里推测一下可能是起着渗透压调横作用。并且是辅助作用?
结果二:植物生长条件影响分泌物分布

图2 不同生长条件下二穗短柄草的根系渗出动态
从历史上看,用于收集分泌物的植物生长在三大类环境中:无菌、非无菌或补充糖的生长培养基(土壤种植的植物除外,此处未考虑)。无菌环境允许仅关注植物来源的化合物,而非无菌环境包括微生物来源的化合物,但允许收集大型植物的分泌物。蔗糖补充条件通常用于拟南芥研究以改善生长和减少表型异质性,但可能会改变植物的碳水化合物代谢。我们通过在无菌、非无菌和补充糖的环境中生长二穗短柄草来评估在这些条件下根系分泌是否明显。表型分析显示,与无菌植物相比,非无菌植物的枝条增加,根重减少,导致根冠比降低(图2a、b)。非无菌生长的植物还形成了更多的侧根、冠根和三级根,导致根总数大约增加一倍。蔗糖生长的植物的组织重量和根形态与无菌生长的植物相当。将在这些环境中生长的植物分泌物收集到所有植物的无菌培养基中2小时,以避免培养基成分对下游分析的影响。所有生长条件都会在PCA图上产生明显不同的分泌曲线(图2c)。在鉴定的109种化合物中,37%在无菌和补充蔗糖条件下显著不同,53%在无菌和非无菌条件下显著不同,68%在非无菌和补充蔗糖条件下显著不同(Anova/Tukey检验,p<0.05)。总的来说,78%的化合物在至少一个配对比较中是不同的。
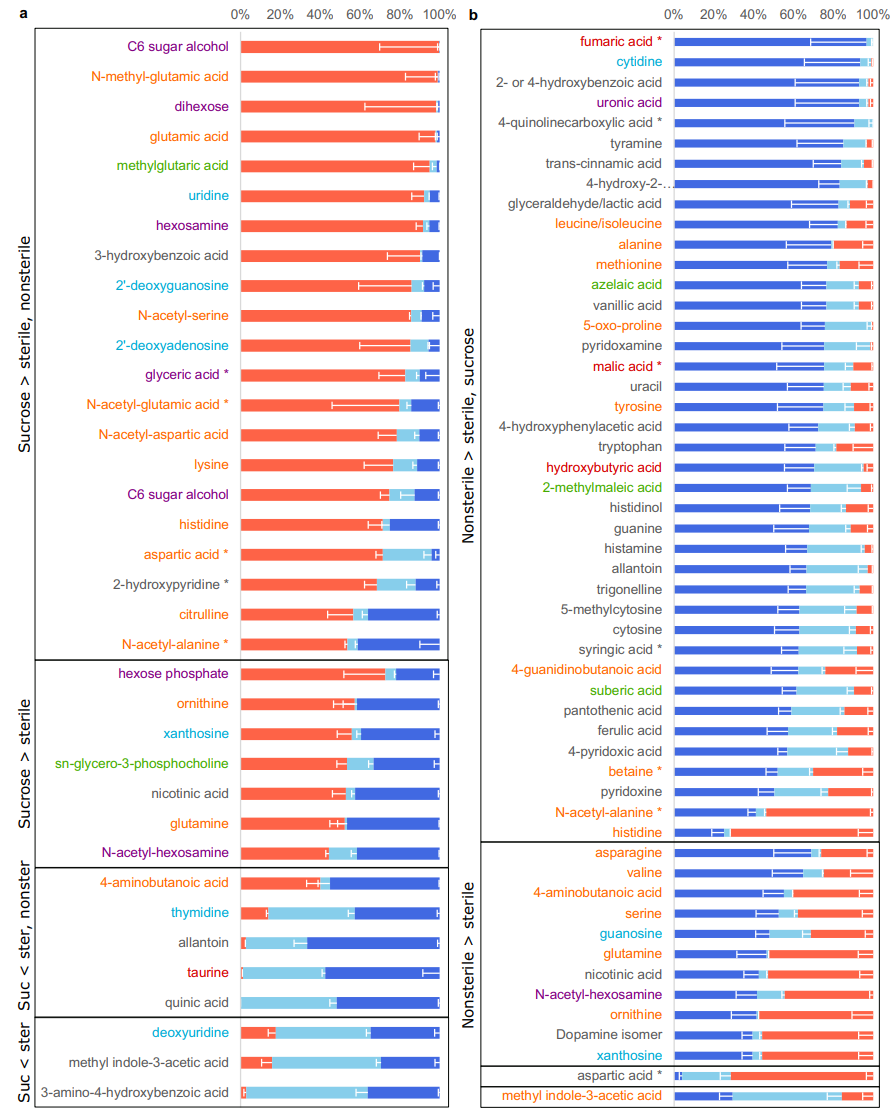
图3 不同生长条件下的二穗短柄草分泌物中差异显著的代谢物
补充蔗糖的植物比无菌生长的植物分泌更多的碳水化合物(并表现出氨基酸分泌增加的趋势),并且它们分泌的有机杂环化合物和有机酸较少(图2d)。与无菌条件相比,添加蔗糖的植物只分泌C6糖醇、二己糖、谷氨酸及其甲基化形式和甲基戊二酸(图3a中的前五种化合物)等。谷氨酸是氨基酸代谢的中枢,因为它可以转化为谷氨酰胺和鸟氨酸,并且谷氨酸转化为2-酮戊二酸是其他氨基酸(例如天冬氨酸)的许多酶促转化所必需的。许多连接的氨基酸通过代谢途径转化为谷氨酸的蛋白质在补充蔗糖的植物中也被上调。谷氨酰胺、谷氨酸和天冬氨酸代谢也影响核苷和核苷酸代谢,一些核苷在补充蔗糖的条件下也会以较高水平分泌(图3a)。虽然植物是自养生物,但它们在这里似乎是混合营养生长的,需要补充糖,通过碳水化合物代谢转化,进而影响氨基酸和核苷的代谢和分泌。
蔗糖是一种常见碳源,增加碳源会增加分泌氨基酸。尤其是谷氨酸,作为氨基酸代谢中枢可能调控各种功能。
非无菌生长的植物显示出更高水平的苯并和更低的碳水化合物以及核苷和衍生物分泌的趋势(图2d)。通常,受影响的单一化合物与在补充蔗糖的条件下发生变化的化合物不同。与无菌条件相比,几种氨基酸的含量更高。此外,许多有机酸(例如富马酸)、苯环化合物(例如苯甲酸及其衍生物)和有机杂环化合物(例如喹啉羧酸及其衍生物)在非无菌条件下的含量高于无菌条件(图3b)。有趣的是,与土壤相关细菌相比,芳香族有机酸由植物相关细菌代谢。因此,许多这些化合物可能在植物微生物相互作用中发挥作用。
这一点和我们我发现相同,带有苯环的有机酸或者其他有机物可能调控植物微生物互作,并产生宏观功能特征。
在无菌条件下收集的分泌物中也检测到所有在非无菌条件下存在量增加的化合物,尽管有时含量要少得多。因此,非无菌条件下代谢物水平的增加可能是由于植物代谢的改变,可能是对微生物存在的反应,或者是由于微生物代谢的额外存在。在此数据集中未检测到报告为微生物特异性的化合物。有趣的是,与无菌环境相比,非无菌条件下很少有化合物的丰度降低。由于微生物是异养生物,并且它们必须利用植物来源的化合物进行生长,因此有两种可能的解释:要么被微生物耗尽的化合物不属于该数据集,要么感兴趣的化合物的分泌率随着消耗的同时增加微生物,使得耗尽。我们得出结论,不同的生长条件确实会导致明显不同的分泌曲线。因此,在不同生长条件下进行的实验比较并非微不足道,应该避免。此处提供的所有进一步数据均来自在无菌、无蔗糖补充条件下生长的植物。
结果三:三种植物的不同根茎代谢特征

图4 根系代谢物的物种特异性模式
不同的植物物种具有不同的代谢能力并组装不同的微生物组。我们想知道它们的分泌物特征有多大不同,以及是否在分泌物中可检测到昼夜特征。、二穗短柄草、拟南芥和蒺藜苜蓿被选为单子叶植物、双子叶植物和双子叶豆科植物的代表,用于收集昼夜分泌物。根和茎的组织也在白天和夜晚结束时被收集。
总体而言,在这三种植物的根和茎中鉴定出143种代谢物。在茎组织中,85%的检测化合物在至少一对配对比较中存在显著差异,而在根组织中,只有38%的化合物是不同的。然而,两种组织类型根据PCA图上的植物种类清楚地分开。在单子叶植物二穗短柄草茎与双子叶植物茎(67%)之间检测到最大差异,而双子叶植物茎之间的差异约为一半。通常,根之间的差异小于茎之间的差异,其中二穗短柄草与蒺藜苜蓿最大,为27%,而其他两个比较较小,为20%。显著不同的根代谢物的热图显示存在六个簇(图 4)。第2和第4簇由单一物种二穗短柄草中丰度最高的代谢物组成,而其他簇由两个物种中高丰度的代谢物组成,而另一个物种的代谢物丰度较低:第1、6簇:拟南芥 (A),二穗短柄草(B)>蒺藜苜蓿(M),第3簇:M、B>A,第5簇:A、M>B。在茎中,与其他相比,二穗短柄草中的许多代谢物丰度较高物种,其次是蒺藜苜蓿和拟南芥。在比较单个物种的根与茎时,还发现了明显不同的代谢特征。蒺藜苜蓿的差异最大,为76%,其次是拟南芥,为33%,二穗短柄草为19%。当按组织或物种绘制时,在组织数据中无法检测到昼夜特征。
结果四:具有昼夜特征的三种植物的不同分泌物概况
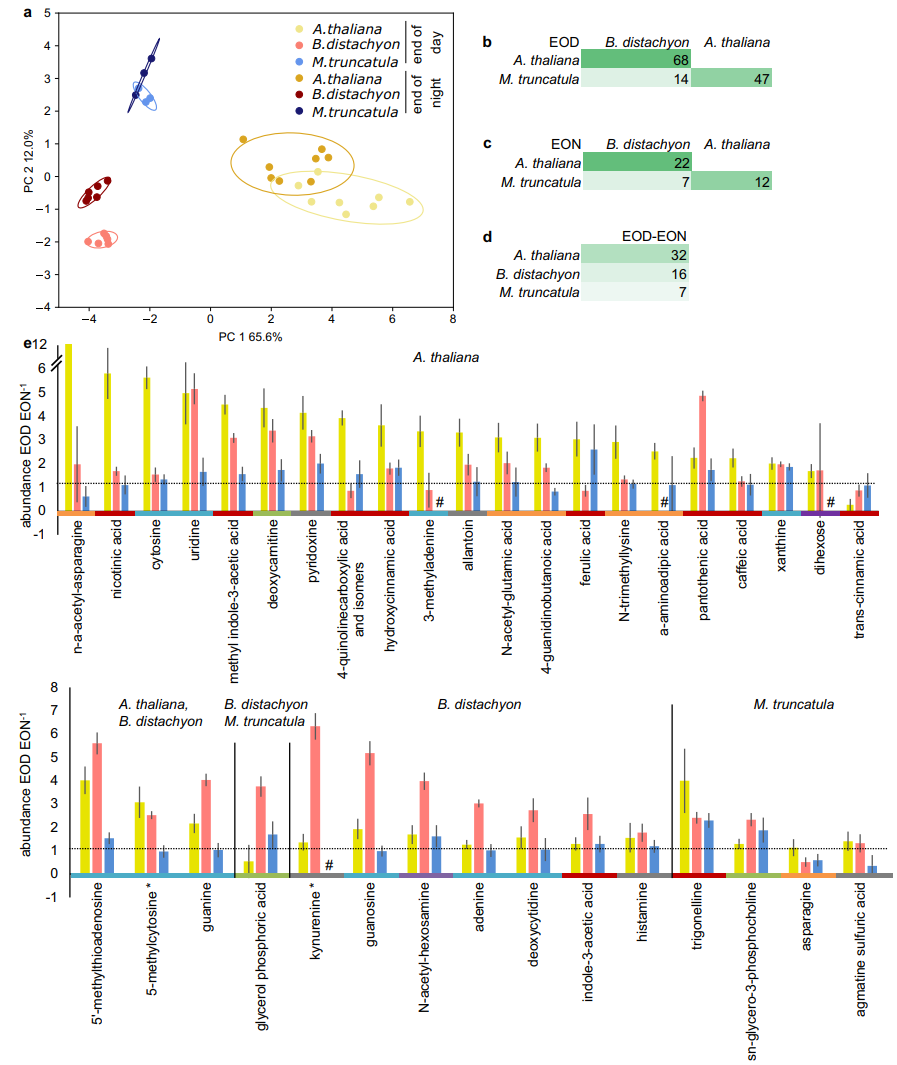
图5 分泌物剖面的昼夜变化
根系分泌物的代谢特征在三种不同物种之间也明显不同(图 5a-c)。尽管在组织中未检测到昼夜差异,但分泌物显示出昼夜特征(培养基分别在白天和夜晚开始时发生变化,收集分泌物2小时,图5a)。本实验共评估了74种代谢物。拟南芥在一天结束时收集的分泌物样本与在夜间收集的分泌物样本之间表现出最大的差异,而蒺藜苜蓿的差异最小(图 5d)。总体而言,在一天结束时两个物种之间77%的分泌代谢物存在差异,而在任何夜间比较中只有28%。两个时间点在拟南芥和二穗短柄草之间表现出最大差异,其次是拟南芥和蒺藜苜蓿(图5b、c)。在一个物种中,48%的代谢物在白天结束时和夜晚结束时有所不同。总之,种间差异在茎中最大,其次是日间分泌物、根和夜间分泌物(图5b、c)。与一天结束相比,两个昼夜时间点之间超过90%的不同化合物在晚上结束时较低,只有肉桂酸、天冬酰胺和胍丁胺硫酸增加(图 5e)。昼夜不同的代谢物属于不同的化学类别。Fishers精确检验显示有机酸、脂质的偶然变化比预期的多,而核苷的变化比预期的少。不同物种间分泌物昼夜模式的显著变化很少一致(图5)。总的来说,我们得出结论,分泌物显示出昼夜不同的代谢特征,大多数化合物在夜间结束时的丰度低于白天结束时的丰度,这与夜间较低的分泌率一致。
结果五:根和分泌物的核心代谢组

图6 根和分泌物中的核心代谢组
我们还对所有三种植物的根和分泌物中存在哪些化合物感兴趣,因为它们可以代表“核心代谢组”。这些化合物可能存在于许多植物物种的根部和分泌物中,因此对于与植物根部相关的核心微生物组的相互作用可能很重要。
为了研究这个问题,代谢物的相对丰度数据被转换为存在/不存在数据(如果在50%以上的样品中高于背景,则存在),因为分泌物和组织的代谢物提取程序不允许进行定量比较。总体而言,在根和分泌物中检测到150种代谢物。检查显示,一半的代谢物(43%)存在于所有物种的根中,包括根核心代谢组(图6)。在所有物种的分泌物中检测到五分之一的代谢物(21%),包括核心分泌物代谢组(图6)。还在所有物种的根中检测到分泌物核心代谢物,因此是核心根代谢组的一个子集(总根核心代谢组:43%+21%=所有代谢物的64%)。在根和分泌物核心代谢组中检测到的化学类别相似,包括氨基酸和其他有机酸、核苷和衍生物、碳水化合物和结合物,在根中则包括脂质(图6)。根核心代谢物没有表现出昼夜特征,而53%的分泌物核心代谢物在分泌物日间和夜间时间点之间表现出差异丰度(图6)。

图7 根和分泌物中的特定代谢物
在这三种植物物种实验中检测到的代谢物中有三分之一未在所有植物物种中检测到,因此不是核心代谢组的一部分。当进一步研究这些代谢物时,一半或更多的化合物仅在根中检测到,而不是在分泌物中,这与核心代谢组数据相当(图7)。此外,25-40% 的化合物在根和分泌物中检测到,并且仅在分泌物中检测到几个百分点。一 些代谢物特定于一种植物物种。通常,这些“特殊”代谢物的出现很复杂。化合物可以在不同的位置(根、分泌物或两者)以及一种或几种植物物种中找到(图7)。
总结:在所有植物物种的根和分泌物中检测到三分之二的化合物,包括根和分泌物核心代谢组。我们推测后者对于与所有植物物种的根相关核心微生物组的相互作用很重要。此外,仅在某些物种和地点检测到三分之一的化合物。如果未来的实验证实这些化合物的独特存在,它们可能负责更专门的植物-微生物相互作用。
讨论:
在文献中,分泌物的收集时间跨度大不相同,从几小时到几天甚至几周不等。通过我们的实验设置,几个小时的收集窗口可以检测到大多数化合物。如果需要更长的收集时间来增加信号强度和/或特定代谢物的检测,则应牢记某些代谢物水平可能已经达到稳定水平。此外,必须考虑到必须谨慎解释此处介绍的时程研究,因为化合物的峰值强度受其他离子存在的强烈影响,使得早期和晚期收集的代谢物分布图之间的比较具有挑战性。
二穗短柄草的生长环境进一步显著影响检测到的分泌物,即使分泌物本身收集在同一介质中也是如此。添加糖的生长培养基导致二穗短柄草的混合营养生长、碳水化合物分泌增加以及氨基酸分泌增加的趋势。这种分泌物特征的转变对于研究拟南芥的研究人员尤为重要,因为它们往往是在补充蔗糖的条件下培养的。分泌在无菌和非无菌条件下也不同,具有更高氨基酸分泌的趋势,这是之前的观察结果。除了氨基酸水平的变化外,大约一半的化合物在无菌和非无菌条件下的丰度存在差异。非无菌条件下的差异分泌可能是微生物代谢或根分泌改变的结果,例如由微生物信号或观察到的根形态改变引起的。在文献中,针对在相同环境中生长的植物使用的不同分泌物收集介质,报告了不同的分泌图谱。与此处使用的等摩尔溶液相比,去离子水中收集的分泌物与等摩尔溶液之间通常会出现最显著的差异。通常,与缓冲溶液相比,去离子水中收集的分泌物显示出更高的代谢物水平。一方面,这可以用代谢组学分析中的基质效应来解释,另一方面可以用扩散梯度增加、渗透压休克或植物细胞在水中裂解等生物学因素来解释。在处理土壤种植的植物时,测试了水:溶剂混合物的原位分泌物收集情况。在分泌物中检测到的化合物通常是在根部合成的。通常,分泌物代谢特征被发现不同于根代谢特征。就水稻而言,在分泌物中发现了63-85%的根代谢物,而在这里,约三分之一的根代谢物也在分泌物中检测到。
组织和分泌物剖面在物种之间明显不同,这是之前对不同物种、栽培品种和生态型以及不同光合类型进行的观察。有趣的是,三分之二的化合物存在于拟南芥、二穗短柄草和蒺藜苜蓿的根和分泌物中,分别构成了根和分泌物的核心代谢组。我们建议在以后的研究中通过研究其他物种的分泌物概况并使用与此处应用的方法不同的方法来扩展核心代谢组的想法。对存在于根和分泌物中的一组核心化合物的描述可能有助于研究植物-微生物相互作用。根与核心附生菌和内生菌相关,这种相互作用可能部分受存在的营养物质和信号化合物控制。此外,虽然核心代谢组可能对与核心微生物组的关联至关重要,但物种特异性分泌物可能导致与特定微生物的关联。众所周知,各种微生物具有不同的底物偏好,并且这些偏好是动态的,具体取决于底物可用性和其他微生物的存在。因此,分泌物或组织中特定化合物的存在可能控制着微生物间的相互作用,例如竞争或交叉喂养。当代谢特征发生变化时,例如植物发育阶段、生物或非生物胁迫、微生物群落反应。
特定分泌代谢物的功能可以用还原法研究。类似于使用合成菌群作为天然微生物组的代表,可以制作简化的分泌物混合物。可以添加或删除单一代谢物,并改变它们的数量。然后可以研究微生物群落对这些合成分泌物的反应。此外,合成分泌物可以应用于天然土壤中的微生物群落,模拟植物的存在。然后,代谢组学方法可用于确定根际微生物的底物偏好,并可用于确定哪些微生物更喜欢哪些分泌物。据报道,许多化合物会影响微生物群落的组成。其中包括通才化合物,例如在许多植物物种的分泌物中检测到的酚类有机酸,以及专门化合物,例如分别由拟南芥和禾本科植物分泌的三萜类化合物和苯并恶嗪类化合物,它们可能是更专门的植物-微生物相互作用的原因。
一个意外的发现是检测到分泌物的昼夜特征,但没有检测到植物组织的昼夜特征。拟南芥在补充蔗糖的条件下生长3周,仅显示390个特征中的7个昼夜变化。另一项研究显示25%波动的代谢物,拟南芥碳代谢突变体表现出根呼吸的变化,以及从叶子和根中输出的糖、氨基酸和有机酸动态的改变。我们发现大多数化合物在夜晚结束时的丰度低于一天结束时的丰度。这可能反映了由于夜间缺乏碳固定,从叶子到根再到根际的代谢物流量较低,可能与夜间水分吸收增加有关。或者它可能是调控过程的结果,可能是由昼夜调控基因驱动的。微生物组丰度和转录活性每天都在变化,植物时钟基因被证明参与了这一过程。此外,根际土壤有机质昼夜不同。迄今为止尚不清楚分泌减少是否是上述研究中观察到的微生物组活性和土壤有机质变化的原因。未来的研究可以调查通过光合作用固定碳、植物内的碳运输和进入根际的碳之间的联系,这取决于其他因素,如蒸腾作用或微生物活动。
这里介绍的研究有很多局限性。其中值得一提的是分泌物和组织代谢组学分析的技术挑战。具体而言,本研究侧重于使用正相色谱法分析极性代谢物。众所周知,与代谢物共洗脱的化合物会影响它们的电离效率。在这项研究中,我们使用内部标准来部分控制这些影响。此外,我们通过根重对分泌物进行归一化,这是除了例如通过总碳分泌归一化之外的常见做法。对于未来的工作,应将本研究中水培植物的分泌物特征与自然环境(不同土壤、土壤提取物)中生长的植物进行比较,以研究生长模式(营养缺陷型、混合营养型)和代谢特征的差异。如果植物能够在竞争中胜过其他生物体,则植物会从其环境中吸收大量化合物。研究自然系统分泌的研究因微生物代谢和土壤物理化学而变得复杂。此外,植物代谢会随着与有益或致病生物(如菌根真菌或青枯菌)的相互作用而发生显著变化。大多数代谢特征的定量和定性变化都没有得到很好的研究,但对于确定植物-微生物相互作用的分子机制至关重要。朝着这个方向迈出的第一步是,例如,在先前收集的分泌物中进行微生物生长测定,以及对具有活微生物或灭活微生物的植物进行处理以确定分泌物的变化。此外,分泌物与土壤颗粒的相互作用对于确定自然环境至关重要。我们得出结论,生长和取样条件是观察到的分泌曲线的关键决定因素。分泌物是动态的,每天变化,对于这里调查的植物物种来说是不同的。尽管如此,还是检测到了许多常见的代谢物,这导致了对根和分泌物核心代谢组的首次描述。
研究方法:
植物生长条件

二穗短柄草Bd21-3种子在70%乙醇中脱壳并灭菌30秒,然后在6%NaOCl、0.1%TritonX-100中灭菌5分钟,然后在水中进行五步洗涤。幼苗在0.5× Murashige & Skoog平板(0.5× MS, MSP01, Caisson Laboratories, USA; 6% w/v Bioworld Phytoagar, 401000721, Fisher Scientific, USA; pH 5.7)上在16小时光照/8小时黑暗条件下发芽在24°C下放置三天。通过在70%乙醇中培养30分钟、在无菌水中漂洗4次、在6% NaOCl中培养30分钟以及在无菌水中漂洗4次,对蒺藜苜蓿cv Jemalong 种子进行灭菌。通过在无菌水中培养4小时吸收种子,然后在0.5×MS平板上发芽三天。拟南芥Col-0种子通过在70%乙醇中浸泡15分钟进行灭菌,然后在100%乙醇中浸泡15分钟,然后干燥。种子在0.5x MS平板上发芽14天,以避免植物淹没在罐子里。
Weck罐(743, Glashaus Inc., USA)用MilliQ水冲洗五次,喷洒70%乙醇,在层流罩中用紫外线处理1小时,并干燥过夜。罐子中装有150毫升5毫米玻璃珠作为惰性固体基质,以保持植物直立,并装有50毫升0.5× MS(MSP01,Caisson Laboratories,美国)。对于0.5MS+suc条件,培养基补充有2% w/v蔗糖(S0389,Sigma-Aldrich,美国)。实验对照罐的设置完全相同,但它们不含植物。在整个实验过程中,对照罐的处理方式与含有植物的罐相同。二穗短柄草和蒺藜苜蓿的三株幼苗和拟南芥的四株幼苗被转移到每个罐中。为了在无菌环境中进行气体交换,将两条微孔胶带(56222-182, VWR)放置在罐子开口处,并用微孔胶带(56222-110, VWR)包裹盖子。非无菌植物以相同的方式设置,除了最后一个微孔带,以实现与环境的气体交换。植物在16小时光照/8小时黑暗条件下在24°C和150 µmol m−2s−1光照下生长至发芽后21天,持续三周。培养基每周更换一次,并在收集根系分泌物的前一天更换。在收集分泌物之前,通过在LB平板上接种50 µl培养基,然后在24°C下培养三天,测试罐子的无菌性。
根系分泌物采集
将罐中的培养基更换为50 ml 0.5×MS培养基。植物在24°C下以 150 µmol m−2 s−1光照培养两个小时或指定的时间。分泌物是在中午收集的,除了在一天的最后2小时收集的日终样本和在晚上的最后2小时收集的夜间样本。在添加蔗糖的培养基中生长的植物的根系分泌物也收集在无蔗糖的0.5× MS中,以避免下游LC/MS分析中的离子抑制。通过移液器收集分泌物,通过0.45 µm过滤器(4654,PALL Life Sciences,USA)过滤,在-80°C冷冻,并冻干(Labconco FreeZone 冻干机)。
植物组织采集
对于昼夜实验,拟南芥、二穗短柄草和蒺藜苜蓿的根和茎组织在一天结束和夜间结束的时间点取样,并立即冷冻在干冰上。用预称重的试管记录组织鲜重,并将样品储存在-80°C直至进一步处理。
液相色谱样品制备
将根和茎组织样本用研磨机研磨两次,每次1.5分钟,频率 30 s−1。将冷冻样品转移到冰上,加入1 ml 4 °C LC/MS级甲醇,涡旋样品以悬浮材料。通过向空管中加入1 ml LC/MS级甲醇制备提取对照。提取对照的处理方式与样品相同。将管在冰上培养1小时,并频繁涡旋。样品在10,000 g和 4°C下离心5分钟。将上清液转移至新管中,24℃真空蒸干甲醇。第二次用1ml甲醇在冰上重复提取,合并样品的上清液。
将根系分泌物样品重悬于3 ml LC/MS级甲醇(CAS 67-56-1,Honeywell Burdick & Jackson,Morristown,NJ,USA)中,涡旋3次,每次10秒,在24℃水浴中超声处理20分钟。对于盐沉淀,样品在4°C 下培养16小时,在5000 g和4°C下离心5分钟,将上清液转移到新的微量离心管中,并在24°C下真空蒸发直至干燥。将样品重悬于500 µl LC/MS级甲醇中,并如上所述执行第二个盐沉淀步骤。
最后,将分泌物和组织样品重悬于含有15 µM内标的100% LC/MS级甲醇中(767964,SigmaAldrich,美国),体积相对于组织鲜重。对于分泌物,使用根鲜重。
代谢组学分析
使用亲水性液体相互作用色谱法对代谢物进行色谱分离,并使用配备HESI-II源探针(ThermoFisher Scientific)的Q Exactive Hybrid Quadrupole-Orbitrap质谱仪进行检测。对于色谱分离,在Agilent 1290系列HPLC系统上使用 Agilent InfinityLab Poroshell 120 HILIC-Z 色谱柱(2.1×150 mm,2.7µm)。内部和外部标准包括在内质量控制目的,在每个独特的样品之间进行空白注射。使用代谢物图谱(https://github.com/biorack/metatlas) 将LCMS数据与内部参考标准库进行比较。代谢物鉴定是根据保留时间(1分钟以内与标准相比)、裂解光谱(人工检查)和精确质量(20 ppm 以内)进行的。LC/MS数据质量是通过分析在运行开始、运行期间和运行结束时包含的质量控制样品来确定的。内标用于评估峰面积和保留时间的样品间一致性。
如果实验处理的平均强度与实验空白的平均强度相比相同或更低,则代谢物被排除在分析之外。对于时程实验,另外将样品与0分钟控制时间点进行比较。此外,代谢物强度表示为最大峰高的百分比,允许样品之间峰高的相对比较(例如,如果感兴趣的化合物在样品之间显著不同),但不能用于绝对代谢物水平量化(例如化合物的微克每克组织感兴趣)。使用 ClassyFire 化合物分类系统将化学类别分配给代谢物。
统计分析
为探索实验条件之间的差异,代谢物谱采用PCA排序,95%置信水平显示为每个处理的椭圆。使用python 2.7 Seaborn包执行了使用Bray Curtis差异矩阵的层次聚类分析。使用python SciPy ANOVA测试分析代谢物显著性水平,并结合python Tukey的真实显著差异测试,其中p=0.05对应于95%的置信水平。
其他关键信息
昼夜实验收集分泌物,白天最后两个小时,夜晚最后两个小时。
根系分泌物处理方法:
0.45微米滤膜, 干冰冷冻,-80°冷冻,冷冻干燥;
使用LC-MS测定。
下一期预告:NC-三种系统发育不同植物的核心代谢组和根系分泌物动态(下):我们看看作者的数据究竟是什么样子?不通过作者的角度进行查看,而直面数据本身,就是就是我文献超精读的意义。







 文章探讨了植物根系分泌物的动态变化,发现收集时间、生长环境(无菌、非无菌、加糖)和物种差异显著影响分泌物代谢组。核心代谢组的概念被提出,指存在于多种植物中的代谢物,可能影响根部微生物群落。此外,研究揭示了分泌物的昼夜变化,但未在植物组织中观察到类似现象。
文章探讨了植物根系分泌物的动态变化,发现收集时间、生长环境(无菌、非无菌、加糖)和物种差异显著影响分泌物代谢组。核心代谢组的概念被提出,指存在于多种植物中的代谢物,可能影响根部微生物群落。此外,研究揭示了分泌物的昼夜变化,但未在植物组织中观察到类似现象。
















 1925
1925

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








