菌株去除揭示影响肠道微生物组代谢输出的相互作用
Strain dropouts reveal interactions that govern the metabolic output of the gut microbiome

Article, 2023-06-22, Cell, [IF 64.5]
DOI:10.1016/j.cell.2023.05.037
原文链接:https://linkinghub.elsevier.com/retrieve/pii/S0092867423005895
第一作者:Min Wang
通讯作者:Michael A. Fischbach
主要单位:
斯坦福大学生物工程系
斯坦福大学医学院微生物与免疫学教研室
斯坦福大学ChEM-H研究所
勒纳研究所克利夫兰医学中心心血管与代谢科学系
勒纳研究所克利夫兰医学中心微生物组与人类健康中心
旧金山Chan Zuckerberg生物中心
勒纳研究所克利夫兰医学中心解剖病理学系
凯斯西储大学计算生物学研究所
- 亮点 -
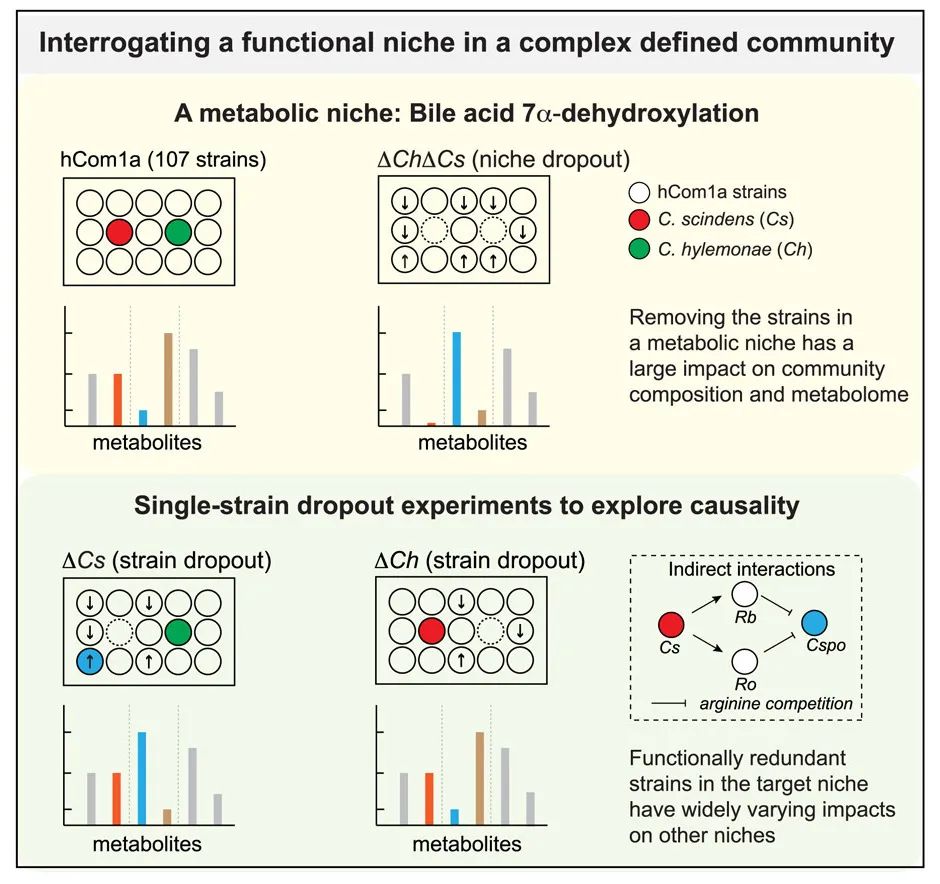
构建缺少代谢生态位的两个菌株的复杂菌群;
与hCom1a相比,ΔCsΔCh定殖的小鼠菌群中有8个菌株相对丰度变化超过100倍;
Clostridium sporogenes(Cspo)在ΔCs定殖的小鼠菌群中增加超过1000倍,而在ΔCh中没有增加;
菌株交换以不可预测的方式在菌群中产生影响。
- 摘要 -
复杂肠道微生物群中单个菌株在菌群中的作用仍然知之甚少。为了解决这个问题,作者构建了复杂的定义群体的变体,即去除占据胆汁酸7α-脱羟基生态位的菌株。去除Clostridium scindens(Cs)和Clostridium hylemonae(Ch)消除了次级胆汁酸生产,并以高度特异性的方式重塑了菌群,8个菌株的相对丰度变化超过了100倍。在单菌种去除菌群中,Cs和Ch的相对丰度相同,对胆汁酸的去羟基化程度相似。然而,产孢梭菌Cspo在ΔCs中增加超过了1000倍,重塑了微生物群衍生的苯丙氨酸代谢物。总之,在生态位内功能冗余的菌株可以在生态位外产生广泛不同的影响,并且菌株交换能以不可预测的方式在菌群中产生影响,从而对不相关的菌群水平表型产生巨大影响。
图形摘要
- 介绍 -
一个典型的肠道微生物群由几百个菌株组成,它们的相对丰度至少跨越了6个数量级。确定单个菌株对菌群生态和宿主生理的影响是一项艰巨的挑战。各种各样的研究已经描述了肠道微生物组细菌菌株的功能特性,体内的功能的揭示通常以一个物种或一个小菌群定殖的小鼠进行研究,对原生菌群背景下菌株功能贡献的认识仍然很困难。
首先,作者考虑到了菌群的功能冗余,即去掉一个菌株,可能由于一个具有类似功能菌株的存在而导致没有表型变化。其次,肠道生态系统被组织成物理和代谢生态位,它们被认为是菌群内的功能单位。一些长期存在的问题是:菌株在生态位中如何发挥作用,菌株到生态位的映射是什么?一个生态位的变化能传播到其他生态位吗,这些事件是如何控制诸如菌群组成和代谢输出之类的突发行为的?
考虑到以上因素,作者决定研究一个生态位而不是单个菌株。鉴于对微生物组化学的兴趣,作者重点对胆汁酸7α-去羟基化进行了研究(一种经过充分研究的微生物途径)。胆汁酸7α-去羟基化为专门利用胆汁酸的有限物种提供了适应性优势,符合代谢生态位的定义。这个生态位的产物是一个高度集中的具有重要生物活性的代谢物池,但其组成物种之间的相互作用知之甚少。
作者利用了最近开发的肠道微生物组模型系统,该系统由100种最常见的肠道细菌组成。结果表明,胆汁酸7α-去羟基化生态位由Clostridium scindens(Cs)和Clostridium hylemonae(Ch)组成。当把它们一起从菌群中移除时(ΔCsΔCh) ,有8种菌株的相对数量急剧上升或下降。移除单菌株的菌群(ΔCs和ΔCh),剩下的另一种菌株都可以完全代谢胆汁酸,并且生态位内的补偿使其成员的相对丰度保持在一个狭窄的范围内。这些实验还可以帮助测试不同菌株之间的因果关系,确定胆汁酸7α-去羟基化过程是特定于Cs菌株、Ch菌株或者两个菌株。ΔCs和ΔCh定殖的小鼠具有相似的胆汁酸谱,但由于Cs与Clostridium sporogenes(Cspo)的特异性相互作用,苯丙氨酸代谢存在巨大且意想不到的差异,这表明在一个生态位内的菌株交换可以产生级联效应,影响不相关的生态位。这些数据表明,可以对复杂的菌群进行高度控制的实验,以阐明菌株层面的因果关系和机制。
- 结果 -
1. 无菌小鼠体内复杂肠道细菌菌群的可重复性定殖
Reproducible colonization of a complex gut bacterial community in germ-free mice
在这项工作中使用的模型微生物群是基于最近开发的104个成员的定义菌群hCom1。为了增强菌群的代谢潜能,额外添加了3个菌株:Turicibacter sanguinis DSM 14220、Lactobacillus plantarum WCFS1和Clostridium sp. D5,从而形成了一个107个成员的菌群(以下简称为hCom1a)。
为了测试hCom1a在C57BL/6N小鼠中的技术和生物学重复性,作者使用了三组小鼠,分别在不同时间独立构建hCom1a菌群进行定殖。如图1A所示,从冷冻保存管中预培养107个成员菌株并通过混合获得移植菌群接种物(hCom1a inoluclum),然后将接种物移植到无菌C57BL/6N小鼠。在经过4周的定殖后,对小鼠的盲肠和结肠内容物进行了高分辨率的宏基因组测序分析。在盲肠中,所有技术重复的菌株丰度非常相似(pairwise Pearson’s R = 0.94 ± 0.04),三组生物学重复的菌株丰度也非常相似(R > 0.87,图1B)。这种高度的可重复性支持了hCom1a作为C57BL/6N小鼠的实验模型。
对C57BL/6N小鼠和接种物的菌群组成进行了分析,得出以下四个结论:(1)接种物中几乎存在所有菌株。有101个菌株的相对丰度均值大于1e−6,两个菌株的相对丰度较低(Anaerofustis stercorihominis DSM 17244、Blautia hydrogenotrophica DSM 10507),还有另外四个菌株在三个重复实验中未检测到(Clostridium methylpentosum DSM 5476、Dialister invisus DSM 15470、Ethanoligenens harbinense YUAN-3和Eubacterium dolichum DSM 3991)(图1C)。(2)接种物中的大部分菌株定殖于小鼠的肠道。至少有96个菌株在盲肠中被检测到,其中83个菌株的平均相对丰度大于1e−6(图1D)。(3)接种物菌群中菌株的相对丰度分布集中,但在盲肠中跨越了6个数量级,几乎所有菌株的变异系数小于0.4(图1C和图1D)。相对丰度发生变化的四个菌株是Bacteroides sp. 2-1-22、Ruminococcus bromii ATCC 27255(Rb)、Slackia heliotrinireducens DSM 20476和Mitsuokella multacida DSM 20544(Mm)。(4)在盲肠中观察到了全部5个细菌门,其中拟杆菌门占主导地位(总读序的58.2%),其次是厚壁菌门(34.7%)、疣微菌门(3.1%)、变形菌门(0.5%)和放线菌门(0.5%)。这些数据表明,hCom1a能够以高度可重复的方式在无菌C57BL/6N小鼠中定殖,支持了本研究中后续的菌株移除实验。
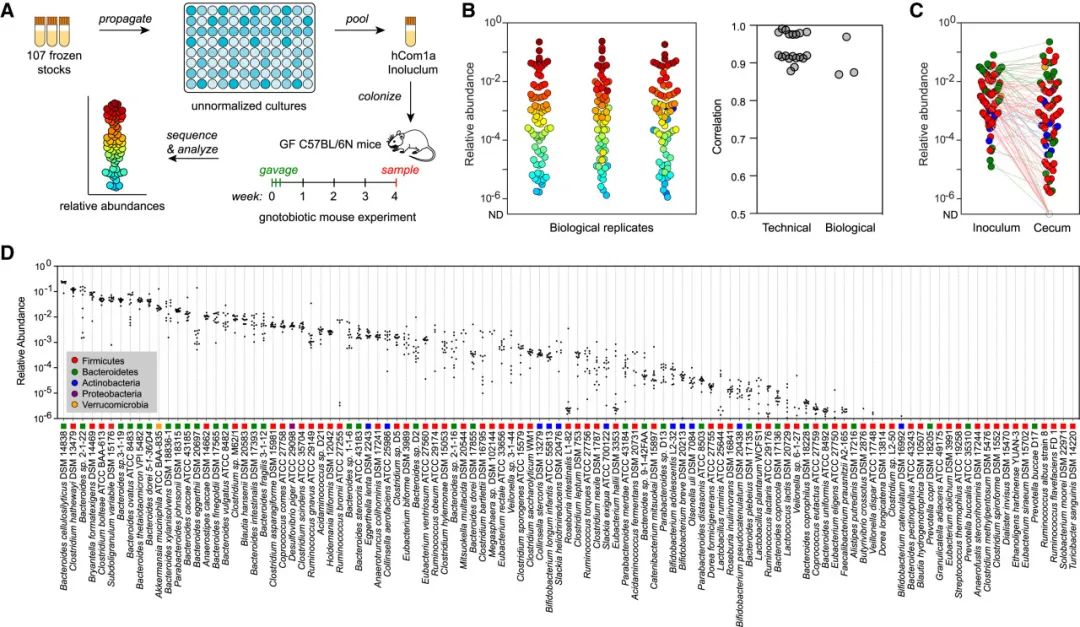
图1 用复杂肠道细菌菌群(hCom1a)定殖无菌C57BL/6N小鼠
(A)实验示意图。从菌株冷冻保存管中培养107株菌株,每24小时传代一次,培养3天后混合成移植菌群接种物。采用灌胃法对无菌C57BL/6N小鼠进行接种物移植(重复3-5只)。定殖4周后,收集自由饲喂的小鼠肠道内容物进行宏基因组测序,并通过NinjaMap分析测定菌群组成。
(B)盲肠中hCom1a的结构是高度可重复的。左图:菌群组成在三个生物重复中高度相似。圆点表示单独的菌株,是第4周时菌群菌株的平均相对丰度,菌株根据其在所有样品中的平均相对丰度着色。右:技术重复和生物重复的Pearson相关系数。所有菌株的相对丰度取log10计算Pearson相关系数,未检测到的菌株的相对丰度设为1e−8。
(C)接种物与第4周菌群的平均相对丰度。菌群中菌株在小鼠肠道定殖时相对丰度超过 6个数量级。根据(D)中的图例按门着色。
(D)大多数菌株的相对丰度分布集中。每一列描述了第4周所有样品中单个菌株的相对丰度。
2. 计算搜索识别胆汁酸7α-脱羟基菌株
A computational search to identify strains that carry out bile acid 7α-dehydroxylation
在hCom1a菌株中,已知只有Cs ATCC 35704和Ch DSM 15053产生次生胆汁酸。作者接下来,确定了hCom1a中是否有其他菌株是7α-去羟化生态位的一部分。首先对hCom1a基因组序列数据库进行了多基因blast搜索,寻找8个基因的bai操纵子(图2A),该操纵子编码胆酸(CA)和鹅去氧胆酸(CDCA)的7α-去羟基化代谢途径,分生成去氧胆酸(DCA)和石胆酸(LCA)(图2B)。在107株中,只有Cs和Ch携带bai操纵子。
然后,作者测试了菌群中是否有其他菌株具有胆汁酸7α-去羟化未知的替代途径。将单独培养的菌株混合构建hCom1a和ΔChΔCs移除菌群,然后在CA存在下培养这些菌群,并通过液相色谱-串联质谱(LC-MS)对其培养上清进行分析。结果显示hCom1a可以将CA转换为DCA,而ΔChΔCs则没有(图2C),表明Cs和Ch是7α-去羟化生态位中仅有的菌株,但不排除hCom1a中其他株菌株在体内进行该反应的可能。通过对公开的人类宏基因组数据进行分析,观察到Cs和Ch经常共存于肠道菌群中,这表明它们在人类肠道中并不是竞争和相互排斥的(图2D)。
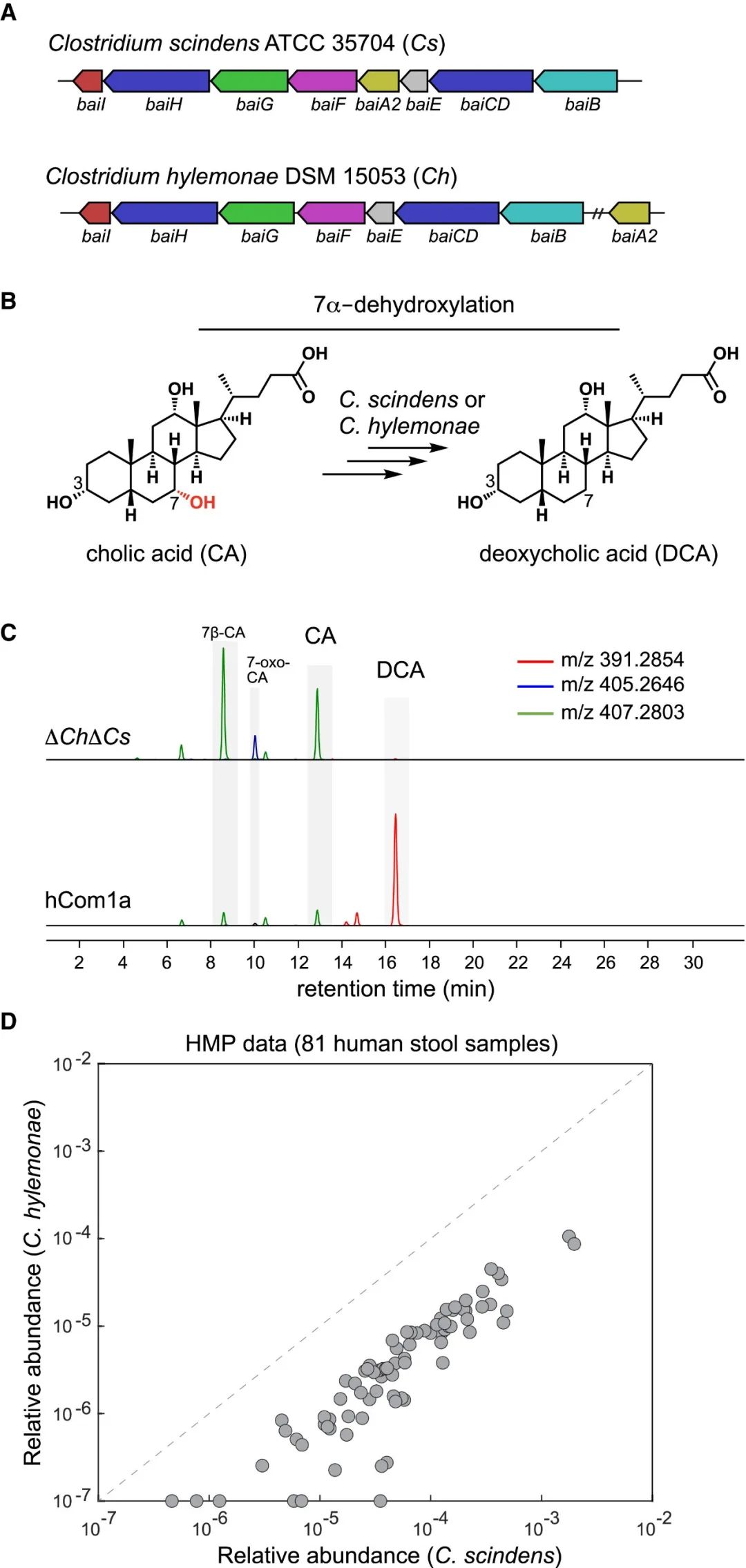
图2 hCom1a的7α-去羟化生态位由Cs和Ch组成
(A)对hCom1a的107个基因组进行多基因blast,只有Cs和Ch含有编码胆汁酸7α-去羟基化途径的bai操纵子。
(B)胆酸(CA)去羟基化成脱氧胆酸(DCA)的简化示意图。
(C)联合提取离子色谱图显示,hCom1a在体外将CA转化为DCA,而双菌株去除菌群ΔChΔCs则不能。先将各菌株分别培养、然后进行混合,按1:100接种到含100 μM CA的Mega培养基中继续培养72 h,收集上清并进行LC-MS分析。
(D)Cs和Ch通常在人类肠道中共同定殖。每个点表示来自NIH人类微生物组计划(HMP)的81个肠道宏基因组样本中的一个,Cs和Ch的相对丰度分别在x轴和y轴上表示。
3. 确定体内7α脱羟基功能的生态位
Determining the occupancy of the 7α-dehydroxylation niche in vivo
为了验证Cs和Ch是否是体内7α-去羟化生态位的唯一占位者,作者用hCom1a或去除两菌株的菌群(ΔChΔCs)移植了无菌C57BL/6小鼠。3周后收集小鼠肠道内容物,并进行靶向代谢组学和高分辨率宏基因组学分析(图3A)。宏基因组数据分析结果证实ΔChΔCs定殖的小鼠盲肠样本中不存在Cs和Ch(图3B)。
Cs和Ch的去除对胆汁酸类化合物的影响较大(图3C)。作为7α-去羟基化产物的次级胆汁酸DCA和LCA及主要衍生物isoDCA和3-oxo-DCA没有在ΔChΔCs小鼠的粪便颗粒中被检测到。相反,ΔChΔCs小鼠表现出更高水平的途径中间体如7β-CA、7-oxo-CA以及CDCA异构体熊去氧胆酸(UDCA)(图3C)。综上所述,这些数据表明Cs和Ch是C57BL/6小鼠体内7α-去羟化生态位中仅有的菌株,移除Cs和Ch会导致次级胆汁酸的完全消除。之前的研究中,去除次生胆汁酸产生是在简单的菌群背景下进行的,或者通过使用抗生素去除原菌群后用抗生素抗性的突变体定殖。相比之下,本研究系统是在复杂菌群环境中明确敲除7α-去羟基化。
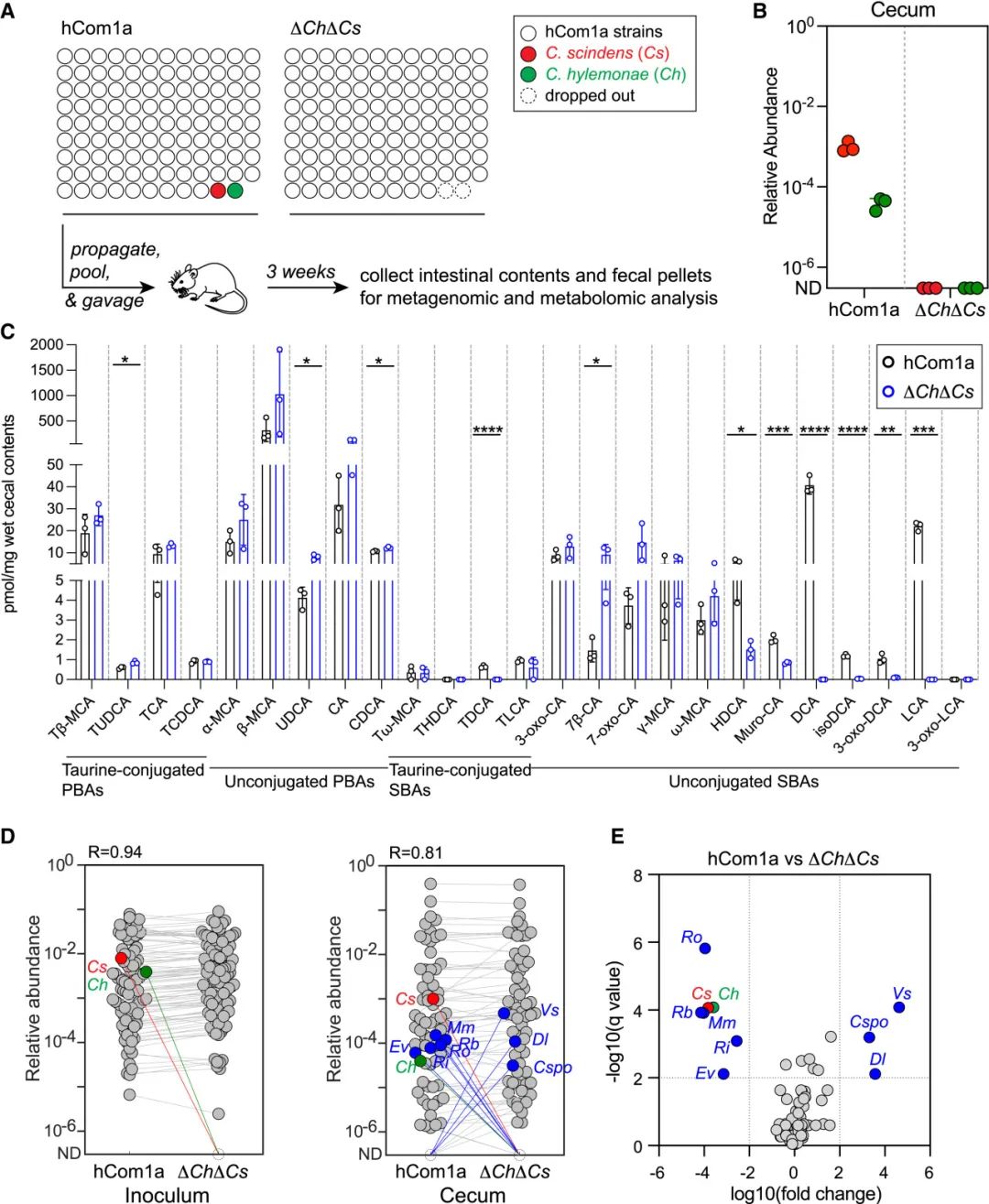
图3 去除Ch和Cs对7α-去羟基生态位的代谢和生态影响
(A)实验示意图。用hCom1a或ΔChΔCs定殖无菌C57BL/6小鼠(每组3只),饲养3周后取粪便颗粒和肠道内容物进行宏基因组分析或靶向代谢物谱分析。
(B)在ΔChΔCs定殖小鼠中检测不到Cs和Ch。对接种物和盲肠菌群的高分辨率宏基因组分析计算相对丰度。
(C)ΔChΔCs定殖小鼠消除了次生胆汁酸产生。盲肠内容物中的胆汁酸通过靶向LS-MS分析进行定量,采用Student’s two-tailed t test评估统计学显著性(∗ p < 0.05;∗∗ p < 0.01;∗∗∗ p < 0.001;∗∗∗∗ p < 0.0001)。PBAs,初级胆汁酸;SBAs,次生胆汁酸。
(D)接种物(左)与盲肠内容物(右)菌群在第3周的平均相对丰度。圆点表示一个单独的菌株,是3个样本的平均值。Cs和Ch分别以红色和绿色突出显示。蓝色表示菌株在hCom1a定殖小鼠和ΔChΔCs定殖小鼠之间的相对丰度有显著差异(FDR < 0.01,倍数变化 > 100)。
(E)相对丰度差异菌株的火山图。横轴以log10(fold change)值表示菌株变化倍数,未检测到的菌株相对丰度设为10−8。使用多重不配对t检验分析并用FDR(Q < 1%)矫正。相对丰度差异显著(FDR < 0.01,倍数变化 > 100)的菌株用蓝色表示,蓝色菌株的全名见图5D。
4. 移除Cs和Ch对一部分菌株有很大影响
Eliminating Cs and Ch has a large impact on a subset of strains
接下来,作者试图评估去除Cs/Ch对菌群其他成员的生态影响。将一个物种从自然生态系统中移除可能会产生难以预测的后果。在小鼠中,已有将物种从简单确定的菌群中移除,或使用抗生素或噬菌体预处理从不确定菌群中移除的研究,但目前尚不清楚物种的移除会对一个复杂的、未受干扰的原生菌群产生什么影响。
hCom1a和ΔChΔCs在小鼠中的组成大致相似(R = 0.84)(图3D)。尽管有97个菌群成员具有相似的相对丰度,但是去除Cs和Ch对8个菌株具有显著影响(q < 0.01,丰度变化倍数 > 100)(图3D和3E)。Veillonella sp. 3-1-44 (Vs),Cspo和Dorea longicatena (Dl)相对丰度急剧上升,而Ruminococcus obeum (Ro),Rb,Mm,Roseburia intestinalis (Ri)和Eubacterium ventriosum (Ev)相对丰度降低(图3D)。说明从复杂的肠道菌群中去除两种菌株对位于7α-去羟基生态位之外的少数菌株有很大的影响。
5. 7α-去羟基生态位内的补偿和功能冗余
Compensation and functional redundancy within the 7α-dehydroxylation niche
为了更清楚地了解7α-去羟化生态位内的相互作用,作者构建了ΔCh和ΔCs两个菌群,其中7α-去羟化生态位被Cs或Ch占据,而不是同时被Cs和Ch占据。然后用ΔCh、ΔCs和hCom1a移植无菌C57BL/6小鼠,每周取样粪便颗粒,持续3周。然后将小鼠处理后收集肠道内容物,并对所有样本进行胆汁酸分析和高分辨率宏基因组测序和序列分析(图4A)。
首先,验证了ΔCs或ΔCh接种小鼠的第3周盲肠样本中菌群中不存在Ch和Cs(图4B)。然后通过宏基因组序列分析分析了生态位内的相互作用。在hCom1a处理组中,Cs和Ch的相对丰度大约为10−3和10−4。与人类数据一致(图2D),当Cs和Ch共同存在于生态位中时,Cs的相对丰度高于Ch。当去除Cs时,Ch的相对丰度上升了12倍。同样地,Cs在ΔCh菌群中丰度有轻微上升(图4B)。因此,Cs和Ch可以共存,但生态位内的补偿使菌群中Cs和Ch总相对丰度保持在相似的水平(hCom1a为1.0×10−3,ΔCs为5.1×10−4,ΔCh为1.5×10−3)。
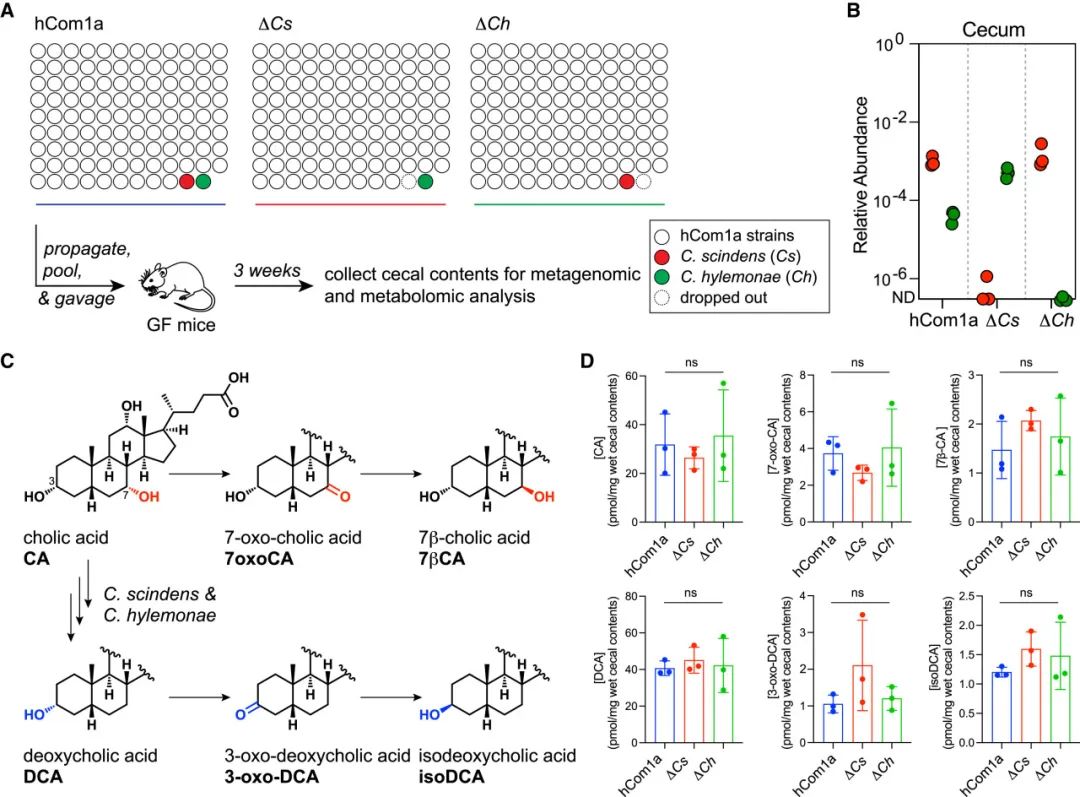
图4 7α-去羟基生态位内的补偿和功能冗余
(A)实验示意图。用hCom1a、ΔCs或ΔCh定殖无菌C57BL/6小鼠(每组3只),饲养3周后取盲肠内容物进行宏基因组和靶向代谢组分析。
(B)7α-去羟基生态位的补偿使菌群中Cs和Ch总相对丰度保持相似。显示了hCom1a、ΔCh和ΔCs定殖小鼠盲肠内容物中Cs和Ch的相对丰度。
(C)肠道菌群转化胆汁酸的代谢途径。
(D)hCom1a、ΔCh和ΔCs定殖小鼠的胆汁酸代谢物具有相似性。在一个完整的菌群中,Cs和Ch可以分别完成将初级胆汁酸转化为次级胆汁酸的核心生态功能。
6. 单菌移除揭示Cs、Ch和菌株间复杂的相互作用
Single-strain dropouts reveal complex interactions among Cs, Ch, and interacting strains
接下来,作者关注了去除菌株对7α-去羟化生态位之外的影响。为了检验ΔChΔCs菌群中观察到的菌株丰度变化是否由Cs或Ch引起,作者将hCom1a定殖小鼠的宏基因组数据与ΔCs和ΔCh定殖小鼠的宏基因组数据进行了比较,以评估菌群中其余菌株的相对丰度(图5A)。ΔCs和ΔCh的组成与hCom1a非常相似(R分别为0.86和0.88)(图5B、5C)。有趣的是,在ΔChΔCs菌群中相对丰度增加或减少超过100倍的8个菌株中,有5个菌株受到Cs去除的影响(Vs和Cspo丰度升高,Ro、Rb和Mm丰度降低),有3个菌株受到Ch去除的影响(Vs丰度升高、Ri和Mm丰度降低)(图5B、5C)。这些受Cs或Ch去除共同影响的菌株可能以同样的机制与Cs和Ch发生相互作用,而其他受单一菌株去除影响的菌株则是以特定方式与Cs或Ch相互作用。
为了更详细地探索7α-去羟化生态位相关的相互作用网络,作者将Cs,Ch和8个受影响菌株的宏基因组数据合并和聚集(图5D)。这些数据符合一个模型,即菌株通过一下三种方式与生态位进行联系:(1)一些菌株对Cs(Rb、Ro和Cspo)或Ch(Ri)具有特异性,这些相互作用可能是菌株特异性的,与胆汁酸无关。(2)Ev和Dl只在双菌株去除菌群中的丰度有变化,表明Cs和Ch有共同的机制,可能与次生胆汁酸的产生有关。(3)其余的菌株(Mm和Vs)在缺少其中一种或两种菌株时均有反应,这表明需要Cs和Ch同时存在(图5E)。作者注意到这些分析无法区分与Cs和/或Ch的直接相互作用和涉及第三种菌株的间接相互作用。尽管如此,这一分析证明了单菌株去除能揭示复杂菌群中菌株-菌株相互作用。

图5 单菌去除揭示了Cs、Ch和相互作用菌株之间复杂的相互作用
(A)实验示意图。用hCom1a、ΔCs或ΔCh定殖无菌C57BL/6小鼠(每组3只),饲养3周后处理,取粪便微球和肠道内容物进行宏基因组分析。
(B和C)虽然大多数菌株在去掉Cs或Ch后保持不变,但少数菌株的相对丰度变化超过了100倍。左:表示在ΔCs和ΔCh菌群接种中无法检测到Cs和Ch存在。中:去掉Cs或Ch分别影响了5个和3个菌株的相对丰度。圆点表示一个单独的菌株,是3个样本的平均值。Cs和Ch分别用红色和绿色突出显示。蓝色表示菌株在hCom1a定殖小鼠和ΔCs或ΔCh定殖小鼠之间的相对丰度有显著差异(FDR < 0.01,倍数变化 > 100)。右:火山图。横轴以log10(fold change)值表示菌株变化倍数,未检测到的菌株相对丰度设为10−8。相对丰度差异显著(FDR < 0.01,倍数变化 > 100)的菌株用蓝色表示,菌株全称显示在热图(D)中。在ΔCs菌群中,解木聚糖拟杆菌(Bacteroides xylanisolvens DSM 18836,Bx)的相对丰度变化接近临界值,没有被进一步研究。
(D)热图表示与Cs和Ch相关的8个菌株相互作用网络。相对丰度低于10−6的菌株用白色表示。
(E)相互作用网络图,菌株以三种方式之一与7α-去羟化生态位相互作用:(1)部分菌株对Cs(Rb、Ro和Cspo)或Ch(Ri)具有特异性,这些相互作用可能是菌株特异性的,与胆汁酸无关。(2) Ev和Dl只在双菌株去除有反应,提示其与次生胆汁酸产生有关。(3)其余菌株Mm和Vs在其中一种或两种菌株缺失时均有应答,说明它们需要Cs和Ch需要同时存在。
7. Dl的生长受到7α-去羟基化产物的抑制
Dl growth is inhibited by a product of 7α-dehydroxylation
接下来,作者尝试了解本研究揭示的消极(抑制性)相互作用的机制。由于Vs在体外生长不强,作者重点研究了Dl和产孢梭菌(Clostridium sporogenes, Cspo)。Dl只有在Cs和Ch都不存在的情况下才能在体内检测到,因此推断Cs或Ch可能会抑制其生长。作者假设这种生长抑制是由Cs和Ch代谢的次生胆汁酸介导的。为了验证这一假设,作者将Dl和Cspo(对照)培养在含有39 μM至1.25 mM CA和DCA的培养基中,由于CDCA和LCA在高浓度下溶解度较差未被考虑。DCA在625 μM生理浓度下完全抑制Dl的生长,而Cspo仅受到部分影响(图S4A)。相比之下,当CA浓度高达1.25 mM时,两种菌株都没有受到影响(图S4B)。这些结果表明,由Cs和Ch产生的DCA可以抑制Dl的定殖。
8. Cs与Cspo相互作用的机理探究
Investigating the mechanism of the interaction between Cs and Cspo
作者首先提出并验证了一个假设,即由Cs产生的可扩散分子抑制了Cspo的生长。作者从两个方面排除了这个分子是DCA的可能性:观察到这种相互作用是Cs特异性的,而不是Ch(图5)。即使Cs和Ch都能产生DCA,但是作者直接证明了DCA不会抑制Cspo的生长(图S4A)。接下来,作者推测抗菌代谢物可能是1-乙酰基-beta-咔啉(AbC)。已有报道表明Cs可以产生AbC并在体外抑制艰难梭菌和其他肠道细菌。DCA在高浓度下具有温和的抑制作用,而即使浓度高达100-500 μM 的AbC对Cspo的生长也没有影响(图S4C)。在后续实验中,Cspo在Cs培养液中培养实验表明:在该条件下,Cs不会产生抑制Cspo生长的可扩散分子(图6A)。
接下来,作者猜测Cs和Cspo之间的相互作用是由于对营养物质的竞争而产生的可能性。Cspo能代谢特定氨基酸,因此作者将重点放在氨基酸利用上。首先分析了hCom1a、ΔCs、ΔCh和ΔChΔCs定殖小鼠盲肠中的氨基酸水平。虽然所有氨基酸的水平在所有群体中基本相似,但精氨酸、组氨酸和色氨酸在盲肠中的含量非常低,表明它们的可用性有限(图6B)。
由于精氨酸是Cspo中特别重要的氨基酸,作者推测可能是Cspo和Cs对精氨酸的竞争介导了相互作用。为合理地验证这一假设,作者系统地筛选了菌群中每个菌株的氨基酸消耗(图6C)。Cs完全不消耗精氨酸,因此作者考虑了第二种可能性:Cs和Cspo之间的相互作用以精氨酸为中心,但是间接的(即涉及中间生物)。
在菌群的精氨酸利用菌中,7种Ruminococcus都在一定程度上消耗了精氨酸(图6C)。值得注意的是,Rb和Ro对Cs去除的响应强烈,但与Cspo的响应方向相反。Rb和Ro的相对丰度与Cs的相对丰度呈强烈的负相关关系(图S2)。Ro可以消耗培养基中约一半的精氨酸,而Rb消耗了所有的精氨酸(图6C)。这些数据表明Rb和Ro可能在体内与Cspo竞争精氨酸。
图6 探究Cs与Cspo相互作用的机理
(A)在Cs或Ch的培养液中未发现扩散的抗菌代谢物。(i)乙酸乙酯(EA)萃取Cs和Ch培养液和对水相冻干。(ii)Cspo在PYF培养基/PYF培养基+EA提取物中的生长曲线。(iii)Cspo在PYF培养基/PYF培养基+冻干物中的生长曲线。
(B)利用液相色谱-串联质谱(LC-MS/MS)对hCom1a、ΔCs、ΔCh和ΔChΔCs定殖小鼠盲肠中氨基酸的靶向谱分析。
(C)hCom1a菌株体外氨基酸消耗情况图。上图:实验示意图;下图:hCom1a菌株氨基酸消耗的热图,按(1-Pearson相关性)聚类。各氨基酸丰度归一化至无菌对照(培养基)并进行log2变换,红色表示氨基酸增加,蓝色表示氨基酸被消耗。这些数据是两个独立实验中的一个。
9. Cs对芳香氨基酸代谢的意外影响
An unexpected impact of Cs on aromatic amino acid metabolism
来自ΔCs和ΔCh定殖小鼠的数据表明,尽管Ch和Cs在胆汁酸代谢生态位中表现出功能上的冗余,但它们对菌群的其他一部分菌株有不同的影响。ΔCh和ΔCs定殖小鼠的盲肠内容物菌群中只有6个菌株(Bx、Ri、Rb、Ro、Mm和Cspo)的相对丰度有显著差异,此外的其他菌株的相对丰度几乎是一致的(图5a)。为了确定ΔCh和ΔCs菌群是否真的无法区分,作者比较了ΔCh和ΔCs定殖小鼠盲肠内容物和尿液中微生物组衍生的代谢物,期望能根据组成相似性找到一致的代谢物谱(图7A)。
令人惊讶的是,代谢物谱表现出了显著的差异(图7B)。首先,三种还原性苯丙氨酸代谢物(苯丙酸、马尿酸和肉桂酰甘氨酸)在ΔCs定殖小鼠中大量产生,但在ΔCh和hCom1a定殖小鼠中的水平非常低(图7C和S3B-S3D)。三个观察结果表明了Cspo的作用:Cspo是唯一在ΔCh和hCom1a定殖小鼠中几乎检测不到,但在ΔCs定殖小鼠中增加了1000多倍的菌株(图5D和7D);Cspo是hCom1a中唯一已知在体外和体内产生还原性苯丙氨酸代谢物的菌株;将Cspo去除从ΔCs去除后定殖小鼠会导致还原性苯丙氨酸代谢物减少(图S6)。
其次,苯丙氨酸的两种氧化代谢物(苯乙酸和苯乙酰甘氨酸)表现出相反的模式(图7C和S3B-S3D)。鉴于还原和氧化途径共享苯丙氨酸为底物而存在相互竞争,因而推测氧化代谢物的减少可能是由于Cspo介导的还原代谢的增加。
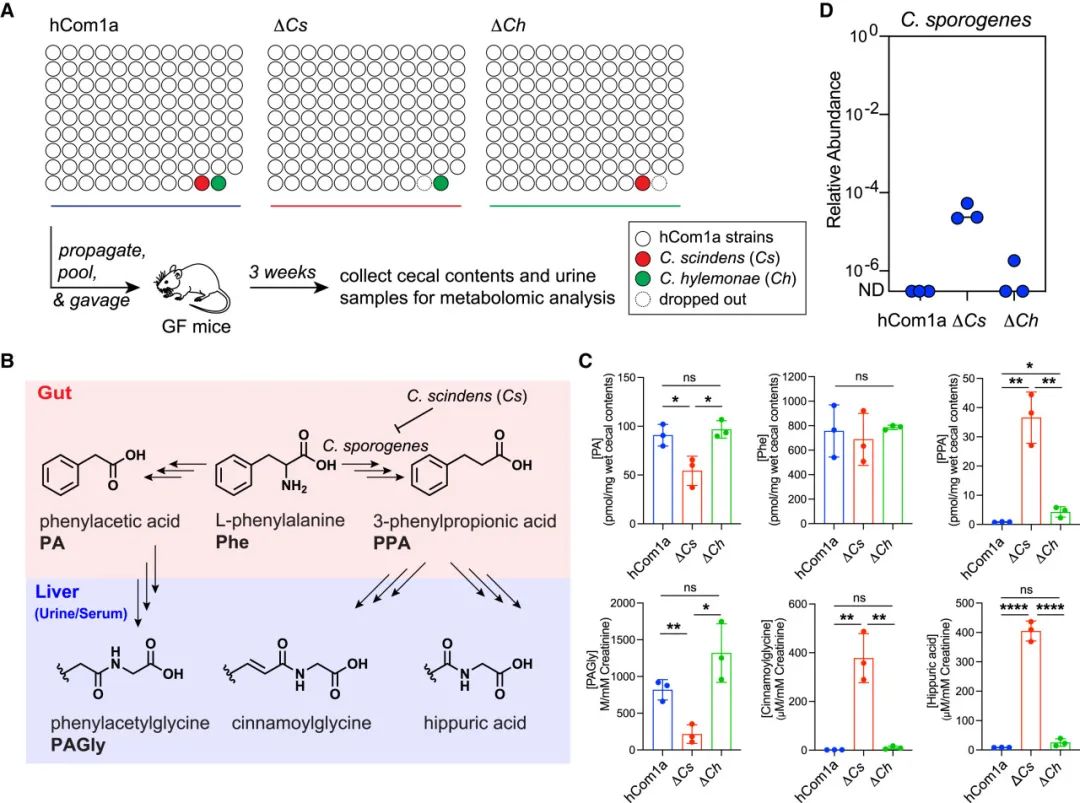
图7 Cs对芳香氨基酸代谢的意外影响
(A)实验示意图。用hCom1a或单株去除菌群(ΔCs和ΔCh)定殖无菌C57BL/6小鼠(每组3只),饲养3周后取粪便颗粒,盲肠内容物和尿液样本进行目标代谢物分析。
(B)某些肠道细菌可以将苯丙氨酸(Phe)还原为苯丙酸(PPA),而苯丙酸被宿主转化为马尿酸和肉桂酰甘氨酸。其他肠道细菌将苯丙氨酸氧化为苯乙酸(PA),在肝脏代谢为苯乙酰甘氨酸(PAGly)。
(C)ΔCs在芳香族氨基酸代谢物输出方面与hCom1a和ΔCh有显著差异。hCom1a和ΔCh几乎完全将苯丙氨酸转化为PA(宿主代谢产生PAGly),尿和血清中几乎检测不到马尿酸(图S3)。相反,ΔCs主要将苯丙酸转化为苯丙酸(宿主将其代谢为马尿酸),尿和血清中的PAGly水平非常低(图S3)。
(D)Cspo在hCom1a和ΔCh定殖小鼠中检测不到,在ΔCs定殖小鼠中相对丰度为10−5到10−4。显示了hCom1a、ΔCs和ΔCh定殖小鼠盲肠内容物中Cspo的相对丰度。采用Student’s two-tailed t test评估统计学显著性(∗ p < 0.05;∗∗ p < 0.01;∗∗∗ p < 0.001;∗∗∗∗ p < 0.0001;n.s 无显著性)。
根据这些数据可以构建一个模型,即菌株交换(ΔCh vs. ΔCs)引发了一个通过菌群级联的多步骤的过程:Cs被Ch取代使Cspo的相对丰度从几乎无法检测增加到约10−4,增加了马尿酸(约16倍)和肉桂酰甘氨酸(约37倍)的水平,减少了苯乙酸酯(约2倍)和苯乙酰甘氨酸(约6倍)的产量(图S5B)。
上述研究中涉及到的代谢物的生物活性需要引起人们注意,如苯乙酰甘氨酸是在心血管疾病中起致病作用。苯乙酰甘氨酸在ΔCs定殖小鼠中的含量大幅下降,它被无毒的马尿酸和肉桂酰甘氨酸所代替。用Ch代替Cs会让苯丙氨酸有益代谢物与有害代谢物的比例高达133倍。因此,7α-去羟基生态位的菌株交换在胆汁酸代谢方面是“沉默的”,而对不相关的菌群水平表型产生了巨大影响。
- 讨论 -
微生物组研究的一个长期挑战是评估单个菌株对菌群生态和宿主生理的影响。过去的研究主要集中在二元培养或简单菌群中的相互作用,其规则和选择条件可能与复杂菌群中有差异。一个明确的复杂菌群提供了构建一个在相关生理背景下去除明确的菌株菌株的环境。这种方法与微生物组遗传系统的最新进展相结合,将大大提高人们对菌株-菌株和菌株-宿主相互作用的理解。
作者的研究关注的是一个代谢生态位而非单个菌株,强调了关注菌群内功能单元的重要性。最初,作者研究的重点是表征次生胆汁酸对宿主的影响,研究了由单个产生胆汁酸的菌落引起的表型是否会被另一个功能冗余的菌株所掩盖。然而,来自菌株去除实验的宏基因组学和代谢组学数据揭示了新的发现,即生态相互作用和菌群代谢之间的联系。
作者通过该模型研究发现在7α-去羟基生态位中存在功能冗余。一个未知的机制使Ch和Cs在生态位中的总相对丰度保持在3倍的范围内,无论生态位是单定殖还是双定殖。Ch和Cs可以共同占据生态位而不存在相互排斥。而当生态位是单定殖时,Cs和Ch在功能上是可互换的,任何一种菌株单独都能够使整个初级胆汁酸去羟基化,并且所得的胆汁酸谱没有显著差异。
然而,生态位中菌株的替换会对菌群其他方面产生意想不到的影响。单定殖生态位为Cs(ΔCh)和Ch(ΔCs)的菌群在组成上极为相似,只有6个菌株在相对丰度上有显著差异。然而Cspo在ΔCs中的意外增殖(在hCom1a和ΔCh定殖小鼠中没有检测到)导致还原性苯丙氨酸代谢物的大量增加,重塑了菌群中不同生态位的化学输出。这一发现有两个重要的含义。首先,它强调了微生物组中物种和菌株水平变化的功能影响。填满同一生态位的不同物种——即使是那些看起来功能冗余的物种——也可能在生态位之外产生巨大的差异。
其次,这对于理解理性社区设计的原则具有重要意义。微生物组研究的一个新兴目标是设计具有感兴趣的免疫或代谢表型的微生物菌群如果目标是建立一个产生马齿酸而不是苯乙酰甘氨酸的菌群,那么显而易见的策略是包括产生前者的菌株,排除产生后者的菌株。然而,通过在一个不相关的生态位中剔除一个品系,作者观察到与理性设计(通过一种不减少多样性或损害任何其他生态位的简单操作)期望的差异。因此,要改变感兴趣的表型,不仅需要考虑实现它的菌株,还需要考虑它们在社区中的相互作用伙伴。
其次,这对于理解理性菌群设计原则具有重要意义。微生物菌群研究中的一个新兴目标是设计具有所感兴趣的免疫学或代谢表型的微生物菌群。如果菌群目标是产生马尿酸而不产生苯乙酰基甘氨酸,那么菌群构建的策略则是包含产生前者的菌株并排除产生后者的菌株。然而,通过在生态位中去除一个菌株,作者观察到了与理性设计期望(不减少菌群多样性、不影响其他生态位)之间的差异。因此,要想改变所感兴趣的表型,不仅需要考虑影响该表型的菌株,还需要考虑菌群中与之相互作用的成分。
- 研究的局限性 -
作为一种模型微生物组,hCom1a在本研究中有两个主要的局限性。首先,与人类粪便菌群相比,它产生的次级胆汁酸数量更少(图S7),这表明可能缺少能够改善胆汁酸代谢的菌株。hCom2是hCom1的衍生物,与人类粪便菌群更具可比性,可用于后续的菌株去除研究。第二,hCom1a只是一个菌群,在人类微生物组中存在大量的菌株和物种水平的差异,因此这里发现的相互作用可能不存在于其他菌群中。
作者的实验结果有两个额外的局限性。虽然详细探讨了Cs和Cspo之间的相互作用,并提供了与精氨酸间接竞争一致的证据(图6、图S4),但这些数据不足以解释互作机制。在进一步研究中,需要去除Ro和/或Rb,且单独或与Cspo进行研究,以及调节精氨酸水平的实验。
作者的实验设置和数据解释可能暗示了一种过于简单的观点,即细菌物种属于单个生态位。实际中,菌株同时占据多个生态位。作者期望本研究的方法可以用来探索菌株与生态位关系,以及菌株-菌株相互作用产生跨多个生态位的影响。
参考文献
Wang M, Osborn L J, Jain S, et al. Strain dropouts reveal interactions that govern the metabolic output of the gut microbiome[J]. Cell, 2023, 186(13): 2839-2852. e21.
- 通讯作者简介 -

斯坦福大学
生物工程系和微生物学与免疫学系
Michael Fischbach
副教授
Michael Fischbach,斯坦福大学生物工程系和微生物学与免疫学系副教授,ChEM-H学者,斯坦福大学微生物组治疗计划的负责人。获得过NIH院长先锋奖获、创新者奖、HHMI-Simons学院学者奖、David和Lucille Packard基金会科学和工程奖学金等。实验室使用基因组学和化学相结合的方法来识别和表征微生物的小分子,重点是人类微生物组。Fischbach博士于2007年获得哈佛大学John and Fannie Hertz基金会化学研究员的博士学位,在那里他研究了铁获取在细菌发病机制和抗生素生物合成中的作用。在马萨诸塞州总医院(Massachusetts General Hospital)担任独立研究员两年后,加入了加州大学旧金山分校(UCSF),在那里成立了自己的实验室,然后于2017年进入斯坦福大学进行研究。Fischbach是Federation Bio和Kelonia的联合创始人兼董事,Revolution Medicines的联合创始人,NGM biopharmacticals和Chan Zuckerberg Initiative的科学顾问委员会成员,以及the Column Group的创新合伙人。
猜你喜欢
iMeta简介 高引文章 高颜值绘图imageGP 网络分析iNAP
iMeta网页工具 代谢组MetOrigin 美吉云乳酸化预测DeepKla
iMeta综述 肠菌菌群 植物菌群 口腔菌群 蛋白质结构预测
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature
一文读懂:宏基因组 寄生虫益处 进化树 必备技能:提问 搜索 Endnote
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流快速解决科研困难,我们建立了“宏基因组”讨论群,己有国内外6000+ 科研人员加入。请添加主编微信meta-genomics带你入群,务必备注“姓名-单位-研究方向-职称/年级”。高级职称请注明身份,另有海内外微生物PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
点击阅读原文,跳转最新文章目录阅读
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








