细菌,作为微生物界的常驻居民,与我们人类有着密切的关系。无论是在我们的肠道、皮肤上还是周围环境中,细菌无处不在。它们在我们的身体内发挥着至关重要的功能,参与新陈代谢过程、帮助消化食物、维持免疫系统平衡等等。然而,细菌也可能引起疾病并对我们的健康造成负面影响。在细菌以我们为宿主的同时,另一种神秘而强大的生物也正以细菌为宿主,展开精彩纷呈的生命博弈,它就是噬菌体。

图1 人体-细菌-噬菌体多重寄生关系[1]
噬菌体是一种依赖细菌和古菌进行生存和繁殖的寄生病毒,一旦进入宿主细胞,噬菌体可以选择进入不同的复制循环。生产型循环会释放新的噬菌体,可以通过不裂解宿主细胞(慢性循环)或在宿主细胞裂解后(裂解循环)实现。另外,噬菌体还可以遵循溶原循环,噬菌体基因组会整合到宿主染色体中,并随着宿主染色体一起复制。噬菌体可以在外界刺激下或者自发诱导退出这种休眠状态并切换到其中一种生产型复制循环。
根据它们的感染循环,噬菌体可以分为不同类型:丝状噬菌体通常遵循生产型慢性循环,其中一些具有进入溶原循环的能力(但并非全部);温和噬菌体的特征是能够进行溶原循环,在诱导后可以通过慢性循环或裂解循环产生新的噬菌体;烈性噬菌体只通过裂解循环复制[2]。

图2 典型的噬菌体感染循环[2]
通过土壤、海洋等环境样本相关研究揭示了噬菌体的高丰度、高多样性以及与宿主之间复杂的相互作用关系。普遍认同的观点是噬菌体塑造了自然界细菌群落的组成和进化,因此在生态系统功能中具有重要作用[2]。另一方面,我们特别关注其在人体肠道中扮演的角色,有助于我们更好地理解肠道微生物的平衡及其对健康的重要性,并为未来的疾病预防和治疗提供更多可能性。在深入了解噬菌体的功能、与微生物组和真核生物相互作用的机制过程中,新方法和技术的出现或许能够从新的维度帮助我们实现创新突破。
一、 噬菌体感染可以引起宿主菌基因表达变化及生理状态差异
深入挖掘机制发现,噬菌体感染可以引起宿主菌基因表达变化及生理状态差异,这种变化较为复杂,并随研究对象的改变而有明显的差异,可能对宿主菌的生存和发展产生重要影响,体现在定植能力、毒力变化、生物膜形成、细胞壁合成、抗性等诸多方面[3]。

图3 噬菌体编码小蛋白(host acquisition factors, HAFs)调控细菌转录机制[4]
案例一:噬菌体phi458降低禽致病性大肠杆菌毒力,促进生物膜形成[5]
禽致病性大肠杆菌 (APEC) 菌株 DE458 在体内和体外都有很高的原噬菌体自发诱导率,构建和表征噬菌体phi458缺失突变体 DE458Δphi458后与野生型菌株进行对比实验发现,DE458Δphi458 的生物膜形成明显减少 (P < 0.01) 、粘附和侵袭能力提高了约6-20倍(P <0.05)。基于50%的致死剂量,DE458Δphi458 的毒力在鸡中增强了大约10倍。此外,禽类感染测定表明,与 WT 菌株相比,肺和肝脏中 DE458Δphi458 的细菌载量分别增加了16.5倍和10倍 (P < 0.05)。qRT-PCR 显示 phi458 的缺失导致 I 型菌毛相关基因 fimH上调了3倍(P < 0.01)。

图4 Phi458增加宿主生物膜的形成、粘附性和侵染性

图5 体内感染期间的细菌定植

图6 毒力基因的定量
案例二:原噬菌体外毒素增强了引起流行性猩红热的化脓性链球菌的定植[6]
猩红热是由人类适应性病原体A群链球菌(即化脓性链球菌)引起的一种急性传染病。东北亚血清型 M12 (emm12) 化脓性链球菌引起猩红热的能力与噬菌体的存在有关,包括原噬菌体 ΦHKU.vir编码分泌的超级抗原 SSA 和 SpeC 以及 DNase Spd1。研究证实GAS HKU16菌株需要HKU.vir编码的外毒素SpeC和Spd1,以及链球菌溶血素O(SLO)的作用,以有效地定植在HLA-B6小鼠模型中,表明细菌被携带毒素基因的噬菌体感染时,毒素可能转移到细菌内,这些获得性毒素可以让A群链球菌更好地在宿主体内定植,有利于提高竞争力。

图7 ΦHKU.vir 编码的 DNase Spd1 可促进对中性粒细胞杀伤的抗性

图8 ΦHKU.vir编码的外毒素和SLO对HKU16鼻咽感染至关重要
案例三:炎症促进了沙门菌属之间的噬菌体转移,进而导致细菌群体进化[7]
噬菌体转移(溶源性转化)是密切相关的肠杆菌科之间基因组多样化的关键驱动力,并被认为能够快速适应新的宿主物种(特别是通过重组毒力因子库)。鼠伤寒沙门菌基因组中通常含有原噬菌体,有些原噬菌体编码毒性基因,可增强宿主菌对肠道上皮细胞的侵袭并加剧机体的肠道炎症。研究者将含有和不含有原噬菌体SpoEø的沙门菌等量混合感染小鼠,发现共感染后含有SpoEø的溶源菌数量稳步增加,进一步研究表明鼠伤寒沙门菌引起肠道炎症的副产物会引发细菌应激反应,导致肠道中噬菌体SpoEø和溶源性转化的增加。
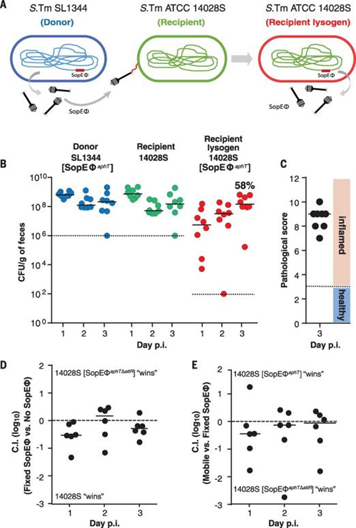
图9 在体内,噬菌体SopEΦ在两种S.Tm菌株之间有效转移

图10 在没有肠道炎症的情况下噬菌体转移减少
案例四:噬菌体协助铜绿假单胞菌在感染期间快速进化[8]
对铜绿假单胞菌实验性慢性伤口感染的研究中发现原噬菌体的插入使dipA、retS等基因被破坏,导致皱褶小菌落变体(RSCV表型)的出现。之前研究表明,慢性感染与RSCV表型菌株相关,该表型病原菌能够逃逸抗生素和宿主免疫作用,表现为具有更高的生物菌膜水平。通过构建基因缺失株的对比实验发现原噬菌体的插入不仅使RSCV表型菌株获得了噬菌体免疫能力,还增强了其生物膜产量和适应力,进一步还有可能对原始菌株进行主动杀伤提升竞争力。

图11 代表性菌株表型形态

图12 PAO1伤口分离株能够免疫噬菌体感染

图13 PAO1 RSCVs菌株相比于PAO1原始菌株适应性增加
案例五:噬菌体φAbp1侵染诱导鲍曼不动杆菌抗性基因表达上调[9]
鲍曼不动杆菌可引起许多医疗手术相关感染以及烧伤和伤口感染,且已被报道对多种抗生素具有抗性。从临床角度来看,探究影响鲍曼不动杆菌毒力和抗生素耐药基因的因素是很重要的,该研究分离了一株特异性侵染广泛耐药性鲍曼不动杆菌菌株AB1的烈性噬菌体φAbp1,并发现φAbp1感染后显著改变了一些基因的表达,包括8个毒力基因和9个耐药基因(P < 0.05)。值得注意的是,3个外排泵相关基因在20 min时上调了1.5倍以上,表明噬菌体感染可能改变了宿主的毒力和耐药性。

图14 菌株AB1在噬菌体感染后与毒力和耐药性相关的基因表达情况
二、 噬菌体调节哺乳动物免疫应答进而影响机体健康状态
越来越多的研究表明,噬菌体可以通过一些独特且神奇的机制调节哺乳动物的免疫应答,进而影响其健康和疾病状态。一种方式是噬菌体通过塑造他们的细菌宿主生态而实现,另一种方式则是直接影响哺乳动物的新陈代谢或免疫系统。在细菌-真核生物共研究中,噬菌体可能发挥着非常重要的作用。
案例一:噬菌体调节哺乳动物先天免疫反应,促进铜绿假单胞菌在体内存活[10]
Pf 是一种具有 ssDNA 基因组的丝状噬菌体,能够在其铜绿假单胞菌细菌宿主细胞周围产生液晶基质,促进生物膜形成和慢性气道感染。研究者使用人和鼠白细胞证明 Pf 噬菌体被免疫细胞吞噬后噬菌体 RNA激活抗病毒 PRR Toll 样受体 3 (TLR-3)。这种激活导致TRIF依赖性I型干扰素的产生,随后抑制了伤口环境中肿瘤坏死因子(TNF)的产生,进一步导致吞噬作用减弱,减缓了从伤口环境中清除Pf阳性铜绿假单胞菌的作用,导致铜绿假单胞菌持续存在和慢性伤口感染。

图15 噬菌体直接刺激哺乳动物免疫反应[11]
案例二:噬菌体蛋白帮助细菌逃避真核生物的免疫防御[12]
Jahn 等研究了海绵体中的噬菌体种群是否含有Ankyrin重复结构域(ANKs),发现这种结构不仅存在于海绵体中的噬菌体种群,还存在于人体的口腔和肠道中的噬菌体群。当这些含有Ankyrin的噬菌体感染宿主细菌细胞时会诱导ANK蛋白的分泌,这提高了细菌在小鼠巨噬细胞存在下的存活率。与产生ANK的大肠杆菌细胞共培养巨噬细胞导致炎症因子TNF-a、Cxcl1和Ifn1的减少,进而导致对细菌细胞的吞噬下降。

图16 噬菌体蛋白帮助细菌逃避真核生物的免疫防御
案例三:噬菌体的扩张与加重的肠道炎症和结肠炎有关[13]
作者使用噬菌体混合物尝试定向清除与结肠癌相关的肠道病原菌粘附性侵入性大肠杆菌(adherent-invasive Escherichia coli,AIEC),发现将噬菌体混合物连续给予小鼠可导致肠道内AIEC的减少,下调与肿瘤生长和转移相关的基因,并保护免受细菌加重的结肠癌。然而,在基因表达数据分析中发现噬菌体处理组小鼠中大量免疫通路上调。随后证明肠道中噬菌体增加导致树突状细胞对噬菌体的摄取增加,内化的噬菌体通过呈现给CD4+T细胞的噬菌体表位触发TLR-9,导致IFN-γ的产生和肠道炎症反应的激活。

图17 噬菌体的扩张与加重的肠道炎症和结肠炎有关
以上例子证实噬菌体与它们的细菌宿主之间的共生关系改变了真核细胞的天然免疫反应,增加了细菌和噬菌体在体内持续存在的可能性。并且随着研究的深入,人们惊讶地发现整个噬菌体颗粒及其成分的存在(包括基因组 DNA 或 RNA、蛋白质衣壳和脂多糖等残留的细菌产物)可以直接刺激哺乳动物的免疫反应[11],这极大地拓宽了我们对噬菌体与宿主之间相互作用的认识,对于免疫系统研究、疾病治疗和生物学领域的发展具有重要的意义。
三、噬菌体研究-传统方法及其局限性
目前对于复杂样本中噬菌体的研究方法可以概括为两类:一、分离培养及感染实验,通过体外细胞培养和感染实验,可以研究噬菌体的寄主范围、感染动力学等。此外,纯化噬菌体颗粒可通过电镜技术直接观察并测定噬菌体的形态、大小和结构特征;二、组学技术,包括经典的全基因组测序和宏基因组测序技术,获取单个或者游离噬菌体群落的基因组信息。


图18 噬菌体分离培养、测序及电镜图[14]
基于这些方法我们已经获取了一些噬菌体的研究成果,但它们仍存在着一些局限性:单株噬菌体的分离培养方法强烈依赖于细菌宿主且实验周期长、通量低,无法获得噬菌体群落的信息。而噬菌体宏基因组研究得到的游离噬菌体信息与探究特定环境中噬菌体与细菌的相互作用适配性不高且丢失了细菌胞内噬菌体的原位信息。除了基因层面的信息,细胞之间存在的转录异质性也是非常重要的信息,可能在互作机制中有较大贡献。
四、噬菌体研究新视角——Mobidrop single-cell microbiome
MobiMicrobe®微生物高通量单细胞基因组测序技术和微生物高通量单细胞转录组技术为解决上述问题提供了新的方案。


图19 MobiNova®-M1仪器、MobiMicrobe®配套试剂
MobiMicrobe®微生物高通量单细胞基因组测序技术基于自主研发的液滴微流控仪器和配套试剂,在液滴生成、融合等过程中实现复杂样本中单个细菌细胞的包裹、裂解、全基因组扩增、片段化、加标签等精微实验,是全球唯一能够基于液滴法实现宏样本单细胞基因组测序的商业化平台。

图20MobiMicrobe®液滴反应流程示意图
搭配MobiMicrobe®微生物高通量单细胞转录组技术,能够在DNA和mRNA层面获取噬菌体的基因组、转录组信息,探索噬菌体多样性,发现新的噬菌体资源,同时研究噬菌体与其宿主微生物的相互作用,包括噬菌体寄生、基因转移等现象,以及宿主对噬菌体的免疫反应等问题。
帮助深入了解噬菌体在微生物群落中的生态功能和对宿主微生物及整个微生物群落的影响,有助于理解微生物群落的稳定性和生态系统的稳定性。
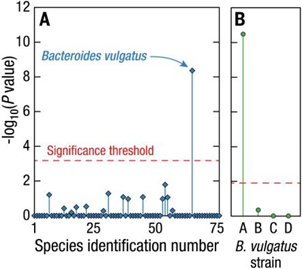
图21 菌株水平分析人类肠道微生物群中宿主-噬菌体关联信息[15]

图22 MobiMicrobe®微生物高通量单细胞转录组技术路径
噬菌体对于人类生活和环境管理的重要性不可估量。它们不仅在微生物体系中发挥着关键作用,而且具有广泛的应用前景,我们可以利用噬菌体作为生物控制和微生物治疗剂,为医疗健康和环境保护赋能。而且,噬菌体研究也有助于我们更好地掌握微生物世界的本质和规律,提高应对疾病和环境危机的能力。
墨卓生物单细胞微生物基因组测序这项技术自发表在《Science》杂志后,就受到微生物领域的万千人关注。为了让更多关注该领域的研究学者有机会利用这一技术解决核心科研问题,深入揭秘微生物背后的故事,我们墨卓推出了微生物单细胞基因组--千万项目资助计划。针对本次活动,墨卓提供专业的全流程免费服务,包括:(1)微生物悬液制备(2)单细胞微生物基因组文库构建;(3)文库测序-150G PE150 测序;(4)raw data 数据处理拆分成单细胞 fastq 格式。点击文章置顶链接,了解活动详情,扫描二维码,即可报名参与。
希望借助微生物单细胞测序技术,我们能够开启噬菌体研究的新纪元,揭示微生物世界中隐藏的宝藏!
//
参考文献
[1] Koskella B, Hernandez CA, Wheatley RM. Understanding the Impacts of Bacteriophage Viruses: From Laboratory Evolution to Natural Ecosystems. Annu Rev Virol. 2022 Sep 29;9(1):57-78.
[2] Chevallereau A, Pons BJ, van Houte S, Westra ER. Interactions between bacterial and phage communities in natural environments. Nat Rev Microbiol. 2022 Jan;20(1):49-62.
[3] 谢翰楠,安庆宇,刘畅,等.噬菌体与细菌相互作用的分子机制研究进展[J].生命科学, 2021.
[4] Tabib-Salazar A, Mulvenna N, Severinov K, Matthews SJ, Wigneshweraraj S. Xenogeneic Regulation of the Bacterial Transcription Machinery. J Mol Biol. 2019 Sep 20;431(20):4078-4092.
[5] Li D, Liang W, Hu Q, Ren J, Xue F, Liu Q, Tang F. The effect of a spontaneous induction prophage, phi458, on biofilm formation and virulence in avian pathogenic Escherichia coli. Front Microbiol. 2022;13:1049341.
[6] Brouwer S, Barnett TC, Ly D, Kasper KJ, De Oliveira DMP, Rivera-Hernandez T, Cork AJ, McIntyre L, Jespersen MG, Richter J, Schulz BL, Dougan G, Nizet V, Yuen KY, You Y, McCormick JK, Sanderson-Smith ML, Davies MR, Walker MJ. Prophage exotoxins enhance colonization fitness in epidemic scarlet fever-causing Streptococcus pyogenes. Nat Commun. 2020 Oct 6;11(1):5018.
[7] Diard M, Bakkeren E, Cornuault JK, Moor K, Hausmann A, Sellin ME, Loverdo C, Aertsen A, Ackermann M, De Paepe M, Slack E, Hardt WD. Inflammation boosts bacteriophage transfer between Salmonella spp. Science. 2017 Mar 17;355(6330):1211-1215.
[8] Marshall CW, Gloag ES, Lim C, Wozniak DJ, Cooper VS. Rampant prophage movement among transient competitors drives rapid adaptation during infection. Sci Adv. 2021 Jul;7(29)
[9] Yang Z, Yin S, Li G, Wang J, Huang G, Jiang B, You B, Gong Y, Zhang C, Luo X, Peng Y, Zhao X. Global Transcriptomic Analysis of the Interactions between Phage φAbp1 and Extensively Drug-Resistant Acinetobacter baumannii. mSystems. 2019 Mar-Apr;4(2)
[10] Sweere JM, Van Belleghem JD, Ishak H, Bach MS, Popescu M, Sunkari V, Kaber G, Manasherob R, Suh GA, Cao X, de Vries CR, Lam DN, Marshall PL, Birukova M, Katznelson E, Lazzareschi DV, Balaji S, Keswani SG, Hawn TR, Secor PR, Bollyky PL. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science. 2019 Mar 29;363(6434)
[11] Wahida A, Tang F, Barr JJ. Rethinking phage-bacteria-eukaryotic relationships and their influence on human health. Cell Host Microbe. 2021 May 12;29(5):681-688.
[12] Jahn MT, Arkhipova K, Markert SM, Stigloher C, Lachnit T, Pita L, Kupczok A, Ribes M, Stengel ST, Rosenstiel P, Dutilh BE, Hentschel U. A Phage Protein Aids Bacterial Symbionts in Eukaryote Immune Evasion. Cell Host Microbe. 2019 Oct 9;26(4):542-550.e5.
[13] Gogokhia L, Buhrke K, Bell R, Hoffman B, Brown DG, Hanke-Gogokhia C, Ajami NJ, Wong MC, Ghazaryan A, Valentine JF, Porter N, Martens E, O'Connell R, Jacob V, Scherl E, Crawford C, Stephens WZ, Casjens SR, Longman RS, Round JL. Expansion of Bacteriophages Is Linked to Aggravated Intestinal Inflammation and Colitis. Cell Host Microbe. 2019 Feb 13;25(2):285-299.e8.
[14] Shen J, Zhang J, Mo L, Li Y, Li Y, Li C, Kuang X, Tao Z, Qu Z, Wu L, Chen J, Liu S, Zeng L, He Z, Chen Z, Deng Y, Zhang T, Li B, Dai L, Ma Y. Large-scale phage cultivation for commensal human gut bacteria. Cell Host Microbe. 2023 Apr 12;31(4):665-677.e7. pii: S1931-3128(23)00117-8.
[15] Zheng W, Zhao S, Yin Y, Zhang H, Needham DM, Evans ED, Dai CL, Lu PJ, Alm EJ, Weitz DA. High-throughput, single-microbe genomics with strain resolution, applied to a human gut microbiome. Science. 2022 Jun 3;376(6597):eabm1483.
关于墨卓
创新驱动、卓鉴未来,墨卓生物创立于美国波士顿,落地中国浙江,汇集了由国际一流科学家和跨国医疗器械公司高管等组成的一批优秀人才。墨卓致力于用创新微流控和单细胞测序技术赋能科学研究与精准医疗。目前已经成为拥有微流控、测序、生化、硬件开发、生信等关键技术,推出单细胞测序与数字PCR双技术平台,在液体活检、伴随诊断、生命科学研究等多领域并行发展的科研+IVD解决方案领跑者.

























 2473
2473

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








