点击蓝字 关注我们
血管紧张素受体阻滞剂治疗通过调节肠道菌群改善高血压血管重构与肠道结构损伤

研究论文
● 期刊: iMeta (IF 23.7)
● 原文链接DOI: https://doi.org/10.1002/imt2.222
●2024年7月18日,首都医科大学附属北京朝阳医院钟久昌团队在iMeta在线发表了题为“Intestinal microbiota by angiotensin receptor blocker therapy exerts protective effects against hypertensive damages”的研究文章。
● 本研究结果表明,血管紧张素受体阻滞剂(ARB)治疗后重塑的肠道微生物在血压下调、血管纤维化损伤、代谢异常和肠道功能障碍中发挥重要保护作用,提示ARB重塑肠道微生物在高血压靶器官保护方面的关键作用,充分揭示了临床实际工作中对肠道菌群介导的降压药物作用新机制。
● 第一作者:李晶、王思远
● 通讯作者:钟久昌(jczhong@sina.com)、董莹(dongying91@foxmail.com)
● 合作作者:闫凯欣、王攀、焦洁、王怡丹、陈牧雷
● 主要单位:首都医科大学附属北京朝阳医院心脏中心心内科、北京市高血压重点实验室
亮 点
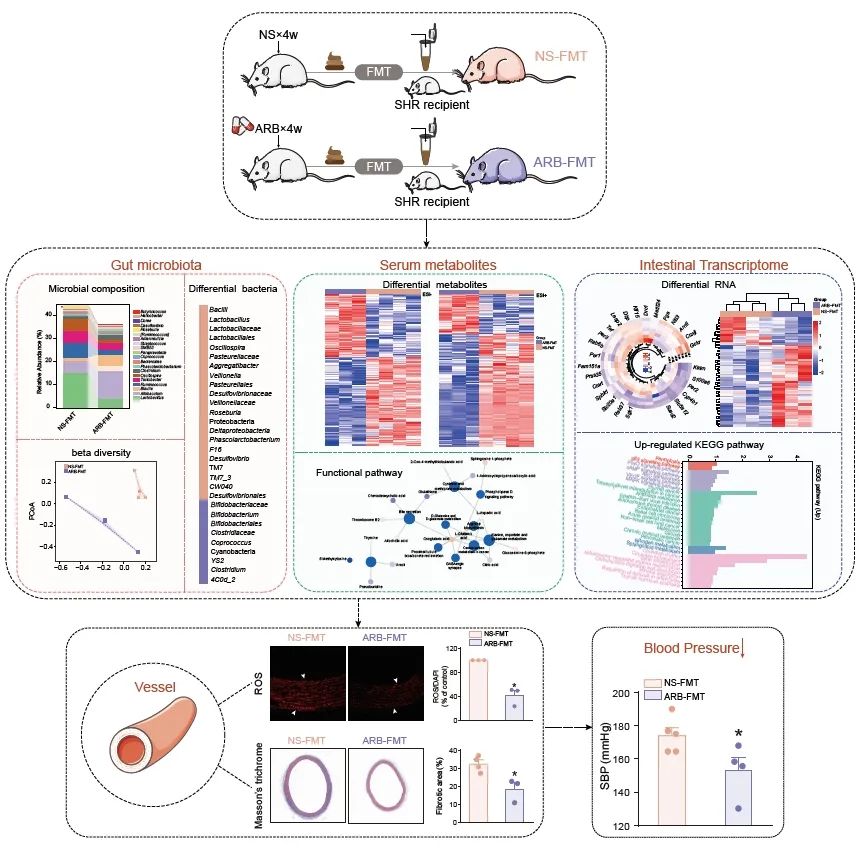
● 血管紧张素受体阻滞剂(ARB)调节的肠道微生物群可降低自发性高血压大鼠(SHR)的收缩压水平,发挥高血压靶器官保护功效;
● ARB重塑的肠道微生物移植(FMT)有助于调节高血压状态下血清代谢组、肠道转录组、肠道菌群及其代谢物;
● ARB-FMT重塑的肠道微生物可减少高血压介导的血管胶原沉积和氧化应激水平,减轻血管和肠道结构损伤。
摘 要
业已证实肠道菌群失调与高血压有关,且药物-宿主-菌群间的相互作用成为目前研究热点。然而,血管紧张素受体阻滞剂(ARB)对宿主肠道菌群的是否起调控作用及其机制如何尚不清楚。为此,我们利用血压控制良好的高血压人群和自发性高血压大鼠(SHR)作为研究对象,深入探究了ARB干预下高血压大鼠肠道菌群的改变如何影响血压、血管和肠道结构功能,并分析了肠道转录组、血清代谢组及肠道微生物改变。在此基础上,我们选取了ARB治疗下血压控制良好的高血压患者作为人类粪菌供体,生理盐水或缬沙坦干预的SHR高血压大鼠作为动物供体,将SHR作为粪菌移植受体。同时利用HE染色、Masson染色、免疫组织学及免疫荧光染色技术评估主动脉和小肠病理,16S rRNA扩增子测序检测肠道菌群。通过转录组和代谢组分析全面解析肠道转录组和血清代谢组的变化。经ARB干预后的菌群移植(FMT),SHR高血压大鼠收缩压水平显著降低,血管组织损伤减轻,血管内胶原沉积和氧化应激损伤减少,肠道结构损伤缓解。有趣的是,上述改变与FMT后高血压大鼠受体肠道菌群重建有关,表现为乳酸杆菌、放线杆菌和脱硫弧菌丰度明显降低。值得一提的是,FMT后检测到高血压大鼠肠道Ciart、Per1、Per2、Per3和Cipc基因水平升高,Nfil3和Arntl表达降低。循环代谢物6β-羟基睾酮和血栓烷B2在ARB-FMT干预的SHR大鼠显著减少。综上所述,ARB治疗后重塑的肠道微生物在血压下调、血管纤维化损伤、代谢异常和肠道功能障碍中发挥重要保护作用,提示ARB重塑肠道微生物在高血压靶器官保护方面的关键作用,充分揭示了临床实际工作中对肠道菌群介导的降压药物作用新机制。
视频解读
Bilibili:https://www.bilibili.com/video/BV1pH4y1c7dH/
Youtube:https://youtu.be/c0VBMz0mZ0w
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
高血压是最常见的心血管疾病之一,具有较高的致残率和致死率,影响着全球超过12.8亿人,与每年多达850万人的死亡直接相关。临床上,高血压往往是脑卒中、冠心病、肾功能障碍等许多恶性疾病的主要危险因素。在全球范围内,高血压导致约70%的中风、50%的急性心肌梗死、50%的心房颤动和20-30%的肾功能不全。此外,中国18岁及以上居民的高血压患病率为25.2%,但仅有15.3%血压控制良好(WC)。高血压的发病机制复杂。越来越多的证据表明,肠道菌群在高血压的发展中起着关键作用,肠道细菌紊乱可能导致血压升高,并损害心脏、血管和肾脏。例如,乳酸杆菌属中的若干物种在血压变异性较低的个体中存在。已有研究表明,以高盐摄入为特征的西方生活方式通过降低鼠乳杆菌而导致高血压。值得注意的是,在患有高血压和蛋白尿的先兆子痫女性中,放线杆菌的种类显著增加,而运动可以抑制自发性高血压动物中放线杆菌的富集。而条件致病菌脱硫弧菌被观察到与收缩压呈正相关,其与不良心血管事件高风险的关联此前研究已有报道。除此之外,调节肠道菌群以维持稳态或调节其代谢产物可能有助于改善宿主的血压。新近研究表明,运动可以重塑高血压大鼠的肠道菌群,降低血压,抑制神经炎症,并通过改善肠道病理和肠黏膜通透性发挥其保护功效。
高血压患者经常接受多药治疗,依从性低且疾病负担重。大多数高血压患者使用口服降压药物,这些药物可能直接与胃肠道微生物相互作用。为了避免药物因素的影响,此前的研究通常排除了接受降压治疗的患者。一项队列研究调查了1003名未使用降压药物的患者,显示肠道菌群和宿主血浆代谢产物与中国成年人的血压有关。另一项研究表明,降压药物显著影响肠道菌群。血管紧张素受体阻滞剂(ARB)被广泛用作一线抗高血压药物,可以改善高血压患者的胃肠道功能。缬沙坦作为一种经典ARB,能显著改变动物肠道菌群。我们前期的研究表明,服用ACEI或ARB的高血压患者在血压控制良好(WC)和控制不佳组之间肠道菌群组成和血清代谢产物具有显著差异。然而,目前对于肠道菌群是否参与ARB的降压作用了解甚少,而ARB治疗后肠道菌群的确切作用和效果也不清楚。
本研究利用血压控制良好的高血压人群和自发性高血压大鼠(SHR)作为研究对象,以接受ARB治疗的动物和WC高血压患者作为供体,对SHR高血压大鼠进行粪菌移植(FMT),明确了ARB重塑的肠道菌群对血压、血管和肠道的影响,评估了高血压状态下肠道转录组和血清代谢组的变化,并挖掘了ARB发挥降压潜力的关键细菌。
结 果
ARB通过调节肠道菌群降低血压及改善高血压血管损伤
为评估ARB的降压作用是否通过肠道菌群,我们利用接受缬沙坦治疗或未治疗的供体SHR进行FMT。生理盐水(NS)干预的SHR作为阴性对照供体。受体动物的FMT实验设计和方案如图1A所示。缬沙坦治疗有效降低了SHR的收缩压、舒张压和平均动脉压(图1B-D)。与对照相比,在ARB-FMT的高血压动物受体中血压显著改善(图1E-G)。为探索在缺乏肠道菌群的情况下ARB能否维持降压效果,我们在ARB给药前先给予抗生素以清除肠道细菌。然而,在应用抗生素后,NS和ARB干预动物的收缩压、舒张压和平均动脉压没有显著差异(图S1A-C),我们的结果表明在缺乏肠道菌群的情况下,作为一线降压药物ARB的降压效果明显受到抑制。
鉴于血管重构被视为高血压靶器官损伤的病理基础,我们检测了FMT受体中血管损伤情况。与NS-FMT组相比,ARB-FMT组显著减轻了血管纤维化的严重程度(图1H,I)。但动脉形态学分析显示,中膜厚度和面积、血管直径和管腔面积,以及反映血管重塑的中膜/管腔比例,两组之间相似,提示ARB重塑的FMT干预发挥其抗血管纤维化功效,但其抗血管肥厚作用不明显。
接下来,我们测定了在ARB-FMT治疗的高血压大鼠动脉内的氧化应激反应和活性氧(ROS)生成情况。ARB-FMT干预后SHR高血压大鼠血管组织氧化损伤明显减轻,表现为ROS生成大大减少(图S2A, B)。我们的结果提示,高血压状态下,ARB治疗以肠道菌群依赖的方式发挥其抗血管纤维化和抗氧化损伤的功效。ARB重塑的肠道菌群可能对高血压大鼠产生更为积极的有益影响。

图1. ARB-FMT后SHR受体的血压降低,血管纤维化减轻
(A)在NS或ARB治疗的供体动物,和随后FMT移植到SHR受体研究的实验方案。SHR,自发性高血压大鼠;NS,生理盐水;ARB,缬沙坦(血管紧张素受体阻滞剂);FMT,粪菌移植;NS-FMT,接受生理盐水治疗的SHR粪菌移植的大鼠;ARB-FMT,接受缬沙坦治疗的SHR粪菌移植的大鼠。(B-D)给予NS或ARB治疗前后,供体SHR的收缩压、舒张压和平均动脉压的变化。每组n = 5。(E-G)接受FMT后,SHR受体的收缩压、舒张压和平均动脉压。NS-FMT每组n = 5,ARB-FMT每组n = 4。(H)NS-FMT和ARB-FMT大鼠主动脉横截面的Masson染色的代表性光镜图像及放大图。比例尺分别为200 μm、100μm和50 μm。(I)每组FMT受体的主动脉中膜厚度、血管直径、纤维化面积、中膜面积、管腔面积和中膜/管腔面积的定量分析。NS-FMT每组n = 4,ARB-FMT每组n = 3。数据表示为均值 ± SEM。*,p < 0.05;ns,不显著。
ARB-FMT干预后高血压大鼠肠道菌群重建以及肠道基因表达谱发生改变
为明确ARB-FMT后SHR受体的肠道菌群是否得到重建,我们对NS-FMT和ARB-FMT两组大鼠的粪便菌群进行了16S rRNA基因测序分析。物种注释揭示了各组中的主要的微生物门、纲、目、科和属(图S3A)。厚壁菌门和拟杆菌门是接受ARB干预的SHRs肠道菌群中最丰富的门类,梭菌纲、拟杆菌纲和丹毒丝菌纲是其中最丰富的纲,梭菌目、拟杆菌目和丹毒丝菌目是其中最丰富的目,瘤胃球菌科、毛螺菌科和丹毒丝菌科是其中最丰富的科。在属水平上,我们在ARB-FMT组中检测到了保护性细菌,如布劳特氏菌、异杆菌和乳酸杆菌。在ARB组和NS组以及ARB-FMT和NS-FMT大鼠进行比较时,共鉴定出23个属的方向变化一致,其中包括ARB组和ARB-FMT组中缺乏的乳酸杆菌和脱硫弧菌(图S4A)。
基于操作分类单元(OTU)鉴定的分类学特征,我们对观察到的OTU进行了Chao1、Shannon、Pielou、Simpson、Faith's pd和good coverage等alpha多样性分析,以评估微生物群落的多样性(图S3B)。在这些指标中,包含三个主要的生态参数:Chao1丰富度指数,用于估算给定群落中存在的操作分类单元总数;Pielou均匀度指数,用于显示群落中的个体在不同操作分类单元上的分布均匀程度;Shannon多样性指数,作为丰富度和均匀度的综合参数。在ARB-FMT组中所有检测的指标均未显示显著差异(图S3B)。尽管ARB-FMT组中观察到alpha多样性较为稳定,但beta多样性分析揭示了细菌特征上的明显群落结构差异, NS-FMT组和ARB-FMT组之间存在显著差异(图S3C)。通过主坐标分析(PCoA)和非量度多维尺度分析(NMDS)两种广泛使用的分析方法,计算Bray Curtis、Jaccard、unweighted UniFrac和weighted UniFrac差异距离,可以清晰的将ARB-FMT组的样本与对照组区分(图S3C)。
对于每种距离,包括Bray Curtis、Jaccard、unweighted UniFrac和weighted UniFrac,采用非加权配对平均法(UPGMA)层次聚类树,进一步验证了NS-FMT组和ARB-FMT组样本之间的相似性,其中Jaccard和weighted UniFrac距离显著区分了两组样本(图S5A-D)。为测试beta多样性的统计显著性,进行了permanova、anosim和adonis分析,揭示ARB-FMT组与NS-FMT组相比微生物群落结构之间的显著差异(图S5D)。
此外,本研究阐明了ARB-TMT后肠道菌群的变化。Venn图显示了每个组中共有和特异的OTU(图2A)。在识别出的7299个OTU中,分别有44.42%和44.29%仅在NS-FMT组和ARB-FMT组中检测到(图2A)。此外,两组中同时观察到824个OTU。在门水平上,无论是基于OTU出现频率或相对丰度,厚壁菌门、拟杆菌门和软壁菌门是NS-FMT组和ARB-FMT组中特有或共用的肠道优势菌(图2B, C)。在属水平上,NS-FMT组和ARB-FMT组之间的大多数独有或共有OTU被注释为颤螺旋菌、瘤胃球菌、乳酸杆菌、异杆菌、布劳特氏菌和梭菌(图2B)。各组之间的共同属与各组中独有属的丰度分布差异显著(图2C)。
LEfSe分析显示了在NS-FMT组和ARB-FMT组中存在显著丰度差异的分类生物标志物(图2D)。根据LDA值的分布,展示了每组显著富集的细菌。在ARB-FMT组中,双歧杆菌、粪球菌和梭菌显著增加,而乳酸杆菌、颤螺菌、放线杆菌、韦荣氏球菌、罗氏菌、考拉杆菌和脱硫弧菌显著减少(图2D)。共现网络揭示了考拉杆菌、链球菌、副普雷沃氏菌、消化链球菌科、异杆菌和乳酸杆菌之间复杂的相互关系(图2E, F)。这些肠道细菌可能在ARB-FMT治疗中存在正相关或负相关,并表现为共生或竞争关系。通过PICRUSt2 软件在KEGG同源基因、EC酶分类号中预测潜在功能,PCoA分析将ARB-FMT组与NS-FMT组区分为明显不同的聚类(图2G)。此外,ARB-FMT后肠道菌群的功能在谷酰辅酶A降解、脂肪酸β-氧化和L-1,2-丙二醇降解通路显著增强,但在L-精氨酸降解、脂肪酸补救和鸟氨酸降解通路上的能力减弱(图2H)。
鉴于肠道病理改变在高血压发展中起到的关键作用,我们接下来研究了ARB改善肠道菌群对血压的降低作用是否涉及缓解肠道损伤。测量小肠的绒毛长度、肌层厚度、杯状细胞数量和纤维化面积时,NS-FMT组和ARB-FMT组观察到类似的结果(图S6A-D)。同时,各组之间小肠内紧密连接蛋白(包括claudin、occludin和TJP1)的染色结果也相似(图S7A-C)。尽管ARB通过肠道菌群对降低血压表现出有益效果,但似乎未能对SHR的肠道病理产生明显的保护作用。
因此,为了深入探索其机制,我们研究了宿主肠道组织的转录组变化。根据肠道基因的表达谱,我们观察到在PCA中,不同组间呈现出类似且不显著离散的分布(图3A)。差异分析表明,ARB-FMT组显著增强了肠道中56个基因的表达,并减少了19个基因的表达(图3B-D)。组间差异最大的基因包括Ciart、Per1、Per2、Per3、Cipc、Cyp4b1、Sphk1、Klf15、Nfil3和Arntl(图3E)。在前10个变化最大的基因中,Nfil3与其他基因呈负相关(图3F)。有趣的是,GO富集分析表明,ARB-FMT大鼠在节律过程、基因表达的昼夜节律调控以及昼夜节律方面具有显著增强的潜力,但缺乏构成细胞周期依赖性蛋白丝氨酸/苏氨酸激酶和蛋白激酶全酶复合体的能力(图3G-H)。同时,基于KEGG数据库的通路分析证实,与昼夜节律、氮代谢、铁死亡和FoxO信号通路相关的宿主基因功能显著增强(图3I)。此外,抑制的基因主要参与了造血细胞谱系、免疫缺陷、脂肪酸延长以及HIF-1信号通路(图3I)。

图2. NS-FMT和ARB-FMT大鼠肠道菌群及其潜在微生物功能差异
(A)Venn图描述了在NS-FMT和ARB-FMT组中检测到的OTU的独有和共有数量。重叠部分表示两组中共有的OTU。(B)在菌群门和属水平上,NS-FMT和ARB-FMT组之间独有和共有的OTUs的出现率。(C)比较了两组间重叠以及各组特有的前10个最优势的门和属的相对丰度。(D) LEfSe揭示了NS-FMT和ARB-FMT两组组不同分类构成。LDA分值的热图和条形图描绘了不同组中显著差异富集的(DE)分类组成。不同分类学统计显著性定义为LDA分数(log10)> 2且p值< 0.05。(E)对前50个主要OTU的相对丰度进行的网络分析,识别了肠道菌群成员之间的共存或互斥关系。每个节点代表一个OTU,饼图显示了OTU在不同组中的相对丰度比。不同OTU可能属于同一菌门或菌属,因此可能存在具有相同名称的不同节点。使用SparCC算法计算相关矩阵,并使用R软件中的igraph包构建共现网络。(F)共现网络中的OTUs被注释为不同的门。连接边表示节点之间的相关性,红线表示正相关,绿线表示负相关。相似度r值表示相关性。使用SparCC算法计算相关矩阵,并使用R软件中的igraph包构建共现网络。(G)PCoA展示了Bray Curtis距离下左侧图KO菌群功能的(轴1和轴2分别代表了总变异的39.6%和36.3%),右侧图中EC菌群功能(轴1和轴2分别代表了总变异的42.2%和33.4%3),这些功能由PICRUSt2预测。(H)基于MetaCyc数据库,各组之间的功能通路明显不同。logFC,log2(ARB-FMT/NS-FMT的倍数变化)。p值用颜色表示。

图3. ARB-FMT大鼠肠道转录组和RNA表达谱
(A)肠道样本中RNA表达水平的PCA,用于评估各组之间的差异。PC1可解释84%的组间差异,PC2解释10%。(B-C)火山图和条形图描述了与NS-FMT组相比,ARB-FMT组基因的分布和数量变化。p<0.05和|log2FC|>1的基因认为有显著差异;FC,折叠变化。红色Up显示ARB-FMT组中显著上调的基因数量(n=56);绿色Down表示显著下调的基因数量(n=19);NS,基因数量没有显著改变(n=17673)。NS-FMT组n = 4,ARB-FMT组n = 3。(D)热图显示了在各组间基因相对丰度的显著差异。通过减去平均值并除以标准差转化为Z分数。当丰度小于平均值时,Z分数为蓝色负值。当丰度高于平均值时,Z分数为红色正值。(E)树状图显示了在各组中前30个最显著富集基因的相对丰度。(F)展示了各组间前10个不同表达基因的相关性。红线表示正相关;绿线表示负相关。(G-H)ARB-FMT组中显著增强(Up)或显著抑制(Down)的基因在GO分类中的前20个最富集(根据FDR调整后的p值)的。数字表示每个GO术语注释的Up或Down基因数。X轴表示富集因子,即每个GO术语中差异富集基因数量与总注释基因数量的比率。(I)ARB-FMT组Up或Down基因的前20个(根据p值)KEGG通路。不同的类别用不同颜色表示。
ARB-FMT治疗后高血压大鼠的血清代谢组改变
肠道菌群产生的小分子代谢产物能够穿过肠道屏障,进入全身循环系统,介导肠道菌群对宿主的影响,在高血压的发病机制中发挥关键作用。因此,我们研究了ARB-FMT组大鼠的血清代谢组特征。通过ESI-(负离子模式)和ESI+(正离子模式)下的层次聚类分析,揭示了各组内样本间的相似性关联(图S8A,E)。PCA、PLS-DA和OPLS-DA等多变量统计分析评分图,进一步展示了NS-FMT组和ARB-FMT组的血清代谢物存在显著差异(图S8B-D,F-H)。图S9A,B展示了在ESI+和ESI-模式下检测到的所有代谢物在血清中的相对水平。火山图表明了NS-FMT和ARB-FMT组中富集的不同化合物的统计分布(图S9C-F)。总体而言,在ESI-和ESI+模式下ARB-FMT组大鼠中显著减少的代谢物分别为1700个和474个,而显著增加的代谢物分别为为1218个和172个。这些组间差异显著的血清代谢物以热图形式展示(图S9G,H)。ARB-FMT组中所有变化代谢物的质荷比(m/z)分布如图S9I-J所示。
根据质荷比(m/z),这些代谢物进一步与人类代谢组数据库数据库和Massbank在内的标准数据库进行匹配,并获取了注释信息。在已注释的代谢物中,ARB-FMT组中共发现了42种,如吡咯-2-羧酸、3-(2-羟基苯基)丙酸、N-乙酰血清素、6β酰羟基睾酮和血栓烷B2(图S10A-D)。此外,ARB-FMT组有13种已注释的代谢物显著升高,以α已酮戊二酸、2-氧代-4-甲基硫代丁酸和鞘氨醇-1-磷酸为代表(图S10A-D)。这些统计上显著差异的富集代谢物之间的强相关性暗示了血清代谢组中的复杂相互作用(图S10E)。我们发现,受ARB-FMT影响的代谢物大多参与了与胆汁分泌、不饱和脂肪酸生物合成、精氨酸代谢、脯氨酸、丙氨酸、天冬氨酸和谷氨酸代谢相关的通路(图S10F-H)。接下来,我们计算了代谢物与潜在相关通路之间的直接联系。α。酮戊二酸、L-谷氨酸和L-天冬氨酸是该网络中的核心代谢物,它们以高频次和强相关性为特征,与多条通路密切相关(图S10I)。综上所述,ARB-FMT对血清代谢组具有显著影响。
WC-FMT干预可部分增强高血压大鼠中ARB降压功效
我们前期分析了高血压患者的肠道菌群和血清代谢组,并阐明了抗高血压治疗与ARB之间的关联。我们认为,ARB治疗控制良好的高血压患者,肠道菌群失调在一定程度上得到了改善,并恢复了肠道菌群的稳态。我们利用人类供体进行了FMT研究,进一步确认和验证肠道菌群在ARB调节高血压治疗中的关键作用,探索可能作为ARB与宿主治疗效果之间联系的关键细菌。
我们探究了ARB治疗下血压控制良好的高血压患者(WC)的粪菌移植是否能进一步缓解SHR的高血压。单纯WC-FMT处理并未显著改善SHR的收缩压、舒张压或平均动脉压(图S11A-C)。因此我们推测,仅使用ARB治疗血压控制良好的高血压患者的粪菌移植可能不足以降低SHR的血压,但可能增强ARB的治疗效果。于是,我们在WC-FMT干预后给予ARB,以探究WC-FMT后部分重建的肠道菌群是否显著促进后续ARB治疗的保护效应。我们研究了WC高血压患者的肠道菌群对高血压损伤的影响(图4A)。在ARB治疗前未接受FMT的SHR作为对照。WC高血压患者的肠道菌群增强了缬沙坦的降压效果(图4B-D)。同样,菌群对动脉的影响主要体现在减轻纤维化方面,但在血管中膜和管腔中并不明显(图4E-F)。此外,接受FMT的动物之间的血管氧化应激水平变化不明显(图S12)。我们的结果表明,ARB对高血压发展的保护作用部分归因于肠道菌群。推测在接受WC高血压患者的肠道菌群的SHR中,可能存在关键细菌作为血压调节和抗高血压治疗效果的潜在介质。

图4. ARB治疗的高血压患者的粪便菌群提高了缬沙坦对SHR的疗效
(A)研究流程图,SHR使用缬沙坦治疗,并分为接受或不接受WC高血压患者粪菌移植组。WC组指高血压患者在ARB治疗下高血压得到良好控制的个体,作为FMT的供体。ARB+WC组为同时接受WC-FMT和缬沙坦干预的SHR受体动物。(B-D)ARB或ARB+WC干预后SHR的收缩压、舒张压和平均动脉压降低。ARB+WC组收缩压(B)、舒张压(C)平均动脉压(D)的降低明显高于ARB组。ARB组n = 5,ARB+WC组n = 7。(E)Masson染色在主动脉横截面的代表性图像。比例尺分别为200主动、100主动和500主。(F)主动脉中膜厚度、血管直径、纤维化面积、中膜面积、管腔面积及中膜/管腔面积比。数据以平均值±SEM表示。ARB组n=5,ARB+WC组n=4,*p<0.05,**,p<0.01,ns:不显著。
补充WC供体菌群对高血压状态下肠道菌群和转录组的调控作用
本研究确定了在ARB治疗下,FMT与非FMT的SHR大鼠之间肠道菌群的差异。与NS-FMT组和ARB-FMT组大鼠的结果相似,动物体内以厚壁菌门和拟杆菌门为主,杆菌纲和梭菌纲为主,乳杆菌目和梭菌目为主,以及毛螺菌科和瘤胃球菌科为主(图S13A)。布劳特氏菌、瘤胃球菌和乳酸杆菌是所有组中最丰富的菌属。如Chao1、Shannon、Pielou、Simpson、Faith's pd和observed species等指数所示,FMT后肠道菌群的α多样性显著增加,而覆盖率则降低(图S13B)。微生物丰富度和均匀性的异常降低已被认为是高血压肠道菌群失调的标志,FMT引起的α多样性变化被认为是其重要的保护性因素。此外,Bray Curtis、Jaccard、unweighted UniFrac和weighted UniFrac之间的差异距离显示ARB和ARB+WC组之间菌落构成的显著差异,在PCoA和NMDS图中呈现出明显分离的聚类(图S13C)。同样,除weighted UniFrac距离外,UPGMA也识别出了各组之间的差异(图S14A-D)。另外,通过permanova、anosim和adonis分析进一步确认了β多样性差异的统计学显著性(图S13D)。
在ARB组和ARB+WC组大鼠体内共检测到802个OTU,主要包括拟杆菌门和厚壁菌门,以及拟杆菌、瘤胃球菌和颤螺菌(图5A-C)。在经FMT联合ARB治疗的大鼠中,显著富集的菌有考拉杆菌、副普雷沃氏菌、嗜胆菌和幽门螺旋杆菌,而减少的细菌则包括片球菌、巨型球菌、小杆菌、放线杆菌、粪芽孢菌属、乳酸杆菌和脱硫弧菌等(图5D)。此外,乳酸杆菌、异杆菌和消化链球菌科之间展现出复杂的相互作用(图5D)。基于KO和EC的Bray Curtis距离分析表明,WC-FMT对肠道菌群功能产生了影响,促进了亚油酸和色氨酸的代谢,以及缬氨酸、亮氨酸和异亮氨酸的降解,但抑制了O-糖苷的生物合成(图5G-H)。
不同组间肠道损伤的比较显示,FMT后病理变化有所改善(图S15A-D),绒毛长度和杯状细胞数量显著增加。相反,WC-FMT组小肠肌层厚度下降和纤维化区域减少(图S15A-D)。组织病理学染色显示,WC-FMT对紧密连接蛋白无显著影响(图S16A-C)。FMT还导致肠道转录组的基因表达谱发生显著化(图6)。PCA显示,ARB+WC组相对于未进行FMT的对照组具有不同的特征(图6A)。有1093个基因显著上调,835个基因显著下调(图6B-D)。有趣的是,FMT影响了多种酶基因,如Asah2、Lct、Alpi、Si、Aadac、Dao和Duox2等图6E)。其中,Duox2与其他酶基因呈负相关(图6F)。FMT促进的基因主要涉及单羧酸、脂肪酸代谢和脂质分解代谢,而减少的基因在免疫系统和炎症反应中发挥重要作用(图6G-H)。基于KEGG通路分析,我们进一步证实了ARB+WC组增强肠道内脂肪酸降解、色氨酸代谢和PPAR信号通路的潜力,同时抑制细胞因子受体相互作用、趋化因子信号通路和肠道免疫网络(图6I)。

图5. 缬沙坦治疗WC-FMT后的SHR大鼠肠道菌群组成和功能分析
(A)Venn图显示了不同组间独有和共有的OTU的分布情况。(B)各组在门和属水平同时或单一检测到的OTU出现率。(C)各组中检测到的排名前十位丰富门和属的相对丰度。(D)LEfSe与LDA评分的分支图和条形图揭示了ARB组与ARB+WC组之间肠道菌群组成的差异。LDA分数(log10)>2和p<0.05表示有统计学意义,显著差异的分类单元按组别进行着色。(E-F)前50个最丰富的肠道菌群成员的网络分析,节点表示OTU,其根据不同组(E)或分配给(F)的相应菌门的相对丰度比率显示。连接线表示OTU之间的相关性。红色表示正相关,绿色表示负相关。相似度以相关系数r值表示。(G)PICRUSt2预测的KO和EC中菌群功能的Bray-Curtis距离如PCoA图所示。(H)不同组别间MetaCyc通路差异显著。logFC,log2(ARB+WC组/ARB组的倍数变化)。

图6. 肠道RNA转录组受到WC肠道菌群的影响
(A)肠道样本中RNA表达水平的PCA用于评估各组之间的差异。PC1可以解释74%的组间差异,PC2解释11%。(B-C)与ARB组相比,ARB+WC组基因的分布和数量变化。p<0.05和|log2FC| >1的基因认为有显著差异;FC,折叠变化。红色Up显示ARB+WC组中显著上调的基因数量(n=1093);绿色Down表示显著下调的基因数量(n=835);NS,基因数量没有显著改变(n=16380)。ARB组n = 5,ARB+WC组n = 8。(D)各组间基因相对丰度的显著差异。(E)树状图显示了在各组中前30个最显著富集基因的相对丰度。(F)展示了各组间前10个不同表达基因的相关性。红线表示正相关;绿线表示负相关。(G-H)ARB+WC组中显著增强(Up)或显著抑制(Down)的基因在GO分类中的前20个最富集(根据FDR调整后的p值)的。数字表示每个GO术语注释的Up或Down基因数。X轴表示富集因子,即每个GO术语中差异富集基因数量与总注释基因数量的比率。(I)ARB+WC组Up或Down基因的前20个(根据p值)KEGG通路。
与WC-FMT相关的循环代谢物
这些发现表明,在接受ARB治疗血压控制良好的WC患者中,肠道菌群显著影响高血压动物的肠道功能。为了深入探讨这一观点并加深我们对受肠道菌群影响的代谢物的理解,采用了非靶向代谢组学方法评估了代谢物。在ESI-模式下获得的数据显示,ARB组和ARB+WC组样本聚类差异显著,这一结果在ESI+模式下也得到了验证(图S17A-H)。所有检测到的化合物的相对丰度如图S18A-B所示。此外,在分析血清代谢组时,我们发现两组之间不同代谢物,WC-FMT抑制了2302个化合物,升高了2857个化合物(图S18C-F)。这些FMT后改变的化合物根据其相对水平和质荷比(m/z)进行了展示(图S18G-J)。
进一步地,我们评估了FMT对代谢组的影响。结果显示,有28种代谢物减少,64种代谢物增加,包括3-羟基苯乙酸、亚油酸、6β-羟基睾酮、血栓烷B2、N-乙酰-5-羟色胺、鹅脱氧胆酸以及d-辛弗林(图S19A-D)。通过相关性分析揭示了这些代谢物之间的共存关系(图S19E)。KEGG通路分析表明,差异富集的代谢物参与了甘氨酸、丝氨酸、苏氨酸和苯丙氨酸代谢、胆汁分泌以及初级胆汁酸生物合成等过程(图S19F-H)。将代谢物与通路相连的网络图显示,L-肉碱、鹅脱氧胆酸和甘氨鹅脱氧胆酸增加,而牛磺胆酸减少,后者与胆汁酸生物合成和分泌相关(图S19I)。在苯丙氨酸代谢中发挥关键作用的代谢物中,对羟基苯乙酸、苯乙酸和3-(2-羟基苯基)丙酸含量增加,而3-羟基苯乙酸含量减少。总体而言,FMT影响高血压动物的代谢状态。
高血压表型、微生物、代谢物和功能基因之间的相关性分析
本研究采用Spearman检验分析了不同组间差异微生物、血清代谢物、肠道基因与高血压表型之间的相关性。在NS-FMT组和ARB-FMT组大鼠中存在显著差异的肠道菌群,如梭菌、韦荣氏球菌、双歧杆菌、放线杆菌和乳酸杆菌,这些微生物与循环中的代谢产物(如13-L-过氧亚油酸、鹅脱氧胆酸和二十碳二烯酸)显著相关,并进一步与宿主的血压水平相关联(见图S20A,表S1)。此外,多种肠道菌群与转录组谱相关,转录组谱又与高血压表型进一步相关(图S20B,表S2)。例如,乳酸杆菌与Fga、Nfil3、Knstrn等基因呈正相关,而这些基因又与收缩压、舒张压或平均动脉压呈正相关。双歧杆菌与Per2、Per3和Rab6b基因呈正相关,而这些基因则与SBP、DBP和MBP呈负相关。此外,共现网络分析揭示了大多数肠道基因与关键代谢产物之间存在高度相关性(图S20C)。Sphk1和Slc20a1与13-L-过氧亚油酸呈负相关,而Ccdc34和Knstrn与鹅脱氧胆酸呈正相关。Fga与二十碳二烯酸呈正相关,而Per2和Per3则呈负相关。
同时,WC-FMT组肠道细菌群落发生变化,其中幽门螺旋杆菌、布劳特氏菌、双歧杆菌、巨型球菌和考拉杆菌等细菌种类与血清代谢产物显著相关,这些代谢产物包括3-羟基丁酸、2-氧-4-甲基硫丁酸、3-羟基苯乙酸和苯乙酸。此外,这些关键化合物还与宿主的高血压表型相关(图S21A,表S3)。另外,特定肠道菌群与血压水平相关的转录组谱系关联(图S21B,表S4)。值得注意的是,布劳特氏菌与Ace、Apoa1和Cyp17a1等基因呈负相关,这些基因也与舒张压或平均动脉压呈负相关。巨型球菌与Tcfl5呈正相关,Tcfl5又与平均动脉压呈正相关。共现网络揭示了肠道转录组谱系与血清代谢组之间复杂的关系(见图S21C)。简而言之,Prodh1与3-羟基丁酸呈正相关,而Galk1则相反。此外,Lrrc8e与苯乙酸呈负相关,而Cyp2d4则表现出相反的相关性。
讨 论
近年来越来越多的证据支持肠道菌群与药物之间复杂的相互作用及其对疾病治疗有效性的潜在贡献。例如,最近的研究表明,微生物来源的代谢物吲哚-3-乙酸对胰腺癌化疗药物的疗效具有临床意义。此外,肠道菌群的组成被认为介导了小檗碱的抗高胆固醇作用,并可能作为药物治疗效果的一个预测指标。再者,肠道菌群还被提出可能降低炎症性肠病药物5-氨基水杨酸的临床疗效。
众所周知,氯沙坦通过改变肠道菌群在高血压动物中展现出对血管和肠道免疫系统有益的影响。然而,肠道微生物群也可能会减弱药物干预的效果,从而导致高血压患者的血压控制不佳。在临床实践中,广泛使用的抗高血压药物疗效的差异性突显了基于肠道菌群的个体化医疗的重要性。我们此前的研究发现ACEI和ARB治疗后肠菌群和代谢物的明显变化;但是,关于WC高血压患者肠道菌群是否对其降压效果有所贡献,尚未系统性阐明。因此,明确肠道菌群如何通过特定机制改善血压患者的血压,具有重要意义。
本文中,我们团队研究了SHR大鼠接受WC高血压患者粪菌移植以及接受ARB治疗后,血管结构和肠道结构变化、粪便菌群、肠道转录组以及血清代谢组学。这一潜在机制对于阐明临床实践中血压控制的结果可能具有重要意义。值得注意的是,ARB重塑的肠道菌群在降低血压、缓解血管纤维化和减轻氧化应激方面发挥了显著作用,这与之前使用氯沙坦的研究一致。此外,该发现表明肠道菌群可以保护血管免受纤维化和活性氧积累的损害,这支持了我们的观察结果。接下来,我们分析了WC-FMT,发现与ARB联合使用时,补充来自WC患者的肠道菌群可显著增强抗高血压治疗疗效。此外,与ARB-FMT组检测到的结果类似,WC-FMT后SHR的高血压得到改善,血管损伤有所改善,肠道病理性得到一定恢复。
尤为关键的是,我们证实了FMT治疗后受体动物的肠道菌群的恢复。微生物学分析揭示,肠道菌群的多样性、结构特征、组成以及功能潜力均受到了显著的调节。类似地,无论是在动物和人源FMT中,均观察到乳酸杆菌、聚合杆菌和脱硫弧菌等细菌的同时减少。此前的研究探讨了乳酸杆菌作为非药物性降压策略的潜力。同时,研究人员最近也阐明了乳酸杆菌在老年高血压个体中的富集现象。此外,作为与炎症相关的细菌,乳酸杆菌属在患有阻塞性睡眠呼吸暂停和炎症性肠病的高血压患者中广泛存在。乳酸杆菌与促进血管收缩并加重血管紧张素II诱导的高血压的三甲胺N-氧化物正相关,这提示了乳酸杆菌在高血压疾病中的关键作用。另外,研究表明高血压与牙周病原菌感染呈正相关。放线杆菌是一种众所周知的牙周致病菌,在高血压或阻塞性睡眠呼吸暂停相关高血压患者中过度表达。此外,粪便中的有害的脱硫弧菌与收缩压呈正相关,在代谢性高血压动物模型中观察到其数量增加。因此,我们推测乳酸杆菌、聚合杆菌和脱硫弧菌可能是决定或调节降压治疗疗效的关键因素。然而,这些细菌参与血压调控的具体机制尚待阐明。
最近的研究发现,与未治疗或血压控制良好的个体相比,巨球型菌在未血压控制不良的高血压患者体内占据主导地位。研究已阐明,在接受降压治疗的高血压患者中,巨球型菌的丰度与收缩压呈正相关,这与我们在血压控制良好的患者粪菌移植后观察到的巨球型菌受到抑制的现象相一致。同时,双歧杆菌在健康对照组和接受降压治疗的患者中均有所增加,但在未接受治疗的患者中则减少,这支持了本研究中在ARB-FMT动物体内检测到双歧杆菌水平升高的可能作用。此外,之前认为在WC高血压患者体内急剧增加的梭菌科和梭菌属,在ARB-FMT后的动物体内得到增强。梭菌属和梭菌目也在ARB+WC组中占据显著地位。我们进一步发现,拟杆菌和副普雷沃氏菌在血压控制不佳的患者中丰度较低,在接受了WC-FMT后显著增加。
通过血清代谢组研究,我们考虑肠道菌群相关的终产物变化可能解释FMT的治疗效果。我们特别关注了6果-羟基睾酮和血栓烷B2水平的显著降低,因为其在菌群移植后均表现出一致的改变。6β菌羟基睾酮是细胞色素P450的代谢产物,多年研究表明,它在Ang II诱导的高血压血管损伤和心血管病理生理变化。事实上,肠道具有产生6导的羟基睾酮的代谢能力。与花生四烯酸相关的代谢产物血栓烷B2是一种血管收缩剂,在原发性高血压患者的血浆和尿液中显著升高,已被证实参与慢性肾病大鼠高血压的发展。使用缬沙坦治疗与血栓烷B2水平的下降趋势相关。因此,在给予ARB-FMT的大鼠中6大B羟基睾酮和血栓烷B2的含量减少,可能有助于降低血压并抑制血管损伤。
鉴于肠道功能在血压调节和高血压发展中的关键作用,我们通过基因富集分析明确了转录组变化。本研究观察到FMT后肠壁中不同的基因表达谱,我们基于动物源性和人类源性菌群移植的验证均显示出了显著的差异。例如,FMT后,Nfil3和Arntl的减少,Ciart、Cipc、Per1、Per2、Per3、Tef、Sgk1、Dbp、Pdk4、Klf15等基因的上调。在这些基因中,Nfil3、Arntl、Ciart、Cipc、Per1、Per2、Per3、Tef和Dbp是昼夜节律的调节因子。Nfil3是菌群依赖性粘膜稳态调节因子,其在上皮组织中的节律性表达受到共生细菌组成变化的影响。尽管另一研究表明Arntl基因表达与女性高血压患者的血压显著负相关,有证据表明Arntl基因敲除显著降低雄性动物的收缩压。相比之下,外周血单核细胞中Per1基因表达水平与血压呈负相关,可能是一个潜在的保护性因素。然而,研究发现Per1基因敲除小鼠血压显著降低,但在SHR肾上腺中,Per1、Per2和Per3基因水平却低于对照组。直至最近,才证实昼夜节律蛋白PER1的敲除加剧了盐敏感性高血压的发展。此外,研究表明缬沙坦能恢复昼夜节律基因Per1和Per2的表达。昼夜节律是一种影响多种代谢通路分子生理活动的复杂机制。昼夜节律失调可能增加心血管疾病、高血压和代谢综合征的风险。我们发现,ARB可能通过菌群依赖方式调节肠道昼夜节律。
高血压患者的结肠中,肠道菌群衍生的代谢产物能恢复Sgk1的下调,这一现象在我们FMT研究中也得到了验证。PDK4可能编码一种酶,该酶通过抑制线粒体活性而促进糖酵解。肺毛细胞中PDK4表达的增加与肺动脉高压中内皮细胞-毛细胞相互作用的减少和小血管减少有关。由于体循环和肺循环在发病机制上可能存在显著差异,PDK4在血压控制中的作用尚待探索。此外,KLF15是心脏肥大的重要负调节因子,已被证实在高血压肾病患者中表达降低。KLF15的缺失被发现会加剧压力诱导的纤维化损伤。有趣的是,一些研究表明KLF15能减轻高血压小鼠的肾脏纤维化和损伤,这与我们在肠道组织中的观察结果一致。
我们全面整合了微生物、代谢产物和基因的功能富集分析中的观察结果。在ARB-FMT或ARB+WC组中,肠道菌群在脂肪酸氧化和生物合成方面的潜能增强,而脂肪酸补救通路的能力被抑制。在ARB+WC动物中,更多的肠道基因参与了脂肪酸降解,而在ARB-FMT中减少的这些基因则具有脂肪酸延长的能力。但值得注意的是,无论是在ARB-FMT动物的肠道转录组基因还是血清代谢物中,均显示不饱和脂肪酸生物合成功能受损。同时,WC-FMT后赖氨酸降解的微生物通路增强,与ARB-FMT组中赖氨酸降解代谢产物的增加相一致。我们的结果支持了最近的一项研究,该研究表明脂肪酸生物合成、代谢和赖氨酸降解可能与高血压和降压药物反应具有潜在的相关性。此外,我们在ARB+WC组中发现,肠道菌群在色氨酸和维生素代谢方面的功能富集增加,这与肠道基因的类似发现相吻合。肠道菌群作为色氨酸代谢的调节因子广为人知,越来越多的证据表明,肠道菌群来源的色氨酸代谢产物在血压调节和高血压中起到促进作用。妊娠期色氨酸代谢通路的损伤已被认为与高血压的发展有关。此外,柠檬酸是TCA循环中的一个中间产物,受损的TCA循环通过能量平衡和离子交换与高血压。有趣的是,我们的发现在WC-FMT后肠道基因中TCA循环和矿物质吸收能力的增强,这与血清代谢物的功能变化一致。先前的研究表明,高血压患者的ABC转运系统中的菌群基因功能显著降低,并可能对健康个体至关重要。在目前的研究中,ARB+WC组的显著代谢物和在ARB-FMT后发生变化的肠道基因均显示出ABC转运体的能力增加。
结 论
作为临床一线降压药物,ARB调节的肠道微生物在血管纤维化重构损伤、代谢异常和肠道结构功能障碍等方面发挥保护作用,共同改善高血压靶器官损伤。我们的研究结果从肠道微生物角度阐明了RAS系统抑制剂ARB作用新机制,其通过调节肠道菌群代谢、减轻血管胶原沉积及氧化应激损伤发挥其降压和高血压靶器官保护双重作用提供了新的见解。
代码和数据可用性
本研究的相关测序数据已存放在Metabolights数据库(登录号:MTBLS7703)和NCBI数据库(登录号:PRJNA956681),可在以下网址公开获取:https://www.ncbi.nlm.nih.gov/sra/PRJNA956681。文章中使用的数据和代码保存在
GitHub中https://github.com/lijing11999/Role-of-ARB-modified-gut-microbiota1。所有的补充材料(文本、图、表、中文翻译版本或视频)可从线上获取。
引文格式:
Li, Jing, Si-yuan, WangKai-xin Yan, Pan Wang, Jie Jiao, Yi-dan Wang,Mu-lei Chen, Ying Dong, and Jiu-chang Zhong2024. "Intestinal Microbiota by Angiotensin Receptor Blocker Therapy Exerts Protective Effects Against Hypertensive Damages." iMeta e222. https://doi.org/10.1002/imt2.222.
作者简介

李晶(第一作者)
● 首都医科大学附属北京朝阳医院心脏中心、北京市高血压重点实验室学术秘书、副研究员,博士生导师。
● 研究方向为肠道菌群及其代谢物与高血压及相关疾病发病机制,相关学术成果以第一或通讯作者在IMeta、Microbiome等期刊发表论文30余篇,单篇他引最高1100余次。现为中国实验动物学会无菌动物专业委员会常务委员,中国病理生理学会生物活性小分子专业委员会委员,北京生理科学会血管医学专委会委员,Animals and Zoonoses期刊青年编委。北京市医管局青苗人才,朝阳区“凤凰计划”高层次人才优秀青年人才,首都医科大学优秀青年人才。先后主持国家自然科学基金面上2项、青年项目1项,北京市自然科学基金面上项目1项。从事肠道菌群和心血管疾病机制研究,对肠道菌群紊乱在高血压的发生发展中的作用研究深入,阐明了高血压人群肠道菌群的变化,揭示了肠道菌群微生态紊乱是高血压发病新的环境致病因素,在国际上首次创新性提出肠道菌群可作为高血压治疗的新靶点。

王思远(第一作者)
● 首都医科大学附属北京朝阳医院心脏中心内科学心血管病科研型硕士,师从国内知名心血管专家钟久昌教授。
● 研究方向为肠道菌群及其代谢物和高血压等心血管疾病发表机制研究。参与多项国家自然科学基金、北京市自然科学基金项目,在IMeta、FASEB J、Nutrients等国际期刊或SCI收录期刊发表论文多篇。现为中国病理生理学会和中国药理学会会员。

钟久昌(通讯作者)
● 北京市高血压重点实验室主任;北京市高血压创新工作室主任;首都医科大学附属北京朝阳医院心脏中心行政副主任、医学研究中心首席科学家兼高血压学科带头人、教授、研究员,博士生导师;上海交通大学医学院特聘教授、博士后合作导师。
● 研究方向为高血压靶器官损害机制与新药靶点,在国际上率先提出血管紧张素转换酶2(ACE2)作为高血压防治新靶点。先后承担国家自然科学基金、国家重点研发计划课题、北京市自然科学基金、上海市科委浦江人才项目、上海市教委/上海交通大学医学院高峰高原双百人计划等20余项科研立项,其中主持国家自然科学基金9项,包括国家重大研究计划项目3项;相关学术成果在Circulation、IMeta、GigaScience、EBioMedicine、Hypertension等国际期刊上发表SCI论文100余篇,成果被N Engl J Med等引用。获得首都医科大学科学技术奖和优秀研究生导师奖;获得授权发明专利4项;主编和参编《实用高血压学》第4版等著作10部。担任国家心血管病中心高血压专家委员会常务委员、中国生物医药产业链创新与转化联盟心脑血管药物工委会主任委员、中国中药协会微循环用药专业委员会副主任委员、北京慢病防治与健康教育研究会高血压分会副主任委员、中国老年学和老年医学学会老年病学分会常务委员、中国药理学会表观遗传药理学专委会常务委员、中国老年保健协会高血压分会常务委员、国际心脏协会中国分会执委会委员、中国病理生理学会心血管专委会委员及北京高血压防治协会秘书长。

董莹(通讯作者)
● 首都医科大学附属北京朝阳医院心脏中心科研秘书,北京市高血压重点实验室;助理研究员。
● 研究方向为高血压环境相关危险因素,先后主持国家自然科学青年基金1项,首都医科大学等校局级课题2项;院级课题1项,以第一作者及通讯作者在IMeta、FASEB J等期刊发表SCI论文18篇,累计影响因子103.579。获得授权发明专利5项;学术任职:中国高血压联盟第七届委员、病理生理协会会员等。
更多推荐
(▼ 点击跳转)
iMeta | 引用13000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
2卷2期封底
2卷4期封底
3卷2期
3卷3期
3卷3期封底
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百千华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表所有领域高影响力的研究、方法和综述,重点关注微生物组、生物信息、大数据和多组学等。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!发行后相继被Google Scholar、ESCI、PubMed、DOAJ、Scopus等数据库收录!2024年6月获得首个影响因子23.7,位列全球SCI期刊前千分之五(107/21848),微生物学科2/161,仅低于Nature Reviews,同学科研究类期刊全球第一,中国大陆11/514!
“iMetaOmics” 是“iMeta” 子刊,主编由中国科学院北京生命科学研究院赵方庆研究员和香港中文大学于君教授担任,是定位IF>10的高水平综合期刊,欢迎投稿!
联系我们
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science








































 3494
3494

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








