点击蓝字 关注我们
枯草芽孢杆菌分泌的代谢产物通过GADD45A- Wnt/β-catenin途径维持肠道屏障完整性

iMeta主页:http://www.imeta.science
研究论文
● 原文: iMeta (IF 23.8)
● 原文链接: https://onlinelibrary.wiley.com/doi/10.1002/imt2.70005
● DOI: https://doi.org/10.1002/imt2.70005
● 2025年2月23日,浙江大学单体中/汪以真等在iMeta在线发表了题为“Enhancement of gut barrier integrity by a Bacillus subtilis secreted metabolite through the GADD45A-Wnt/β-catenin pathway”的文章。
● 本研究采用微生物组、代谢组和转录组技术,结合猪和小鼠模型以及猪和人的细胞模型,探究了新型枯草芽孢杆菌对肠道稳态的调控作用,并阐明了其通过关键功能性代谢产物2-羟基-4-甲基戊酸(HMP)调控肠道屏障功能的分子机制,为益生菌及其功能性代谢物开发与肠道健康调控上的应用提供了借鉴。
● 第一作者:刘事奇
● 通讯作者:单体中(tzshan@zju.edu.cn)
● 合作作者:蔡沛燃、有文静、杨明顺、涂羽昂、周炎冰、Teresa G. Valencak、肖英平、汪以真
● 主要单位:浙江大学动物科学学院、浙江省农业科学院
亮 点
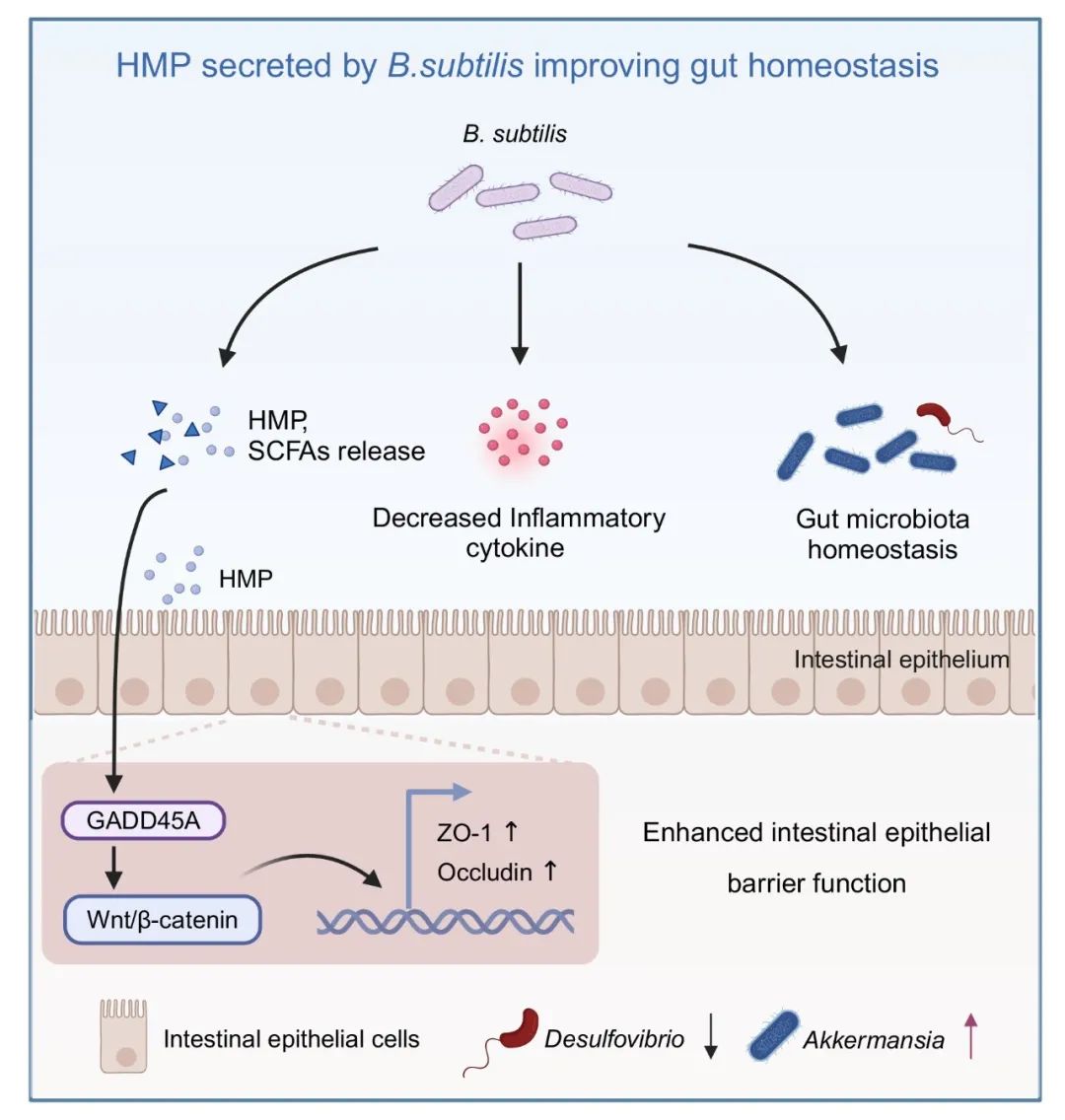
● 枯草芽孢杆菌(B. subtilis)缓解脂多糖(LPS)诱导的急性肠道损伤和炎症;
● B. subtilis 缓解肠道菌群失衡并增加阿克曼菌属(Akkermansia)的相对丰度;
● B. subtilis 分泌的代谢物HMP增强肠道上皮屏障完整性;
● GADD45A是肠道上皮屏障的新型调节因子;
● HMP通过GADD45A-Wnt/β-catenin通路调节肠道上皮屏障的完整性。
摘 要
炎症性肠病(IBD)是全球健康面临的重大挑战,其特征为肠道炎症、屏障功能受损及菌群失调,且目前针对IBD的治疗方法有限。在本研究中,我们分离了一株新型枯草芽孢杆菌(Bacillus subtilis, B. subtilis),揭示了其在维持肠道屏障稳态方面具有较好效果。研究结果表明,B. subtilis调节肠道屏障功能的作用主要依赖于其代谢产物;结合体内和体外的代谢组学分析,筛选鉴定到一种B. subtilis来源的、具有改善肠道屏障功能的新型代谢产物——HMP。进一步发现,GADD45A是肠道屏障完整性的关键调控因子,HMP通过激活GADD45A进而激活下游的Wnt/β-catenin信号通路调节肠道屏障功能。本研究为益生菌及其功能代谢产物开发与IBD等肠道相关疾病的治疗和肠道健康调控提供了新思路。
视频解读
Bilibili:https://www.bilibili.com/video/BV1Cm9CYMEqd/
Youtube:https://youtu.be/X_bexJGuAD4
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
肠道稳态依赖于肠道菌群、肠道上皮和宿主免疫系统之间的复杂相互作用。肠道稳态的失调可能引发一系列肠道病理变化,其中炎症性肠病(IBD)是最为常见且难以治疗的疾病之一。IBD包括克罗恩病(CD)和溃疡性结肠炎(UC),其特征是胃肠道(GI)出现慢性、间歇性炎症。IBD的典型特征包括免疫失调、细胞因子分泌异常、肠道屏障受损以及肠道菌群失衡。肠道屏障是肠道菌群与黏膜免疫系统之间的界面,对维持黏膜稳态至关重要。肠上皮由单层上皮细胞组成,通过紧密连接相互连接,形成物理屏障,有效阻止病原体和内毒素等有害物质穿过肠黏膜进入血液。这些相邻的上皮细胞通过紧密连接蛋白(如occludin、zonula occludens(ZOs)和连接粘附分子(JAMs))相互连接,包括闭合蛋白(Occludin)、闭锁小带蛋白(ZOs)和连接黏附分子(JAMs),以维持肠道屏障的完整性。肠道屏障的完整性是维持肠道稳态的基本前提。
具有调节肠道屏障功能的益生菌可以维持肠道稳态。众多研究表明,口服益生菌可以保护肠道屏障的完整性,并在结肠炎期间减轻肠道炎症。例如,口服阿利斯泰普菌(Alistipes onderdonkii)可激活芳香烃受体(AhR)信号通路,从而减轻DSS诱导的小鼠结肠炎。最近的一项研究显示,乳酸杆菌CCFM1267显著恢复了DSS诱导的小鼠结肠炎中的结肠长度和紧密连接蛋白表达,同时改善了疾病进程。此外,Bacteroides ovatus有效改善了高脂饮食小鼠的肠道屏障完整性,减少了全身炎症并降低了胰岛素抵抗。这些研究为IBD期间益生菌的治疗应用提供了重要的数据。B. subtilis是一种能够形成孢子的革兰氏阳性菌,被认定为“一般认为安全”(GRAS)的菌种,已被广泛用于生产各种化学品。少数芽孢杆菌科的菌株的安全性已得到证明,可为人类食用。例如,有5种B. subtilis已获得美国食品药品监督管理局(FDA)的GRAS认证,并被批准用于食品产品中。欧洲食品安全局(EFSA)已将B. subtilis列入“合格推定安全”(QPS)名单,允许其在食品工业中使用。研究表明,B. subtilis在治疗肠道疾病方面具有巨大潜力。B. subtilis M6通过调节肠道菌群改善了肉鸡模型中的肠道屏障和抗氧化能力;B. subtilis还通过调节肠道菌群抑制产蛋鸡的肠道炎症和氧化应激。此外,B. subtilis已在临床上被证实可以缓解功能性消化不良患者以及健康受试者的胃肠道异常症状。课题组前期研究发现,新型B. subtilis发酵饲料可以改善猪的生长性能和肉品质。然而,目前尚不清楚B. subtilis是否影响急性肠道损伤和黏膜屏障功能障碍。尽管一些B. subtilis菌株已被报道在改善肠道屏障功能方面是安全、有效的,但其潜在的分子机制尚不明确。
因此,本研究旨在探究一株新型B. subtilis在调节肠道屏障功能中的作用,并解析其潜在的分子机制。在本研究中,我们分离出了一株新型B. subtilis,证明了其具有较好的抗炎活性,并能在LPS诱导的肠道损伤模型中维持肠道菌群的稳态、维持肠道屏障功能。进一步通过菌液上清与灭活菌的动物试验,证明了B. subtilis调节肠道屏障功能主要依赖于其代谢产物的作用。联合体内和体外试验的代谢组学分析,鉴定到一种B. subtilis来源的新型代谢产物——HMP,并揭示了HMP可显著改善肠道屏障的完整性。机制上,HMP可通过激活GADD45A-Wnt/β-catenin通路改善黏膜屏障的完整性。总之,我们的研究为B. subtilis及其代谢产物在IBD等肠道相关疾病的治疗和动物肠道健康调控提供借鉴。
结 果
B. subtilis缓解LPS诱导的急性肠道损伤和炎症
本研究探究了B. subtilis在脂多糖(LPS)诱导的急性肠道损伤中的保护作用。在给10周龄的雄性C57BL/6J小鼠灌服无菌生理盐水或B. subtilis 14天后,腹腔注射LPS以构建急性炎症与肠道损伤的小鼠模型(图1A)。结果显示,4组小鼠的体重和脾脏重量均无显著差异(图S1A-C)。相比对照组,LPS处理显著提高了血清中肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-1β(IL-1β)的水平,而B. subtilis处理显著降低了血清中的TNF-α、IL-6和IL-1β的水平(图1B-D)。苏木精-伊红(H&E)染色与免疫荧光染色结果显示,LPS处理导致肠绒毛的萎缩,以及Occludin的表达降低(图1E)。B. subtilis处理恢复了肠绒毛的形态和Occludin蛋白表达(图1E)。Western blot结果表明,LPS处理降低了紧密连接蛋白ZO-1和Occludin的蛋白水平,而B. subtilis显著恢复了ZO-1和Occludin的表达(图1F,S1D)。此外,LPS处理显著增加了空肠中Tnfα和Il-6的mRNA表达,而LPS + BS组的Tnfα和Il-6的mRNA表达显著降低(图1G,H)。同样地,LPS导致小鼠结肠组织中肠绒毛萎缩、肠道屏障损伤和炎症细胞浸润,B. subtilis处理改善了LPS诱导的肠绒毛损伤和炎症细胞浸润(图1I)。与LPS组相比,LPS + BS处理上调了ZO-1和Occludin的mRNA表达水平(图1J,K)。Western blot结果表明,B. subtilis处理能够恢复LPS诱导的Occludin表达降低(图1L,S1E)。此外,B. subtilis处理也显著降低了结肠中Tnfα和Il-6的mRNA表达(图S1F)。
为了进一步探究B. subtilis调控肠道屏障功能的效果,我们制备了来源于B. subtilis的发酵饲料(FF),评估其在猪模型上的效果(图1M)。尽管在肠绒毛形态上没有显著差异(图S1G),但源自B. subtilis的发酵饲料(BS FF)显著增加了Claudin2、Claudin3和ZO-1的mRNA表达(图1N)。在蛋白水平上,BS FF显著上调了Claudin1的蛋白表达(图1O)。此外,与对照组相比,补充10%的FF显著增加了血清IgA水平(图S1H),还可以显著提高结肠组织中超氧化物歧化酶(SOD)的活性(图S1I)。综上,B. subtilis可缓解肠道炎症、增强肠道上皮屏障的完整性。

图1. B. subtilis增强肠道上皮屏障并缓解炎症
(A)小鼠试验设计;(B-D)血清中炎症细胞因子TNF-α(B)、IL-6(C)和IL-1β(D)的水平(n = 5);(E)空肠组织代表性H&E染色结果和Occludin的免疫荧光染色结果;(F)空肠中ZO-1和Occludin的Western blot检测结果;(G)空肠组织中Tnfα的相对mRNA水平(n = 5);(H)空肠组织中Il-6的相对mRNA水平(n = 5);(I)代表性结肠组织的H&E染色图像和肠绒毛的透射电镜(TEM)观察结果;(J)结肠组织中ZO-1的相对mRNA水平(n = 5);(K)结肠组织中Occludin的相对mRNA水平(n = 5);(L)结肠组织中ZO-1和Occludin的Western blot分析;(M)猪模型的试验设计;(N)空肠组织中Claudin2、Claudin3和ZO-1的相对mRNA水平(n = 6);(O)结肠组织中Claudin1的Western blot分析。
B. subtilis改善肠道菌群失衡,提高有益菌的相对丰度
鉴于肠道菌群对宿主免疫和肠道稳态的关键作用,我们通过16S核糖体RNA(16S rRNA)基因测序技术分析肠道菌群组成的变化。主坐标分析(PCoA)显示,LPS组与对照组(Ctrl组)之间的细菌群落存在显著差异,LPS + BS处理和LPS处理对细菌群落的影响较小(图S2A)。在结肠中,拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobiota)和变形菌门(Proteobacteria)是最丰富的门,平均丰度超过90%(图S2B)。此外,LPS组中疣微菌门的水平较低,而LPS + BS处理恢复了其丰度(图S2B)。在属水平上,阿克曼菌属(Akkermansia)和寡养单胞菌属(Stenotrophomonas)的丰度较高(图S2C)。与LPS组相比,LPS + BS组中阿克曼菌属(Akkermansia)、副拟杆菌属(Parabacteroides)、另枝菌属(Alistipes)和异普雷沃菌属(Alloprevotella)的丰度显著升高(图S2C)。
为了研究菌群在门和属水平上的系统发育关系,通过多序列比对获得了前100个属的代表性序列,并构建了系统发育树(图S2D)。结果显示,最丰富的属是厚壁菌门(Firmicutes)(图S2D)。值得注意地,阿克曼菌属(Akkermansia)是一种调节肠道屏障功能的重要益生菌,其丰度在LPS处理后降低,而LPS + BS处理恢复了其丰度(图S2D)。为了阐明B. subtilis对结肠菌群组成和结构特征的影响,我们使用热图展示了35个属的相对丰度(图S2E)。脱硫弧菌属(Desulfovibrio)和毛螺菌属(Lachnoclostridium)在LPS组中富集,而双歧杆菌属(Bifidobacterium)、异杆菌属(Allobaculum)、异普雷沃菌属(Alloprevotella)和副拟杆菌属(Parabacteroides)在LPS + BS组中富集(图S2E)。同样地,LPS处理降低了阿克曼菌属(Akkermansia)的丰度,而LPS + BS处理恢复了其丰度(图S2E)。此外,LPS处理增加了脱硫弧菌属(Desulfovibrio)的丰度,而LPS + BS处理降低了其丰度(图S2E)。基于KEGG数据库,通过PICRUSt分析预测了微生物的代谢功能。结果表明,与LPS组相比,LPS + BS组中丙酮酸代谢、鞘脂代谢、膦酸和膦酸盐代谢、硒化合物代谢、D-丙氨酸代谢、氮代谢和维生素B6代谢显著增强,而托烷哌啶和吡啶生物碱生物合成、脂肪消化吸收以及初级胆汁酸生物合成减弱(图S2F)。同样,与LPS组相比,LPS + BS组中柠檬酸循环和膜运输功能可能显著增强(图S2F)。
为了探究差异菌与紧密连接蛋白和炎症因子基因表达水平之间的关系,我们进行了相关性分析(图S2G)。阿克曼菌属(Akkermansia)的相对丰度与Occludin的表达呈强正相关,与Tnfα和Il-6的表达呈负相关(图S2G)。Limosilactobacillus的相对丰度与ZO-1的表达呈正相关,而与Tnfα和Il-6的表达呈负相关(图S2G)。此外,包括脱硫弧菌属(Desulfovibrio)和颤螺菌属(Oscillibacter)在内的一些属与Tnfα和Il-6的表达呈强正相关,而与ZO-1的表达呈负相关(图S2G)。综上B. subtilis能够改善有益菌群的丰度,减少了LPS诱导的菌群失调,这与肠道上皮屏障的稳态密切相关。
B. subtilis对LPS诱导的肠道损伤保护作用与其代谢产物有关
为了探究B. subtilis发挥生理功能是依赖于其代谢物还是菌体本身,于是给野生型小鼠分别灌胃服用热灭活的B. subtilis(HI BS)或过滤后的B. subtilis上清液(BS.sup),随后接受LPS处理(图2A)。结果显示,BS.sup预处理显著降低了血清中炎症细胞因子TNF-α和IL-6的水平(图2B)。同时,BS.sup和HI BS处理均降低了血清中IL-1β的水平(图2B)。组织形态学结果显示,LPS处理诱导肠绒毛的萎缩和基底层的增厚,而BS.sup处理则恢复了肠绒毛的形态和Occludin的蛋白表达(图2C)。与LPS组相比,BS.sup处理显著上调ZO-1和Occludin的mRNA表达(图2D)。此外,BS.sup和HI BS处理均降低了空肠中Tnfα的mRNA表达(图S3A)。在结肠组织中,H&E染色和透射电子显微镜的结果表明,LPS导致肠绒毛的萎缩和损伤,而BS.sup处理则保护了肠道形态(图2E)。在mRNA水平上,BS.sup和HI BS处理均恢复了ZO-1和Occludin的表达水平(图2F)。与HI BS组相比,BS.sup处理显著增加了ZO-1和Occludin的表达水平(图2F)。
为了进一步比较BS.sup和HI BS对肠道紧密连接蛋白的影响,我们在体外用BS.sup或HI BS处理IPEC-J2细胞24小时(图2G)。与对照组(0%)相比,添加10%的BS.sup显著提高了ZO-1和Occludin的表达(图2H,S3B)。补充5%的BS.sup也显著上调了Occludin的蛋白水平(图2H)。此外,HI BS处理也提高了Occludin的表达,但同时降低了ZO-1的表达(图S3C,3D)。在LPS诱导的肠道屏障损伤模型中,LPS显著降低IPEC-J2细胞中肠道紧密连接蛋白的表达(图2I,J)。当用10%的BS.sup预处理时,能够恢复ZO-1和Occludin的蛋白表达(图2J)。因此,B. subtilis对LPS诱导的急性肠道损伤的保护作用主要与其代谢产物相关。

图2. B. subtilis的保护作用主要依赖于其代谢产物
(A)小鼠模型的试验设计;(B)血清中炎症细胞因子TNF-α、IL-6和IL-1β的水平(n = 5);(C)代表性空肠组织H&E染色结果和Occludin的免疫荧光染色图像;(D)空肠组织中ZO-1和Occludin的相对mRNA水平(n = 5);(E)代表性结肠组织H&E染色图像和透射电子显微镜(TEM)图像;(F)结肠组织中ZO-1和Occludin的相对mRNA水平(n = 4);(G)BS.sup与IPEC-J2细胞共培养的试验设计;(H)IPEC-J2细胞中GAPDH、Occludin和ZO-1的Western blot分析;(I)BS.sup处理对LPS诱导的IPEC-J2细胞损伤影响的试验设计;(J)GAPDH、Occludin和ZO-1的Western blot分析。
B. subtilis对小鼠肠道代谢图谱的影响及其关键代谢产物的鉴定
为了筛选和鉴定调节肠道屏障功能的代谢产物,我们首先对小鼠结肠内容物样本进行了非靶向代谢组学分析(小鼠实验1,图3A)。主成分分析(PCA)表明,不同处理改变了代谢物的组成(图3B)。为了分析B. subtilis对肠道代谢物组成的影响,我们通过VIP(Variable Importance in Projection)>1和p值<0.05(方差分析)筛选差异代谢物。KEGG分析表明,差异代谢物主要与代谢途径有关,例如酪氨酸代谢、碳代谢和维生素B6代谢(图3C)。为了在类别水平上展示LPS + BS组与LPS组之间差异代谢物的类别,进一步构建气泡图(图3D)。我们观察到大量与氨基酸代谢及其代谢物、杂环化合物以及有机酸及其衍生物相关的不同代谢物(图3D)。通过非靶向代谢组学检测B. subtilis培养基上清液和LB对照培养基(图3E),我们在B. subtilis培养基上清液中发现了1257种显著上调的代谢物和910种显著下调的代谢物,如火山图所示(图3F)。同样地,大量代谢物与氨基酸及其代谢物有关(图S4A,B)。值得注意的是,B. subtilis还可以分泌短链脂肪酸(SCFAs),如异丁酸、戊酸和戊二酸(图S4C)。此外,差异代谢物的KEGG分析表明,ABC转运蛋白、嘌呤和核苷酸代谢是富集的途径之一(图3G)。
为了筛选介导B. subtilis功能效应的关键代谢物,对体外和体内的代谢组学检测结果进行联合分析(图3H)。通过联合分析“LPS + BS与LPS相比上调(体内实验)”和“BS.sup与对照相比上调(体外实验)”,筛选得到80种重叠代谢物(图3I)。为了找出潜在的关键功能代谢物,我们进一步根据以下条件进行筛选:匹配水平<3,匹配得分>0.7,VIP值>1.6,p值<0.05(图3I)。最终,我们鉴定到了8种关键代谢物,包括HMP、2-羟基-2-甲基丁酸(HMBA)、虎杖苷(Polydatin)、吲哚-5-羧酸(ICA)、异甜菊醇、L-苯丙氨酸(L-Phe)、Tyr-Asp和Phe-Ile-His-Arg(图3I)。此外,相关性分析结果表明,这些代谢物的丰度与ZO-1和Occludin的表达水平相关(图3J)。

图3. 鉴定B. subtilis分泌的关键代谢物
(A)小鼠实验1中结肠内容物的代谢组学分析(n = 5);(B)对照组、LPS组和LPS + BS组结肠代谢组学的主成分分析(PCA)图;(C)显著差异代谢物的富集分析;(D)差异代谢物在类别水平上的分布;(E)来自B. subtilis的培养基上清液(BS.sup)和对照LB培养基的代谢组学分析(n = 3);(F)差异代谢产物的火山图(VIP > 1,p值 < 0.05);(G)差异代谢物的富集分析;(H)通过联合分析鉴定关键代谢物;(I)筛选到的关键代谢物;(J)关键代谢产物与紧密连接蛋白和炎症因子表达水平之间的相关性分析。Ctrl,对照组;LB,Luria-Bertani培养基。
B. subtilis来源的代谢产物HMP改善紧密连接蛋白的表达和肠道屏障的完整性
为了研究B. subtilis来源的代谢产物对肠道屏障的影响,我们用5种关键代谢物(HMP、HMBA、Polydatin、ICA和L-Phe)处理IPEC-J2细胞24小时(图4A)。发现,HMP和Polydatin显著增加了ZO-1和Occludin的mRNA表达,而HMBA、ICA和L-Phe对肠道紧密连接蛋白的表达没有影响(图4B,C)。随后,我们进一步比较了HMP和Polydatin对IPEC-J2细胞中紧密连接蛋白表达的影响(图4D,S5A)。用1 μM、10 μM或100 μM的HMP处理显著增加了ZO-1和Occludin的蛋白水平(图4E,F)。然而,Polydatin对Occludin和ZO-1的蛋白水平没有显著影响(图S5B,C)。此外,我们进一步探究HMP对Caco-2细胞中紧密连接蛋白蛋白表达的影响(图4G)。结果显示,100 μM的HMP处理显著提高了Occludin的蛋白水平(图4H,I)。
接下来,我们进一步利用小鼠模型确定HMP的作用,试验设计见图4J。LPS处理诱导了小鼠腹泻表型,而LPS +高浓度HMP(HH)或LPS +低浓度HMP组(LH)的小鼠表现出较轻的腹泻症状(图4K)。组织形态学结果表明,LPS导致空肠肠绒毛萎缩,而HMP处理能够维持肠绒毛的正常形态(图4L)。在mRNA水平上,LPS处理降低了Occludin和ZO-1的表达,而HH处理恢复了Occludin和ZO-1的表达水平(图4M)。此外,HH处理也恢复了Occludin蛋白表达(图S5D,E)。同样地,LPS处理破坏了结肠组织的形态,而HMP处理保护了肠道形态并维持了Occludin和ZO-1的表达(图4N-4O)。以上结果表明,HMP是B. subtilis对肠道屏障保护作用的有效介导者。
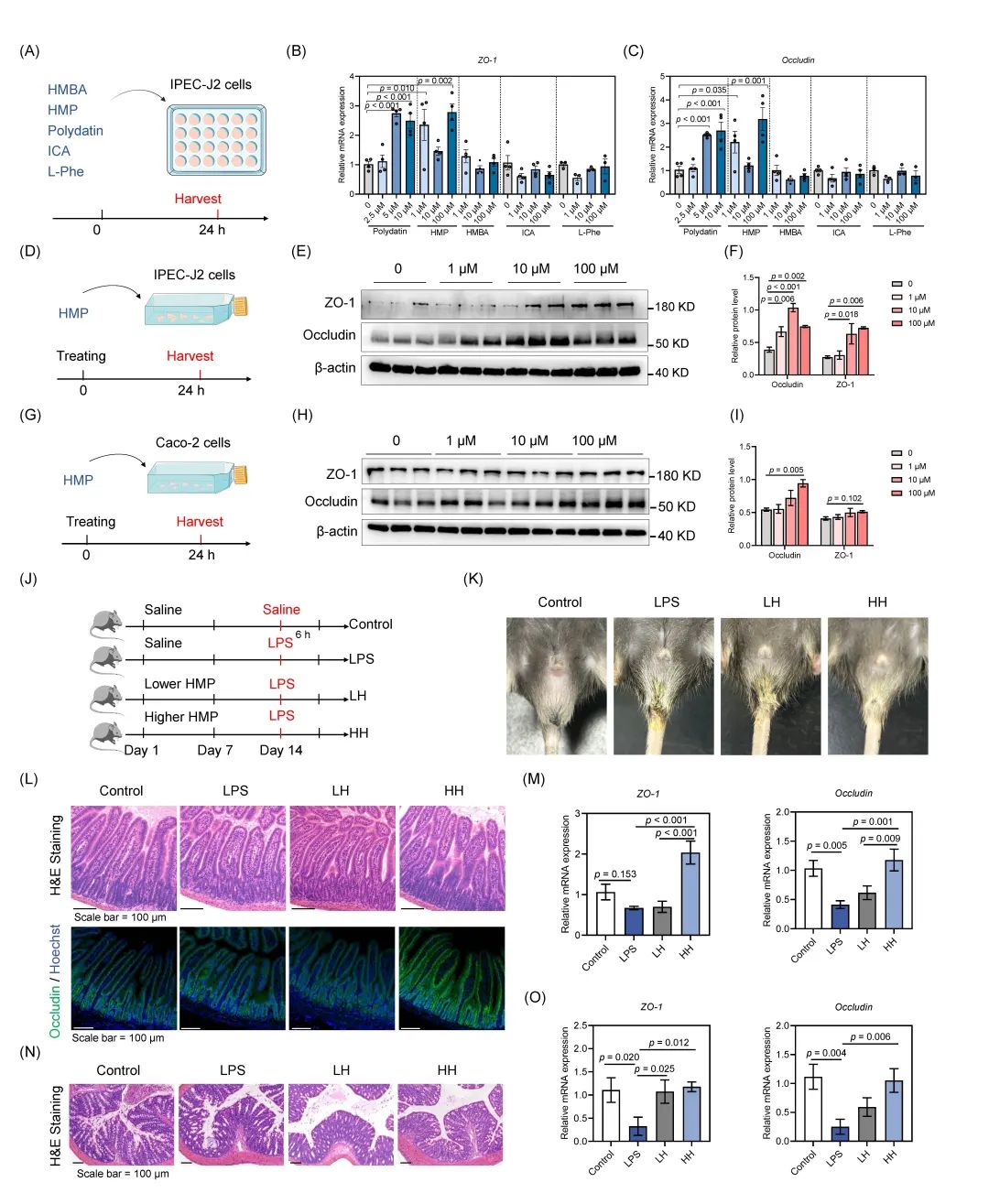
图4. B. subtilis来源的HMP在体内外改善肠道上皮屏障
(A)代谢物处理IPEC-J2细胞的试验设计;(B-C)ZO-1和Occludin的mRNA表达水平(n = 4);(D)HMP处理IPEC-J2细胞的试验设计;(E)ZO-1和Occludin的Western blot分析(n = 3);(F)蛋白相对表达水平已用β-actin归一化处理;(G)HMP处理Caco-2细胞的试验设计;(H)Occludin和ZO-1的Western blot分析(n = 3);(I)蛋白相对表达水平已用β-actin归一化处理;(J)小鼠模型的试验设计;(K)腹泻症状的代表性图像;(L)代表性空肠组织H&E染色图像和Occludin的免疫荧光染色图像;(M)空肠组织中ZO-1和Occludin的mRNA相对水平(n = 5);(N)结肠组织的代表性H&E染色图像;(O)结肠组织中ZO-1和Occludin的mRNA相对水平(n = 5);统计分析采用单因素方差分析(ANOVA),数据以均值±标准误(SEM)表示。HMBA,2-羟基-2-甲基丁酸;HMP,2-羟基-4-甲基戊酸;HH,高剂HMP;ICA,吲哚-5-羧酸;LH,低剂量HMP;L-Phe,L-苯丙氨酸。
GADD45A是肠道上皮屏障的新调控因子
为了挖掘参与调控肠道屏障完整性的潜在调控因子,我们重新分析了公开可获取的RNA测序数据。结果显示,在DSS结肠炎小鼠模型中,肠道紧密连接蛋白的表达逐渐降低,Gadd45的表达水平也随之降低(图S6A)。在健康个体和患有溃疡性结肠炎(UC)的患者的结肠样本中,UC患者的Gadd45a表达显著降低(图S6B)。同样地,我们进一步比较了Caco-2细胞相关的公开数据,发现赭曲霉毒素A处理显著降低了紧密连接蛋白ZO-1和Occludin的表达,以及Gadd45a、Gadd45b和Gadd45g的表达水平(图S6C)。因此,Gadd45a可能在调节肠道炎症和肠道屏障完整性方面发挥重要作用。最近的一项研究表明,Gadd45a参与调节肠干细胞(ISCs)的功能。
接下来,进一步研究B. subtilis和HMP对GADD45A表达的影响。结果显示,在LPS诱导的肠道损伤模型中,B. subtilis或HMP处理挽救了Gadd45a的mRNA表达水平(图5A,S6D)。与LPS组相比,B. subtilis处理显著提高了空肠和结肠组织中GADD45A蛋白的水平(图5B,S6E,F)。HMP处理也在LPS诱导的肠道损伤中恢复了GADD45A的蛋白表达(图S6G,H)。
为了探究Gadd45a对肠道紧密连接蛋白和肠道屏障完整性的影响,我们在IPEC-J2细胞中进行敲低/过表达Gadd45a。与对照组(Ctrl)细胞相比,敲低Gadd45a(shG45A)显著降低了Occludin和ZO-1的表达(图5C)。相反,过表达Gadd45a(oe-G45A)提高IPEC-J2细胞中Occludin和ZO-1的表达水平(图5D,E)。因此,GADD45A可能调控肠道紧密连接蛋白的表达和肠道屏障功能。
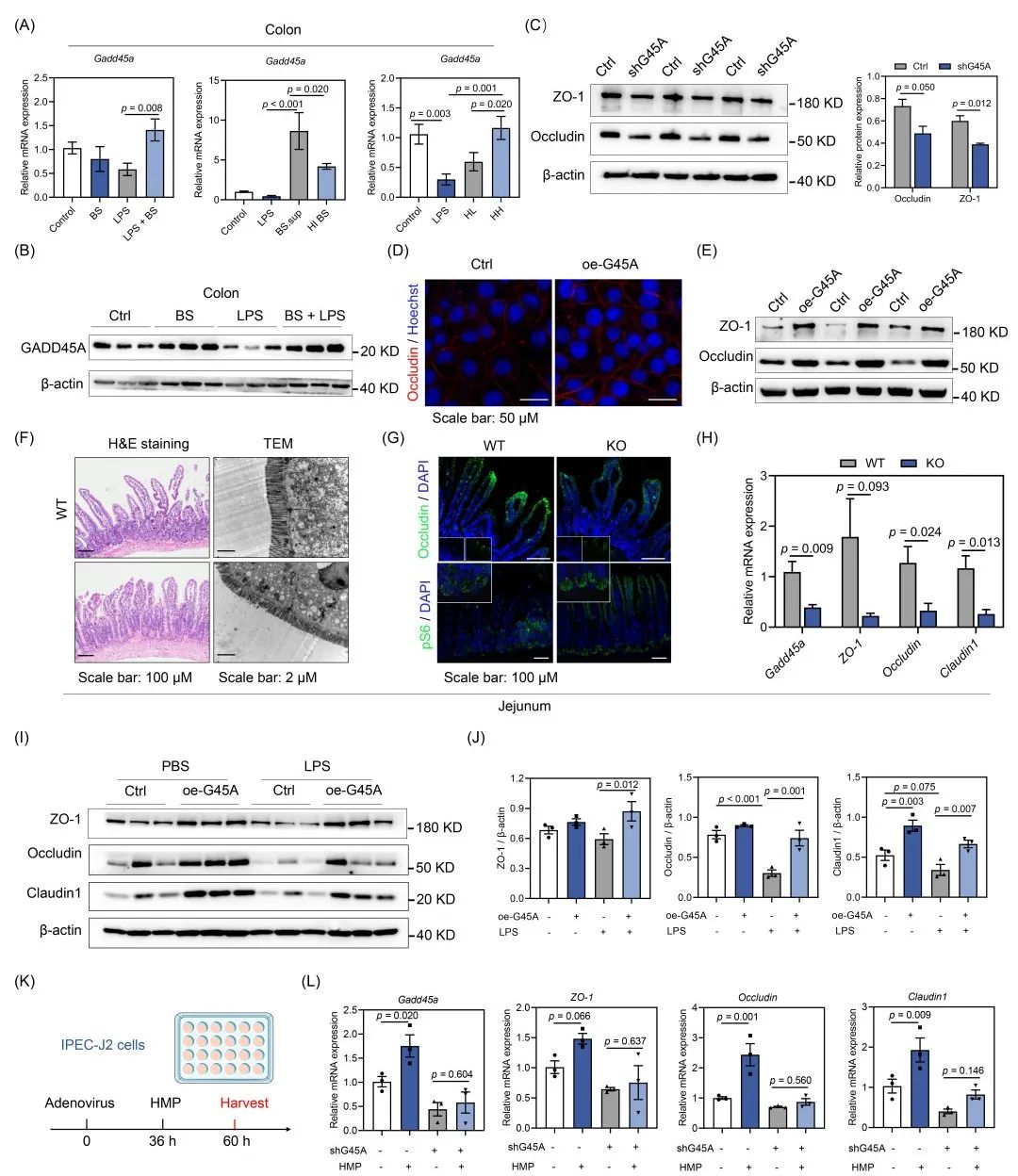
图5. GADD45A是肠道上皮屏障的新调控因子
(A)结肠组织中Gadd45a的mRNA相对水平(n = 5);(B)结肠组织中GADD45A的Western blot分析(n = 3);(C)ZO-1、Occludin和β-actin的Western blot分析(n = 3);(D)IPEC-J2细胞中Occludin的代表性免疫荧光图像;(E)对照组和oe-G45A细胞中ZO-1、Occludin和β-actin的Western blot分析(n = 3);(F)空肠组织代表性的H&E染色和透射电子显微镜图像;(G)Occludin、pS6和DAPI的免疫荧光图像;(H)野生型(WT)和Gadd45a基因敲除(KO)小鼠中Gadd45a和肠道紧密连接蛋白的mRNA相对水平(n = 6);(I)在对照和过表达Gadd45a腺病毒处理36小时后,PBS或10 μg/mL LPS处理24小时。ZO-1、Occludin和β-actin的Western blot分析;(J)相对蛋白水平用β-actin进行归一化处理;(K)细胞试验设计;(L)Gadd45a、Occludin、ZO-1和Claudin1的mRNA相对水平(n = 3)。shG45A,敲低Gadd45a;oe-G45A,过表达Gadd45a;pS6,磷酸化核糖体蛋白S6。
GADD45A是B. subtilis对缓解肠道损伤作用的关键介导者
为了进一步在体内研究Gadd45a对肠道屏障完整性的影响,我们构建了Gadd45a基因敲除(KO)小鼠。结果显示,Gadd45a敲除导致肠绒毛高度降低(图5F,S7A)。Gadd45a敲除还导致Occludin蛋白表达降低(图5G)。近期研究表明,mTOR过度激活诱导上皮细胞坏死、肠道屏障损伤以及对DSS诱导的结肠炎的敏感性。Gadd45a 敲除小鼠空肠中核糖体蛋白S6磷酸化(pS6)水平增加(图5G,S7B)。此外,Gadd45a敲除显著降低了与肠道紧密连接相关的基因(如Occludin和ZO-1)的mRNA表达(图5H)。因此,Gadd45a敲除可能降低肠道紧密连接蛋白的表达。
接下来,我们使用腺病毒在IPEC-J2细胞中敲低Gadd45a,然后用LPS处理,以进一步明确GADD45A在LPS诱导的肠道损伤中的功能。shG45A显著降低ZO-1、Occludin和Claudin1的表达(图S7C,D)。LPS处理降低了肠道紧密连接蛋白表达,而过表达Gadd45a恢复了IPEC-J2细胞中ZO-1、Occludin和Claudin1的水平(图5I,J)。综上所述,Gadd45a过表达可缓解LPS诱导的肠道屏障损伤。
我们进一步研究了HMP是否以GADD45A依赖的方式提高肠道紧密连接蛋白的表达(图5K)。在mRNA水平上,HMP在缺失Gadd45a的情况下无法维持紧密连接蛋白的表达(图5L)。因此,HMP增强肠道屏障功能依赖于GADD45A的作用。
GADD45A通过Wnt/β-catenin通路增强肠道屏障功能
为了探究GADD45A调控肠道屏障功能的下游通路,对对照组(Ctrl)和oe-G45A组的IPEC-J2细胞进行转录组测序分析。基因表达热图显示,GADD45A过表达显著改变了mRNA表达谱(图S8A)。火山图表明,与对照组相比,oe-G45A组中528个基因显著上调,240个基因显著下调(图S8B)。对上调基因的KEGG富集分析显示,肠道免疫系统、Toll样受体信号、ECM-受体互作及p53信号通路显著富集(图S8C);而下调基因则富集于缝隙连接、Hippo信号及Wnt信号通路(图S8D)。Wnt信号通路相关基因的热图表明,oe-G45A影响了Wnt信号传导,提示其可能通过该通路发挥调控作用(图S8E)。此外,oe-G45A显著改变了mTOR信号通路相关基因的表达(图S8F)。通过qPCR验证发现,oe-G45A显著增加了Wnt信号通路关键因子(如DVL2和DVL3)的表达(图S8G)。此外,shG45A降低了β-catenin蛋白磷酸化水平,并提高S6核糖体蛋白磷酸化(图S8H)。以上结果表明,GADD45A可能通过Wnt/β-catenin和mTOR信号通路调控肠道屏障稳态。
为验证GADD45A是否依赖Wnt/β-catenin信号通路改善肠上皮屏障,我们使用对照或shG45A腺病毒处理IPEC-J2细胞36小时,随后加入Wnt激动剂BML-284(图S8I)。结果显示,BML-284可恢复shG45A诱导的Occludin、ZO-1、ZO-2及Claudin1表达下调(图S8J)。在蛋白水平上,shG45A降低了ZO-1的蛋白表达,而BML-284处理可恢复其表达(图S8K)。此外,Wnt拮抗剂LF3阻断了GADD45A诱导的ZO-1蛋白表达上调(图S8L)。综上,GADD45A通过Wnt/β-catenin信号通路改善肠上皮屏障功能。
讨 论
肠道屏障完整性对肠道健康至关重要,肠道稳态失调与众多胃肠道疾病密切相关。因此,维持肠道屏障完整性是预防和治疗胃肠道疾病的关键目标。在本研究中,我们探究了益生菌B. subtilis在LPS诱导的急性肠道损伤小鼠模型中维持肠道屏障功能的效果,明确了B. subtilis维持肠道屏障功能的作用主要通过其代谢产物介导,揭示了B. subtilis通过分泌的一种新代谢产物HMP激活GADD45A以维持肠道屏障的完整性。此外,我们还初步解析了GADD45A调节肠道屏障功能的分子机制。
近期,许多研究报道了B. subtilis的作用,例如抑制沙门氏菌感染、维持肠道菌群稳态以及缓解肠道氧化损伤。与此同时,B. subtilis的有效性和安全性也在临床试验中被证实。与先前研究一致,我们的结果表明,B. subtilis改善了LPS诱导的小鼠肠道上皮屏障损伤。尽管B. subtilis在维持肠道稳态和健康方面的作用已被报道,但其作用机制尚不清楚,目前很少有研究涉及B. subtilis发挥生物学功能的活性成分及其潜在作用机制。Leistikow等报道,B. subtilis分泌的肽通过破坏细菌群体感应和生物膜组装,对抗耐多药金黄色葡萄球菌感染,并提高抗生素的疗效。在本研究中,我们比较了BS.sup和HI BS对肠道屏障的调节作用,并发现B. subtilis的代谢产物在调节肠道上皮屏障完整性方面发挥了关键作用。
肠道菌群在调节宿主肠道上皮屏障稳态中也发挥着不可或缺的作用。我们还观察到口服B. subtilis改变了肠道菌群的组成。具体来说,B. subtilis影响了与肠道紧密连接蛋白表达显著正相关的Akkermansia和Limosilactobacillus的相对丰度。据报道,这些细菌可以调节肠道屏障的功能。例如Akkermansia通过分泌丙酸加速肠道干细胞介导的上皮发育,并保护肠道免受辐射诱导的损伤。因此,B. subtilis与宿主菌群之间的相互作用可能也与肠道屏障完整性有关。
在本研究中,我们鉴定了一种B. subtilis的代谢产物HMP,并进一步通过小鼠试验和细胞试验揭示其在调节肠道屏障功能方面的作用效果。迄今为止,关于HMP的生理功能的研究很少。最近有报道称,R. torques的定植或HMP干预减轻了代谢功能障碍相关脂肪性肝炎(MASH)小鼠的炎症和纤维化。本研究中,我们证明了HMP通过上调GADD45A的表达增强肠道屏障功能。然而,本研究尚未解析HMP如何精确激活GADD45A,以及肠道上皮细胞中是否存在HMP受体。
GADD45A是一种由p53控制的组蛋白折叠蛋白,可被多种细胞应激诱导。我们以往的研究表明,GADD45A调节骨骼肌中的肌内脂肪沉积和棕色脂肪的发育,在脂质代谢稳态中发挥重要作用。一些研究表明,GADD45A可能是治疗肠道疾病的关键靶点。例如,与正常黏膜组织相比,结直肠癌(CRC)患者肿瘤组织中GADD45A的表达显著下调。然而,目前尚不清楚GADD45A是否参与调节肠道屏障完整性。本研究结果表明,GADD45A缺失可降低体内外肠道紧密连接蛋白的表达。GADD45A过表达改善了肠道屏障功能,并保护肠道屏障免受LPS损伤。GADD45A通过Wnt/β-catenin信号通路增强了肠道紧密连接蛋白的表达。值得注意的是,GADD45A激活Wnt/β-catenin通路的分子机制还有待进一步研究。
β-catenin介导的经典Wnt信号通路调节肠道细胞的增殖、分化以及肠道上皮的稳态。在本研究中,Wnt信号激活剂BML-284并未影响肠道紧密连接蛋白的表达,但能够恢复敲低GADD45A而导致的IPEC-J2细胞中紧密连接蛋白表达的降低。GADD45A对紧密连接蛋白表达的调节作用由Wnt信号通路介导。然而,我们尚未研究BML-284处理是否能够在GADD45A缺失小鼠中同样恢复紧密连接蛋白的表达水平并维持肠道屏障的完整性。
结 论
本研究证明了B. subtilis可缓解LPS诱导的肠道屏障损伤和炎症,发现其代谢产物发挥了主要作用;并首次揭示源自B. subtilis的代谢物HMP能够调节肠道屏障功能;明确了GADD45A是维持肠道屏障完整性的新调控因子,GADD45A通过其下游的Wnt/β-catenin信号通路促进肠道紧密连接蛋白的表达,并维持肠道屏障的完整性;且HMP维持肠道屏障的完整性的作用依赖于GADD45A。本研究为益生菌及其代谢物开发与肠道屏障相关疾病治疗和肠道健康调控提供了新的理论依据。
方 法
动物试验
8周龄的雄性野生型(WT)C57BL/6J小鼠购自江苏集萃药康生物科技有限公司(中国江苏)。Gadd45a基因敲除(Gadd45a-/-)小鼠由美国国家癌症研究所的Albert J. Fornace Jr.教授提供,维持C57BL/6遗传背景。Gadd45a-/-小鼠及其野生型同窝对照小鼠(作为对照组)均来自杭州师范大学维持的Gadd45a杂合小鼠繁殖群。所有小鼠均在特定病原体无感染的条件下饲养,并保证自由饮水、提供标准啮齿动物饲料。
为了探究B. subtilis对LPS诱导的急性肠道损伤和炎症的作用,分别用200 μL无菌生理盐水或200 μL B. subtilis(1 × 10⁹ CFU/mL)灌胃小鼠14天;随后,腹腔注射LPS(0.1 mg/kg,溶于无菌生理盐水)或无菌生理盐水。在LPS处理6小时后,小鼠被施以安乐死。
为了探究B. subtilis的功能成分,分别用200 μL空白培养基、热灭活(HI)B. subtilis或过滤后的B. subtilis上清液(BS.sup)灌胃小鼠14天,腹腔注射LPS 6小时后取样。
为了探究HMP的功能,分别用200 μL无菌生理盐水、100 mg/kg体重的HMP(低剂量HMP,LH)或200 mg/kg体重的HMP(高剂量HMP,HH)灌胃小鼠14天,腹腔注射LPS 6小时后取样。HMP溶解于无菌生理盐水中(产品编号A01045455-5G)。
为了探究B. subtilis来源的发酵饲料对猪肠道屏障功能的影响,在猪饲粮中分别添加0%、5%以及10%的B. subtilis来源的发酵饲料,调整3组饲粮蛋白水平一致,发酵饲料的底物为玉米、豆粕、麸皮。预饲期4天,试验期38天。
菌株培养
Luria Bertani(LB)培养基配方:10 g/L胰蛋白胨、5 g/L酵母提取物和10 g/L NaCl。B. subtilis在37°C的恒温振荡器中以180 rpm/min的转速培养。
细胞培养与LPS处理
本研究中使用的IPEC-J2和Caco-2细胞系由本实验室提供。IPEC-J2和Caco-2细胞在含有Dulbecco改良Eagle培养基(DMEM)、10%胎牛血清(FBS,Gibco)和1%青霉素/链霉素的培养基中培养,培养条件为:37℃、5% CO₂,每2天更换新鲜培养基。将10 mg/L LPS(MCE公司)添加到培养基中,处理24小时以诱导肠道上皮损伤。
血清TNF-α、IL-6和IL-1β的测定
采用酶联免疫吸附测定(ELISA)试剂盒,按照制造商的说明进行操作,并在450 nm处使用微孔板读数仪进行分析,以测定血清中TNF-α、IL-6和IL-1β的水平。ELISA试剂盒购自江苏酶免生物工程有限公司(江苏,中国)。
组织病理学分析
浸泡在4%多聚甲醛溶液中的空肠和结肠样本经过脱水、石蜡包埋,并采用苏木精-伊红染色,具体方法如我们之前的研究所述。
免疫荧光染色
免疫荧光染色按照之前描述的方法进行。荧光图像使用Leica DM 6000B荧光显微镜(配备×20物镜,数值孔径0.70)以单通道灰度图像形式拍摄。所用抗体详见表S1。
Western Blot
Western blot分析按照之前描述的方法进行,一抗信息见表S1。免疫检测采用增强型化学发光Western blot底物试剂盒(BL523A,BioSharp,北京,中国),并使用ChemiScope 6200 Western成像分析仪(上海勤翔科学仪器有限公司,中国)进行检测。
16S rRNA基因测序与分析
序列分析采用Uparse软件(版本7.0.1001,http://drive5.com/uparse/)进行。序列匹配度达到或超过97%的被聚类为同一个分类单元(OTUs),并为每个OTU选择一个代表性序列进行后续注释。通过参考序列数最少的样本对丰度数据进行标准化处理,并利用这些标准化数据集进行α多样性和β多样性分析。β多样性分析用于研究样本之间物种组成的差异。主坐标分析(PCoA)结果的可视化通过R(版本3.6.3)中的stats和ggplot2包实现。
代谢组学分析
在多组分析中,差异代谢物的筛选基于VIP评分(VIP > 1)和p值(p < 0.05,方差分析)。VIP评分是从正交偏最小二乘判别分析(OPLS-DA)的结果中提取。代谢组学分析结果通过R(版本3.6.3)实现。在进行OPLS-DA之前,数据经过对数转换(log2)和均值中心化处理。为防止过拟合,进行200次置换检验。代谢物通过KEGG化合物数据库(http://www.kegg.jp/kegg/compound/)进行注释,并进一步利用KEGG通路数据库(http://www.kegg.jp/kegg/pathway.html)进行通路分析。
B. subtilis的关键代谢产物筛选
首先,对“LPS + BS与LPS相比上调的差异代谢物(体内实验)”和“BS.sup与对照组相比上调的差异代谢物(体外实验)”进行联合分析,以寻找重叠的差异代谢产物;然后,我根据以下条件筛选关键代谢产物:匹配水平 < 3,匹配得分 > 0.7,VIP值 > 1.6,以及p值 < 0.05;此外,结合筛选到的代谢产物的丰度与紧密连接蛋白表达水平的相关性来进一步识别关键代谢产物。
实时定量聚合酶链反应(qPCR)分析
RNA提取、文库构建和qPCR的详细实验材料和操作步骤见补充材料。基因特异性引物序列见表S2。基因相对表达分析采用2-ΔΔCT法。
数据统计分析
统计分析利用SPSS软件(版本25.0,IBM公司,美国)和R(版本3.6.3)。分析结果利用GraphPad Prism 8.4软件(Prism公司)进行可视化,所有数据以均值±测量标准误(SEM)表示。两组之间的数据比较采用独立t检验,多组数据采用单因素方差分析(ANOVA)进行分析。详细的实验材料和操作步骤,包括样本收集与处理技术以及统计分析方法,见补充材料。
代码和数据可用性
本研究中的代谢组学数据已上传至中国国家生物信息中心/中国科学院北京基因组研究所的OMIX数据库(https://ngdc.cncb.ac.cn/omix/select-edit/OMIX008263 和 https://ngdc.cncb.ac.cn/omix/select-edit/OMIX008265),高通量16S rRNA扩增子测序数据已上传至中国国家生物信息中心/中国科学院北京基因组研究所的国家基因组数据中心的基因组序列档案库(https://ngdc.cncb.ac.cn/gsa/search?searchTerm=CRA021310)。数据和脚本可在GitHub上获得:https://github.com/lsqaa/iMeta。补充材料(方法、图表、表格、幻灯片、视频、中文翻译版本及更新材料)可通过在线DOI或iMeta Science(http://www.imeta.science/)获取。
引文格式:
Shiqi Liu, Peiran Cai, Wenjing You, Mingshun Yang, Yuang Tu, Yanbing Zhou, Teresa G. Valencak, Yingping Xiao, Yizhen Wang, Tizhong Shan. 2025. “Enhancement of gut barrier integrity by a Bacillus subtilis secreted metabolite through the GADD45A-Wnt/β-catenin pathway.” iMeta 4: e70005. https://doi.org/10.1002/imt2.70005
作者简介

刘事奇(第一作者)
● 浙江大学动物科学学院在读博士研究生。
● 研究方向为动物分子营养与肠道稳态及猪肉品质调控,以第一作者(含共一)在国际著名期刊iMeta、Matter、Food Hydrocolloids以及本领域国际TOP期刊Animal Nutrition和Meat Science等发表SCI论文7篇。

单体中(通讯作者)
● 浙江大学长聘教授、博士生导师,浙江大学动物科学学院副院长。
● 主要从事分子营养与动物糖脂代谢和肉品质调控等方面的研究,承担国家级人才、国家优青、国家重点研发课题等国家级项目10余项,在Matter、Nature Communications、Journal of Cachexia Sarcopenia and Muscle、Food Hydrocolloids、Research、Journal of Animal Science and Biotechnology、Animal Nutrition、Meat Science等上发表学术论文120余篇;连续入选全球前2%顶尖科学家榜单;授权国家发明专利15项、软著9项;获2022年中国产学研合作创新奖1项,作为主要完成人获浙江省自然科学一等奖等省部级一等奖4项、二等奖1项;共同制定国家标准2项、行业/团体标准3项;主编/副主编专著教材3部、参编2部。目前为Scientific Data、Journal of Animal Science and Biotechnology、Animal Nutriomics等期刊编委以及60余种期刊审稿专家。
更多推荐
(▼ 点击跳转)
iMeta | 引用16000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 兰大张东组:使用PhyloSuite进行分子系统发育及系统发育树的统计分析
iMeta | 唐海宝/张兴坦-用于比较基因组学分析的多功能分析套件JCVI
iMeta封面
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
3卷2期
3卷3期
3卷4期
3卷5期
3卷6期
4卷1期
iMetaOmics封面
1卷1期
1卷2期
2卷1期
期刊简介
“iMeta” 是由威立、宏科学和本领域数千名华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表所有领域高影响力的研究、方法和综述,重点关注微生物组、生物信息、大数据和多组学等前沿交叉学科。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括中英双语图文、双语视频、可重复分析、图片打磨、60万用户的社交媒体宣传等。2022年2月正式创刊!相继被Google Scholar、PubMed、SCIE、ESI、DOAJ、Scopus等数据库收录!2024年6月获得首个影响因子23.8,位列全球SCI期刊前千分之五(107/21848),微生物学科2/161,仅低于Nature Reviews,学科研究类期刊全球第一,中国大陆11/514!
“iMetaOmics” 是“iMeta” 子刊,主编由中国科学院北京生命科学研究院赵方庆研究员和香港中文大学于君教授担任,是定位IF>10的高水平综合期刊,欢迎投稿!
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science











































 109
109

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








