背景:阿尔茨海默病(AD)是最常见的与年龄相关的痴呆症,它促使记忆、思维和社交技能的衰退。痴呆的初期阶段可能与轻微症状相关,而症状向更严重状态的进展在患者之间是异质的。最近的研究表明,功能网络映射有助于预测症状进展的潜力。然而,这些研究主要使用了静息态功能磁共振成像中的静态功能连接(sFC)。最近,动态功能连接(dFC)作为功能连接方法学的重要进步,已被认识到能够区分健康和疾病人群的大脑网络动态。
方法:我们应用群体独立成分分析从1385名不同阶段AD症状的个体中提取认知控制网络(CCN)内的17个成分。我们估计了CCN内17个成分之间的dFC,随后将dFC聚类为3种重现的大脑状态,并估计了每个受试者的隐马尔可夫模型和占用率。然后,我们研究了CCN dFC特征与AD进展之间的联系。此外,我们研究了sFC与AD进展之间的联系,并将其结果与dFC结果进行了比较。
结果:AD症状的进展与额中回内部连接的增加相关。此外,非常轻微的AD(vmAD)在顶下小叶内部(在sFC和dFC中)以及该区域与CCN其余部分之间(在dFC分析中)显示出较少的连接。我们还发现,随着AD进展,额中回内部连接在sFC(静态功能连接)和dFC结果中均有增加。最后,与vmAD相比,我们发现正常大脑在额中回内部连接较低且海马体与CCN(认知控制网络)其余部分连接较高的状态下花费的时间显著更多,这突显了在这种疾病中评估大脑连接动态的重要性。
结论:我们的结果表明,AD的进展不仅改变了CCN(认知控制网络)连接强度,还改变了这个大脑网络中的时间属性。这表明CCN的时空模式作为一种生物标志物,区分了AD的不同阶段。本文发表在BRAIN CONNECTIVITY杂志。(可添加微信号19962074063或18983979082获取原文及补充材料,另思影提供免费文献下载服务,如需要也可添加此微信号入群)
关键词:阿尔茨海默病;认知控制网络;动态功能连接;静息态功能磁共振成像
声明:
通过假设功能连接随时间静态不变,许多以往的研究忽略了阿尔茨海默病(AD)进展中的大脑动态。在这里,我们使用纵向静息态功能磁共振成像数据来探索AD进展中认知控制网络功能连接的时间变化。这项研究的结果将增进我们对AD潜在机制的理解,并有助于未来这种神经障碍的治疗方法的发现。
介绍:
阿尔茨海默病(AD)是最常见的与年龄相关的痴呆症,影响65岁以上人群中的10-30%(Masters等,2015年)。它通常导致记忆、认知、日常功能和社交技能的衰退。AD通常缓慢地经历三个阶段:包括轻度认知障碍(MCI;早期阶段)、轻度痴呆(中期阶段)和重度痴呆(晚期阶段;Ryan和Rossor,2011年)。迄今为止,尚无治疗AD的方法,但一些干预措施,包括药物(Massoud和Léger,2011年)和非药物(Shigihara等,2020年;Zucchella等,2018年)治疗,可以减缓其进展,特别是在早期阶段被发现时(Yiannopoulou和Papageorgiou,2020年)。因此,预测AD的进展和区分这种疾病的不同阶段是对这种精神障碍进行早期医疗干预的关键步骤(Badhwar等,2017年;Brand等,2019年;Garam等,2019年;Gupta等,2019年;Kruthika等,2019年;Wang等,2019b年)。此外,鉴于痴呆的初期阶段在患者间表现出异质性症状,识别有从MCI进展到早期或晚期痴呆风险的个体是具有挑战性的(Komarova和Thalhauser,2011年)。
近年来,从静息态功能磁共振成像(rs-fMRI)获得的功能连接(FC)已显示出对基于大脑网络连接的当前和未来AD的预测敏感性(Badhwar等,2017年;Brier等,2014年;Wang等,2007年,2019b年;Zhao等,2020年)。大量与AD相关的文献集中于默认模式网络(DMN)FC的破坏,而其他大脑网络则被忽视(Agosta等,2012年;Balthazar等,2014年;Miao等,2011年;Zhong等,2014年)。然而,像认知控制网络(CCN)这样的其他大脑网络在AD进展中很少被研究。正如以前的研究所显示的,CCN(认知控制网络)包括:顶下小叶、额下回、额中回、海马、岛叶、中扣带皮层和额上回,它们参与执行功能,包括工作记忆、内部和外部导航以及注意力(Breukelaar等,2017年;Dhanjal和Wise,2014年;Han等,2018年;Wang等,2019a年;Westerhausen等,2010年),这些在AD中受损(Masters等,2015年)。例如,最近的一项研究表明,AD患者在执行工作记忆任务时,与正常受试者相比,额上回、额中回和顶叶区域的激活更多(Yetkin等,2006年)。另一项研究发现,从正常到MCI的进展中顶下小叶厚度发生变化(Greene和Killiany,2010年)。另一项研究显示,AD患者的海马体与其他大脑区域之间出现断连(Allen等,2007年)。因此,我们假设研究这个大脑网络将揭示有关AD的基本神经机制及其纵向进展的有用信息。
与传统的静态FC(sFC)不同,后者代表整个扫描过程中平均的大脑连接,动态FC(dFC)指的是时间序列子间隔内的大脑连接(Calhoun等,2014年)。近年来,来自rs-fMRI时间序列的dFC在不同神经障碍,包括精神分裂症(Dong等,2019年;Sendi等,2020a,b年)、重性抑郁障碍(Zendehrouh等,2020年)和AD(Fiorenzato等,2019年;Fu等,2019年)的潜在大脑连接模式方面被证明极具信息性。此外,从dFC获得的特征被证明比其sFC(静态功能连接)对应物更敏感于大脑障碍,例如,在将健康受试者与患者进行分类时(Rashid等,2016年;Vergara等,2018年)。任何与大脑障碍相关的认知缺陷和临床症状可能不仅取决于特定大脑区域对之间连接的强度,还取决于这些区域连接的时间变化模式。
在这项工作中,我们利用纵向静息态功能磁共振成像(rs-fMRI)数据(LaMontagne等人,2019年),预测AD中CCN的动态功能连接(dFC)及其与行为评分的相关性,可以阐明这种神经障碍的病理生理机制。更具体地说,我们假设不同AD阶段的认知状态可以与这组受试者中CCN dFC所表现的时间波动相联系。为了找到这种联系,我们利用滑动窗口方法,随后通过k均值聚类来识别一组连接状态,以研究CCN内的dFC(Allen等人,2014年)。我们探索了AD症状严重程度与特定状态下CCN FC之间的联系。为了进一步研究和建模dFC的时间变化,我们估计了每个受试者的dFC占用率(OCR)。接下来,我们通过对估计的OCR特征进行统计分析,探索了这些特征与认知评分之间的联系。最后,我们研究了CCN sFC(静态功能连接)特征与AD症状严重程度之间的联系,并将其结果与dFC结果进行了比较。
方法
在这项研究中,相关伦理委员会授予了伦理批准,根据华盛顿大学医学院机构审查委员会的规定,在扫描前从每个受试者处获得了知情同意。
参与者
数据来自开放获取成像研究系列-3队列,包含1098名参与者的成像和相关临床数据。这些数据是在华盛顿大学奈特阿尔茨海默病研究中心进行的几项持续研究中收集的,时间跨度为15年。本研究使用了1385次rs-fMRI以及扫描时的临床和人口统计信息(来自910名受试者),年龄范围为42-95岁(LaMontagne等人,2019年)。临床痴呆评分量表总分(CDR-SOB)用于评估扫描时参与者的认知阶段。所有受试者在临床核心评估时的CDR必须≤1,一旦参与者达到CDR=2或CDR-SOB>9,他们就不再符合研究资格(LaMontagne等人,2019年)。使用CDR-SOB,我们将所有受试者分为两组,包括健康对照组或HC(CDR-SOB=0)和非常轻微的AD或vmAD(CDR-SOB>0;O’Bryant等人,2008年)。总共,我们有1028次HC扫描和357次vmAD患者扫描。人口统计信息在表1中提供。
表1. 人口统计和临床信息

CDR-SOB,临床痴呆评分量表总分;F,女性;HC,健康对照组;M,男性;MMSE,简易精神状态检查;vmAD,非常轻微的阿尔茨海默病。
数据采集
MRI数据是从两台TIM Trio 3T扫描仪上收集的,这些扫描仪配备了20通道头部线圈和泡沫垫稳定器,后者放置在耳朵旁边以减少运动(西门子医疗)。使用回波平面成像(EPI)序列采集高分辨率T2*加权功能图像,其中回波时间=27毫秒,重复时间(TR)=2.2秒,翻转角度=90°,切片厚度=4毫米,切片间隙(中心到中心)=4毫米,矩阵大小=64,视野=256×256×128立方毫米。扫描持续时间为6分钟。
数据处理
我们使用MATLAB2019环境中的统计参数映射(SPM12)处理fMRI数据。在预处理之前,丢弃了前5个扫描时间点,并对fMRI数据进行了切片时间校正。为了考虑受试者头部运动,我们使用了刚体运动校正。接下来,成像数据进行了空间标准化,以适应蒙特利尔神经学研究所空间中的EPI模板,并重采样为3×3×3立方毫米。最后,我们使用高斯核以半高全宽6毫米平滑处理了fMRI图像。
我们使用了NeuroMark自动独立成分分析(ICA)流程,该流程使用先前得出的成分(区域)图作为先验,进行空间约束的ICA(Du等人,2019年),以提取可靠的CCN独立成分或成分。在NeuroMark中,通过匹配来自两个大样本HC数据集的群体级空间图来识别可复制的成分。如果成分在CCN内的灰质中显示出峰值激活,则被识别为有意义的区域。识别了十七个数据驱动的CCN成分。这些成分显示在表2中。
表2 成分列表

功能连接估计
对于每个受试者,i=1.....N,通过滑动窗口方法估计了17个CCN成分的dFC,如图1所示。通过将矩形(窗口大小=20;TRs=44秒)与高斯(σ=3s秒)卷积得到的锥形窗口被用于在每个时间点定位数据集。基于皮尔逊相关性计算的相关矩阵被用来测量CCN成分之间的dFC(图1中的步骤1)。每个受试者每个窗口的dFC估计被串联起来,形成一个(CxCxT)数组(其中C=17表示成分数量,T=139窗口),代表了随时间变化的CCN成分之间大脑连接的变化(Calhoun等人,2014年)。此外,我们通过计算17个CCN成分之间的皮尔逊相关性来计算每个受试者的sFC(静态功能连接)。有了17个CCN成分,我们估计了136个连接特征(图1中的步骤1)。
聚类和潜在特征估计
我们应用k均值算法对dFC窗口进行处理,将数据划分为一组分离的簇。使用基于簇内与簇间距离比率的肘部准则,估计出最优质心状态数为三。这个最优数是通过在2到9之间搜索得到的。我们在聚类算法中使用欧几里得距离度量,并进行了1000次迭代(Allen等人,2014年;Calhoun等人,2014年)。聚类输出结果是所有受试者的三种状态和每个受试者的状态向量(图1中的步骤2)。接下来,为了使用状态向量模拟每个受试者的dFC时间变化,我们计算了每个状态中dFC的占用率(OCR)。OCR代表每个受试者占据给定状态的时间比例(图1中的步骤3)。从这三种状态中,我们为每个受试者计算了三个OCR特征。

图1. 分析流程。
步骤1:使用群体独立成分分析(group-ICA)识别了认知控制网络(CCN)中17个成分的时间序列信号。在CCN(认知控制网络)中识别出17个区域后,使用锥形滑动窗口对时间序列信号进行分段,然后计算功能连接(FC)。
步骤2:在向量化FC矩阵后,我们将它们串联起来,然后使用k均值聚类(k = 3)将FC分组为三个不同的状态。使用肘部准则来找到最优的k值。此外,这个聚类中使用了欧几里得距离度量。
步骤3:然后,基于每个受试者的状态向量,从每个受试者的状态向量中计算了占用率(OCR)特征,总共三个特征。接着,我们探索了特定状态连接特征与临床评分之间的联系。此外,我们研究了OCR与临床评分之间的联系。同时,我们计算了整个记录时间的皮尔逊相关性,以估计静态功能连接(sFC)。
CCN,认知控制网络;FC,功能连接;ICA,独立成分分析;OCR,占用率;sFC,静态功能连接。
统计分析
为了找到dFC特征(包括OCR)与每个状态中dFC的单元值以及简易精神状态检查(MMSE)得分之间的联系,我们使用了考虑年龄和性别的偏相关分析。我们对从每个受试者的17个CCN成分获得的136个特定状态的CCN特征与临床评分之间的联系,以及从每个受试者的状态向量获得的3个OCR特征与临床评分之间的联系进行了统计分析,分别进行。同样,我们使用了控制年龄和性别的偏相关分析,分析CCN sFC特征与MMSE之间的关系。所有p值(OCR的3个p值,特定状态CCN特征的136个p值和sFC CCN特征的136个p值)均经过Benjamini–Hochberg方法调整,以控制假发现率(FDR)(Benjamini和Hochberg,1995年)。
结果
临床和人口统计结果
健康对照组(HC)和非常轻微的阿尔茨海默病(vmAD)的平均CDR-SOB(临床痴呆评分量表总分)分别为0±0和2.59±1.92。HC和vmAD的平均MMSE得分分别为28.88±1.34和25.94±3.60。使用两样本t检验,我们发现HC和vmAD之间的MMSE存在显著差异(

)。HC和vmAD的平均年龄分别为69.83±8.64和75.18±7.77。使用两样本t检验,我们发现HC和vmAD年龄之间存在显著差异(t[1384] =-10.62,未校正
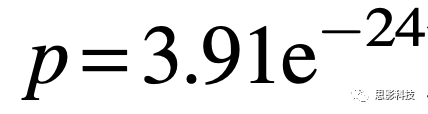
)。值得注意的是,由于组间存在显著的年龄差异,我们在本研究中进行的所有相关性分析中都控制了年龄和性别。
dFC状态概述
图2展示了通过k均值聚类识别出的三个重现的dFC状态,包括状态1、状态2和状态3。在所有状态中,顶下小叶、额下回、额中回和海马内的FC都是正的。在所有状态中,CCN的所有亚区域中,海马与CCN其余部分的连接性最低。此外,在所有状态中,状态1显示了海马体与CCN其余部分之间最强的负连接。值得一提的是,负相关通常不被视为噪声,而是在众多研究中被讨论和解释(Chai等人,2012年;Fox等人,2005年;Krishnamurthy,2015年;Wang等人,2007年;Williamson,2007年)。此外,与其他状态相比,状态2在额中回内的连接性最弱。这个状态相对于其他状态显示了海马体与CCN其余部分之间更多的连接。同样,状态3显示了额下回内最强的正连接。最后,我们测量了每个受试者在状态1、状态2和状态3中的OCR(占用率)。OCR代表每个受试者在每个状态中花费的时间。我们发现受试者分别在状态1、状态2和状态3中花费了33.68%、28.02%和38.30%的时间。此外,使用配对t检验,我们发现状态1和状态2的OCR之间(t[1384] = 4.62,FDR校正后p < 1e-4)、状态1和状态3之间(t[1384] = 3.73,FDR校正后p < 1e-4)以及状态2和状态3之间(t[1384] = 8.62,FDR校正后p < 1e-4)存在显著差异。

图2. dFC状态。使用k均值聚类方法识别的三个dFC状态。每个状态是一个17×17矩阵,其中正连接以热色显示,负连接以冷色显示。我们将所有17个成分放在9个区域,包括顶下小叶(IPL)、额下回(IFG)、额中回(MIFG)、海马体(HIPP)、岛叶(INS)、额内侧上回(SMFG)、辅助运动区(SMA)、额上回(SFG)和中扣带皮层(MCC)。在所有状态中,海马体都与CCN的其余部分显示出连接。然而,海马体与CCN其余部分的连接在状态2中更高。此外,状态3显示了额下回内最强的正连接。我们发现受试者分别在状态1、状态2和状态3中花费了33.68%、28.02%和38.30%的时间。
dFC,动态功能连接;HIPP,海马体;IFG,额下回;INS,岛叶;IPL,顶下小叶;MCC,中扣带皮层;MIFG,额中回;SFG,额上回;SMA,辅助运动区;SMFG,额内侧上回。
功能连接特征与MMSE之间的相关性
在每个状态中,我们平均了每个受试者所有dFC的连接特征。更具体地说,每个受试者在每个状态中都有多个dFC。然后,在每个状态中,我们使用每个受试者的dFC特征的平均值(即136个连接特征的平均值)作为其特定状态的FC。然后,我们通过控制年龄和性别计算了每个受试者的平均单元特征与MMSE之间的偏相关,以探索这些特征如何随着从HC阶段到AD阶段的进展而变化。这些结果显示在图3中。有希望的相关性(FDR未校正p < 0.05)用红色(正相关)和蓝色(负相关)显示。此外,通过FDR校正的显著相关性用星号标记。
在状态1中,我们观察到MMSE与顶下小叶至额下回的连接性之间存在正相关。我们还发现MMSE与额中回内的连接性之间存在负相关。
在状态2中,我们发现额中回内的连接性及其与额下回的连接性与MMSE呈负相关。
在状态3中,我们发现额下小叶与CCN其余部分(包括额下回、额中回、岛叶、额上回和中扣带皮层)之间的连接与MMSE呈正相关。与状态1和状态2一样,我们观察到额中回连接性与MMSE之间的负相关。
此外,我们探索了CCN(认知控制网络) sFC(静态功能连接)特征与MMSE之间的联系,如图3中最右侧面板所示。与dFC结果类似,我们发现AD进展减少了下顶叶小叶内的连接性以及下顶叶小叶与额上回之间的连接性。我们在sFC和dFC结果中发现了额下回内连接性与AD进展之间的类似模式。此外,我们发现AD进展增加了额下回内的连接性以及额下回与顶下小叶之间的连接性。

图3. 每个状态的FC和sFC与MMSE之间的相关性。
在每个状态中,我们平均了每个受试者所有dFC的单元特征,然后我们通过控制年龄和性别计算了每个受试者的平均单元特征与MMSE之间的偏相关,以探索这些特征如何随着从正常阶段到AD阶段的进展而变化。同样,我们探索了sFC特征与MMSE之间的联系。具有显著p值(p ≤ 0.05)的相关性用红色和蓝色突出显示。通过多重比较的显著组差异用星号标记(FDR校正,q = 0.05)。
IPL、IFG、MIFG、HIPP、INS、SMFG、SMA、SFG和MCC。AD,阿尔茨海默病;FDR,假发现率;MMSE,简易精神状态检查。
dFC时间模式与MMSE之间的相关性
为了找到MMSE与dFC时间特征(包括OCR(占用率))之间的联系,我们通过控制年龄和性别使用了偏相关分析。通过计算MMSE与OCR之间的相关性,我们发现状态2的OCR(代表在状态2中花费的时间)与MMSE呈正相关(图4;r = 0.073,FDR校正后p = 0.01,n = 1385)。这意味着症状更严重的受试者在状态2中花费的时间较少,而状态2显示了最低的额中回连接性。

图4,OCR与MMSE之间的相关性。状态2的OCR与MMSE之间的偏相关。
r = 0.073,FDR校正后p = 0.01,n = 1385。
讨论
最近的研究证明,从静息态功能磁共振成像(rs-fMRI)获得的大脑功能连接性极其动态,可以揭示许多疾病群体中大脑连接性的潜在机制差异(Damaraju等,2014年;Dong等,2019年;Fiorenzato等,2019年;Fu等,2019年;Garrity等,2007年;Miller等,2016年;Sun等,2019年;Zhi等,2018年)。此外,认知控制网络(CCN),在多种认知功能中发挥重要作用,似乎随着阿尔茨海默病(AD)的进展而退化(Dhanjal和Wise,2014年)。因此,在当前研究中,我们认为研究CCN功能连接性的时空模式将为AD的进展提供新的信息。更具体地说,我们研究了CCN的十七个数据驱动成分(包括顶下小叶、额下回、额中回、海马体、岛叶、中扣带皮层和额上回)的静态功能连接(sFC)和动态功能连接(dFC)。我们发现CCN中的功能连接性确实高度动态,代表了这种模式中功能协调的灵活性。然后,在每个状态中,我们使用FC特征与MMSE之间的偏相关来探索FC特征是否与认知评分有关。
AD进展对特定状态dFC和sFC的影响重叠
我们发现下顶下小叶内部的连接性在sFC和dFC(状态1和状态3)中与MMSE呈正相关,这意味着从正常状态到AD状态的进展中,顶下小叶的FC减少。神经影像学研究的一些证据暗示了顶下小叶在广泛的行为和功能中的作用,包括认知功能(Bzdok等,2016年;Caspers等,2013年;Wang等,2017年)。例如,之前的研究证实了下顶叶区域在维持注意力控制中的重要作用(Shapiro和Hillstrom,2002年)。报道了AD进展导致顶下小叶灰质体积减少(Greene和Killiany,2010年;Oishi等,2018年)。最近的一篇研究报告称,通过对下顶叶区域施加经颅直流电刺激,可以改善AD患者的工作记忆(Roncero等,2017年)。所有这些研究都强调了这个区域在AD进展中的作用。然而,顶下小叶的功能连接性研究不足。
在我们的研究中,使用相对较大的数据集并分析了sFC和dFC,我们发现随着AD的进展,顶下小叶的功能连接性受到影响,比本研究中研究的其他CCN区域更为显著,尤其是在AD早期阶段,从正常大脑到非常轻微的AD(vmAD)的进展中。因此,这个区域可能是未来AD研究的一个合理的大脑区域目标。然而,这种连接性在状态2中并未显示与MMSE的显著相关性。这种顶下小叶与CCN亚区域连接性的异常时空模式可能强调了研究dFC和在较短时间内分析FC的重要性。最近的一项研究显示了顶下小叶与默认模式、突显、执行控制和感觉运动网络之间的破坏模式(Wang等,2015年)。当前研究提供了关于顶下小叶与CCN其余部分之间破坏模式的新知识。
有趣的是,在sFC和dFC分析中,我们发现额中回内部连接性的增加与AD轻微症状的认知下降呈正相关。之前的研究通过显示AD患者额中回的更多激活,介绍了AD中神经资源的补偿机制(Woodard等,1998年)。在当前研究中,AD中额中回连接性的增加进一步支持了补偿机制,以减少CCN其他区域连接性下降对AD受试者的影响(Gaubert等,2019年)。
AD进展对特定状态dFC和sFC的影响差异
额下回在dFC分析中显示了破坏模式(增加和减少)。尽管我们发现所有三个状态中额下回与顶下小叶之间的连接性随着从健康到vmAD的进展而减少,但状态1和状态3中额下回与额中回之间的连接性在这一进展中增加。而在sFC分析中,我们发现AD进展只增加了额下回内部的连接性和额下回与顶下小叶之间的连接性,并且我们没有观察到像在dFC数据中发现的破坏模式(即增加和减少)。这种破坏模式提供了关于AD进展对CCN FC影响的信息层,只能通过dFC分析捕获。在一项试点研究中,通过经颅磁刺激刺激额下回以改善AD早期阶段的注意力。然而,结果在所有测试中并不一致且显著(Eliasova等,2014年)。我们发现额下回连接性有多种不同模式的结果进一步强调了评估AD干预潜力的额外研究的重要性,通过调节这些连接模式。
像顶下小叶和额下回一样,我们在dFC分析中观察到了额中回与CCN亚区域之间的连接性破坏模式,既有增加(仅在状态1中)也有减少(在所有三个dFC状态中)。而在sFC分析中,只有在分析sFC信息时,额中回与CCN其余部分之间的连接性随AD的进展而增加。当前研究使用了相对较大的样本量来展示额中回与CCN亚区域其余部分之间的连接性破坏模式,可能说明了在较短时间框架内研究功能连接性的重要性。
有趣的是,海马体在CCN所有区域中显示出较小的影响。这一结果与之前的研究一致,该研究表明海马体连接性在早发型AD中的变化较少(Park等人,2017年)。与CCN中的其他区域相比,这些证据可能表明海马体与CCN其他亚区域的连接性是AD影响的最后大脑区域之一。然而,之前的研究发现海马体与作为默认模式网络(DMN)一部分的后扣带皮层之间存在连接障碍(Grieder等人,2018年)。因此,我们的发现可能仅限于海马体与CCN亚区域之间的连接性,而海马体与CCN之外的其他大脑网络之间的连接性可能随着AD的进展而受到破坏。
AD进展调节CCN dFC
接下来,为了模拟dFC的时间模式,我们估计了OCR。此外,为了探索dFC的时间模式如何与认知相关,我们通过控制年龄和性别计算了OCR与MMSE之间的相关性。在这项分析中,我们发现状态2的停留时间与MMSE显示出显著且正相关。这意味着轻度受损和轻微症状的受试者倾向于在显示所有状态中额中回内部连接性最少的状态中停留的时间少于正常大脑。这进一步证明了疾病对调节CCN FC时间属性的影响。
此外,状态2显示了海马体与大脑其余部分之间相对较高的连接性。尽管我们没有发现海马体连接强度与临床评分之间的显著相关性,但AD进展的时间调节效应可能揭示了一些关于这种疾病对海马体的影响的新信息,即使是在疾病的早期阶段。这一发现可能突出了研究较短时间内功能连接性的重要性。以前的研究强调了AD对大脑FC时间模式的影响。一项涉及29名AD患者和31名HC受试者的研究发现,AD患者比HC受试者在一个连接模式稀疏的状态中花费更多时间,在这个状态中,运动网络与大脑的其余部分隔离。此外,同一项研究发现AD患者无法从低网络间连接的状态切换到更高连接的网络配置(Schumacher等人,2019年)。在另一项研究中,已经显示出帕金森病患者的dFC时间模式改变,与当前研究的结果一致(Fiorenzato等人,2019年)。在当前研究中,我们提供了关于AD进展改变CCN时间模式的新证据。
局限性和未来方向
这项工作存在一些局限性。MMSE通常用于测量AD不同阶段大脑的认知状态。然而,一些研究表明,MMSE在AD诊断中是一个噪声测量(Wang等,2015年)。窗口大小的选择是对动态行为的隐含假设,即短窗口捕捉更快的波动,而较长的窗口比较短的窗口平滑得更多。以前的dFC研究表明,30到60秒之间的窗口大小是捕捉dFC波动的合理选择,任何超过安全限制的窗口大小,即预处理的fMRI时间序列中存在的最大波长,都不会显著改变结果(Preti等,2017年)。此外,k均值聚类需要预先定义的知识来设置聚类参数,包括距离度量。通过应用不同的距离度量,我们没有观察到结果的显著差异;然而,应用其他聚类方法,如鲁棒连续聚类,将消除这个缺点,并可能改善聚类结果(Shah和Koltun,2017年)。
如前所述,之前的研究显示了海马体作为CCN的一部分与DMN在AD中的断连(Grieder等,2018年)。因此,需要对这种CCN与DMN之间的断连及其与AD进展的联系进行前瞻性研究。尽管在当前研究中我们关注基于先前知识在认知障碍中的CCN作用,但未来需要研究和方法,可以机械性地移除研究dFC中不相关的网络(Cohen等,2015年;Qiao等,2019年;Schlesinger等,2017年)。
结论
总结来说,我们通过比较正常状态和非常轻微的阿尔茨海默病(vmAD)的参与者,探索了认知控制网络(CCN)的静态功能连接(sFC)和动态功能连接(dFC)。我们发现AD进展对CCN亚区域的影响不同。它减少了顶下小叶内部的连接性(在sFC和dFC数据中都有)及其与dFC中其他区域的连接性。我们在dFC分析中发现额下回和额中回与CCN其他亚区域的连接性既有增加也有减少。而在sFC分析中,我们只观察到额中回连接性与CCN其余部分之间的连接性增加。此外,我们发现从正常到vmAD的进展减少了在额中回内部连接性较少且海马体与CCN其余部分连接性较高的状态中的停留时间。这一结果进一步支持了额中回在AD进展中的作用。有趣的是,虽然局部(单元格层面)的海马体模式没有受到AD进展的影响,但更全局(基于状态的)模式将CCN与海马体联系起来,显示出随着AD进展占用率降低。我们的结果表明,AD进展不仅改变了连接强度,还影响了大脑网络连接的时间属性。换句话说,我们的发现提出了CCN的时空模式作为AD的生物标志物,可根据症状严重程度区分患者。总的来说,由于sFC和dFC可能揭示AD进展对CCN连接性的不同方面,我们的结果表明分析sFC和dFC数据是有益的。























 6974
6974

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








