这项安慰剂对照的多模态[功能磁共振成像-脑电图(fMRI-EEG)]人脑成像研究提供了迄今为止对致幻剂急性脑作用最全面的观察。它评估了N,N-二甲基色胺(DMT),这是一种能产生沉浸式改变意识体验而不减弱清醒度的致幻剂。研究观察到全局超连接、分层组织的崩塌和网络内完整性的降低(fMRI),这与alpha能量的降低和熵的增加(EEG)相关。通过独立的正电子发射断层扫描(PET)数据确定的5-羟色胺2A受体表达最密集的区域受DMT影响最大,并与语言和语义处理等进化认知功能相关的区域重叠。这些结果支持了致幻剂影响大脑组织的主要轴线,以及与之相关的人类意识体验质量的观点。本文发表在PNAS杂志。
摘要
致幻剂引起了医学界的兴趣,但其对人脑功能的影响尚未完全理解。在一项全面的、受试者内、安慰剂对照设计中,我们获取了多模态神经影像[即EEG-fMRI(脑电图-功能磁共振成像)]数据,以评估静脉注射(IV) N,N-二甲基色胺(DMT)对20名健康志愿者大脑功能的影响。在20mg DMT和安慰剂分别静脉注射前、注射期间和注射后同时进行EEG-fMRI扫描。在与本研究剂量一致的情况下,DMT作为5-羟色胺2A受体(5-HT2AR)激动剂,能诱导深度沉浸和根本改变的意识状态。因此,DMT是探索意识体验神经相关性的有用研究工具。fMRI结果显示,DMT导致全局功能连接(GFC)显著增加,网络解体和去分离,以及主要皮层梯度的压缩。GFC×主观强度图与独立的PET衍生5-HT2AR图相关,两者都与暗示人类特有心理功能的元分析数据重叠。EEG测量的主要神经生理特性变化与各种fMRI指标的特定变化相关,丰富了我们对DMT效应神经基础的理解。本研究的发现在前期工作基础上进一步确认了DMT——以及可能的其他5-HT2AR激动剂致幻剂——主要作用于大脑的跨模态联合极,即与物种特定心理进步相关的、神经发育和进化上最近的皮层,该区域高度表达5-HT2A受体。
N,N-二甲基色胺(DMT)是一种经典的血清素能致幻剂,也是一种有用的意识探测工具。植物来源的DMT可能已在仪式和治疗环境中使用了数千年,而且,像其他致幻剂一样,合成产品现在正在作为药物加心理治疗组合的一部分进行临床试验,用于治疗抑郁症。DMT可以诱导一种强烈和沉浸式的改变意识状态,特征是生动复杂的想象,以及被传送到另一个现实或维度的感觉,而不会降低清醒度。在足够高剂量下,常见遇到有知觉的"存在"或"实体"的描述。这种本体论上令人震惊的体验被发现与随后的形而上学信念和心理健康的变化相关,并且已经对DMT体验的现象学与濒死体验和梦境状态进行了正式比较。
用于治疗各种心理健康状况的致幻剂治疗的临床试验已经产生了持续有希望的安全性和有效性结果。所谓经典致幻剂的标志性心理效应是通过5-羟色胺2A受体(5-HT2AR)激动作用引发的。大量收敛证据表明,5-HT2A受体激动是致幻剂治疗作用的触发事件,可能启动皮质可塑性过程,这些过程通过辅助心理支持得到利用。
大多数使用纯DMT的人类研究涉及静脉给药方式。以这种方式给药,该药物作用迅速——在~3分钟达到峰值,~15分钟后消退;这非常适合检查与快速进入和退出高度改变的清醒意识质量相关的大脑功能的快速变化。因此,DMT的人类功能神经影像学为推进我们对意识状态神经生物学的理解提供了独特的科学机会。
先前评估致幻剂大脑效应的功能磁共振成像(fMRI)研究结果显示,网络内功能连接(FC)或"完整性"降低,网络间FC增加或"分离"减少,大脑连接性谱系更大,全局超连接的大脑状态,大脑状态之间更自由的转换,以及主要感觉-联合皮层梯度的减少。重要的是,这些研究在致幻剂对人类大脑的跨模态联合皮层极(或"TOP")的作用上大致收敛。TOP位于皮层组织分层梯度的上端,而单模态感觉区域位于下端。TOP与抽象语义表征、更长的信息处理时间窗口相关,相对更脱离感觉输入,同时在灵长类皮层扩张和发展中也较晚出现。这些发现表明,致幻剂的主观效应取决于联合皮层的失调。神经影像学研究的证据还表明,这种皮层失调可能导致"较低"或进化和发展上"较早"系统(如所谓的边缘系统)的去抑制。
在本研究之前,只能对致幻剂效应下进行的电生理学和fMRI功能性大脑活动记录进行间接相关性分析;因此,本研究提供了同时获取然后相关这些数据的机会,同时利用DMT的短期作用。并行获取脑电图(EEG)和fMRI还使我们能够看到真正的神经元活动(即通过EEG数据),而不必通过可能被药物直接血管作用混淆的血流动力学信号[即fMRI血氧水平依赖(BOLD)信号]来推断。此外,EEG的高时间分辨率提供了可靠的方法,将致幻剂引起的节律和熵相关效应与fMRI捕获的大脑连接性同时变化联系起来。因此,EEG的包含使我们对致幻剂的神经元作用有信心。
在这项研究中,我们在静息状态条件下,通过在同时记录范式中结合fMRI和脑电图(EEG),推进了先前检查致幻状态神经相关性的工作。在闭眼、静息状态条件下,向健康志愿者静脉注射DMT(相对于安慰剂)。这种方法提供了重要的进展,因为它能够直接观察神经元活动的变化(EEG),同时观察通过fMRI血氧水平依赖(BOLD)信号看到的间接变化。此外,EEG-fMRI组合克服了每种模态在时间或空间分辨率上的限制——使得通过非侵入性当代人类功能神经影像学收集尽可能全面的大脑活动信息成为可能。
材料和方法
参与者和实验程序
这是一个单盲、安慰剂对照、平衡设计的研究。最初的访问是在帝国理工学院研究设施进行的,重点是评估身体和心理健康以确保适合性。排除标准包括:在参与时年龄小于18岁,MR禁忌症,无迷幻药物经验,对迷幻药物有不良反应,精神病或身体疾病史使其不适合参与(例如糖尿病、癫痫或心脏病),精神疾病家族史,或滥用酒精或药物。所有参与者都提供了书面知情同意书以参与研究。这项研究得到了伦敦国家研究伦理委员会和卫生研究局的批准,并按照修订后的赫尔辛基宣言(2000年)、国际协调委员会的良好临床实践指南和国家卫生服务研究治理框架进行。帝国理工学院赞助了这项研究,该研究是在家庭办公室许可下使用附表1药物进行的。
志愿者在帝国理工学院临床成像设施参加了两天的测试,间隔两周。在每个测试日,参与者到达并接受药物滥用测试,并参与两个单独的扫描会话。在最初的会话(无任务)中,他们接受静脉注射安慰剂(10毫升无菌盐水)或20毫克DMT(以富马酸盐形式溶解在10毫升无菌盐水中)-在30秒内注射,然后用10毫升盐水在15秒内冲洗-以平衡顺序(一半参与者接受安慰剂,另一半接受DMT)。第一个会话始终包括持续的静息态扫描,持续28分钟,DMT/安慰剂在第8分钟结束时注射,扫描在注射后20分钟结束。参与者躺在扫描仪中,闭上眼睛(使用眼罩防止眼睛睁开),同时记录EEG活动。扫描程序后,参与者接受采访并完成了设计用于评估扫描期间主观效果的问卷[视觉模拟量表和经过验证的量表:11维改变状态的意识问卷-ASC-11D和神秘体验问卷-MEQ-30]。然后是第二个会话,程序与初始会话相同(包括扫描条件),但在此次会话中,参与者(音频)提示每分钟在实时评估药物效果的主观强度,同时在扫描仪中。这些评级然后用于分析本报告。
本文报告了有关静息态扫描的结果,在这些扫描中没有要求强度评级,同时使用在其他(未分析)扫描运行中收集的强度评级作为动态fMRI和EEG分析的协变量。总共20名参与者完成了所有研究访问(7名女性,平均年龄= 33.5岁,标准差= 7.9)。
fMRI和EEG采集
图像在3T MR扫描仪(西门子Magnetom Verio syngo MR B17)上使用12通道头部线圈与EEG采集兼容。功能成像使用T2*加权BOLD敏感梯度回波平面成像序列[重复时间(TR)= 2000毫秒,回声时间(TE)= 30毫秒,采集时间(TA)= 28.06分钟,翻转角(FA)= 80°,体素大小= 3.0 × 3.0 × 3.0毫米3,35个切片,切片间距= 0毫米]。还采集了全脑T1加权结构图像。
EEG在MRI环境中在图像采集期间记录。EEG数据在31个头皮位置按照10到20惯例记录,使用MR兼容的BrainAmp MR放大器(BrainProducts,慕尼黑,德国)和MR兼容的帽子(BrainCap MR; BrainProducts GmbH,慕尼黑,德国)。该系统将所有电极参考到FCz,AFz用作接地电极。我们还记录了两个额外的ECG通道,以改善心率采集以在EEG预处理期间最小化伪影,并且所有阻抗都保持在20kΩ以下。EEG以5 kHz采样,并具有250 Hz的硬件低通滤波器。使用Brain Products SyncBox硬件确保EEG-MR时钟同步。在扫描仪外部,在DMT/安慰剂注射之前,额外记录了5分钟的闭眼静息态,以确定EEG活动在时间和频率域中的轮廓,并确保伪影最小化程序实现了类似的轮廓。
fMRI预处理
与之前的LSD研究一样,我们使用了相同的预处理流程。在20名参与者中,有4名由于在DMT注射后的8分钟内头部移动过大而被排除在组分析之外[>20%的清洗体积(scrubbed volumes),清洗阈值为帧间位移(FD)0.4]。另外3名参与者在达到整个28分钟扫描的20%清洗体积阈值后被排除在动态分析之外。
预处理步骤包括:1)去除尖峰[3dDespike,分析功能性神经影像(AFNI)];2)切片时间校正[3dTshift,AFNI];3)运动校正[3dvolreg,AFNI],通过将每个体积配准到与所有其他体积最相似的体积(内部代码);4)脑提取[BET,FSL];5)刚体配准到解剖扫描;6)非线性配准到2mm MNI脑[对称归一化,高级归一化工具(ANTS)];7)清洗-使用FD阈值0.4,并将清洗体积替换为周围体积的平均值。
额外的预处理步骤包括:8)空间平滑(FWHM)6 mm [3dBlurInMask,AFNI];9)带通滤波在0.01和0.08 Hz之间[3dFourier,AFNI];10)线性和二次去趋势[3dDetrend,AFNI(73)];11)回归出9个干扰回归因子[所有干扰回归因子都带通滤波与步骤9相同:其中6个与运动相关(3个平移,3个旋转),3个与解剖相关(未平滑)。具体来说,解剖干扰回归因子是:a)脑室[Freesurfer,在2 mm空间中侵蚀],b)引流静脉(DVs)[FSL的CSF减去Freesurfer的脑室,在1 mm空间中侵蚀],c)局部白质(WM)[FSL的WM减去Freesurfer的皮质下灰质结构,在2 mm空间中侵蚀]。关于局部WM回归,AFNI的3dLocalstat用于计算每个体素的局部WM时间序列的平均值,使用以每个体素为中心的25 mm半径球体]。
与头部运动相关的值(即帧间位移;FD)在DMT和安慰剂之间存在显著差异(P = 0.003)。虽然我们采用了显著的运动校正方法,但我们的发现仍可能受到运动的影响。为了进一步验证这些发现的鲁棒性,我们使用了一个子样本,其中8名参与者在使用相同的排除阈值(FD = 0.4)时没有显示出运动与连接性的关系。这个子样本是通过递归删除参与者直到DMT条件下欧几里得节点距离与运动与功能连接性之间的相关性不再显著为止(SI附录,图S10)。第二个子样本是通过使用更严格的排除方法FD = 0.2(SI附录,图S4)确定的,结果只有3名参与者。结果在两个分析中得到了广泛的复制(SI附录,图S2和S3)。
EEG预处理
使用BrainVision Analyser软件的平均伪影模板减法(AAS)算法去除梯度伪影(GA)。该算法计算基于21个TR窗口的滑动平均的代表性模板伪影,然后从每个TR窗口中减去它,从而去除大部分MR相关噪声。在梯度伪影校正后,数据被降采样到250 Hz,并通过放置心跳标记对应于R峰的ECG通道(低通滤波在15 Hz)来减少弹道心动图(BCG)伪影。使用AAS算法通过生成多个心脏周期的平均模板来校正脉冲伪影,然后从该周期中减去该模板。以下预处理步骤使用Fieldtrip软件进行:数据被去均值,带通滤波在1到45 Hz之间,并分段为单独的2秒试验。然后,数据被视觉检查,并删除与颌部紧张和粗糙伪影相关的试验。独立成分分析随后被执行以去除残余的BCG和GA伪影以及眼球运动。如果仍然观察到粗糙伪影,则删除相应的数据段,并再次运行ICA以获得更好的结果。通过比较扫描仪外EEG轮廓在时间和频率域中的结果以及扫描仪内数据来验证预处理结果。由于伪影过大,20名参与者中有2名被删除。此外,由于α分析是在固定的8到13 Hz窗口内执行的,因此一名参与者的α峰值在7.5 Hz的参与者被删除。我们必须丢弃(由于伪影)初始8分钟数据的25%的参与者被删除了主要的EEG结果,如图4所示。在考虑整个28分钟扫描时,没有其他参与者达到25%的阈值。与fMRI数据相比,EEG使用了更高的排除阈值,因为这是常规的,由于EEG具有更高的时间分辨率和信噪比。EEG-fMRI分析仅针对那些在fMRI和EEG排除阈值中幸存下来的参与者(n = 12)进行。
数据分析
网络内完整性(fMRI)
为了分析典型的静息态网络(RSN)的完整性,我们采用了Yeo等人广泛使用的七网络分区,包括视觉网络(VIS)、躯体运动网络(SM)、背侧注意网络(DAN)、腹侧注意或突显网络(SAL)、边缘网络(LIM)、额叶控制网络(FP)和默认模式网络(DMN)。
对于DMT和安慰剂扫描,通过对7个相关空间成分(网络)应用FSL的双重回归分析来确定每个RSN的网络内完整性。双重回归首先使用成分作为回归因子应用于每个受试者的四维(4D)BOLD数据集,得到每个IC(成分)的时间序列矩阵。然后,这些时间序列被回归到相同的4D扫描中,以获得每个受试者特有的空间图[参数估计(PE)图像]。对于每个受试者,在每个RSN中,计算了DMT/安慰剂扫描的平均PE,得到的PE代表了每个RSN的完整性。配对t检验用于计算每个RSN的条件之间的完整性差异(FDR校正多重比较)。
网络间分离(fMRI)
网络分离是使用与我们之前涉及LSD和裸盖菇素的工作相同的程序获得的。获得了代表7个感兴趣的RSN之间连接的静息态功能连接(RSFC)矩阵。将每对RSN的双重回归第一步的时间序列输入GLM,得到表示RSN对之间功能连接强度的PE值。GLM进行了两次,每个RSN在一个模型中作为因变量,在第二个模型中作为自变量,然后取平均值,为DMT和安慰剂生成两个7 × 7矩阵。通过对矩阵每个象限进行t检验(FDR校正多重比较)来确定DMT和安慰剂之间的差异。
成对功能连接(fMRI)
通过数据驱动的方法测试了DMT给药期间大脑区域对之间连接改变的程度。首先,通过获取与Schaeffer图谱相关的100个区域加上来自AAL图谱的12个皮层下区域的平均活动来降低fMRI数据的维度。然后,对DMT和安慰剂给药期间的112个区域中的每一对进行皮尔逊相关分析,得到每种条件下由112*112个连接(或"边")组成的连接矩阵。最后,对每条边进行配对t检验,得到DMT和安慰剂之间的差异(FDR校正多重比较)。
全局功能连接(fMRI)
全局功能连接是通过取大脑每个区域到所有其他区域的每个皮尔逊相关系数值的归一化Fisher Z分数的平均值获得的。为了减少统计检验的数量,我们考虑上述112个区域。网络水平的全局连接是通过平均对应于Yeo等人的七个网络中每个网络的所有Schaeffer分区的GFC(全局功能连接)值获得的。
动态功能连接(fMRI)
使用锥形滑动窗口方法计算动态连接矩阵。44秒(22 TR)的滑动窗口与6秒(3 TR)高斯核卷积,步长为2秒,获得整个28分钟会话的持续时间(8分钟基线加20分钟注射后)。为了研究GFC(全局功能连接)(每个区域)和成对连接(每条边)的动态变化,我们使用了DMT减去安慰剂会话的实时强度评分(也与6秒高斯滤波器卷积)。这些评分变化被应用于线性混合效应模型(每个脑区一个),使用GFC(或成对FC)时间序列(DMT减去安慰剂)作为响应变量,强度时间序列作为预测变量(截距和斜率作为随机变量,按受试者分组;FDR校正多重比较)。为了证实我们的发现,我们使用了与我们之前工作中20 mg剂量相对应的平均DMT血浆水平,而不是主观强度评分。
此外,我们还通过对每个时间点(即每个TR)进行成对t检验比较,探索了DMT效应时间过程中GFC(网络水平)变化发生的显著时刻。这项分析在全局和用于的7个静息态网络中的每一个上进行。通过时间聚类统计确定DMT和安慰剂之间平均GFC(全局和每个网络)的显著变化,这些统计是通过对每个受试者的时间序列的标签(DMT和安慰剂)进行置换获得的空分布计算的。
与血清素受体密度的重叠
通过取Schaeffer图谱加上AAL图谱的12个皮层下区域中每个区域的值,将动态GFC的变化与血清素受体密度进行比较,这些值来自动态GFC分析得出的线性效应模型。这是针对每个相应区域的5-HT2A受体密度图进行的,这些密度图来自Beliveat等人的研究。
频谱分析(EEG)
对于频谱分析,我们对预处理信号执行了不规则重采样自谱分析(IRASA),以分离振荡成分对频谱功率的特定贡献(与1/f活动分离),遵循之前的工作,考虑到通常与EEG上的1/f活动相关的混杂因素。然后将频谱划分为以下频带:delta(1至4 Hz)、theta(4至8 Hz)、alpha(8至13 Hz)、beta(13至30 Hz)和gamma(30至45 Hz)。对于时间平均谱活动,我们为DMT和安慰剂条件创建了注射前后各八分钟的数据块。两种条件的比较是在减去各自的基线(在注射前获得)后进行的,以消除顺序效应和与预处理程序相关的整体功率差异。对每个频带分别进行谱分析,并使用基于聚类的置换检验(7,500次置换)的t统计来确定DMT和安慰剂之间存在显著差异的通道。
信号多样性(EEG)
遵循我们之前涉及DMT的研究,以及那些使用LSD、裸盖菇素和氯胺酮进行的研究,我们使用Lempel-Ziv 1976算法进行了信号多样性分析。每个单电极的EEG信号使用其2秒时段的平均值进行二值化,然后使用LZ76算法生成唯一子序列的字典,其大小量化信号的时间多样性(此处表示为LZs)。使用Fieldtrip基于聚类的置换检验(7,500次置换)的t统计来确定显示DMT和安慰剂之间显著差异的通道。通道间的平均LZs在此表示为LZc。对于所有EEG指标的平均分析,从DMT和安慰剂条件中减去8分钟基线,以解释访问间信号质量的潜在差异。
谱活动和信号多样性的动态分析
我们通过计算每个频带的平均谱功率(和LZs)与每个时段(DMT减去安慰剂)、每个通道和每个受试者的Pearson相关系数来进行动态EEG分析。然后对结果值进行Fisher Z标准化,并使用基于聚类的置换检验(7,500次置换)的t统计与空分布进行比较,以确定每个频带和LZs的显著效应通道。通过时间聚类统计确立DMT和安慰剂之间的时间特定变化,这些统计是通过对时间序列的标签(DMT和安慰剂)进行置换获得的空分布计算的。置换是通过对数据进行循环旋转来完成的,因此保持每个时间序列的自相关和谱特性不变。在每次置换中,执行相同的算法并存储最大聚类统计值(即聚类内所有T分数的总和)。然后将这些值汇集在一起建立一个空分布,将原始聚类统计与之比较以评估其显著性。
皮层行波
我们使用与之前研究相同的分析方法量化行波的数量和方向。首先,我们将EEG信号分割成1秒的窗口,滑动步长为500毫秒。接下来,我们为每个时间窗口组成一个2D时间-电极图,堆叠五个中线电极(即Oz、POz、Pz、Cz和FCz)。然后我们对每个图进行2D快速傅里叶变换,从中提取上下象限的最大值,分别量化前向和后向波的功率[更多细节见Alamia等人的研究]。为获得替代基线,我们在随机化电极顺序100次后对每个图执行相同的分析。这种洗牌生成一个具有相同时间功率但没有空间信息(即波的方向性)的替代2D-FFT谱。最后,我们考虑2D-FFT中从每个象限提取的最大值与替代谱中100次重复的平均值之间的对数比,以分贝为单位量化前向和后向波的数量。重要的是,这个值量化了前向和后向波的数量,与没有皮层波的零假设相比。
EEG-fMRI分析
我们通过相关EEG活动的时间序列与之前DMT与安慰剂比较中显著的每个测量(delta、alpha、beta和gamma功率,以及LZ)来确定EEG和fMRI测量之间的关系。我们选择了在两种条件之间显示最高统计差异的电极,并随时间平均其活动及其相应的对侧对。分析中省略了缺失的时段(由数据清理导致),显示活动超过时间序列平均值5个标准差的时段被插值。数据在0.01至0.08 Hz进行带通滤波,并与规范血液动力学响应函数卷积,以匹配fMRI预处理。然后将结果时间序列与6秒高斯滤波器卷积,以匹配fMRI动态功能连接矩阵的处理。GFC和成对功能连接的时间序列以与上述相同的方式形成(动态功能连接)。12名受试者的数据在EEG和fMRI的全部28分钟内均通过预处理程序。使用线性混合效应模型进行统计分析,以EEG时间序列作为响应变量,每个脑区的GFC(全局功能连接)时间序列作为预测变量(截距和斜率作为随机变量,按受试者分组;FDR校正多重比较)。线性混合效应模型的使用使我们能够利用DMT诱导的大脑指标的被试内变异性来找到这些之间的有意义关系(图5)。相反,当在进行被试间相关之前采用时间序列的平均方法(忽略被试内变异性)时,这些关系不太明显(补充信息,图S8和S9)。
皮层梯度
皮层梯度是使用BrainSpace工具箱计算的。为了提高计算效率,表面首先从fsaverage 5空间下采样到10,000个顶点。对于每个受试者,通过计算所有顶点之间的成对Pearson相关性来计算10,000 × 10,000的连接矩阵。如同之前所做的,该矩阵经过z变换,并按行以90%的稀疏度进行阈值处理,以仅保留最强的连接。然后对阈值化的z矩阵计算余弦相似度,以生成捕捉顶点之间全脑连接模式相似性的相似度矩阵。这个相似度矩阵是我们在此使用的扩散映射嵌入算法所需的输入。使用余弦相似度作为首选的相似度度量与过去的工作一致。
扩散映射嵌入,一种来自图拉普拉斯家族的非线性流形学习技术,被应用于相似度矩阵,以识别个体受试者水平的梯度成分。该技术从高维相似度矩阵中估计一组低维嵌入成分(梯度),其中每个嵌入可以直观地视为FC模式相似性协方差的一个维度。在嵌入空间中,通过许多连接或几个非常强的连接强烈连接的顶点(由FC模式相似性加权)更接近,而几乎没有连接或没有连接的顶点更远。嵌入空间中两点之间的欧几里得距离等同于以这些点为中心的概率分布之间的扩散距离(因此算法得名),每一个都等同于正文中提到的"梯度得分差异"。该算法由单个参数α控制,α控制流形上采样点密度的影响(α = 0,最大影响;α = 1,无影响)。扩散映射嵌入特别以α = 0.5为特征,这允许在估计嵌入空间时考虑数据点之间的全局和局部关系。
遵循过去的工作,为了实现跨受试者的比较,执行了Procrustes旋转(编者注:Procrustes旋转是一种数学方法,用于将一组几何形状或数据点与另一组进行最佳匹配。在这个脑成像研究的上下文中,Procrustes旋转被用来对齐不同受试者的脑功能梯度数据)以将个体受试者的嵌入(梯度)成分与所有受试者的组平均嵌入成分模板对齐。这种旋转确保了跨受试者的梯度轴匹配。使用SurfStat工具箱中实现的基于表面的线性模型进行组间对比和行为关联分析。
结果
功能磁共振成像(fMRI):静态静息态功能连接(sRSFC)
20名参与者(平均年龄33.5岁,标准差7.9,7名女性)接受了高剂量(20毫克)的DMT富马酸盐和安慰剂,采用受试者内、平衡、伪随机设计。同步fMRI和EEG记录从注射DMT/安慰剂前8分钟开始,持续到注射后20分钟(主观效应见SI附录,图S1)。为确定DMT对大脑连接的影响,我们使用fMRI BOLD信号分析了注射DMT/安慰剂后8分钟内平均的静息态功能连接(RSFC),这与主观强度峰值时间一致。为了将这种时间平均分析方法与更动态的指标区分开来,我们将其命名为"静态"RSFC或"sRSFC"。对于网络内RSFC或完整性和网络间RSFC或分离,我们使用独立成分分析(ICA)推导出一组典型的静息态网络(RSNs),然后使用"双回归"方法检查RSFC变化。为补充这些分析,我们计算了全局功能连接(GFC),它反映了给定区域与大脑所有其他区域的平均RSFC(即相关性)(详见材料和方法)。
与安慰剂相比,DMT显著降低了所有典型RSNs的网络内完整性(P < 0.05,FDR校正),但突显(SAL)和边缘(LIM)网络除外。在突显、额顶叶(FP)和默认模式网络(DMN)中发现GFC显著增加(P < 0.05,FDR校正)(图1A),与人脑主要RSFC梯度的跨模态联合皮层极(或TOP)重叠(36)。此外,发现DMT降低了网络间分离,特别是额顶叶、突显和默认模式网络(图1B)(P < 0.05,FDR校正),再次涉及跨模态极。

图1.DMT导致RSN完整性和分离减少,GFC增加。
(A) DMT(红色)与安慰剂(蓝色)的网络内sRSFC或完整性分析(参数估计和Fisher Z值)显示,7个网络中有5个网络的完整性显著降低,7个网络中有3个网络的全局功能连接(GFC)增加(FDR校正,P < 0.05)。
(B) 网络间分离的减少在FP/DMN/SAL或TOP网络与其他网络之间尤为明显(*P < 0.05,FDR校正)。
(C) GFC的增加在与人脑主要梯度TOP相关的区域尤为明显(P < 0.05,FDR校正)。补充分析见SI附录,图S2和S3(不含运动混淆)和SI附录,图S5(使用全局信号回归)。
(D) 用于分析的网络(sRSFC = 静态静息态功能连接);网络;VIS = 视觉;SM = 体感运动;DAN = 背侧注意;SAL = 腹侧注意/突显;LIM = 边缘;FP = 额顶叶;DMN = 默认模式;TOP = 跨模态联合极)。
对个体脑区GFC的分析[遵循Schaefer等人的区域划分]证实了TOP(跨模态联合皮层极)区域的超连接性(P < 0.05, FDR校正)(图1C)。最后,与安慰剂相比,DMT条件下的全脑GFC(即所有区域的平均GFC)显著增加[t(15) = 3.11, P = 0.007, 95% CI = [0.028 0.15]]。
由于潜在的头部运动混淆,我们使用两个不同的参与者子样本(没有显著运动混淆)重复了静态RSFC分析(材料和方法)。发现与本文主要结果部分报告的结果一致(SI附录,图S2和S3),在这两个子样本中,DMT和安慰剂之间的头部运动没有显著差异(SI附录,图S4)。此外,应用全局信号回归(GSR)后,我们发现结果一致(SI附录,图S5)。在所有分析中,都观察到DMN和背侧注意网络(DAN)的解体;DMN和FP网络的GFC普遍增加;在内侧前额叶皮层、背外侧前额叶皮层、岛叶和颞顶联合区发现区域GFC增加。
fMRI: 动态静息态功能连接(dRSFC)
为了更好地研究DMT对大脑功能的动态影响,我们将实时口头报告的主观强度评分(材料和方法)与通过滑动窗口方法测量的动态功能连接(dRSFC)进行了映射。计算了GFC(每个区域和每个网络)和成对功能连接指标(每个连接;详见材料和方法)。发现DMN/FP/SAL/LIM GFC与实时强度评分之间存在显著正相关(P < 0.05, FDR校正),即DMN/FP/SAL/LIM GFC增加与更大的强度相关。强度评分与大脑各区域之间的成对连接广泛存在显著正相关;然而,强度与视觉(VIS)-体感运动(SM)/皮层下区域的成对连接之间存在负相关(P < 0.05, FDR校正)(图2A)。补充这些结果,选择性dRSFC变化与DMT的平均血浆浓度水平之间也观察到相关性(图2B)。
图2.DMT下大脑RSFC的动态变化
(A,左)显示DMT减去安慰剂后实时强度评分与动态全局功能连接(GFC)之间显著相关的区域(P < 0.05, FDR校正)。(A,中)DMT相对于安慰剂对网络GFC的动态影响,显示DMN/FP/SAL网络的GFC显著增加—所有这些都与大脑主要功能梯度的TOP相关,以及LIM网络(*P < 0.05, **P < 0.01, ***P < 0.001; FDR校正)。(A,右)成对功能连接(FC)矩阵,表示强度评分与动态功能连接之间的关联(显著连接在下对角线中突出显示;FDR校正)。
(B)显示DMT血浆水平与区域GFC、网络GFC和成对FC显著相关的区域(FDR校正)。(C,左)安慰剂、DMT条件下区域GFC随时间的变化。
(C,右)DMT减去安慰剂的结果,叠加报告的平均强度评分(±SEM)。黑框突出显示网络GFC变化统计显著的时期(聚类校正,P < 0.05)。
(D)DMT/安慰剂给药后前七分钟的平均(DMT-安慰剂)成对FC矩阵。
(E)5-HT2AR密度图与动态GFC(表示GFC与强度评分关系的beta值)之间发现显著相关。(网络: VIS = 视觉; SM = 体感运动; DAN = 背侧注意; SAL = 腹侧注意/突显; LIM = 边缘; FP = 额顶叶; DMN = 默认模式; SC = 皮层下区域; TOP = 跨模态联合极)。
关于具体动态,与安慰剂相比,DMN和FP的GFC增加在DMT注射后最初几分钟(约1-6分钟)最为显著(P < 0.05,聚类校正)(图2C)。成对连接分析显示,在第一分钟内,大多数脑区的GFC增加,而从第二分钟开始,低级单模态感觉和运动区域之间的分离变得更加明显(图2D)。
根据之前对人类的正电子发射断层扫描(PET)成像工作,得出了5-HT2A受体的平均结合潜能或"密度"图。研究了这种体内图与本研究的动态GFC结果之间的关系。结果显示,5-HT2A受体密度与以强度评分为解释变量的GFC回归模型之间存在显著的正相关关系。这一结果暗示DMT诱导的5-HT2AR刺激对GFC增加及其与精神致幻状态主观强度的关系有(逻辑上的)因果效应(图2E)。
最后,利用NeuroSynth工具(一个与功能术语相关的大脑激活坐标数据库),我们研究了GFC和5-HT2A受体密度图与功能之间的关联。SI附录图S6显示了与GFC和5-HT2A受体图最密切相关的前30个(非解剖学)功能术语(见SI附录图S7,了解心理测量指标与成像指标之间的探索性相关)。这两张图都强调了高级认知和语言功能,符合DMT对人脑主要梯度TOP的根本影响。
fMRI: 主要皮质梯度
鉴于DMT似乎对全脑组织有根本性作用,我们进而直接研究了大脑主要感觉运动到联合皮层梯度的变化。结果显示DMT对全脑有作用,更具体地说,大脑的主要或基本感觉-联合轴或梯度被压缩。为执行此分析,我们按照之前的工作应用了梯度映射分析。如材料和方法中所述,这种方法涉及应用非线性降维算法—"扩散图嵌入"。该算法的输入是受试者间区域FC相似性矩阵,其中每个值代表两个给定区域之间全脑FC的相似性。该算法的输出是皮质上连续变化的"梯度",每个梯度代表功能连接(不)相似性的特定轴。值得注意的是,这种方法揭示的主轴代表了一个从低级感觉运动极到高级跨模态联合皮层极(我们在此称之为TOP)的层级轴。人类大脑功能、解剖、发育和进化的大量特性似乎与这种感觉运动到联合皮层梯度相匹配。在目前的结果中,高级TOP(跨模态联合皮层极)区域显示梯度分数降低(与向零移动一致),而低级单模态区域显示梯度分数增加(与向零移动一致)—解释了整体轴的压缩(图3 A和B)。基于网络的分析进一步阐明了这种皮质层级的压缩,单模态感觉网络(如体感运动;SM和视觉;VIS)以及DAN内的梯度分数增加,而FP、DMN和LIM内的分数减少(图3C)。这些分析暗示大脑中单模态-跨模态分化和宏观尺度层级组织的减少(图3D)。
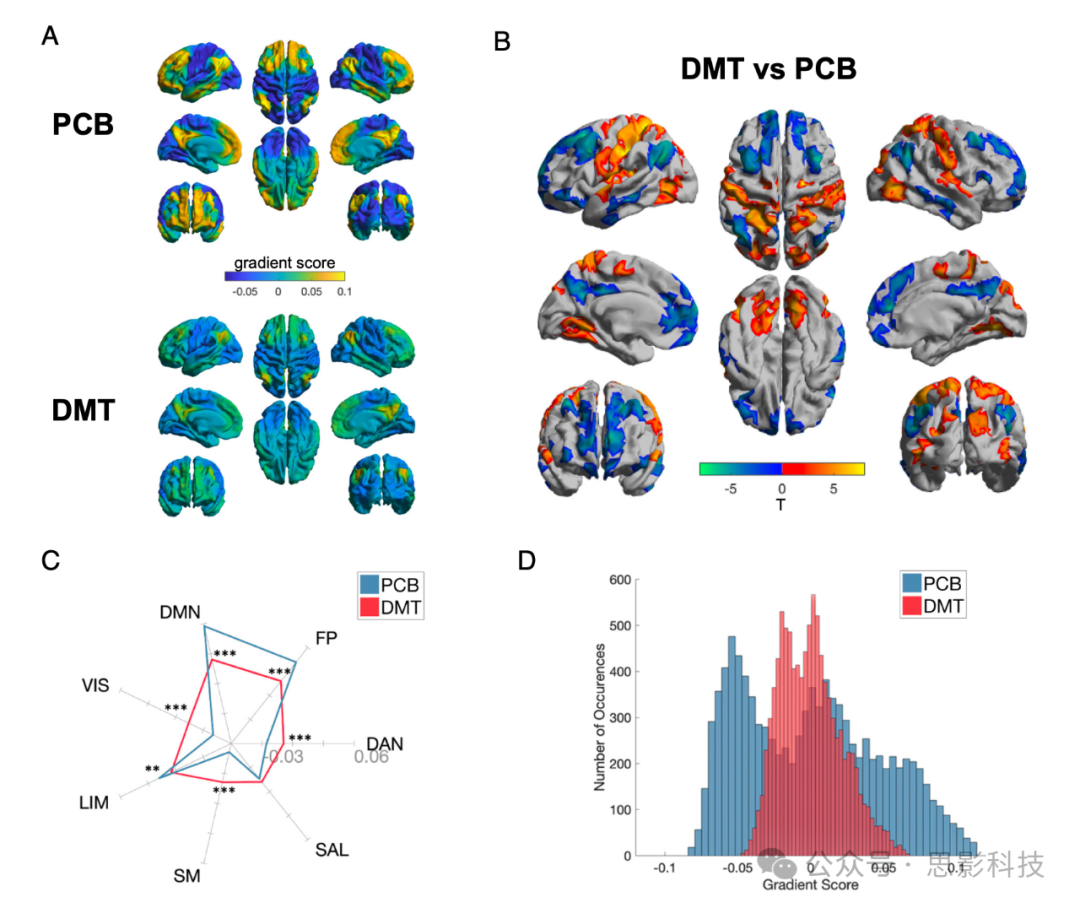
图3.DMT下主要梯度的压缩
(A)安慰剂(上)和DMT(下)条件下的平均主要梯度,代表从单模态到跨模态皮层的主轴。
(B) DMT > 安慰剂组间顶点间(上)和(C)网络间(下)对比。网络间径向图显示DMT和安慰剂条件下每个网络的平均网络内主要梯度分数(*P < 0.05, **P < 0.01, ***P < 0.001; FDR校正)。
(D)直方图显示安慰剂和DMT条件下每个脑区主要梯度值的分布。(网络: VIS = 视觉; SM = 体感运动; DAN = 背侧注意; SAL = 腹侧注意/突显; LIM = 边缘; FP = 额顶叶; DMN = 默认模式)。
EEG:频谱功率、信号多样性和皮质行波
DMT对EEG测量的脑活动的影响包括静态(注射后8分钟的平均值)、动态(强度评分vs EEG测量)和时间分辨(用于检测显著差异期)分析。在所有三种情况下,DMT下记录的数据都与安慰剂下记录的数据进行了对比(详见材料和方法)。与之前DMT研究结果一致,静态分析显示DMT下alpha功率广泛下降(P < 0.01,聚类校正),delta(P < 0.05,聚类校正)和gamma频带(P < 0.01,聚类校正)均有增加。此外,与安慰剂相比,DMT条件下通过Lempel-Ziv复杂度(以下简称"LZc"表示全局平均值,"LZs"表示单通道)确定的信号多样性广泛增加(P < 0.01,聚类校正)(图4 A和B)。此外,动态分析(强度vs EEG测量)证实了这些发现,并进一步揭示了实时强度评分与delta功率和LZc变化之间的正相关,即更强烈的体验与delta功率和LZc的更大增加有关。全局alpha和后部beta功率变化与主观强度之间也观察到负相关,更强烈的体验与alpha和beta功率的更大降低有关(P < 0.05,聚类校正)(图4C)。

图4.DMT对EEG频谱功率和信号多样性的影响
(A) DMT诱导的alpha功率广泛降低以及信号多样性(通过Lempel-Ziv[LZ]估计)、delta和gamma功率增加。
(B)全脑功率谱和信号多样性(LZc)显示条件间一致的差异。
(C)逐分钟强度评分与delta功率和LZs增加呈正相关,与全局alpha和后部beta功率变化呈负相关(•P < 0.01, ºP < 0.05,聚类校正)。
(D) DMT对delta和alpha功率以及LZc的时间分辨效应(阴影区域对应条件间统计差异的时期,P < 0.05,聚类校正)。绿色轨迹反映随时间变化的平均主观强度评分。
(E)在DMT与安慰剂的对比中观察到显著的后向波(BW)功率和增加的前向波(FW)功率(每个条件都经过基线校正)。
(F) LZc与"体验丰富度"之间的相关性。LZs = 每通道Lempel-Ziv;LZc = 跨通道平均Lempel-Ziv。
关注特定统计显著性时期,alpha功率降低(~0至8分钟,P = 0.001,聚类校正)和LZc增加(~2至14分钟,P = 0.001,聚类校正)与安慰剂分离的整体体验比例大于delta功率增加—后者仅在起始阶段分离(~0至4分钟,P = 0.006,聚类校正)(图4D)。此外,在DMT给药后的第一分钟观察到边缘显著的beta功率降低(~0至1分钟,P = 0.04,聚类校正)。
额外分析发现DMT下后向行波功率显著降低,前向行波功率增加,与之前的结果一致(图4E)。最后,与强先验假设一致,信号多样性(注射后8分钟的平均值)与视觉模拟量表项目"你的意识体验有多丰富"的评分相关(r = 0.7, P = 0.008;图4F)。
EEG和fMRI的并行变化。
利用本研究独特的EEG和fMRI数据同步记录,分析了delta、alpha、beta和gamma频带活动以及全局信号多样性(LZc)的时间过程,结合fMRI功能连接测量,重点关注GFC和全脑成对FC。图5显示了使用显示最显著效应的电极和EEG指标的数据的相关性(材料和方法)。

图5.EEG变化与fMRI RSFC变化的关系
A-D显示了EEG测量与每个区域的全局功能连接(GFC)(左脑表面;显示显著区域;P < 0.05,FDR校正)、网络GFC(中间条形图;显著P < 0.05,FDR校正)和成对功能连接(FC)(右相关矩阵,下象限显示显著链接;P < 0.05,FDR校正)之间的关联。
(A)额叶delta功率与广泛的GFC和分布式连接呈正相关。
(B)顶叶alpha功率与高级和注意网络以及边缘网络的GFC呈负相关。
(C)枕叶gamma功率与额顶叶和边缘网络的GFC增加呈正相关。
(D)信号多样性(LZc)与高级和边缘网络的GFC增加相关(*P < 0.05, **P < 0.01, ***P < 0.001;FDR校正)。(网络:VIS = 视觉;SM = 体感运动;DAN = 背侧注意;SAL = 腹侧注意/突显;LIM = 边缘;FP = 额顶叶;DMN = 默认模式;SC = 皮质下区域)
将关键EEG指标作为解释关键fMRI指标变化的变量的回归模型,得出了一致的结果,揭示了大脑主要感觉-联合梯度的变化。具体而言,在额叶电极测得的平均delta功率与一种广泛的GFC模式呈正相关,这种模式包括额叶、颞叶、顶叶、运动和视觉联合皮层,这一发现在成对FC结果中得到了重复(P < 0.05,FDR校正)(图5A)。顶叶电极的平均alpha功率变化(降低)与TOP网络和区域的GFC变化(增加)呈负相关。对于低级区域,出现了更复杂的关系,alpha功率降低与视觉和体感运动区域之间的耦合减弱相关,而与这些感觉区域和TOP(跨模态联合皮层极)区域之间的耦合增强相关(P < 0.05,FDR校正;见图5B中的成对FC相关矩阵)。枕叶电极的gamma功率变化(增加)与FP区域和LIM网络的GFC变化(增加)相关(P < 0.05,FDR校正)(图5C)。信号多样性(LZc)变化(增加)与TOP网络以及LIM网络的GFC变化(增加)相关(P < 0.05,FDR校正)(图5D)。简而言之,这些关系反映了EEG和fMRI测量活动中的模态独立变化(图1-4),但通过证明每个指标内的变化方向在模态之间显著相关,以重要和有意义的方式推进了这些发现。EEG和fMRI的同步互补还使我们能够理解神经元变化(EEG)与通过fMRI的BOLD信号观察到的网络效应的平行关系。此外,我们利用DMT的短效作用来探索两种模态中的受试者内轨迹,并发现EEG和fMRI之间的有意义关系,这些关系在采用受试者间相关的平均方法时并不明显(SI附录,图S8和S9)。
讨论
利用同步进行的两种互补成像模态(EEG-fMRI),本研究提供了精神药物对人脑急性作用的先进视角。其结果更新了当前关于精神药物状态神经相关物的思考,巩固了一些相对成熟的特性—如网络解体和去隔离、alpha功率降低和自发信号复杂度或熵增加,以及指标之间的关系—同时也增强了对一些较新观察的信心—如改变的行波以及增加的delta和gamma功率,和全局功能连接(GFC)。
然而,也许本研究结果最有启发性的方面是它们如何汇聚于精神药物对大脑的全局作用,暗示了大脑跨模态联合皮层极(TOP)活动的失调。虽然在皮层主要组织梯度低端的低级感觉运动模块之间的通信减少也被观察到,但动态和时间分辨分析表明,这些效应可能在时间上滞后于大脑TOP的主要作用。
精神药物是研究意识神经生物学的特别有用的研究工具。它们能够以根本且通常持久变革的方式改变意识质量,同时保持清醒状态,这在药理学上可以说是无与伦比的。我们认为,目前的结果,特别是那些涉及全脑组织的结果,如全局FC、成对FC和主要FC梯度,现在指向了精神药物对大脑的一种特征性全局作用,这种作用是稳健、可靠、独特的,不仅揭示了"精神药物意识",而且更广泛地揭示了意识体验。
现在大量多样的汇聚数据正在强调人类皮层的主要功能梯度,从低级感觉运动皮层极到高级跨模态联合皮层极,作为人脑的一个定义性组织维度。涵盖与这一主要梯度、维度或轴匹配的所有相关特性超出了本文的范围,但一些重要的例子包括:灵长类到人类的皮层扩张;个体发生的皮层扩张;发育成熟的各个方面 - 包括延长的可塑性期、髓鞘化程度、代谢和血流、兴奋性神经传递;5-HT2A受体表达;信息处理的抽象程度和时间持续性[见Sydnor等人的综述];以及与唤醒的亚慢周期相关的行波。
本研究并非第一个将全脑指标应用于精神药物神经影像学数据并显示其与精神药物体验特征方面关系的研究,也不是第一个提出深刻的全脑作用可能区分经典精神药物和类似化合物(如MDMA)的研究;然而,它以全面的多变量和多模态方式,结合特别沉浸式的精神药物体验,研究了精神药物对大脑的全局作用。
浮现的图景是药物诱导的大脑定义性主要梯度的崩塌,使其跨模态联合皮层极与皮层其余部分的分离程度降低—或更加整合。TOP(跨模态联合皮层极)本质上是跨模态的,在进化上是"新"的或最近的,而低级皮层是单模态和较老的。体内PET图谱中5-HT2A受体分布与主要功能梯度以及精神药物的全局FC效应重叠(图2E),意味着精神药物诱导的5-HT2AR信号增加是相关功能效应的原因;这一假设得到了计算模型的支持。
在本研究中,我们发现大脑活动的失调(例如,通过alpha功率降低以及gamma功率和信号多样性增加来指示)与大脑TOP处全局功能连接的增加相关。这些发现表明,在精神药物作用下,大脑功能转变为更加熵增的模式,这可能解释了它们独特的现象学。我们还发现DMT后(额叶)delta功率增加;这些增加与全局连接性增加状态(fMRI)相关,这与增加的delta可能作为意识显著改变的标志,而不是仅与意识水平降低相关的传统观点一致。同时,我们发现alpha功率降低、gamma功率增加和信号熵增强与边缘网络中更高的GFC相关(图5 B-D),这与精神药物现象的出现可能涉及边缘系统去抑制的假说一致,这对记忆和情感处理有影响(30)。总的来说,这些发现汇聚于DMT诱导的5-HT2AR激动作用使高级皮层活动和边缘系统活动失调的观点。
关于人类大脑、心智和行为的独特性有很多理论—例如,见Sydnor等人的综述。灵活和容量大的信息处理—特别是在语义和语言领域—是一个候选特征。因此,GFC × 强度和5-HT2A受体空间图谱与NeuroSynth功能术语重叠,这些术语与我们物种进化显著的认知能力相关,如"语言"和"语义",可能具有启发意义。
最近的发现表明,5-HT2AR信号在皮层扩张的早期阶段发挥直接的、受体和物种选择性作用,例如增加基底祖细胞的增殖。这提出了一种可能性,即精神药物的关键靶点—5-HT2A受体—在人类皮层的扩张中起了某种因果作用。皮层神经元的丰富性,特别是在皮层的TOP[从猕猴到人类增加20倍],是人类大脑的一个定义特征。5-HT2A受体最密集的表达可以在皮层的TOP找到,正如本研究所示,这也是精神药物产生初始和最强效应的地方。通过5-HT2AR激动作用增加突触生长暗示该受体参与了个体发生的大脑发育和学习。
事实上,现在有大量证据将5-HT2AR信号与各种神经和行为可塑性的诱导联系起来,但这些效应是否在功能上有益或有害是一个复杂的问题,取决于多个因素。相关地,精神药物的急性和长期心理效应被认为高度依赖于情境,这解释了为什么在精神药物治疗中如此强调"设置和环境"。值得注意的是,5-HT2AR在初级视觉皮层也有密集表达(SI附录,图S6),而DMT以诱导生动的视觉意象而闻名。需要进一步研究来检验我们发现的DMT诱导的皮层TOP和视觉区域之间的特定连接性增加(图2 A和B),这可能有助于解释DMT体验的视觉质量。
仅从本研究来回答DMT的作用与其他经典精神药物的具体差异是困难的,因为本研究只关注DMT,且缺乏活性药物对照条件。本研究的大多数发现与先前对精神药物神经影像学数据的观察一致,尽管由于研究设计和20mg静脉注射DMT的主观效力,本研究具有更高的保真度和多层次深度。Delta功率增加可能是DMT特有的,但需要更多研究来验证这一点(例如,参见refs. 32, 39, 和48)。
关于其他药物和状态,这里观察到的DMT和EEG-fMRI效应的模式和质量与先前观察到的血清素再摄取抑制剂、兴奋剂、镇静剂、解离剂[尽管参见Forsyth等人研究]以及MDMA的效应有很大不同。有趣的是,可以推测高级区域和网络中全局功能连接性的增加可能是经典精神药物作用的一个相对独特的特性。然而,在有经验的冥想者冥想时以及精神分裂症和婴儿期也观察到了类似的大脑功能概况(即高级皮层活动失调和大脑层级组织的压缩)。
DMT增加了外周唤醒标记,我们的一些成像发现与唤醒增加一致,如alpha功率降低、DMN完整性降低和LZ增加。然而,这里观察到的DMT引起的大脑变化的广度和幅度超出了仅仅由唤醒引起的预期。重要的是,在验证分析中,我们没有发现嗜睡评分与各种成像指标的条件间效应之间存在令人信服的关联(SI附录,表S1)。此外,delta功率增加和相关的超连接性的发现与唤醒增加或嗜睡减少不一致。DMT的当前结果与先前LSD和裸盖菇素改变大脑功能的发现一致,这些先前的研究并未一致观察到唤醒标记的增加。尽管如此,还需要进一步工作来区分大脑中特定的精神药物效应与仅仅的唤醒增加或嗜睡减少。
需要注意的是,fMRI连接性指标对头部运动高度敏感,虽然我们确实发现DMT条件下的头部运动显著大于安慰剂,但对具有相似头部运动的参与者子样本的分析显示,结果与主要结果部分报告的结果一致(SI附录,图S2和S3)。未来的研究应努力收集更大的数据集,包括更多参与者,理想情况下在各条件间头部运动相当。
虽然本研究发现DMT诱导的全局功能连接性变化与强烈主观效应评分之间存在显著关系,但成像指标与特定主观效应(如视觉意象、"实体"遭遇、沉浸感;SI附录,图S7)之间几乎没有相关性。未来的研究—结合神经影像学与时间分辨的主观体验测量和/或体验采样以及广泛的受试者内数据收集—可以利用数据量和质量的改进进行更细致的"神经现象学"分析。
最后,本研究结果的一个次要组成部分是直接测试了所谓的"熵脑假说",该假说认为精神药物提高自发性大脑活动的熵与意识体验的"丰富性"增加平行—其中丰富性被定义为内容的深度。在这里,我们通过自我评定的意识体验丰富性与LZc增加(图4F)之间的显著相关性找到了对这一假说的明确支持—LZc是自发性大脑活动熵或复杂性的有用标记。
结论:
总之,本DMT多模态、多变量EEG-fMRI研究揭示了对大脑TOP(跨模态联合皮层极)活动的强烈调节作用,5-HT2A受体(精神药物的主要靶点)在此处表达最为密集。观察到皮层TOP与大脑其他部分之间通信的增加,可以解释为信息处理扩展和高度联想认知风格的证据。有趣的是,可以推测这些全局大脑变化的幅度是否与神经和行为意义上的可塑性增加(即易于塑造或塑模的特性)有关。本研究的结果巩固了精神药物靶向和调节发育和进化上最近的皮层的观点。此外,它们暗示这种高级皮层的正常功能可能对保持人类特有的心理能力是必要的,但对觉醒的意识体验本身并非必要。























 7896
7896

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








