功能性磁共振成像(fMRI)的出现标志着在体内实时测量人脑功能的一项重要技术突破。部分原因是由于其四维特性(包括三个空间维度和时间),fMRI数据在过去几十年中激发了大量统计方法的发展,以应对其独特的时空特性。本文概述了当前功能性脑测量的研究现状,特别聚焦于fMRI,强调了过去十年的关键发展。此外,本文还展望了未来,讨论了社区中尚未解决的研究问题,并概述了未来潜在的研究课题。本文发表在知名统计学杂志Annual Review of Statistics and Its Application上。
关键词:fMRI,功能性磁共振成像,大脑,连接性,预测,静息态fMRI,统计学
1. 引言
功能性磁共振成像(fMRI)的出现为体内实时测量人脑功能提供了一项重大的技术进步。fMRI 的一个独特特性是其能够每秒生成空间密集的全脑图像,捕捉与脑活动相关的生理测量。这使研究人员能够在执行任务或处于静息状态时观察大脑的活动。fMRI 是一个不断增长的非侵入性人类功能神经影像技术家族的一部分,该家族还包括正电子发射断层扫描(PET)、脑电图(EEG)、脑磁图(MEG)、单光子发射断层扫描、功能近红外光谱(fNIRS)和基于功能超声的成像。
在本文中,我们将 fMRI 视为一种测量生理人脑功能的方法,这是我们在此的主要关注点。我们添加“生理”一词以区别于心理、行为、口头和书面功能评估,如记忆测试。尽管界限并不完全清晰,我们的重点在于那些通过测量生理变化来评估整体神经元活动的技术驱动方法,这些活动通常发生在导致行为输出的因果路径的早期。此外,我们不讨论动物模型,完全聚焦于人类脑功能。
在体内测量人脑功能是一项权衡取舍的活动。想象一下有一组滑块,控制空间分辨率、空间覆盖范围、变异性、神经元测量的直接性、侵入性、时间分辨率、对干扰的测量敏感性、在扫描仪中执行功能范式或测试的能力、便携性、成本、受试者群体以及分析难度。当您将滑块推向理想值时,其他滑块会被移动到较不理想的值。例如,fMRI 具有出色的空间分辨率,但相对于神经元活动具有较低的时间分辨率,对干扰因素(例如,见 Power 等,2020,2012)的敏感性高,中等成本,低便携性,以及高分析难度,并通过血氧化作为神经元活动的代理进行测量。
fMRI 的受欢迎程度在于它提供了相对较高的空间和时间分辨率的组合,且在整个大脑中具有相对均匀的覆盖和敏感性。尽管其时间分辨率不如 EEG、MEG 或 fNIRS,但仍可用于区分大约 100 毫秒间隔发生的事件(Menon 等,1998;Lindquist 等,2008)。它可以以相对较高的空间分辨率(2 mm³)每秒成像整个大脑,或以较低的空间分辨率每 200 毫秒成像一次。由于其非侵入性,fMRI 特别适合纵向研究。实际上,有些个体已经被扫描了数百次且没有不良反应(Choe 等,2015;Poldrack 等,2015)。这使得在发展、衰老、训练或治疗过程中反复扫描个体成为可能。
此外,MRI 扫描仪具有极高的多功能性。它可用于收集与局部血流和氧合相关的功能图像,揭示大脑解剖结构的结构图像,以及允许识别和分析大脑主要纤维束的扩散加权图像(DWI)。标准 fMRI 图像提供与血流和氧合相关的功能活动测量,这反过来又与代谢需求相关。这种对比被称为血氧水平依赖(BOLD)信号(Ogawa 等,1990),并被绝大多数使用 fMRI 报告脑活动的研究所采用。
由于在三个空间维度和时间上具有高维特性,fMRI 数据激发了大量统计方法的发展,以应对其独特的特性。对于那些不熟悉这项技术的人来说,本文作者之一在 2008 年发表的一篇文章回顾了 fMRI 的最新发展,重点关注相关的统计主题(Lindquist 2008)。这篇当前的文章在某些方面是一个更新,突出显示了自上篇文章以来十年半出现的一些主题,并回顾了一些趋势和未来可能的发展方向。
2. 测量大脑功能
2.1. 成像和电生理方法
功能性脑图像测量局部脑区代谢活动、氧气使用以及神经递质的释放与接收等方面的变化。存在多种成像方法,它们为人类脑功能提供了有用且互补的视角。这些效应可以在从秒级到年级的时间尺度以及从神经柱级分辨率到大规模脑系统的空间尺度上发生。不同的方法对不同的效应具有不同的敏感性,这取决于成像类型和数据分析方式。本文简要概述了各种成像技术,并试图将fMRI置于这些方法的背景下进行讨论。
2.1.1. 功能性磁共振成像
fMRI最常见的用途是测量BOLD信号,这是一种血氧化水平与脑血流的复杂组合(Ogawa等,1990)。虽然它并不直接测量神经元活动,但与突触后输入的增加相关,并伴随着区域内谷氨酸依赖的局部场电位增加(Buxton等,1998b;Logothetis等,2001)。BOLD信号并不测量随时间变化的任何生理参数的绝对水平。相反,它测量相对活动,以任意单位表示,这些单位在不同扫描仪之间有所不同,并随时间漂移。这使得BOLD在成像长时间尺度上的活动变化时不是一个理想的选择;然而,它对短时间(例如,10-30秒)的变化非常敏感。通过关注功能连接性的变化,通常通过对脑区之间的BOLD时间序列进行相关分析,可以克服跨较长时间间隔比较状态的能力限制。BOLD fMRI因其信号的稳健性以及广泛可用的经过良好测试的商业数据采集序列而变得流行。它也可以安全地在同一参与者身上重复进行,并且不需要放射性化合物注射。为完整起见,应该注意存在其他类型的fMRI。例如,动脉自旋标记(ASL)是一种获取局部脑血流定量测量的方法(Buxton等,1998a)。与BOLD fMRI不同,ASL图像具有绝对单位(毫升/分钟),并且可以在几个月内保持稳定,允许直接比较不同心理状态和/或时间的血流水平。这使得ASL对于某些实验设计来说是一种有吸引力的替代方法。然而,ASL的信号强度约为BOLD的十分之一,且直到最近才有稳定的商业序列可用。
图1 展示了fMRI的基本数据结构和分析方法。可以看到结构性MRI(图1a)与fMRI(图1b)在解剖分辨率上的差异。fMRI已被用于各种各样的分析和研究中。图1d–f展示了使用fMRI数据进行的分析示例,包括脑图谱绘制、连接组学和预测建模。
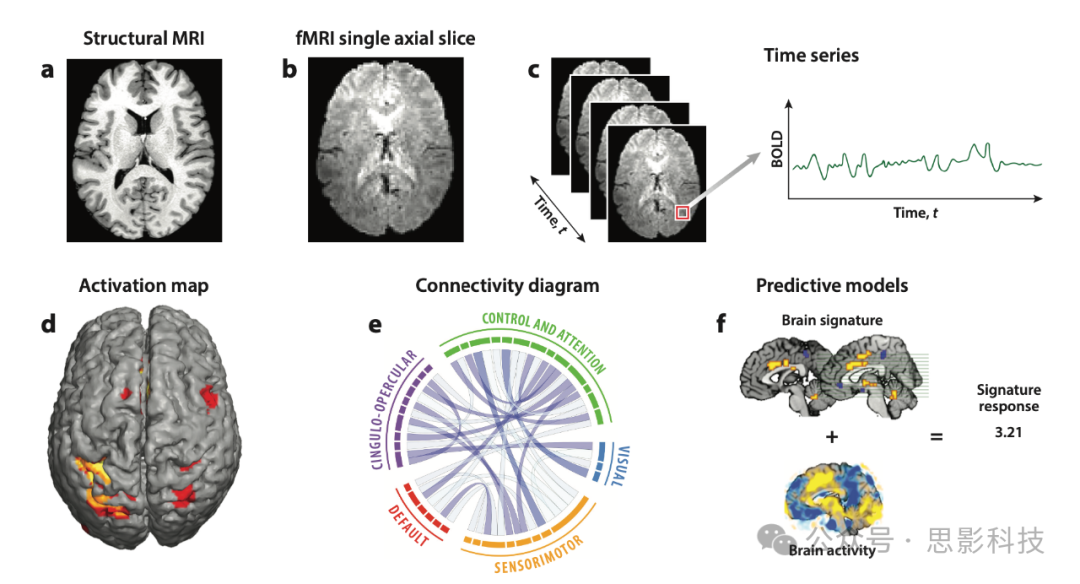
图1展示了功能性磁共振成像(fMRI)数据结构和基本分析方法。面板a显示了一幅结构性MRI图像,而面板b显示了fMRI的一张轴向切片,面板c说明了这些切片如何形成一个时间序列。面板d–f展示了使用fMRI数据可以获得的各种结果,包括(d) 激活图、(e) 连接图示和(f) 预测模型。
2.1.2. 正电子发射断层扫描
PET是一种多功能工具,能够提供与注入血液中的放射性标记化合物相关的三维图像(Ter-Pogossian等,1980)。例如,它可以用于测量与脑血流、氧代谢和葡萄糖利用相关的激活。PET涉及合成放射性同位素并将其生物化学地附着到感兴趣的分子上。研究人员将放射性标记的化合物注入血液中。当放射性同位素衰变时,它会发射出反向行进的正电子。位于头部周围的一组探测器检测这些正电子,不同位置发射的频率可以重建为三维体积。最常见的放射性示踪剂是15O(氧-15),用于评估脑血流,以及18F(氟),用于评估脱氧葡萄糖映射。
在PET中,存在时间分辨率、空间分辨率和变异性之间的权衡。此外,PET获取成本高昂,需要快速衰变的同位素、复杂的设备和专家团队。尽管如此,PET在测量生理功能方面具有独特的能力,能够利用专门创建的独特同位素来标记相关的功能性生理脑过程。
2.1.3. 脑电图
脑电图(EEG)通过检测头皮上的电流来工作。它对引起神经元发放的电位变化敏感,特别是那些发生在大脑表面并垂直于颅骨方向的电位(Hari & Puce 2023)。由神经元活动产生的电位可以被建模为偶极子。EEG源估计算法试图重建源偶极子,通常通过假设存在一个或几个偶极子,并找到最适合观测数据的配置来实现。
EEG的一个优势是其快速的时间分辨率,这使得研究人员能够在事件发生后数十至数百毫秒的时间尺度上测量大脑变化。其他优势包括其成本效益和便携性。然而,缺点包括其不均匀的大脑覆盖,特别是在较深的结构中,以及信号来源的不确定性。源定位模型可以非常复杂,并利用有关脑结构的详细信息,但当存在多个分布式源时,确定性的解决方案是难以实现的。
脑电图的一个近亲是皮层脑电图(EcOG),它将电极板直接放置在脑皮层上。这在需要开颅术的脑手术患者中是可能的,例如严重的癫痫病例。由于其直接放置在皮层上,EcOG没有了颅骨衰减,与EEG相比,EcOG产生的信号更强、更集中。然而,空间范围仅限于手术区域,这可能因患者而异。此外,由于EcOG仅用于严重疾病病例,样本量较小,且结果往往无法普遍化。
2.1.4. 脑磁图
脑磁图(MEG)是脑电图(EEG)的又一个近亲(Hari & Puce 2023)。与测量电场的EEG不同,MEG使用磁力计来测量由脑功能的电流产生的局部磁场。由于磁场与皮层中产生的电偶极子垂直,MEG倾向于对沿着颅骨表面定向的偶极子而非垂直于颅骨的偶极子敏感。因此,MEG对皮层沟内的神经活动敏感,而对回内的神经活动不敏感。
与本文中描述的所有脑测量方法一样,MEG代表了物理学、工程学和生物学的卓越融合,需要复杂的分析。MEG提供了与EEG相似的时间分辨率和更好的源定位能力。后者之所以如此,是因为磁场不受颅骨的扭曲影响,因此活动可以更精确地定位。然而,跨个体的配准是具有挑战性的。此外,MEG设备和专业知识相对稀缺,仅存在于大型研究中心。
2.1.5. 功能近红外光谱
多通道功能近红外光谱(fNIRS)允许研究人员通过在任务期间将近红外光应用于头皮,测量皮层表面区域的区域性脑氧合血红蛋白(oxy-Hb)和脱氧血红蛋白(deoxy-Hb)浓度变化,从而评估皮层脑活动(Villringer等,1993;Villringer & Chance 1997)。
当近红外光照射到头皮时,它能够穿透颅骨和下方的大脑组织,一部分光被反射回放置在光源(照明器)旁边的探测器。到达探测器的光量与光源和探测器之间区域组织的光学性质相关。由于血液中血红蛋白的低吸收性,可以通过多波长的光衰减来测量围绕照明器-探测器对的区域内oxy-Hb(氧合血红蛋白)和deoxy-Hb(脱氧血红蛋白)的浓度。这一点很重要,因为oxy-Hb和deoxy-Hb浓度的变化已知是神经活动的间接标志。因此,fNIRS提供了与BOLD fMRI研究的相同脑机制的测量。每对光源-探测器组成一个通道,测量信号的覆盖范围取决于光源和探测器之间的距离。穿透深度通常在厘米级别。多通道fNIRS可以通过在头部表面放置多个光源-探测器对来同时监测多个脑区。
尽管fNIRS关注的是与fMRI类似的脑机制,其在覆盖范围和深度方面的空间分辨率显著较低。此外,由于BOLD反应的相对迟缓(Lindquist 2008),fNIRS的有效时间分辨率低于测量头皮上各通道信号的其他成像模态,如EEG和MEG。然而,相比之下,fNIRS具有诸多优势,包括以相对低成本、非侵入性和便携的方式测量oxy-Hb和deoxy-Hb的变化;后者使其在其他神经影像方法不可行或不切实际的环境中极为有用。
2.2. 基本数据结构
fMRI 数据具有根本性的层级结构。参与者可能会在不同的日子进行多次会话的纵向扫描。在一个会话中,通常会多次启动和停止扫描仪,收集被称为“运行”(run)的短时间数据。一个 fMRI 运行由一系列 3D 图像或体积的时间序列组成,这些图像是在受试者执行任务或简单休息时获取的。一个单一的体积(volume)通常包含数十万体素(即对应于脑位置的小立方体体积),尽管具体数量因采集选择而有显著差异。不同研究中的体积间重复时间(TR)也有所不同。2000 年代早期研究的典型 TR 为 2–3 秒,但随着加速成像技术的最新进展(Moeller 等,2010),小于 500 毫秒的 TR 越来越常见。通常,参与者级别的数据使用大规模单变量分析来研究每个体素的实验效应,称为一阶分析。产生的实验效应量图,称为对比图,是二阶分析的输入数据,用于评估参与者之间效应的可靠性,包括组间差异和个体差异效应。
fMRI 数据以自定义格式存储,并附有相关的元数据,即关于成像参数的信息。历史上,不同扫描仪制造商和软件包的数据格式差异很大。例如,通用电气(General Electric)扫描仪上的原始数据以名为 P-files 的专有格式保存,西门子(Siemens)扫描仪则以 DICOM(医学数字成像与通信)文件格式保存。DICOM 文件包含单个时间点单个脑体积的单个切片数据,附有大量头信息,尽管不同扫描仪使用和存储这些信息的方式不同。预处理和统计分析软件包需要将这些图像转换为其他标准格式。尽管这些格式因软件包而异,但大多数软件包都支持使用 NIfTI(Neuroimaging Informatics Technology Initiative)图像,这是一种标准格式。一个 3D NIfTI 文件包含每个体积的一张图像,而一个 4D NIfTI 文件包含单个参与者的图像体积时间序列。两者都使用 .nii 扩展名。一个较旧的文件格式是 Analyze 图像格式,它使用 .img 扩展名和包含元数据的单独头文件,扩展名为 .hdr。
上述数据代表所谓的体积(volume)数据,这些数据由许多大小相同的体素组成的 3D 脑体积时间序列构成。然而,研究人员越来越多地使用另一种数据表示方式进行分析,即将皮层灰质表示为二维流形表面。数据位于每个半球约 30,000 个顶点的三角网格上,并在每个时间点进行测量。基于表面的分析提供了若干优势,包括降维、去除多余的组织类型、改善跨受试者的对齐以及更真实的位置间距离。后者很重要,因为沿皮层表面的测地距离比体积 fMRI 数据中的欧几里得距离更有意义地衡量神经元激活的不相似性,这归因于皮层的褶皱。因此,表面数据在空间模型中特别有优势。
最初,基于表面的数据存储在 GIfTI 文件中(NIfTI 文件的表面几何格式),这些文件不包含来自皮层下和小脑灰质区域的数据。最近,出现了向 CIFTI(Connectivity Informatics Technology Initiative)文件格式的转变,该格式以“灰坐标”(灰质中的基于大脑的坐标系统)存储数据(Fischl 2012)。这些数据将左、右半球的皮层灰质数据表示为皮层表面顶点,皮层下和小脑的灰质数据表示为体素。希望使用 CIFTI 文件格式进行工作的统计学家应首先阅读 Pham 等人的文章(2022)。
最后,脑成像数据结构(BIDS)(Gorgolewski 等,2016)格式是一种组织和描述成像数据集的标准。它将图像和图像衍生的表型组织到一个标准目录结构中,使得数据和相关分析管道的共享更加容易。自其创建以来,围绕 BIDS 已发展出庞大的工具和资源生态系统。虽然最初是为 fMRI 数据实现的,最近 BIDS 格式也已扩展到 MEG(Niso 等,2018)和 EEG(Pernet 等,2019)数据。
2.3. 实验类型
大多数神经影像研究涉及实验操作与观察性关联评估的混合。各种实验设计被用于在不同的设置下收集数据。基于任务的fMRI(tfMRI)研究通过刺激呈现来操控一个或多个环境方面。最初,几乎所有fMRI研究都采用这种方法。近年来,替代设计越来越受欢迎。静息态fMRI(rsfMRI)研究不涉及实验操控;相反,受试者在静息时被观察。生态或自然主义设计涉及在扫描期间观看电影或听故事。尽管呈现了刺激,但这些刺激并未被实验性操控,且在时间上没有随机分配级别,使其成为观察性研究。
2.3.1. 基于任务的功能性磁共振成像
tfMRI研究涉及呈现刺激并对参与者的表现施加要求。其主要目的是建立所呈现的刺激或任务指令与脑活动之间的关系。一个有效的tfMRI设计将操控特定的心理过程,旨在将其映射到脑活动上,以高灵敏度和特异性检测与这些心理事件相关的脑反应,并最大限度地提高后续统计推断的适当性和普遍性。为实现这些目标,研究人员需要仔细考虑呈现何种类型的刺激以及何时呈现。
在tfMRI研究中,研究人员通常检验关于一个或多个脑区是否受到某个特定刺激或刺激组合影响的假设。结果通常以统计图的形式总结,显示在脑体素上执行的假设检验结果,并通过颜色编码显示对刺激有非零反应的证据强度。这种类型的分析通常使用广义线性模型(GLM)(Lindquist 2008,Monti 2011)进行。它可用于识别对单一类型事件做出反应的脑区,比较不同类型的事件,并评估脑活动与感兴趣变量之间的相关性。GLM通常使用回归模型进行,其中Yi(t, v)表示受试者i、体素v和时间t的fMRI值。通过采用一个或多个delta函数,δi(t),即任务期间为1,其他时间为0,来创建刺激函数。为了考虑血流动力学反应函数,即刺激与血流变化之间的延迟,δi(t)与血流动力学反应函数h(t)进行卷积(在典型的数学意义上)。无论这是否是跨受试者的共同固定函数,还是通过估计在受试者之间变化,或通过一阶导数泰勒展开等工具近似,都是一个活跃的研究领域(Lindquist & Wager 2007,Lindquist等,2009)。多变量回归模型的结果是一个受试者和体素特定的系数向量,βi(v)。然后,这些βi(v)向量通常通过第二阶段线性模型在受试者之间作为预测变量或结果变量进行分析,同时考虑诸如治疗、暴露、人口统计学特征等受试者级别的特征。
当多个预测变量可以用来解释来自脑体素或兴趣区域(ROI)信号的变异性时,GLM是合适的。分析通常通过大规模单变量检验进行,即在每个体素上拟合单独的模型。这需要连续执行数千个假设检验,因此,对多重比较的不当校正可能导致虚假的发现(Lindquist & Mejia 2015)。
创建适当的设计以收集和分析tfMRI数据是一个重要问题。然而,这些内容已在其他综述文章中得到广泛覆盖(例如,Lindquist 2008,Ombao等,2016),因此我们将读者指引至这些文献,并在本文中关注其他主题。
2.3.2. 静息态功能性磁共振成像与自然观影
大约十年前,大多数fMRI实验研究与认知任务相关的脑激活。过去十年中,研究重点转向了替代实验设计,包括在受试者处于静息状态时研究大脑功能。在开创性工作中,Biswal及其同事(1995)发现,不同脑区的BOLD时间序列在静息状态下高度相关,这表明之前被认为是这些区域噪声的信号实际上是由一致的自发活动引起的。后续研究识别出多个大规模网络,即使在没有任务的情况下也显示出一致的相关活动。例如,包括腹内侧和背内侧前额叶皮层、后扣带回、内侧颞叶和上颞皮层在内的多个脑区构成了所谓的默认模式网络(Raichle等,2001)。这些区域在参与者未明确参与特定任务时始终激活。
近年来,静息态fMRI(rsfMRI)研究越来越受欢迎,人们希望它们能够提供与老化、精神病理学、表现和临床症状相关的信息。通常,静息态扫描中的受试者被要求在实验期间集中注视一个注视十字,或闭上眼睛。扫描通常每个受试者持续5到12分钟,使得获取大量受试者的数据具有成本效益。此外,由于实验设计不需要同步,跨多个研究实验室组合数据也变得容易。这导致了大量受试者的静息态数据的可用性。大多数rsfMRI研究调查低频范围(0.01–0.08 Hz)的BOLD振荡,这些频率与呼吸(0.1–0.5 Hz)或心血管(0.6–1.2 Hz)信号对应的频率是可分离的。研究表明,非神经生理信号可能会干扰静息态数据,移除混杂信号(例如呼吸或心血管噪声)可以提高归因于神经活动的数据质量。
静息态数据的分析与基于任务的研究不同。由于没有实验操控,因此无法进行GLM分析。绝对活动水平没有意义,通常不进行分析,但可以量化和分析不同脑区之间的相关性。这些脑区间的相关性被视为连接性的代理(即脑区之间的通信)。连接性值被用于分析与个体间差异和个体内部状态效应的关系(见图2示例)。
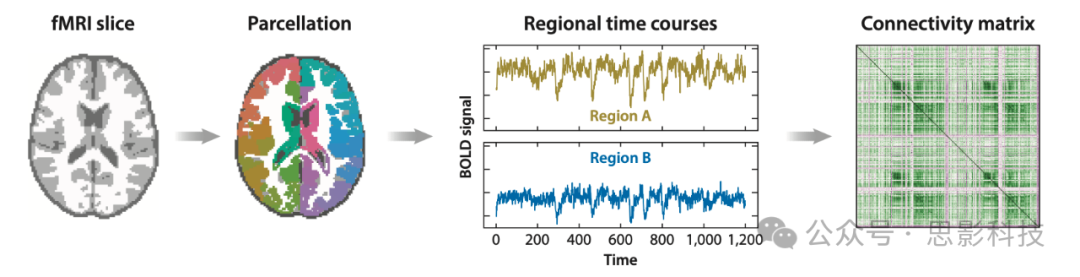
图2 用于分析静息态功能磁共振成像(rsfMRI)的连接矩阵的创建。在将大脑划分为独立的区域后,提取每个区域的血氧水平依赖(BOLD)信号。连接矩阵给出了每对区域之间的BOLD信号随时间的相关性。
rsfMRI分析的一个陷阱与对个体间心理状态差异和研究人员实际成像的生理过程的不确定性有关。虽然实验的目标是控制受试者所参与的心理过程类型,但在静息态研究中没有这种控制。此外,休息状态下的一些一致性脑活动已被证明依赖于生理噪声,包括与头部运动、呼吸、脉动运动和心跳引起的血管氧合相关的伪影。
为了减少个体间心理状态的差异,一些研究人员在测量fMRI数据时让参与者观看电影或听播客。这些有时被称为自然观影任务(Nastase等,2019)。在这种情况下,扫描可能在多个会话中持续长达10小时,所获得的大量数据可以通过利用脑活动与当前刺激组成特征之间的独特协变模式,从脑活动中预测当前感知。与静息态研究不同,这些数据在参与者之间是时间锁定的,因此这些数据类型通常用于访问跨受试者的连接模式。
2.4. 连接组学
连接性涵盖了大脑组织的各个方面。人类大脑组织的研究主要依赖于静息态fMRI(rsfMRI)数据。由于没有特定的实验任务可用于创建预测变量,因此无法应用传统的广义线性模型(GLM)分析。因此,研究重点已经从传统的脑图谱绘制研究转向研究大脑连接性和脑区间关系。在方法上,这一转变使研究从关注单个体素的大规模单变量分析转向跨一组感兴趣区域(ROI)的多变量分析。在这里,重点放在ROI之间的连接上作为主要兴趣点。
2.4.1. 功能连接性
已经提出了各种方法来研究功能连接性。最简单的方法基于计算ROI之间或种子区域与其他脑体素之间的双变量相关性。考虑一个fMRI运行,其中收集了T个体积(volume),对于每个区域j,设Bij = (Bij(1), …, Bij(T))是该区域BOLD信号强度的汇总向量。例如,它可以是区域的平均时间序列,即
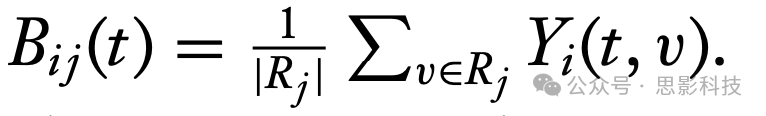
。设Zi(j, j’)为Bij与Bi j’之间的皮尔逊相关系数,即区域j和j’之间随时间的相关性。那么,一个参与者的功能连接性可以通过一组相关性{Zi(j, j’) : 1 ≤ j < j’ ≤ R}来总结,其中R是给定分析中使用的区域或体素数量。这通常通过方差/协方差矩阵Zi表示。
连接性分析可以在受试者内部使用每个ROI或体素的时间序列数据进行(见图2),或在受试者之间使用从每个受试者和区域提取的汇总统计数据进行。然而,如果存在与两个变量相关的第三变量,双变量相关性可能会产生误导性的结果。为了解决这一问题,通常采用偏相关。此外,已经开发出逆协方差估计方法,以简化高维设置下的计算(例如,见Qiu等,2016)。其他测量方法,如互信息和相干性,也可用于构建由不重叠的脑区组成的网络。
另一种分析方法涉及使用多变量分解方法,在不对其形式进行先验假设的情况下,识别体素级别的共激活模式。聚类、主成分分析(PCA)和独立成分分析(ICA)在这一背景下被广泛使用(Correa等,2007;Nebel等,2014)。这些方法对于rsfMRI数据的体素级别分析特别有价值。为了让读者了解这种分析风格,考虑将Yi视为Yi(v, t)元素的时间×体素矩阵。设
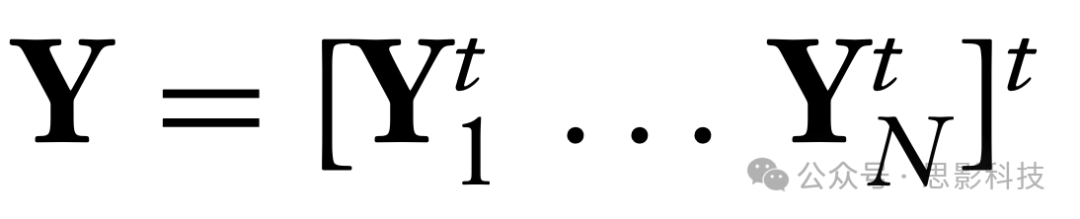
为堆叠的受试者特定数据的N × T 乘 V矩阵。那么,所谓的群体ICA(有关综述,见Calhoun等,2009)在概念上拟合模型Y = WS,其中假设Y具有独立同分布(i.i.d.)的列,S具有独立同分布的列且行之间独立。之所以需要“概念上”这个词,是因为ICA需要通过PCA进行均值减法和降维。已经提出了许多考虑统计问题的ICA统计变体(Lee等,2011;Li等,2012;Eloyan等,2013;Risk等,2014;Wang & Guo,2019;Mejia等,2020,2023)。
其他统计方法基于Zi或其等效汇总,这些汇总源自独立成分分析(ICA)(Joel等,2011)。例如,一种相对较新的方法使用协方差回归工具和模型,假设对数旋转尺度的线性性:
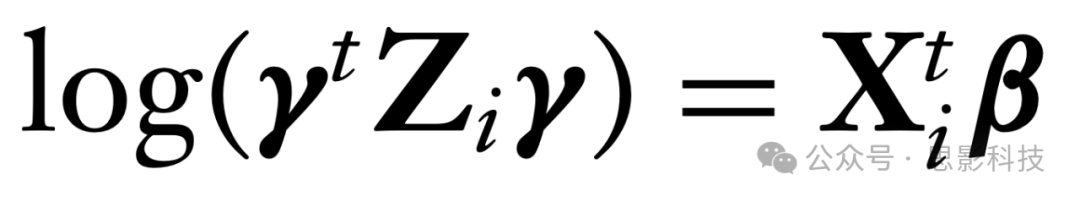
(赵等,2021a,b, 2024)。
2.4.2. 有效连接性
有效连接性描述了一个脑区对其他脑区生理活动的定向影响(Friston 2011)。通常,研究人员定义一小组脑区和连接,并进行统计检验以比较模型拟合度并评估各个连接的显著性。连接的方向特异性常常导致研究人员假设模型暗示因果关系。
鉴于潜在模型的数量庞大,区域和连接的选择依赖于解剖学和理论上的考虑。因此,有效连接性分析需要一个描述区域间连接的神经解剖模型和一个描绘其连接模式的数学模型。评估有效连接性的常用方法包括结构方程模型(SEM)、Granger因果关系分析和动态因果建模(DCM),每种方法都有其独特的方法和优势。
SEM专注于解释数据的方差-协方差结构。它由一组预定义的脑区和它们之间的定向连接组成。路径系数量化了一个区域活动的单位变化导致其影响区域活动的预期变化,反映了测量时间间隔内的平均影响。SEM分析与BOLD信号直接相关的数据。
DCM旨在分析神经水平的过程,它包含了一个神经网络模型,并通过神经血管耦合模型将观察到的fMRI信号与其底层生成模型联系起来。DCM明确指定节点和连接,可以容纳心理学调节变量。
Granger因果关系不依赖于预定义的结构模型,而是量化一个区域过去值在预测另一个区域当前值时的预测效用。虽然它提供了时间优先性的信息,但并不能推断经典意义上的因果关系。
尽管使用专门针对有效连接性分析的方法的研究人员常常将他们的发现解释为表明因果关系,但他们通常未能明确定义他们所说的因果关系,或明确概述他们寻求测量的效应及其有效解释所需的条件(Lindquist & Sobel 2016)。
2.4.3. 干预与因果关系
另一个相关的研究主题是大脑(共同)活动在从暴露到结果的路径中作为中介变量的中介作用(Lindquist 2012, 陈等,2018)(见图3)。最近的研究转向潜在结果框架,以定义需要估计的因果效应,例如暴露对结果的直接效应(不通过大脑(共同)活动)以及通过大脑(共同)活动对结果的间接效应。考虑一个二元处理变量A,其中A = 1表示处理,A = 0表示对照,一个大脑中介变量M,以及一个结果变量O。直接和间接效应是基于潜在结果定义的,O(a, m)表示如果将处理设为A = a,同时将大脑中介变量设为M = m,参与者将得到的结果,以及潜在结果M(a),表示如果将处理设为A = a,大脑中介变量的值。

图3 大脑作为中介。在用于表示中介框架的三变量路径图中,处理和暴露变量是标量,而中介变量可以是矩阵、函数或激活图。缩写:BOLD,血氧水平依赖
一个直接(非大脑中介)效应的例子是O(1, m) − O(0, m),即在处理与对照下,如果能够干预保持大脑中介变量在固定值m时,结果的变化。另一个直接效应的例子是O{1, M(0)} − O{0, M(0)},对应于将大脑中介变量固定在对照下的值。一个间接(大脑中介)效应的例子是O{a, M(1)} − O{a, M(0)},即在将暴露保持在A = a时,由于处理与对照下大脑中介变量的差异导致的结果变化(Pearl 2001, VanderWeele 2016)。因果推断领域的结果可以用来阐明在什么假设下,研究人员可以从神经影像数据中有效地得出因果结论。
例如,如果处理是随机化的,但大脑测量不是,那么针对单一中介变量的标准方法假设在分析中已经调整了中介变量-结果关系中的任何混杂因素,并且不存在同时影响中介变量和结果且本身受到处理影响的变量(VanderWeele 2016)。
Lindquist (2012)开发了一种适用于中介变量是时间函数的方法,并将其应用于一项疼痛试验,其中中介变量是选定脑区的fMRI时间序列。其他相关工作集中于将中介分析扩展到高维图像设置或减少所需的路径假设(Caffo et al. 2008; Chén et al. 2018; Geuter et al. 2020; Zhao et al. 2020, 2022; Nath et al. 2023; Zhao & Luo 2023)。
展望未来,fMRI与经颅磁刺激(TMS)和经颅直流电刺激(tDCS)的结合有望将神经成像观察大脑活动的能力与TMS/tDCS操纵大脑功能的能力相结合。这为推断大脑活动如何影响任务表现开辟了新途径,可以通过比较随机分配接受刺激或不接受刺激的受试者来实现。最终,我们认为像TMS/tDCS这样允许直接操纵中间结果的技术,为研究有效连接性提供了最有前景的方法。
2.4.4. 时变连接性
最初用于确定功能连接性的统计方法假设其在整个实验运行过程中是静态的(即,持续5–15分钟)。因此,每个实验运行通常会产生一个单一的连接性估计值,例如协方差、相关性或部分相关矩阵,代表整个运行期间各脑区之间的关系。然而,最近的研究兴趣转向分析时间变化的(或动态的)功能连接性(TVFC)(Hutchison 等,2013;Preti 等,2017;Lurie 等,2020),假设功能连接性的变化发生在从秒到分钟的时间尺度上。这扩展了第2.4.1节中定义的相关集合至
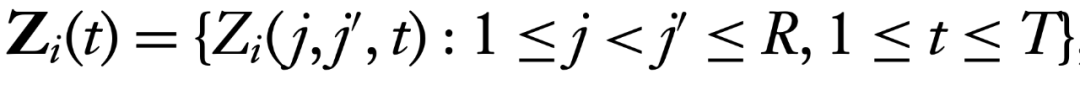
,其中,回想一下,T是时间点的数量。
在这里,目标通常是将大脑分类为若干不同的连接模式(大脑状态),参与者在实验过程中在这些状态之间转换。如果我们将这些大脑状态表示为S1, S2, ..., SK,我们假设每个Z(·,·,t)在每个时间点t都处于某个状态Sk中。
大量研究表明,大脑状态在群体和个体之间都能可靠地观察到。已经证明,时变功能连接(TVFC)的其他特征,如在特定状态下停留的时间长度和状态之间的转换次数,可能会随年龄、疾病状态或遗传影响而变化。此外,TVFC分析显示出改善我们对脑部疾病引起的功能改变的理解的潜力。越来越多的共识认为,假设整个实验过程中功能连接是静态的可能无法充分捕捉脑区之间关系的全貌。
通常,多个脑区之间的TVFC用一系列协方差、相关或偏相关矩阵来表示,描述了在某个时间点这些区域之间的关系。研究这些矩阵之间的差异以及个体在它们之间转换的方式,使研究人员能够研究连接如何随时间动态变化。然而,这个科学上有用的想法在估计和推断上引入了额外的复杂性。请注意,时变连接矩阵的维度通常大于输入数据矩阵,通过平滑假设进行汇总。目前,通常有两种主要的分析路径用于评估TVFC。首先,可以估计时间分辨的功能连接(例如,每个时间点的相关矩阵),然后对矩阵应用聚类技术,得到代表大脑状态的固定连接模式集。在大多数研究中,时间分辨的功能连接使用滑动窗口方法计算,聚类使用k-means算法进行(Allen et al. 2014)。其次,可以使用基于状态的模型直接估计大脑状态集。这可以通过变点分析(Cribben et al. 2012)或隐马尔可夫模型(Vidaurre et al. 2017, Shappell et al. 2019)等技术来完成。
TVFC的一个关键问题是,在大多数情况下,没有进行适当的统计推断。相反,导出的大脑状态估计被呈现时没有提供与之相关的不确定性信息。因此,很难将重要的波动与纯粹由偶然出现的波动区分开来(Lindquist et al. 2014)。这里,一个重要目标是确定TVFC估计是否显著不同于使用不表现TVFC的过程生成的时间序列所得到的估计。这需要为TVFC创建一个空分布,可以通过模拟或重采样创建替代空分布来实现。早期的工作提出使用时间序列的相位随机化(Handwerker et al. 2012),扫描会话的随机化(Keilholz et al. 2013, Choe et al. 2021),或使用向量自回归模型(Chang & Glover 2010)。最近的工作集中在统计平稳性作为感兴趣的特征。创建替代数据的最佳方法仍然是一个开放的问题。
2.4.5. 网络分析
通常,研究重点在于构建由各种脑区组成的网络。然而,随着脑区数量的增加,网络内连接的数量可能会带来解释上的挑战。新兴的网络神经科学领域旨在使用一组简洁且有意义的汇总统计量来表征这些复杂网络,并为神经影像数据引入了众多拓扑测量。这些测量描述了大脑的组织属性。跨参与者群体比较网络拓扑有潜力揭示与特定神经或精神疾病相关的连接异常。
可以将大脑概念化为一个图,其中脑区作为节点,边表示脑区之间的结构性或功能性连接。例如,这个图可以是加权的,两个脑区之间的边权重等于它们之间的相关性。更常见的是,通过在某个阈值下进行阈值化(通常在一系列不同的阈值下重复分析)来获得二元图。大脑组织结构的各个方面可以使用图论测量来总结。在具有正常认知功能的健康受试者中,大脑表现出“小世界”特性,其特点是密集连接的脑区群组允许在局部邻域内进行功能分离,同时较长距离的连接允许跨分布区域进行功能整合(Sporns & Zwi 2004)。这种特性在某些神经或精神疾病中以及随着正常老化过程可能会发生改变(Bassett & Bullmore 2009),使得图论方法成为研究这些状况的有用工具。
考虑一个具有R个脑区的图,该图有无向、无权重的边。大脑功能整合的度量包括特征路径长度
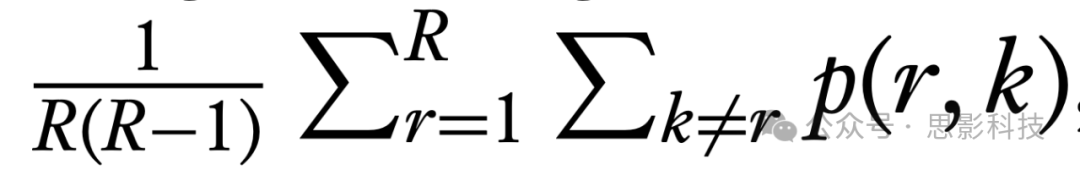
,其中p(r, k)是区域r和k之间最短路径的长度(以路径中的边数量计)(Rubinov & Sporns 2010)。大脑功能分离的一个度量是聚类系数
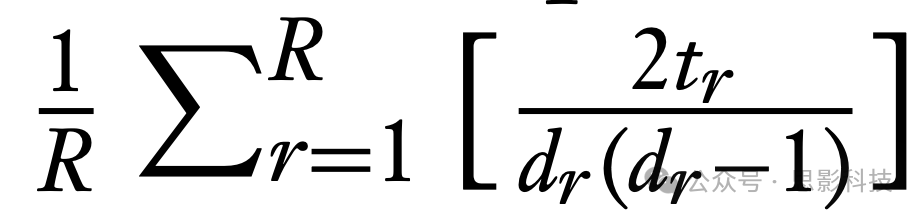
,其中dr是连接到区域r的边的数量(即其度数),tr是图中包含区域r的三角形数量(Rubinov & Sporns 2010)。
大脑功能分离的另一个度量是模块度。这个数值基于将节点划分为若干个不重叠的模块或社区。给定划分的模块度是
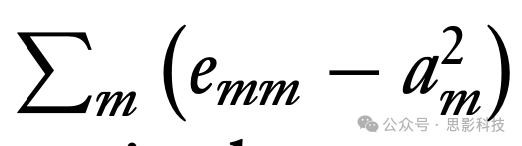
,其中emm是连接模块m中两个节点的所有边的比例,am是在模块m中的边端的比例,求和是对划分中的所有模块进行的(Newman 2004)。用于(近似)最大化所有可能划分中这个数值的算法被用来获得图的模块度,较高的值表示更明显的模块结构。
在阿尔茨海默病(AD)中,研究发现聚类系数和模块度随疾病进展而降低,表明随着疾病进展,在健康受试者中发现的网络结构发生了破坏(Brier et al. 2014)。与健康对照组相比,原发性进行性失语症患者在路径长度、聚类系数和模块度方面存在差异,表明原发性进行性失语症组中的网络组织更加分离(Tao et al. 2020)。
2.5. 预测建模与人工智能
功能性磁共振成像(fMRI)提供了一种在系统层面探索人类大脑表征的工具,既可以检查大脑区域内的局部活动模式,也可以检查整个大脑的分布式活动和连接模式。研究人员越来越感兴趣于构建心理现象的综合多变量大脑模型(Woo 等,2017)。这些模型的复杂性各异,从单一大脑区域活动与结果之间的简单关联,到更复杂的多变量模型,解释分布在解剖区域和系统中的众多特征的脑活动模式对结果的影响。这类多变量模型已被开发用于各种心理现象,并应用于多种神经和精神疾病(Haxby 等,2000;Wager 等,2013;Arbabshirani 等,2017)。
这类分析的一个共同目标是利用大脑活动来预测结果或为心理状态或结果开发风险评分。这涉及将大脑特征视为一组预测变量 B,将行为或临床变量视为一个或多个结果 S。因此,从概念上讲,我们寻求确定 P(S|B)。这种方法被称为预测映射,它不同于传统的大脑映射中使用的广义线性模型(GLM)方法,后者侧重于基于刺激或症状推断大脑区域的激活,或 P(B|S)。
预测映射可以考虑其他相关的心理变量,并将大脑活动与通过心理测量模式测量的潜在心理变量相关联。尽管通常被称为多体素模式分析,预测映射不必仅仅在体素上操作;它也可以分析网络、区域或其他分布式组件。预测映射可以预测分类或连续的结果(Pereira 等,2009),并使用相关的回归或分类线性或机器学习工具。
尽管初期取得了一些成功,但基本的限制因素阻碍了这些大脑模型的精确性和泛化能力。一个显著的限制是个体功能拓扑的变异性,即尽管解剖上对齐,不同个体在特定刺激的最佳编码皮层区域存在差异。近期在个体间功能对齐方面的进展,如超对齐(hyperalignment)(Haxby 等,2011;2020)、共享响应模型(shared response model)(Chen 等,2015)以及使用最优传输(optimal transport)进行对齐(Thual 等,2022),旨在通过基于共享表征几何对齐个体间的功能大脑表征来应对这些挑战。
在分析 fMRI 数据时,人工智能(AI)模型相较于传统统计模型具有多项优势。首先,神经网络(NN)能够捕捉复杂的非线性关系。这对于 fMRI 数据尤为重要,因为大脑活动由神经区域之间复杂的非线性交互所支配。神经网络还能够通过连续的层次自动学习数据的分层表征,这对于从成像数据中提取难以通过传统统计方法捕捉的相关特征或模式是有益的。可以使用神经网络构建自编码器进行降维和特征学习。最后,一些神经网络能够捕捉比常用于表示 fMRI 数据的多变量自回归模型更长距离的依赖关系。同时,神经网络的可解释性有限,容易过拟合,并且计算密集。
循环神经网络(RNN)是一类专门处理序列数据(如 fMRI)的深度学习模型。然而,由于梯度消失问题(Bengio 等,1994),传统的 RNN 在捕捉长期依赖关系方面存在困难。来自早期时间步的信息在通过网络层传播时迅速衰减。为了解决这个问题,长短期记忆(LSTM)网络被采用,它们设计用于捕捉序列数据中的长期依赖关系(Hochreiter & Schmidhuber,1997)。LSTM 网络在 fMRI 数据分析中的应用示例包括提取用于下游分析任务的时间表征(Wu 等,2022)、预测认知状态(Li 等,2022)以及生成用于模拟研究的合成 fMRI 时间序列数据(Qiang 等,2021)。然而,大多数将 LSTM 网络应用于非常长的 fMRI 时间序列的应用倾向于使用分箱或滑动窗口技术,因为 RNN 存在的问题。
最近,最初为自然语言处理任务提出的Transformer模型在分析fMRI数据方面显示出了潜力。Transformer模型具有自注意力机制,使其在进行预测时能够权衡输入序列中不同部分的重要性(Vaswani等,2017)。最初,输入的时间序列被转化为一组嵌入。这涉及将每个ROI在每个时间点的时间序列映射到一个更高维的空间,可能包括诸如时间特征的信息。为了构建注意力机制,查询(Q)、键(K)和值(V)是从这些嵌入中导出的。计算注意力的公式因此为:
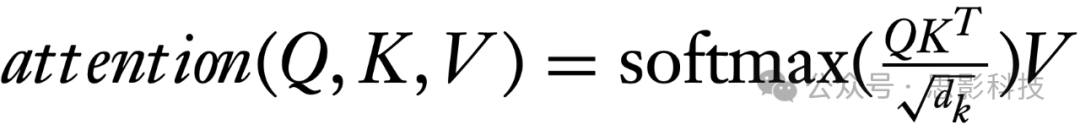
其中dk是键的维度。考虑一个例子,我们可以定义 H = Q = K = V,其中元素hjk是前一隐藏层第k个ROI的第j个时间的输出(Huang et al. 2021)。
在fMRI分析中,注意力权重有助于模拟不同区域如何随时间相互影响。这种机制使transformer能够捕捉长程依赖关系,并比LSTM网络更有效地利用上下文信息,后者受到顺序处理的限制。Transformer具有高度可扩展性,可以处理任意长度的输入序列。它们还可以在大规模数据集上进行预训练。最后,transformer模型的注意力权重提供了对fMRI序列相关部分的洞察,使模型比LSTM网络更具可解释性。
然而,transformer模型在神经影像学领域仍然相对较新,也可能显著增加模型复杂性和计算负担。这一领域的持续研究包括开发针对神经影像学数据特定特征的transformer架构(Malkiel et al. 2022, Asadi et al. 2023, Bedel et al. 2023)。
2.6. 多模态功能-结构整合
在过去的十年中,越来越多的研究强调整合多模态脑成像数据,以深入了解人类大脑在健康和病理状态下的复杂运作。这种跨学科的方法结合了各种成像模态,如结构磁共振成像(MRI)、扩散张量成像(DTI)和功能性磁共振成像(fMRI),以实现对大脑结构和功能的全面理解(Liu 等,2014,2015;Calhoun & Sui,2016;Niyogi 等,2024)。这些方法的协同作用使得能够探索大脑的解剖连接性、功能动态性和代谢状态,从而提供对大脑功能架构的整体视图。此外,DTI 和解剖 MRI 技术在提供针对广泛神经和精神疾病的个性化预测方面起到了关键作用(Sabuncu 等,2015)。
来自多源数据的结合通常采用数据整合或数据融合技术(Sui 等,2012)。整合方法通过利用另一种数据类型的信息来增强一种数据类型,其中一种模态的特征可以优化另一种模态的分析,从而提高预测模型的精确度(George 等,1995;Babiloni 等,2004;Henson 等,2010)。相比之下,融合方法则通过结合各种模态共同参与分析过程(Calhoun & Adali,2008;Friston,2009)。融合技术有助于识别多种成像模态之间的相互关系,这些关系在单独检查这些数据集时是无法察觉的。这些技术有潜力显著丰富我们的理解,使我们能够更明确地洞察与衰老或疾病相关的变化。其他允许多模态分析的辅助技术包括通过将一种模态的信息映射到另一种模态来研究功能-结构关联。例如,结构性大脑特征,如皮层形态和连接密度,在塑造功能连接模式中起着关键作用。因此,最近的研究表明,皮层区域内功能激活的程度与该区域的结构特征密切相关,包括皮层体积、厚度、表面积和曲率(Tillisch 等,2017)。此外,本地交换的皮层活动的程度似乎受到局部连接密度的影响(Bullmore & Sporns,2012)。
功能-结构关联的量化可以通过在健康和疾病人群中利用跨模态连接性和协方差模型来实现。该领域的研究重点在于探索不同成像模态之间的这种关系,例如 DTI-fMRI 和结构 MRI–fMRI 关联。近期研究强调了灰质和白质特性对特定脑区功能激活的影响,表明整合 DTI 和 fMRI 技术为阐明脑部疾病背后的认知过程提供了机会(Soldner 等,2012;Tang 等,2012;Mascalchi 等,2014)。此外,系统神经科学的一个基本假设是结构特征可以预测或与功能连接相关(Segall 等,2012),纵向研究进一步证明了在儿童和青少年大脑发育过程中结构变化与功能变化之间的同步性(Casey 等,2005)。
多样化脑成像测量的可用性促进了广泛分析方法的发展。这些方法的根本目标是检测在不同特征集之间表现出显著统计关联或相关性的潜在模式。具体而言,多变量方法擅长通过突出相关的潜在因素来揭示各种数据模态之间的联合关联。该类别涵盖了传统的潜变量模型,如偏最小二乘法(Martínez-Montes 等,2004)、多模态典型相关分析(Correa 等,2007)、概率主成分分析(PCA)(Tipping & Bishop,1999)和部分公共主成分分析(Flury,1987;Wang 等,2021a)。
此外,现代策略采用深度学习框架在共享潜在空间中捕捉非线性表示。诸如自编码器和变分自编码器(Kingma & Welling,2013;Rezende 等,2014;Antelmi 等,2019)等技术被用于其在潜在空间中解开潜在关联的能力。深度典型相关分析(Deep Canonical Correlation Analysis,Andrew 等,2013)进一步扩展了这些能力,提供了一个强大的工具用于深入的多模态数据分析。
2.7 数据预处理问题
在统计分析之前,fMRI数据需要经过一系列预处理步骤。这是必要的,因为BOLD信号包括由神经元激活和非神经元波动引起的变化。后者被视为干扰信号,研究人员在分析之前寻求将其去除。这包括诸如漂移、尖峰伪影、运动相关伪影以及由于非神经生理原因引起的波动等非神经元波动。这些相关噪声源可能对任何后续分析产生重大影响。因此,数据在分析之前需要经过一系列预处理步骤(Caballero-Gaudes & Reynolds,2017;Ciric 等,2017)。fMRI数据通常进行的主要预处理步骤包括重建、畸变校正、切片时序校正、运动校正、结构与功能图像的共配准、标准空间归一化、空间平滑、时间滤波和生理噪声校正。
一个重要的问题是,通常在任务fMRI(tfMRI)和静息态fMRI(rsfMRI)分析中使用的预处理流程是模块化的。这意味着它们由多个独立的步骤按顺序和灵活的顺序执行。研究表明,以这种方式进行预处理可能会重新引入在先前预处理步骤中已被移除的伪影(Lindquist 等,2019)。如果考虑到每个步骤都由一个独立的算法组成,通常是将数据对干扰协变量进行线性回归,随后使用残差进行后续分析,或者设计用于去除特定类型伪影的线性滤波操作,就可以看到这一点。因此,每个步骤可以被视为将数据投影到一个子空间上的几何投影,执行一系列投影可能会将数据移动到不再与先前移除的子空间正交的子空间,从而重新引入与干扰协变量相关的信号。因此,线性滤波操作不是可交换的,执行顺序至关重要。当任何标准预处理步骤的组合(包括运动回归、清洗、基于成分的校正、生理校正、全局信号回归和时间滤波)按顺序执行时,这些问题可能在实践中出现。
2.8. 重复性
鉴于存在噪声和复杂的处理决策,测量验证在该领域中必然成为核心关注点。本文所涵盖的许多测量类型的一个关键问题是数据采集地点的影响。地点效应可能包括扫描仪的品牌和型号、数据采集协议以及进行分析的团队的特殊性。即使在仔细校准和控制下,地点效应仍然使跨地点比较具有挑战性,对多地点研究产生了巨大影响。借鉴计算生物学中纠正所谓批次效应的思路,神经影像学中的地点效应已经通过线性调整策略得以解决,例如著名的ComBat(Yu等,2018)技术。除了ComBat,研究人员还解决了已知的伪影问题,如fMRI中的运动伪影(详见Power等,2015的综述)。最近的研究将地点和批次效应视为因果效应,从而使用因果推断的统计工具(Bridgeford等,2021a)。
技术重复样本的使用是验证脑测量的主要工具。这些技术允许测量重复性,即在重复测量下测量结果的相似程度。在一组在两次测量中被测量的受试者中计算最小距离匹配数,即所谓的指纹,是一种常见的重复性衡量方法(Finn等,2015;Airan等,2016;Wang等,2021b)。测量是否作为指纹功能有其用处,但并不完整;测量的可重复性既不是测量效用的必要条件,也不是充分条件。尽管如此,在其他条件相同的情况下,具有低的受试者内变异性和高的受试者间变异性对于更好地利用fMRI特征是更好的。
一些可重复性度量包括图像组内相关系数(I2C2)(Shou et al. 2013)和可辨别性(Bridgeford et al. 2021b)。I2C2是一种基于二阶矩的组内相关度量,利用多层主成分分析(PCA)(Di et al. 2009)。这属于多变量可重复性估计的类别,形式为g(Σbetween)/(g(Σbetween) + g(Σwithin))——即组间变异性除以组间和组内变异性之和的度量。I2C2使用g作为迹,其中变异性估计通过多层PCA获得。相比之下,Wilks的lambda使用g作为这些矩阵估计的行列式。而可辨别性则定义为在比较重复的主体对时,主体与自身的距离比与其他主体更近的实例比例。假设没有并列情况,与所有观测对之间距离相关的秩矩阵足以计算这些度量。此外,Wang等人(2020)发现了与可辨别性经验度量一致的群体模型。
2.9. 大规模神经影像学
神经影像学研究中收集的数据类型不断演变,这导致了新统计模型开发的需求。在未来几年,我们预计纵向研究、多地点研究、大样本量研究、每个参与者拥有多小时数据的小规模精密绘图研究以及联邦研究将会增加。在本节中,我们讨论其中的一些主题及其相关的统计问题。
2.9.1. 大样本量研究
最近关于小规模fMRI研究如何削弱神经影像研究可靠性的讨论很多(Button等,2013)。其论点是小样本研究在检测真实效应方面具有低统计功效,并且统计显著结果成为真实效应的可能性较低。最近,大量、不同生命阶段的数据集(包含超过1,000名受试者)可用性大幅增加。已经进行了若干大规模神经影像研究,以调查不同人群中大脑结构、功能和连接性的各个方面。
人类连接组计划(Human Connectome Project,HCP)是一个旨在描述和量化人类连接组(包括结构和功能)的倡议(Van Essen等,2013)。HCP由多个部分组成,每个部分针对特定的年龄范围,包括发育、年轻成人和老年(Somerville等,2018;Bookheimer等,2019)。人生HCP包括横断面和纵向分析,以比较不同年龄组的大脑连接性并跟踪个体随时间的变化。
青少年大脑认知发展(Adolescent Brain Cognitive Development, ABCD)研究是一项纵向项目,旨在了解来自多样背景的约11,000名儿童在10年内的大脑发展(Casey 等,2018)。所有儿童在研究开始时年龄为9至10岁,并在整个青春期及早期成年期被跟踪研究,使研究人员能够随着时间的推移跟踪大脑发展和行为的变化,并理解各种因素如何影响这些变化。该研究包括结构性和功能性磁共振成像(fMRI),以及认知和行为评估。
阿尔茨海默病神经影像倡议(Alzheimer’s Disease Neuroimaging Initiative, ADNI)是一项纵向研究,专注于阿尔茨海默病(AD)及相关疾病(Petersen 等,2010)。数据包括来自AD患者、轻度认知障碍者和健康对照者的MRI和PET扫描。其目标是识别疾病进展的生物标志物,并开发更好的早期诊断和监测方法。
通过元分析增强神经影像遗传学(Enhancing NeuroImaging Genetics through Meta-Analysis, ENIGMA)是全球研究人员之间的合作,旨在利用神经影像学研究大脑结构和功能。ENIGMA对来自多个研究团队的神经影像数据进行元分析,以提高统计功效并识别稳健的研究发现。它已对多种脑部疾病进行了研究,包括精神分裂症、重性抑郁障碍和阿尔茨海默病。参与的团队向集中数据库贡献数据,在那里采用数据协调程序,以确保跨地点数据以一致的方式处理和分析。大规模的元分析用于识别与特定脑特征或疾病相关的遗传变异。这些分析通常涉及数千名参与者,并利用先进的统计方法来检测稳健且可复制的遗传效应。
英国生物库(UK Biobank)是世界上最大的生物医学数据库之一,完成后将最终包括来自超过100,000名参与者的影像数据(Sudlow 等,2015;Miller 等,2016)。该数据库包括结构性MRI、扩散MRI和fMRI等多种数据类型。该数据库在促进与衰老、疾病风险和遗传相关的大规模人群推断方面具有独特的能力。
最后,急性转慢性疼痛特征(Acute to Chronic Pain Signatures, A2CPS)研究旨在开发一套客观的生物标志物,以预测在急性疼痛事件(如手术)后慢性疼痛是否可能发展或缓解(Berardi 等,2022;Sluka 等,2023)。A2CPS将结合影像学、组学、感觉测试和心理社会评估,研究与过渡到慢性疼痛或具有韧性的各种患者特征。该研究将跟踪大约2,800名参与者,从急性疼痛事件发生时起,持续六个月。
2.9.2. 统计考虑
大规模数据集数量的增加将需要开发新的统计方法来分析数据并识别有意义的效应。虽然一些常用的统计方法将继续适用于这一新范式,但其他方法则需要改进和进一步发展。使用标准样本量发现大脑结构和功能与行为表型之间的可重复关联是困难的。然而,随着样本量的增加,即使是小效应也具有较高的统计功效,更容易被检测到。检测这些显著效应中哪些是重要的,将需要增加领域知识以及采用替代的分析方法。
大规模数据集允许进行人群推断。然而,需要可扩展的统计推断方法来发现数据中的重要模式。考虑到异质性并确保研究发现能在不同群体中推广,将对得出有意义的结论至关重要。许多研究包含来自多个地点的数据,不同地点之间的成像协议、硬件和扫描程序的差异可能会导致问题。在统计分析中考虑这些类型的地点效应非常重要,如第2.8节所讨论的那样。涉及对同一对象进行重复测量的纵向神经影像学研究数量的增加,将需要能够有效处理相关数据和缺失数据的纵向统计模型。
显然,使用大规模数据集具有许多统计上的优势:首先,它们可以提供调查高阶交互作用和在模态之间进行数据融合所需的统计功效。其次,许多这些数据集提供了更为多样化的人口统计信息,能够以足够的精确度研究协变量。第三,它们允许研究人员对具有特定特征组的参与者进行子分析。第四,它们可以用于在分析较小规模研究的数据时创建先验。第五,它们提供了一种验证较小规模研究结果的方法。第六,它们可以用于测试新方法在小样本研究中的可重复性。
最近,Marek 等人(2022)利用 ABCD 研究的数据探索了样本量与效应量之间的关系。他们发现,随着样本量增加到数千,尽管效应量减小,但结果的可重复性得到了改善。也就是说,在分析大规模数据集时,研究人员应该预期较小但更可靠的关联。
最后,值得注意的是,不需要获取数千名参与者也可以获得稳健且可重复的发现。精密映射研究通过对相对较少的参与者(通常超过10小时的功能性数据)进行扩展数据采集(Gordon 等,2017),允许创建可靠的个体化大脑组织映射和生成个体特异性的功能连接组,这些连接组揭示了大脑网络中空间和组织变异性的重要新信息(详见 Michon 等,2022 的最新综述)。
2.10. 影像学中的争议
当然,每当使用统计方法时,防止模型假设的违反是非常重要的。在神经影像学(以及许多其他领域),一些标准统计方法尚未通过数据实验进行验证。Eklund 等人(2016)发现了一种常用方法假设的一个重大违反,他们展示了用于校正多重比较的随机场理论的一些关键假设在实践中被违反了。在这项研究中,他们使用来自多个受试者的静息态fMRI(rsfMRI)数据进行基于任务的群组分析。这些是零假设数据,因为没有任务。他们在使用标准方法控制多重测试时估计了假阳性率。值得注意的是,当名义假阳性率为5%时,他们发现一些标准fMRI软件包的假阳性率高达70%!一个关键原因是违反了随机场理论所依赖的模型假设。非参数置换检验对名义错误率的遵守更好。
分析流程的选择可能对fMRI研究结果产生重大影响。举例来说,Carp(2012)对同一数据集应用了6,912个独特的分析流程,发现虽然许多流程在类似区域产生了激活,但峰值位置因所使用的分析流程而有很大差异。Botvinik-Nezer 等人(2020)通过向70个不同的研究团队提供相同的数据集进行独立分析,进一步探讨了这一问题。研究表明,fMRI结果中的显著变异难以避免。这甚至引发了一个更微妙的统计问题,即使用不同流程的分析是否在测试相同的问题,因为包含额外的协变量最终会改变估计模型参数的解释(Lindquist,2020)。研究显示,尽管所应用的流程对用于做出显著性二元决策的阈值统计图有很大影响,但并未过度影响基础的空间模式,这些模式在不同流程之间似乎是稳定的。这指出了在高维环境下使用零假设显著性检验框架中使用高阈值相关的问题。它还表明,可能更好地使用直接利用空间模式来分析数据的多变量模式基方法,而不是专注于单个体素的检验。此外,Marek 等人(2022)的上述结果显示,与单变量方法相比,多变量方法在可重复的全脑关联方面表现更高。
3. 入门指南
对于那些希望开始进行功能神经影像分析的人来说,当然第一步是获取数据并将其读入分析系统。幸运的是,如前所述,已经有多个倡议在研究人员之间公开共享医学影像数据。这些倡议从不同地点、扫描仪和成像协议获取数据,组建了丰富的资源。此外,还有几个用于医学图像处理的免费开源软件包。神经影像数据最流行的软件包仍然是 SPM(统计参数映射)(Friston 等,2007),这是一个基于 MATLAB 的工具箱。AFNI(功能神经图像分析,Analysis of Functional NeuroImages)(Cox,1996)是另一个用于大脑图像分析的全面软件包。FSL(FMRIB 软件库)(Jenkinson 等,2012)是另一个可用于分析fMRI、MRI和DTI数据的软件包。FreeSurfer(Fischl,2012)是一个用于研究大脑表面,特别是皮层和皮下解剖结构的工具箱,使用结构性、fMRI、DTI和PET数据。此外,还有一个基于 Python 的管道,Nipype(Python 神经影像管道和接口,Neuroimaging in Python Pipelines and Interfaces)(Gorgolewski 等,2011),它在一个统一的框架内提供了上述软件包的接口。因此,Nipy(https://nipy.org/)的用户可以交互式地探索来自不同软件包的算法并将它们组合起来以更快地处理数据。最后,我们提到 Neuroconductor,这是一个专门为从事神经影像统计工作的统计学家设计的 R 语言平台(Muschelli 等,2019)。
4. 展望未来
展望未来,自然需要对功能神经影像学界正在努力解决的一些最重要的开放性研究问题进行评估,并预测这些问题在未来十年可能成为研究重点。
转化神经科学,位于基础神经科学与临床应用的交汇处,是一个极为重要的关注领域。随着功能神经影像学的出现,人们有相当大的乐观预期,认为它不仅会增强我们对心智的理解,还会提供临床上有用的工具。然而,除了在术前规划方面的进展外,它对临床实践并未产生显著影响。我们相信,增加预测模型的使用可以提供有效的效应量和临床意义的估计,从而为基于功能神经影像数据的临床生物标志物的发展铺平道路(Woo 等,2017)。
未来研究的一个重要驱动力将是大规模、多样化的全生命数据集的可用性。随着数据可用性的激增,对有原则的统计方法来分析随之而来的数据并发现有意义的效应的需求也随之增加。虽然某些传统统计方法在这一新兴范式中仍将保持其效用,但其他方法则需要改进和进一步发展。展望未来,我们预计将更广泛地整合替代方法论,如贝叶斯技术和多变量预测模型,并辅以效应量等测量方法的增加使用。此外,从流行病学文献中获得的见解表明,许多大信号在进行大规模研究和实施混杂因素校正后会减弱或显著衰减。
这些全生命周期数据集通常为每个受试者收集大量来自多种不同成像和非成像模态的数据。整合这些不同类型的多模态数据代表了另一个关键的进步途径。使用不同数据类型进行有原则的数据融合的发展,特别是在存在缺失数据的情况下,仍然是一个重大挑战。
小规模研究也可能发挥作用。令人惊讶的是,不需要实际的人类就可以测量功能性的人类脑细胞(Smirnova 等,2023)。最近的生物技术使科学家能够从干细胞创建功能性脑类器官,即由神经元和其他神经细胞组成的小簇。诱导多能干细胞可以从其他细胞(通常是皮肤细胞)分化为脑类器官。然后,可以使用与脑电图(EEG)和皮层电图(EcOG)概念上类似的技术来测量由此产生的类器官中的神经元功能。类器官代表了一种在体外测量人类神经元功能的令人兴奋的新方法。
最后,与其他学科一样,人工智能(AI)将在神经影像学研究中扮演越来越重要的角色。虽然AI在学习特定算法方面表现出色,但其在生物标志物开发方面的记录不那么成功(He 等,2020)。然而,AI在功能神经影像学中有许多潜在的应用。首先,AI可以作为强大的数据合成工具,促进自动化的元分析、分析流程和脑图信息的合成。其次,AI通过迁移学习等技术,能够以有原则的方式融合群体级数据集与小规模数据集。第三,AI可以基于现有数据集生成合成数据,从而允许敏感数据的共享。第四,AI有潜力以更短的采集时间获取更高质量的图像。
对使用fMRI数据理解功能性大脑的兴趣仍然广泛存在。持续的发展速度和问题的跨学科性质为研究人员带来了巨大的挑战。跨学科合作仍然至关重要。统计学在其中扮演着重要角色,但统计学家必须拥抱问题的跨学科性质,走出自己的舒适区。在本文中,我们试图阐明脑成像领域中的一些令人兴奋的问题,并为统计学家参与其中提供了切入点。























 3947
3947

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








