论文简介

标题:Longitudinal MRI-based fusion novel model predicts pathological complete response in breast cancer treated with neoadjuvant chemotherapy: a multicenter, retrospective study(纵向MRI结合新模型预测新辅助化疗乳腺癌的病理完全缓解:多中心回顾性研究)
作者:YuHong Huang; Teng Zhu; XiaoLing Zhang; Wei Li; XingXing Zheng; MinYi Cheng; Fei Ji; LiuLu Zhang; CiQiu Yang; ZhiYong Wu; GuoLin Ye; Ying Lin; Kun Wang.
期刊:eClinicalMedicine(IF=9.6)
原文链接:https://doi.org/10.1200/JCO.2023.41.16_suppl.599
文章亮点
这篇论文的创新之处在于利用纵向多参数MRI结合影像组学和深度学习技术,开发出一种集成学习模型来预测乳腺癌患者对新辅助化疗(NAC)的病理完全缓解(pCR)。
通过提取和分析大量的影像特征,该研究能够针对不同的乳腺癌分子亚型(HR+/HER2−、HER2+和TNBC)构建精确的预测模型。多层感知器(MLP)在所有亚型中表现出卓越的诊断性能,尤其是在外部验证队列中展示了高准确率、敏感性和特异性。
这种非侵入性工具不仅在多中心数据集上表现出稳健性,还能够帮助临床医生制定个性化的手术策略,特别是在决定NAC后的乳腺保留手术和前哨淋巴结活检方面。该研究为乳腺癌治疗提供了一种创新的决策支持工具,具有广泛的临床应用潜力。
概念解析
影像组学:影像组学是一种高通量的方法,用于从放射影像(如CT、PET、MRI等)中自动提取和分析大量定量影像特征。其一般流程包括:数据选择、医学成像、特征提取、探索性分析和建模。通过这些流程,影像组学可以揭示影像中潜在的生物学信息,辅助临床决策。
深度学习技术:深度学习是一种机器学习算法,模仿人类大脑的神经网络结构,特别适合处理复杂模式和大规模数据集。它通过训练多层神经网络,从数据中自动学习特征和模式,广泛应用于图像识别、自然语言处理等领域。在医学领域,深度学习技术可以用于自动识别和分类医学影像中的病变。
影像组学+深度学习技术:影像组学与深度学习技术的结合是为了更有效地处理和分析医学影像数据。通过深度学习的能力,能够自动提取更为复杂和深层次的影像特征并进行模式识别,而影像组学提供的高通量特征分析使模型具有更高的稳定性和一致性。结合两者的优势,可以创建更为精确和鲁棒的预测模型,从而提升对疾病的诊断和预测能力。这种集成方法能够增强影像解析的深度和广度,为个性化医疗提供强大的技术支持。
影像组学和深度学习技术的联合为医学研究和临床实践带来了多方面的重要益处。自动化分析复杂的医学影像数据,显著提高诊断和分级疾病的准确性与效率,从而助力医生制定更精确的治疗方案。此外,这种结合还促进了个性化医疗的发展,通过深度学习模型对影像组学特征的深度挖掘,可识别特定患者的生物标志物和预测疾病进展。
这种跨学科的整合不仅为科研人员提供了发表高质量论文(如SCI)和申请重要基金(如中基金)的机会,还能够完善临床知识体系,提高疾病诊断的准确性。
更重要的是,现在对比单组学文章,发现多组学更具有优势!此外,多组学融合机器学习技术,多重创新点叠加,文章竞争力更强!终极秘籍还是在于结合临床!将组学数据与临床和病理信息相结合,临床应用价值不就上来了吗?
如果有做这方面研究并且想发高分论文的小伙伴们现在可以抓紧上车9月份的影像组学人工智能应用培训班!
课程大纲:

培训班适用人群:
放射科医生/技师、超声科医生/技师、临床各科室医生、研究生、科研人员
培训班开课时间:
2024 年 9 月 20 日— 22 日远程在线授课
(开课前一天帮助学员安装平台,后三天授课)
培训班报名:
添加肖老师立即报名学习(laoxiao2077)
报名福利:
1.给数据:提供10G+的影像,病理,超声,临床等多模态练习数据。
2.给工具:特征提取、建模,统计分析,绘制ROC,DCA,校准曲线等图表一键执行,体验三天一篇SCI;而且这些工具赠送实操讲解视频。
3.给思路:10篇SCI多维度拆解,从 0 到 1 拆解论文步骤,技术路线的具体应用。
4.给福利:后续每周训练营解构中科院一区,二区,三区文章100+ ,10小时的标书热点方向视频讲解,300+SCI论文,100小时各种论文构思拆解回放全部免费送
研究背景和目的
乳腺癌患者对新辅助化疗(NAC)的反应存在显著差异,准确识别病理完全缓解(pCR)对于制定合适的手术策略和指导切除范围至关重要。然而,目前缺乏一种非侵入性工具能够准确预测pCR。影像组学和深度学习作为医学影像定量分析的强大工具,能够从多参数磁共振成像(MRI)中捕捉到肉眼无法识别的肿瘤异质性,并基于乳腺癌的特定分子亚型进行精确分析以预测pCR。
尽管已有研究探索了影像组学和深度学习在预测乳腺癌NAC反应中的潜力,但尚无研究专门针对不同分子亚型的乳腺癌,利用纵向MRI影像组学和深度学习技术预测pCR。
因此,本研究的目的是开发一种基于纵向多参数MRI的集成学习模型,能够准确预测乳腺癌患者在接受NAC后的pCR。通过在多中心数据集上的验证,该模型不仅展示了其在不同中心的稳健性,还为乳腺癌术后治疗策略的个性化制定提供了潜在的临床应用价值。
方法学概述
影像组学分析:研究从每位患者的NAC前和NAC后的多参数MRI序列中提取了14,676个影像组学特征。使用了Pyradiomics模块进行特征提取,这些特征包括形状特征、灰度依赖矩阵(GLDM)、灰度大小区域矩阵(GLSZM)、邻近灰度差异矩阵(NGTDM)、灰度游程长度矩阵(GLRLM)和灰度共生矩阵(GLCM)等。为了获取更多衍生图像,应用了高斯滤波器和小波变换。
深度学习分析:研究采用了ResNet50框架进行深度学习模型的训练。模型接收多个输入,包括NAC前和NAC后的动态对比增强(DCE)MRI图像。训练完成后,从全连接层中提取特征作为深度学习特征,总共获得了4096个特征。
特征选择:使用了最小绝对收缩和选择算子(LASSO)回归来减少特征数量,并通过Spearman相关性分析评估特征间的多重共线性。对于相关系数≥0.8或≤−0.8的特征对,仅保留诊断性能更好的特征。
机器学习模型构建:使用选择的影像组学和深度学习特征构建了三种单一模态模型(NAC前、NAC后和delta模型)。采用了五种分类算法,包括逻辑回归、随机森林、XGBoost、支持向量机(SVM)和多层感知器(MLP)神经网络。最终通过集成学习策略整合单一模态模型。
模型评估:使用ROC曲线、校准曲线和决策曲线来展示模型的预测能力,并计算了AUC、特异性、敏感性、准确性、阳性预测值(PPV)和阴性预测值(NPV)等诊断指标。
图文导读
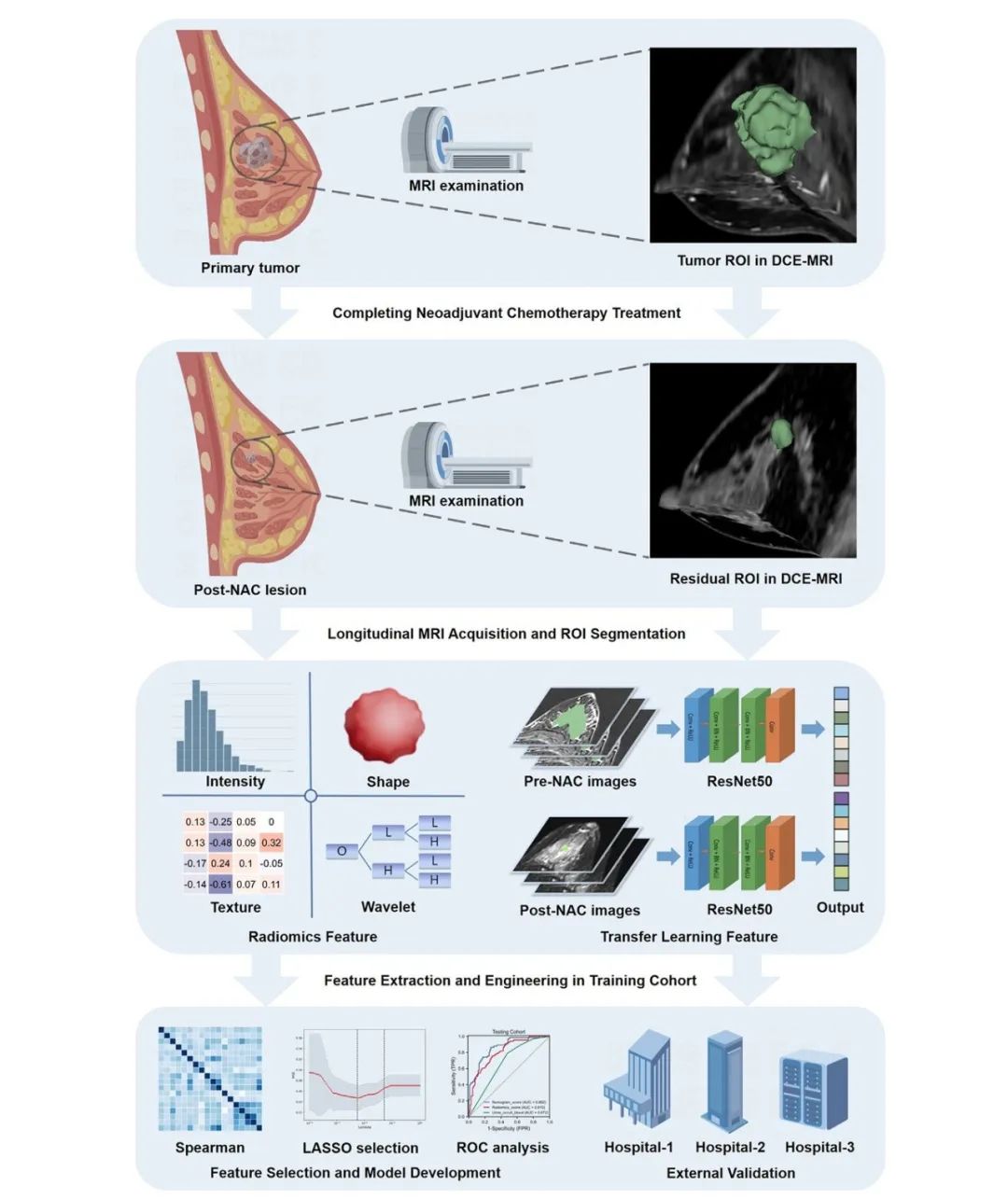
图 1:基于纵向 MRI 的放射组学深度学习在预测新辅助化疗的病理完全缓解(pCR)中的研究设计和工作流程。
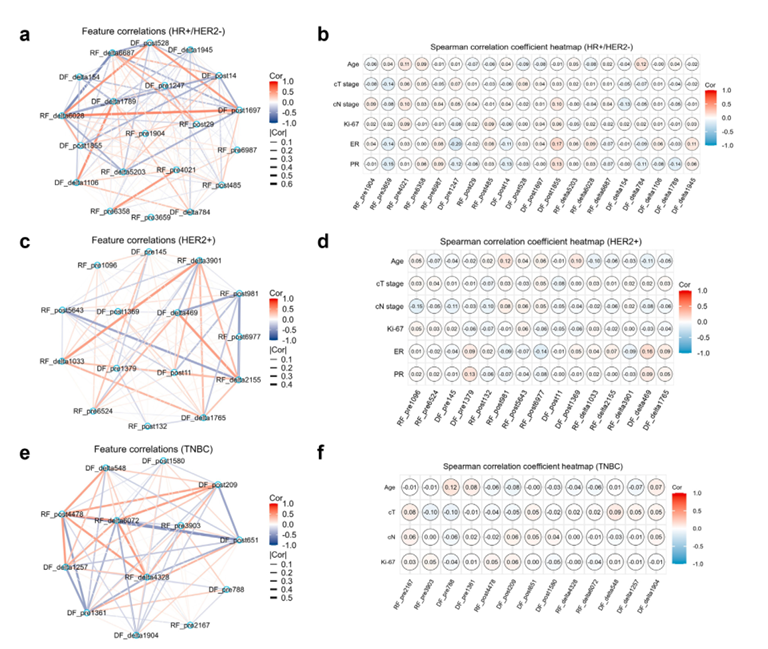
图 2:Spearman 相关系数网络图显示了在 HR+/HER2− (a)、HER2+ (c) 和 TNBC 亚型 (e) 中,每对选定特征之间的关系。Spearman 相关系数热图显示了在 HR+/HER2− (b)、HER2+ (d) 和 TNBC 亚型 (f) 中,选定特征与临床特征之间的关系。每个特征都是独立的预测因子,因为在每个亚型中都没有相关系数 >0.8 的情况。此外,来源于影像的所有特征与临床特征都是独立的,因为在每个亚型中也没有观察到相关系数 >0.8。
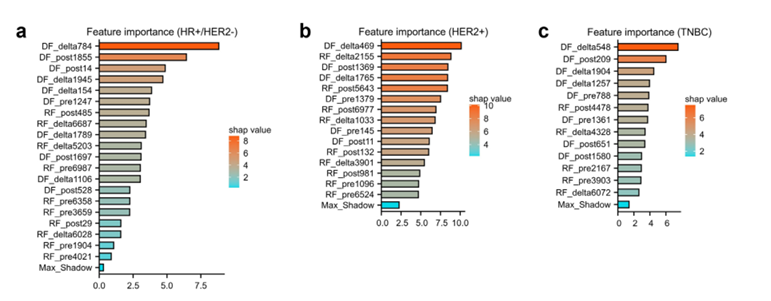
图 3:水平条形图显示了在 HR+/HER2− (a)、HER2+ (b) 和 TNBC 亚型 (c) 中,选定的放射组学和深度学习特征的重要性。在三个随机森林模型中,所有选定特征的 Shapley 值都高于每个亚型中相应的最大阴影值。这表明所有特征都对模型的开发有贡献。
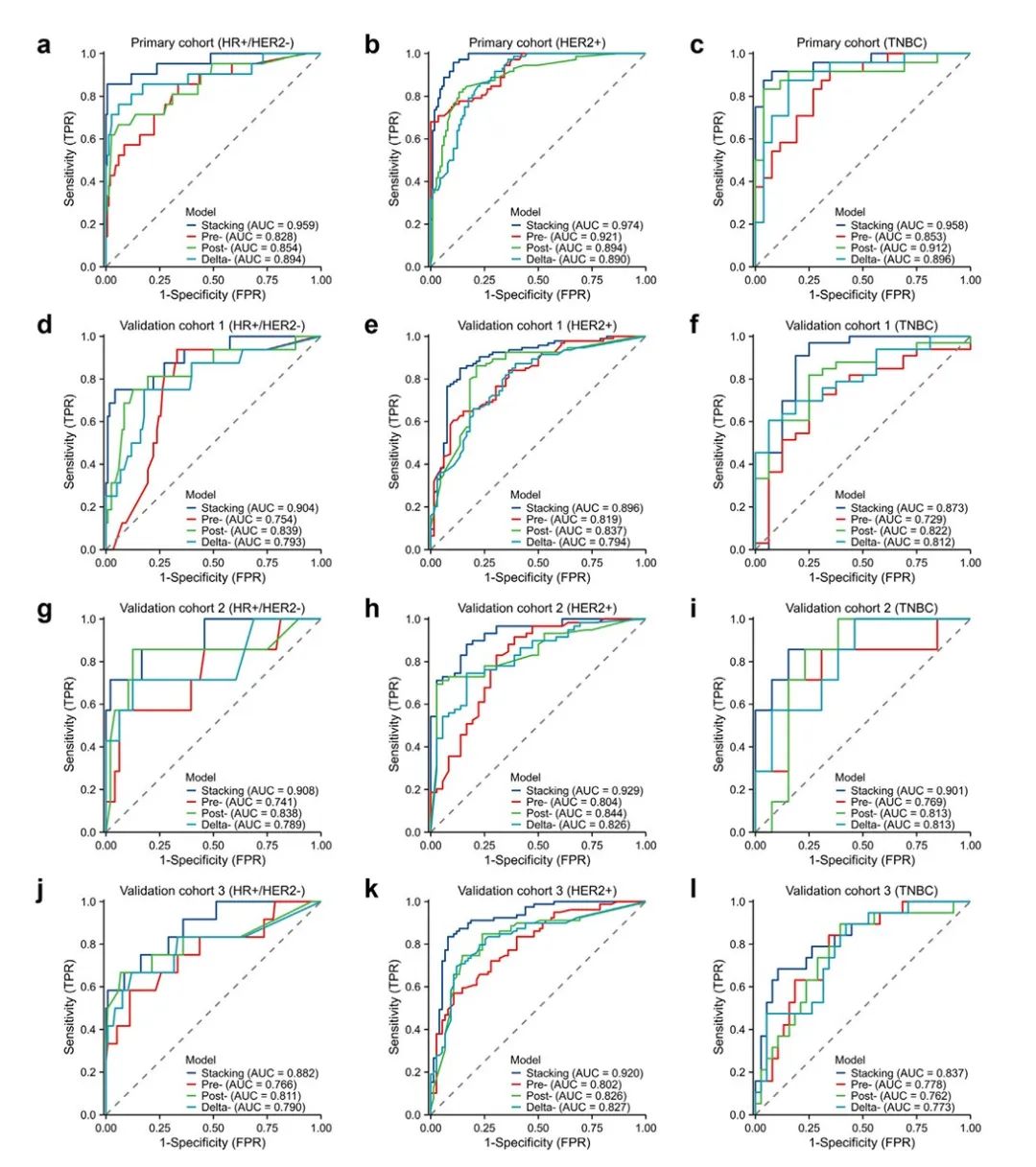
图 4:不同模型在主要和外部验证队列中的预测性能 (a–l)。图示显示了主要队列中,HR+/HER2− (a)、HER2+ (b) 和 TNBC 亚型 (c) 的堆叠模型、前模型、后模型和变化模型的 ROC 曲线。图示显示了验证队列 1 中,HR+/HER2− (d)、HER2+ (e) 和 TNBC 亚型 (f) 的堆叠模型、前模型、后模型和变化模型的 ROC 曲线。图示显示了验证队列 2 中,HR+/HER2− (g)、HER2+ (h) 和 TNBC 亚型 (i) 的堆叠模型、前模型、后模型和变化模型的 ROC 曲线。图示显示了验证队列 3 中,HR+/HER2− (j)、HER2+ (k) 和 TNBC 亚型 (l) 的堆叠模型、前模型、后模型和变化模型的 ROC 曲线。
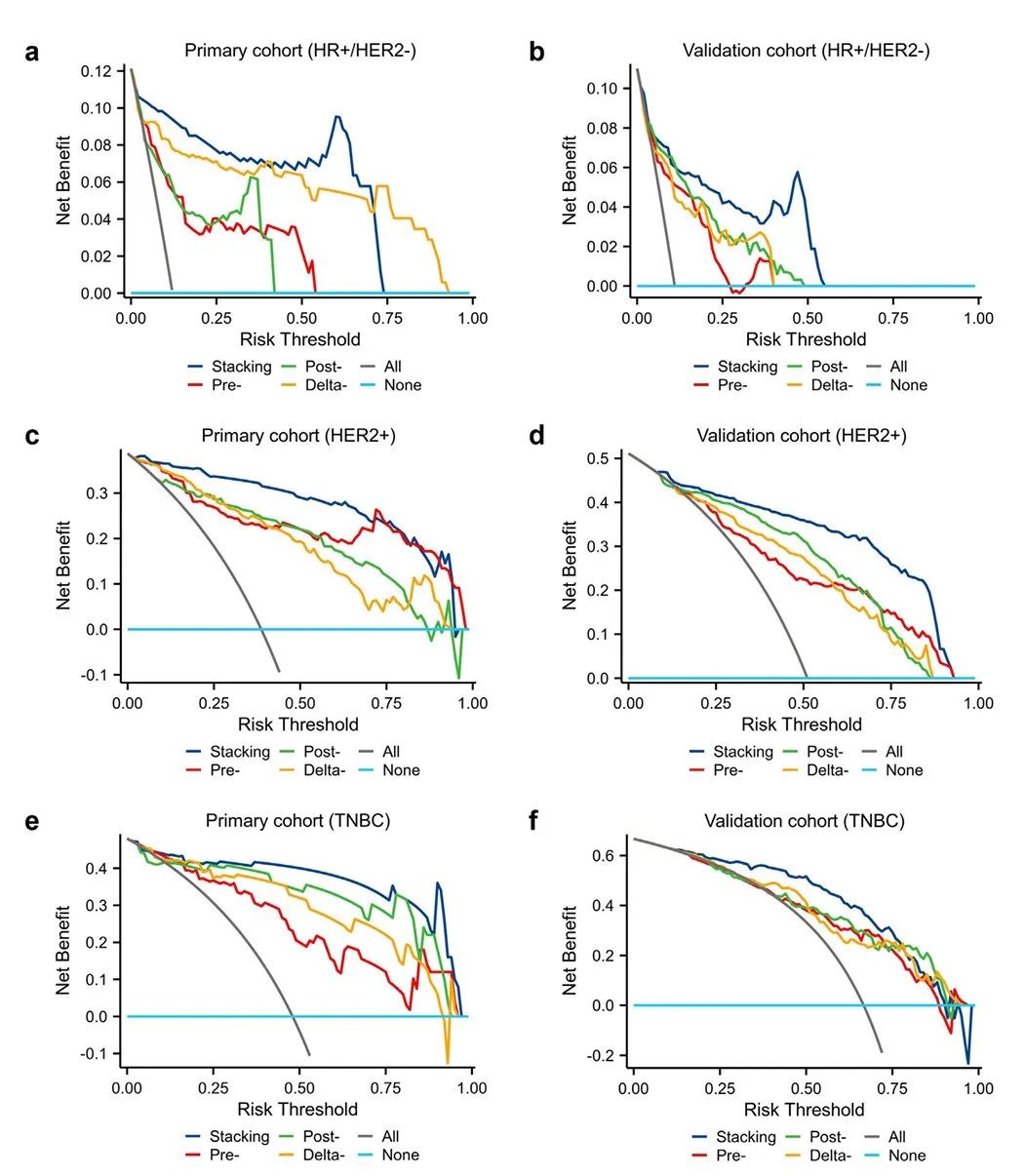
图 5:不同模型在主要和外部验证队列中的预测性能 (a–f)。图示显示了主要队列中,HR+/HER2− (a)、HER2+ (c) 和 TNBC 亚型 (e) 的堆叠模型、前模型、后模型和变化模型的决策曲线。图示显示了验证队列中,HR+/HER2− (b)、HER2+ (d) 和 TNBC 亚型 (f) 的堆叠模型、前模型、后模型和变化模型的决策曲线。
研究结果
本研究成功构建了基于纵向多参数MRI的集成学习模型,用于预测乳腺癌患者在新辅助化疗(NAC)后的病理完全缓解(pCR)。通过整合影像组学和深度学习特征,模型在不同分子亚型的乳腺癌中展现出卓越的预测性能。
研究结果显示,该模型在多个外部验证队列中均表现出较高的诊断准确性和稳定性,尤其是在AUC、特异性和敏感性等指标上均取得了显著的结果。此模型不仅能够帮助临床医生在NAC治疗后制定个性化的手术策略,如乳房保留手术和前哨淋巴结活检,还能在不增加额外费用的情况下,作为现有手术风险分层策略的补充。研究成果为乳腺癌的精准治疗提供了新的工具,并为未来在更大范围和人群中应用奠定了基础。
总结展望
本研究开发了一种基于纵向多参数MRI的集成学习模型,用于预测乳腺癌患者对新辅助化疗的病理完全缓解。该模型在多中心验证中展现出优异的诊断性能,为临床决策提供了有力支持。这一非侵入性工具有望改善手术风险分层策略,协助制定个性化治疗方案。
然而,本研究仍存在一些局限性,如回顾性设计和单一影像模态的使用。未来研究方向包括进行前瞻性验证、整合更多影像模态(如病理全切片图像和超声图像),以及探索模型在更广泛地区和人群中的应用价值。此外,将该模型与临床因素相结合,可能进一步提高预测准确性,为乳腺癌患者的精准治疗开辟新途径。























 1750
1750

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










