有时候需利用电泳后胶图定量DNA的浓度和含量,这里需要对图像中的条带作灰度分析。灰度是图像中每个像素的亮度信息。这里结合我自己使用imageJ分析灰度的经验,总结下大概流程和小贴士。
分析灰度的两种方法:
法1 mageJ打开胶图>Image>Type>8-bit,Edit > Invert>Process>Substract Background, Analyze>set scale>转换为pixel,>Set measurements>选中IntDen,Area,Mean gray value>框选条带ctrl+m测定>测空白处>空白处积分密度-条带积分密度
图解:
1.图片处理:
Image>Type>转换为8-bit,
Analyze>set scale>将单位转换为pixel


黑白反转,去背景:

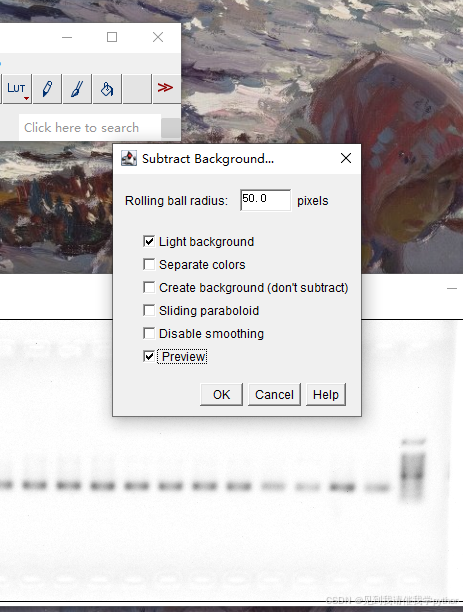
2.测量:
Analyze>set measurements处设置需要测的参数,这里选了面积、平均灰度和积分密度

选择工具:

个人选用的是方框,有朋友反应她用椭圆工具比较好用。我这里因为后面设定了ROI,所以方框用起来也很方便
框选了marker条带,打开Analyze>Tools>ROI manager(选区管理器),弹出来一个小弹窗管理器,点击add将这个框添加到管理器中,以后如果不小心丢失了选框,只要在管理器中点击这个框的名称,就会在这个框选定的地方重新出现你的方框,再也不用担心测量多个条带时选框丢掉


(图中选区有设置第一道,也就是框中间那个序号1,在这个方法中不需要)
接下来,就可以ctrl+M或者英文输入法下单击M愉快地测定啦
在测定时,框的面积保持一致。在使用鼠标时,如果光标在框内是箭头,就是可以移动方框且不变形,若光标是手指,方框会变形
当然,选择方框,然后键盘上下左右键平移,也非常丝滑~

在测完条带后,不要忘了选一处背景,测一下
得到结果后,看RawIntDen,用空白处的减去其他条带的,得到结果与DNA浓度成比例。假如知道一条的浓度和灰度结果,就可以对其他条带进行定量
如已知这个marker最上面一条是10ng/uL,也就是其他条带浓度可以根据比例计算:
 (S1)
(S1)
Fin
法2 个人觉得比较适合高通量工作:
mageJ打开胶图>Image>Type>8-bit,Edit > Invert,Process>Substract Background, Analyze>set scale>转换为pixel,框选空白区>ctrl+1选定>ctrl+c +v复制空白到与条带同高度的marker处,遮挡下杂乱的带,后同样选区选定可以分清的一条marker,复制到与待测条带一样水平处。
框选一行条带,带上空白>Crtl+1>ctrl+3,直线工具划分峰图,魔棒点击计算面积>测试条带的积分-空白处的积分(area)
大概是通过图像中像素灰度计算积分,下面是操作:
转换为8-bit类型,黑白反转,消除背景,设置长度单位的工作相同,
后面我需要把marker条带抠到和其他条带同一水平,因为我的ladder比较杂乱,所以我先抠了一块背景遮一下没有用到的ladder
框选一片背景,
ctrl+1或者Analyze>Gels>Select First Lane,选择选区

选中的区域可以ctrl+C,ctrl+V,在选框原位被复制,只要把它拉到该去的地方就好了
 →
→
同样操作,选区,复制,将顶上分离的marker复制到和其他条带一个水平

开始测量:
框选要测的条带:

我这里后面多选了是为了测背景。ctrl+1选择第一道,然后ctrl+3或Analyze>Gels>Plot Lane,调出这一泳道的图像

用直线工具划分每个独立的峰:

选择魔棒工具,单击每一个峰,出来一个弹窗是峰下面积

条带峰下面积减去空白处的峰下面积,得到灰度结果,用S1计算待测条带DNA浓度
Fin
法1和法2计算出来的结果相关性好,两种方式都可以用来定量DNA

其他小Tips:假如使用的核酸染料带电荷,比如带正电,在电泳过程中染料也会迁移。所以如果使用大胶,要注意各层的核酸染料不一样,得到的条带亮度不一样,所以每一层条带只能和本层的marker比较、定量。所以跑胶时每一行都放一个marker。
如有纰漏,敬请指正




















 2万+
2万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








