今天分享一篇2021年6月份的文章,发表在Hepatology, IF:17.423。文章探索了伴有血管侵犯肝细胞癌的分子景观,识别了由MYC癌基因驱动的不同转录、表观遗传和蛋白质组学变化;FN1蛋白组织高表达,血浆水平高表达及其侵袭迁移的生物学功能,并证实FN1作为潜在无创生物诊断标记物的临床意义。文章内容复杂,环环相扣,让我们看看它是如何完成的。

一、摘要
Background and aims: 血管侵犯(VI)是HCC复发和预后不良的一个重要危险因素。HCC中血管侵犯的分子驱动因素还有待研究。探索侵袭性HCC的分子景观将有助于识别治疗靶点和无创性生物标志物。
Approach and results: 本研究,使用癌症基因组图谱(the cancer genome atlas; TCGA)数据。 在TCGA肝癌队列(n = 373)中,5% (n = 17)的肿瘤存在大血管侵犯,25% (n = 94)的肿瘤存在微血管侵犯。 功能通路分析显示,MYC癌基因是VI中mRNA、miRNA和蛋白质组学变化的共同上游调控因子。研究进行了侵袭性的人源性HCC和MYC驱动的小鼠源性HCC的蛋白质组学比较分析,确定了纤维连接蛋白是侵袭性HCC的蛋白质组学生物标志物(小鼠纤维连接蛋白1 [Fn1], P = 1.7 × 10-11; 人类FN1, P = 1.5 × 10-4)。 在机制上,研究发现FN1促进肝癌细胞的迁移和侵袭表型。通过一个独立的人HCC组织芯片队列证明了人HCC中纤维连接蛋白过表达(n = 153; P < 0.001)。 最后,相对于肝硬化患者,HCC患者血浆纤维连接蛋白水平显著升高。
Conclusions:研究探索了伴有血管侵犯肝细胞癌的分子景观,识别了由MYC癌基因驱动的不同转录、表观遗传和蛋白质组学变化。MYC上调纤维连接蛋白FN1的表达,促进了HCC的侵袭性。此外,纤维连接蛋白FN1是伴血管侵犯HCC中的一种有前途的无创蛋白生物标志物。
二、流程图

三、结果简述
1. 血管侵犯是与肝癌复发相关的预后因素。
在TCGA队列(n=373)中,血管侵犯(VI)存在于34.9%的肿瘤患者(n=111),大血管侵犯存在于5.8% 患者(n=17)和微血管侵犯存在于29.1% 患者(n=94)。

肿瘤分期越晚期(I期为14%,II期为64%,III期为53%)(p=0.03),更高的肿瘤分级(15%的低分级,46%的中/高分级)(p=0.03),更高的血清甲胎蛋白水平(p=0.02),HCC患者伴血管侵犯的患病率越高。


微血管侵犯(64%)和大血管侵犯(65%)肿瘤的复发率高于无血管侵犯(45%)的肿瘤。
(p < 0.001)。

与没有血管侵犯的HCC患者相比,存在大血管侵犯HCC患者预后较差。与无血管侵犯的HCC患者相比,存在微小或大血管侵犯的HCC患者无复发生存期明显较短。总之,HCC中存在血管侵犯与侵袭性肿瘤行为和不良预后密切相关。

为了确定人类HCC中驱动血管侵犯的基因组事件,研究首先比较了有或没有血管侵犯的肿瘤突变谱。TP53突变在血管侵犯肿瘤中的发生率(37.5%)高于无血管侵犯肿瘤的发生率(25%)。(p = 0.03)。与无血管侵犯的HCC患者相比,染色质结构的调节因子HIST1H1C的突变几乎只存在于血管侵犯的HCC患者中(4.8%vs0.5%,p=0.01)。
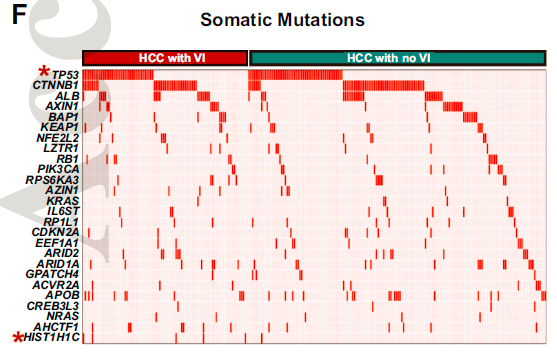
此外,在有无血管侵犯的HCC患者之间,没有发现任何显著的拷贝数差异,拷贝数变之间具有相似性。

因此,目前的研究结果并没有揭示伴血管侵犯的HCC肿瘤中基因型与表型之间的关系,这促使进一步研究转录组学和蛋白质组学的景观。
2. 伴有血管侵犯的HCC转录组景观。
研究进一步分析了HCC的转录谱,以识别血管侵犯肿瘤中失调的基因和通路。研究识别出102个差异表达基因,其中92个基因高表达,10个基因低表达。

将血管侵袭相关基因标记与已发表的HCC预后基因标记进行比较,研究发现在HCC中与不良预后相关的基因类富集,如Hoshida亚类S1,Boyault G3亚类和Woo肝癌复发特征等。

研究进行了上游调控途径分析,以确定全局转录变化的基因组驱动因素。最终识别出MYC (p=9.8 x 10-4), CREBZF (p=2.0 x 10-3), HOXD13 (4.2 x . 4),ATF4 (5.0 x 10-3)和ZBTB17 (5.02 x 10-3)是血管侵袭相关转录组中最重要的上游调控因子。通过证明血管侵袭相关基因标记与之前报道的其他几个MYC基因标记显著重叠,进一步证实MYC是这一表型的重要转录调控因子。


对于microRNA而言, 研究鉴定了70个microRNA,这些microRNA在血管侵犯的肿瘤中有差异表达,其中23个过表达,47个低表达。前10差异表达的microRNA及对应的靶基因展示如下。
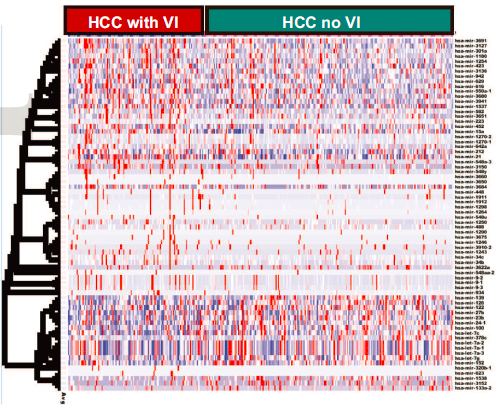

其中的一些microRNA,如mir-122、mir-21和mir-100,此前已被证实与HCC发病机制有关。这些数据证明了microRNAs如何可能使肿瘤转向更具侵袭性的表型。研究进一步分析上游调控因子分析,发现TP53 (p=1.4 X 10-10)、MYC (3.4 X 10-5)、CDKN2A (p=1.7 X10-4)、NPM1 (p=1.3 X10-4)和YBX1 (p=9.7 X10-4)是差异表达的血管侵犯相关microRNAs的前五大转录调控因子。

本研究通过对血管侵犯HCC肿瘤转录谱的分析揭示了与侵袭表型相关的基因和通路的富集,并确定了MYC癌基因作为HCC中血管侵袭的共同驱动因素(从mRNA,microRNA转录水平分析)。
3. 伴有血管侵犯的HCC 蛋白质组学改变的功能评估
考虑到蛋白质是细胞功能的最终效应器,为了进一步理解基因组和转录组变化的功能含义,研究分析了血管侵犯HCC肿瘤的蛋白质组学景观。在有无血管侵犯的肿瘤中进行差异蛋白表达分析,共识别出87个差异表达蛋白。
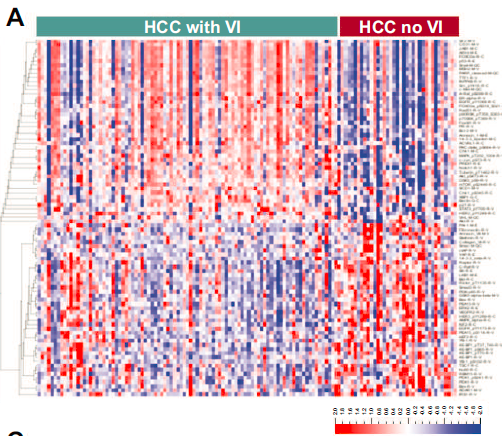
血管侵犯HCC肿瘤中表达前10种蛋白参与了多种细胞功能,包括细胞黏附、凋亡和代谢等。

蛋白组学变化的功能通路分析揭示了细胞活力(p=6.4 × 10-39)、细胞迁移(p=4.1 × 10-31)、增殖(p=1.5 × 10-49)和血管生成等生物学过程(p=3.5x10-14)在血管侵犯HCC肿瘤中显著上调,而凋亡(3.1x10-54)和衰老(7.7x10-15)等通路显著下调。

研究评估了蛋白质组变化的上游转录调控因子。前5位调控因子分别为TP53 (p= 1.4 × 10-37)、MYC (p=8.7 × 10-24)、JUN (p=5.3 × 10-23)、E2F1 (4.3 × 10-22)和FOXM1 (p=1.7x10-19)。

同时,RB1通路、VHL通路等肿瘤抑制通路在血管侵犯肿瘤中显著下调。因此,对HCC中与血管侵犯相关的蛋白质组学变化的功能分析描绘了侵袭性肿瘤表型的特征。
4.跨物种蛋白质组学分析表明,纤维连接蛋白是侵袭性HCC的生物标志物
本研究表明MYC癌基因是HCC中血管侵袭相关mRNA、microRNA和蛋白质组学变化的上游重要调控因子。利用MYC驱动的小鼠源性转基因模型进一步探索血管侵犯HCC肿瘤特征。

研究进一步发现血管侵犯是小鼠MYC-HCC的一个高度普遍的特征 。

研究通过液相色谱-质谱法(LCMS)评估了与MYC-HCC相关的蛋白质组学变化景观。与对照组小鼠肝脏相比,HCC肿瘤组织中含392个过表达蛋白,360个低表达蛋白。(此处为方便展示将此图旋转了90°)。

甲胎蛋白(AFP), β-catenin,vimentin等分子在人类HCC中较高,但在MYC-HCC更高;氨甲酰磷酸合成酶1,酸性磷酸酶1和醛缩酶B等分子在人类HCC中较低,但在MYC-HCC中更低。

在MYC-HCC中,蛋白质组学变化的上游最显著的调控因子被证实为MYC (p=8.2 X 10-79)。人HCC中其他基因组调控因子如Trp53 (4.1 X 10-53)和β-catenin (4.2 X 10-23)也被发现是MYC-HCC蛋白组学变化的重要上游调控因子,如下图所示。

在生物功能上,如癌细胞迁移(p=6.9 X 10-8)和侵袭性(1.4 X 10-7)在小鼠MYC-HCC中被激活,从而证实MYC-HCC肿瘤具有侵袭性表型。

研究进行跨物种比较分析,以识别在MYC驱动的小鼠HCC (n=759)和伴有血管侵犯的人HCC (n=87)富集的共有蛋白,最终发现7种蛋白质在两组之间重叠。

其中,纤维连接蛋白(FN1)在两个队列中都是过表达蛋白。蛋白印迹法(WB)进一步证实了纤维连接蛋白在MYC驱动的小鼠HCC中过表达。

免疫荧光表明在MYC-HCC的癌细胞和肿瘤间质中,纤维连接蛋白都被观察到过表达。此外,基质FN1主要在血管周和瘤周部位表达,在MYC-HCC的IHC染色中,10%的癌细胞本身表达FN1。


研究发现FN1在MYC-HCC中过表达。随后进一步发现MYC促进纤连蛋白FN1转录的机制证据。首先,Chip-seq实验的meta分析显示,MYC在该基因中与人类FN1基因上游结合。而后,motif 分析表明在真核启动子数据库(EPD)的数据中发现FN1启动子区域有多个MYC结合位点。随后,利用ENCODE数据库,根据FN1转录起始位点附近MYC结合位点的存在,确定FN1为MYC的转录靶基因。最后,发现在TCGA泛癌数据库中,包括HCC在内的13个实体瘤中,MYC水平与FN1水平呈正相关。(这些图均在附图,由于权限附件未能下载)。综上所述,这些结果表明MYC在癌细胞中转录调控FN1的表达。
5. 纤维连接蛋白(FN1)促进人肝细胞癌的侵袭和迁移
研究首先评估了纤维连接蛋白在人类HCC中的功能作用,利用cancer dependency map data数据库分析全基因组CRISPRi和RNAi来评估敲除纤维连接蛋白FN1影响肝癌细胞系的生存能力情况。在20个HCC细胞系中,所有细胞系在CRISPRi或RNAi筛选上的依赖评分均不低,表明FN1对肝癌细胞的存活或增殖不是必需的。

为了评估FN1在HCC中的功能作用,使用FN1敲低的两种HCC细胞株SKHep1和sn182F,这两种细胞株都有中性依赖评分。分别用qPCR和免疫荧光证实FN1 mRNA和蛋白的敲除效果。

由于在人类HCC中发现FN1与血管侵袭有关,本研究采用基底膜侵袭试验评估FN1是否在癌细胞侵袭中发挥作用。研究结果表明FN1敲低的癌细胞通过基底膜的侵袭能力下降。

通过划痕实验,研究还发现FN1敲低的SKHep1细胞系迁移能力也下降。上述结果均表明FN1促进肝癌细胞的侵袭和迁移能力。

6. 验证人HCC中纤维连接蛋白组织表达
在TCGA队列中,纤维连接蛋白FN1在肿瘤中的表达不仅与血管浸润有相关性,而且FN1高表达与肿瘤分期晚(p=0.01)肿瘤分级高(p=0.08),无瘤复发期短(p=0.001)(这些图均在附图,由于权限附件未能下载)。通过组织芯片进一步证实FN1的表达情况,肝细胞癌中FN1表达阳性的细胞百分比高于无肝细胞癌的肝硬化(25.3% vs. 17%, p=0.002)或对照组非肝组织(25.3% vs. 8.9%, p=0.01)。
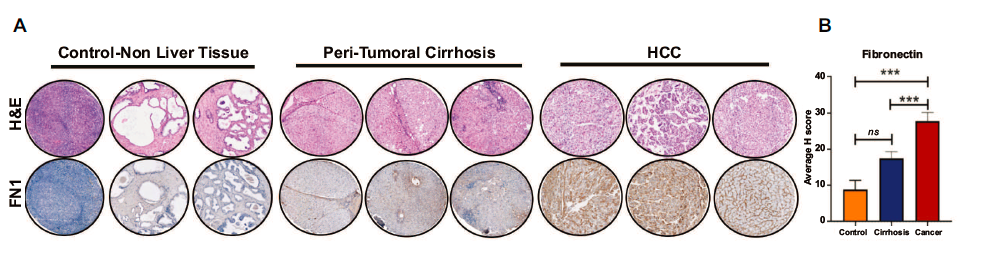
此外,研究还评估了来自公共肝癌样本库的人类病理蛋白图谱(HCPA)数据库的纤连蛋白表达情况,与组织芯片结果具有一致性,HCC肿瘤中均表达了纤维连接蛋白,大多数(75%,n=9)中至高表达,25%低表达。这些数据证实了纤维连接蛋白在人类HCC中显著过表达。
为了验证FN1表达与血管侵犯HCC之间的关系,研究分析了已知血管侵犯的肿瘤(n=6)和无血管浸润的肿瘤(n=6)的FN1表达差异和独立队列中人类HCC组织(n=12)中FN1的表达。两组患者的原发性肿瘤分期和肝硬化病因相匹配。结果仍表明FN1在肝癌组织中高表达。

此外,研究发现FN1在微血管侵犯肿瘤中的表达高于无微血管侵犯的肿瘤(p = 0.001)。有趣的是,在血管侵犯的肿瘤微血管系统中,纤维连接蛋白FN1在肿瘤栓子中持续过表达。这些结果表明在人类HCC中,肿瘤FN1表达与血管侵犯相关。

6. 纤维连接蛋白(FN1)作为晚期HCC的非侵袭性生物标志物
最后,该研究评估了纤维连接蛋白FN1是否可以作为肝癌的非侵袭性血浆生物标志物。研究进行了一项试点病例对照研究,前瞻性招募了年龄、性别、种族和肝硬化病因相匹配的HCC患者(n=35)和无HCC肝硬化患者(n=10)。

与肝硬化对照组相比,HCC患者血浆纤维连接蛋白水平显著升高。相比之下,在TCGA队列中,另外两种在HCC组织中高表达的蛋白PAI-1和VEGFR2在HCC患者血浆中没有升高。AFP是HCC的一个已知的生物标志物,但在肝硬化患者之间没有显著差异。

FN1诊断HCC的灵敏度和特异性优于AFP。联合AFP和FN1比单独FN1 或单独AFP 诊断HCC具有更佳的灵敏度及特异性。PAI-1和VEGFR2作为诊断指标效果不佳。

血浆FN1水平在多灶性HCC患者和晚期HCC患者更高。基于肝病的病因分组,血浆FN1水平没有显著差异。与组织纤连蛋白FN1表达一致的是,肿瘤侵犯血管的HCC患者血浆FN1水平高于未侵犯血管的HCC患者。

四、优缺点
当前的研究仅强调了具有血管侵犯的HCC肿瘤的独特分子特征,然而本研究进一步深入分析了这种临床相关的、侵袭性的HCC亚型。具有良好的创新性,补充空白。最终该研究确定MYC癌基因是这种血管侵犯HCC表型的主要驱动因素,并提出纤维连接蛋白FN1是侵袭性HCC的一个有前景的无创诊断预测因子。具有极佳的临床意义。总之,本文章深入探究了血管侵犯肝细胞癌的分子特征,识别了癌基因MYC的重要作用,揭示了FN1的分子表达及生物学机制,并证实FN1可作为潜在无创诊断分子标记物的临床价值。
最后Ps: 我们在B站还有优质文章分享视频哦~,希望大家多多关注。

往期精品(点击图片直达文字对应教程)
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集





















































 4579
4579

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








