小罗碎碎念
这篇文章是发表在《Translational Oncology》期刊上的一篇综述文章,标题为“Using deep learning to predict anti-PD-1 response in melanoma and lung cancer patients from histopathology images”,作者包括Jing Hu、Chuanliang Cui、Wenxian Yang、Lihong Huang、Rongshan Yu、Siyang Liu和Yan Kong。文章主要探讨了深度学习在预测黑色素瘤和肺癌患者对抗PD-1疗法反应方面的潜力。
文章概述
背景:
- 免疫检查点封锁(ICB)显著改善了黑色素瘤和肺癌患者的临床结果,但只有一小部分患者能从ICB中受益。
- 深度学习已成功应用于辅助临床诊断。
方法:
- 研究中,
190张黑色素瘤的H&E(苏木精-伊红)染色切片被分割成256×256像素的小块,用作卷积神经网络(CNN)的训练集。 - 另外收集了
54张黑色素瘤和55张肺癌的H&E切片作为独立测试集。
发现:
- 在
54个黑色素瘤测试样本中,实现了0.778的AUC(95% CI: 63.8%-90.5%),其中15个(65.2%)应答者和23个(74.2%)非应答者被正确分类。 - 在
55个肺癌样本中,也获得了0.645的AUC(95% CI: 49.4%-78.4%)。
解释:
- 据作者所知,这是首次使用深度学习直接从H&E切片预测患者对
抗PD-1反应的研究。 - CNN模型达到了最先进的性能,并有潜力在常规临床实践中筛选出可能受益于ICB的患者。
研究设计和患者队列:
- 从TCGA-SKCM数据库收集了
476名患者的全切片图像,选择了190名干扰素-γ(INFG)得分最高和最低20%的患者作为训练数据。 - 根据肿瘤反应(应答者与非应答者),选择了
2016年3月至2017年12月在北京大学肿瘤医院参与四项抗PD-1单克隆抗体单药治疗临床研究的54名患者。 2019年7月15日至2019年10月16日期间,广东省人民医院的非小细胞肺癌(NSCLC)队列作为第二个验证数据集(n =55名患者)。
图像预处理和模型训练:
- 将每个图像分割成小的256×256像素块,使用
OpenSlide库进行处理。 - 使用
Macenko方法对每个块进行颜色标准化。 - 使用
Xception神经网络提取特征,并通过主成分分析(PCA)进一步降低特征维度。 - 使用减少的特征训练
支持向量机(SVM)分类器来预测免疫治疗状态。
与TILs和其他深度学习模型的比较:
- 构建了一个基于VGG-16的TILs识别深度学习模型,并计算了使用TILs预测抗PD-1反应的AUC,仅为0.58。
- 评估了其他六种深度学习模型的预测准确性,提出的CNN模型的AUC值远高于这些模型。
结论:
- 研究表明,基于深度学习的模型可能仅通过常规H&E切片就能确定哪些患者可能对ICB有反应。
- 讨论了当前深度学习模型的局限性,并指出深度学习最终可能以一种时间敏感和成本效益的方式,高效地识别最有可能从免疫治疗中受益的患者。
要点归纳
- 最近的研究表明,免疫检查点阻断 (ICB) 改善了黑色素瘤和肺癌患者的临床结果
- 深度学习可以增强临床诊断,并通过H&E图像预测抗PD-1反应
- CNN模型在预测抗PD-1反应方面取得了最先进的性能
- 旨在在常规临床实践中筛查ICB有益患者的研究
- 用于准确预测免疫治疗生物标志物的组织病理学图像
- 深度学习算法直接预测H&E图像的抗PD-1响应
- 方法包括在分段的 H&E 载玻片上训练 CNN,并在独立集上进行测试
- 结果显示,具有高AUC值的预测性能
- 深度学习可以潜在地改善癌症患者抗PD-1反应的预测
交流群
欢迎大家来到【医学AI】交流群,本群设立的初衷是提供交流平台,方便大家后续课题合作。
公众号发表的文章会分享到群里,学术会议和比赛也会不定期分享,欢迎组队参与和线下交流!!
最后再介绍一下小罗自己:课题组位于广州,专业方向是医学人工智能,研究内容主要是病理组学,目前已借助自媒体与北大、北航、南方医等院校的课题组建立了联系,欢迎更多的人加入我们的队伍!!

一、背景
恶性黑色素瘤是最具侵袭性的癌症类型之一,起源于黑色素细胞,并倾向于早期转移[1]。与白人患者不同,亚洲患者中最常见的黑色素瘤亚型为肢端型和粘膜型,占该患者群体所有黑色素瘤肿瘤的58%[2]。
在过去的几十年中,癌症治疗的发展,如针对PD1和CTLA4的免疫检查点阻断(ICB)已显示出对各种癌症类型的显著临床益处[3]。在KEYNOTE-151试验中,首次评估了帕博利珠单抗在中国患者中的安全性及有效性,这些患者在一线化疗后病情进展。客观缓解率(ORR)非常低,为16.7%(95% CI,10%−25.3%),其中肢端型为15.8%,粘膜型为13.3%[4]。
此外,ICB在肺癌中的抗肿瘤效果也较低,在20-30%的非小细胞肺癌(NSCLC)患者中观察到,大多数患者对ICB无反应[5]。
知识点补充:一线化疗
一线化疗(First-line chemotherapy)是指针对某种癌症的最初治疗方案,通常是在诊断出癌症后,患者接受的第一轮化疗。化疗是使用药物来治疗癌症的一种方法,这些药物可以杀死或阻止癌细胞的生长和分裂。
一线化疗的目的包括:
-
治愈:在一些癌症类型中,如果癌症处于早期阶段,一线化疗可能会尝试完全消除癌细胞。
-
控制病情:在某些情况下,癌症可能无法完全治愈,但一线化疗可以用来控制病情的进展,延长患者的生存期。
-
缓解症状:化疗还可以帮助减轻由癌症引起的症状,如疼痛、出血或压迫感。
-
辅助手术或放疗:有时,一线化疗会在手术前进行,以缩小肿瘤,使手术更容易进行(新辅助化疗)。在其他情况下,它可能在手术后进行,以消除可能残留的癌细胞,减少复发的风险(辅助化疗)。
-
作为放疗增敏剂:化疗药物有时与放射治疗联合使用,以增加癌细胞对放射线的敏感性,提高治疗效果。
一线化疗的选择取决于多种因素,包括癌症的类型、阶段、患者的整体健康状况以及可能的副作用。化疗方案可能包括单一药物或多种药物的组合,具体取决于癌症的特定特征和治疗目标。
值得注意的是,化疗并非没有副作用,它可能会对正常细胞造成一定的损害,导致如脱发、恶心、疲劳、感染风险增加等症状。因此,医生会密切监测患者的反应,并在必要时调整治疗方案。
知识点补充:客观缓解率
客观缓解率(Objective Response Rate, ORR)是衡量抗癌治疗有效性的一个指标,它表示在一定时间内,治疗后肿瘤体积缩小达到或超过特定标准的患者所占的比例。这个指标通常用于评估化疗、靶向治疗、免疫治疗等癌症治疗手段的疗效。
客观缓解率的计算方式:
客观缓解率是通过比较治疗前后肿瘤的尺寸来计算的。根据RECIST(Response Evaluation Criteria in Solid Tumors)标准,肿瘤的缩小被分为几个类别:
- 完全缓解(Complete Response, CR):所有目标肿瘤的消失,且持续一段时间后没有新的肿瘤出现。
- 部分缓解(Partial Response, PR):目标肿瘤的最大直径总和减少达到或超过30%,并且至少维持一段时间后没有新的肿瘤出现。
- 疾病稳定(Stable Disease, SD):肿瘤的最大直径总和减少不超过30%,同时增加不超过20%。
- 疾病进展(Progressive Disease, PD):肿瘤的最大直径总和增加超过20%,或出现新的肿瘤。
客观缓解率通常只计算CR和PR的情况,不包括SD和PD。计算公式如下:

客观缓解率的意义:
- ORR是评估治疗效果的直接指标,可以反映治疗对肿瘤生长的实际抑制效果。
- 在临床试验中,ORR是一个重要的终点,用于决定某种治疗方法是否值得进一步研究或批准上市。
- ORR也可以帮助医生和患者了解治疗可能带来的益处,以及预计会有多少患者从治疗中获益。
然而,客观缓解率并不等同于总生存率或无进展生存率,后两者分别衡量的是患者从治疗中获益的总时长和疾病无恶化的时长。有些治疗可能提高ORR,但对总生存率或无进展生存率的提升作用有限。因此,在评估治疗效果时,需要综合考虑多个指标。
过去的研究表明,肿瘤突变负荷(TMB)、微卫星不稳定性(MSI)和PD-L1表达可能预测某些癌症类型对ICB的反应[6–8]。然而,目前尚无生物标志物能够在临床上具有显著准确性来预测免疫治疗耐药性或益处。因此,对于亚洲黑色素瘤患者,迫切需要有效的免疫治疗生物标志物。
近年来,研究发现组织病理学图像可以用来准确预测几种免疫治疗生物标志物。Jakob等人评估了来自TCGA的315份STAD样本、360份CRC的石蜡包埋样本和378份CRC的快速冷冻样本的H&E切片,以分类MSI与微卫星稳定(MSS)患者。MSI检测的AUC分别为0.81、0.84和0.77[9]。Xu等人研究了来自TCGA的253例膀胱癌患者队列。他们的方法在区分高TMB和低TMB患者方面的准确率为73%,AUC为0.75[10]。
尽管可以根据MSI或TMB状态推导出患者从ICB中获益的潜力,但鉴于这些生物标志物仅部分与ICB反应相关,因此将其作为ICB反应预测的替代指标会增加一个中间步骤,从而降低组织病理学图像的预测能力,并限制其临床应用。因此,我们研究了深度学习算法是否能够直接从H&E图像预测抗PD-1治疗的反应。
在本研究中,我们设计了一个系统的卷积神经网络(CNN)模型,该模型可以帮助确定癌症患者对抗PD-1治疗反应的可能性。我们在100多种黑色素瘤和肺癌样本上测试了我们的模型。该模型还可以推广到其他肿瘤。这项工作代表首次使用迁移学习来确定H&E切片样本对免疫治疗反应的研究。
二、方法
2-1:研究设计与患者队列
本研究从TCGA-SKCM数据库中收集了总共476例患者的全切片图像,其中选择了190例干扰素-γ(INFG)评分位于最高和最低20%的患者作为训练数据。
肿瘤浸润淋巴细胞(TILs)的映射基于从GDC下载的13个TCGA肿瘤的H&E图像(n=1896)[11]。从2016年3月至2017年12月,北京大学肿瘤医院的54例患者被纳入研究,这些患者参加了四项针对不可切除的第三阶段或第四阶段(AJCC癌症分期手册第8版)晚期黑色素瘤的抗PD-1单克隆抗体单药治疗临床试验,并根据肿瘤反应(应答者与非应答者)进行选择。研究者的评估采用RECIST版本1.1。
广东省癌症医院在2019年7月15日至10月16日间的一个非小细胞肺癌(NSCLC)队列被用作第二个验证数据集(n=55例患者)。肿瘤反应同样由研究者使用RECIST版本1.1进行评估。
2-2:图像预处理与模型训练
由于组织病理学图像尺寸较大,难以直接由神经网络处理。因此,使用OpenSlide库[12]将每张图像分割成256×256像素的小瓦片,放大倍数为20×。
去除细胞内容信息较低的小瓦片(>40%为背景)。接着,使用Macenko方法[13]对每个小瓦片进行颜色标准化。通过4个尺度半径(r=2,4,6,8)的局部二值模式(LBPs)[14]提取的多纹理特征被转化为40维特征向量。随后,采用不需要预定义聚类数量的亲和传播(AP)算法[15],以获得数十个中心小瓦片。
为了将这些中心小瓦片转化为信息特征,应用了带有ImageNet预训练参数的Xception[16]神经网络来提取2048维特征向量。神经网络中的参数被固定,最后一层全连接层被弃用。中心小瓦片的特征向量按其所在聚类的相应比例进行加权求和。
为了进一步降低提取特征的维度,我们选择了主成分分析(PCA)。根据总选定成分解释的方差百分比,选择了前20个成分,用作最终分类器的输入(见图1)。
Fig. 1 展示了使用深度学习模型预测抗PD-1疗法反应的流程图,该模型基于苏木精-伊红(H&E)组织学图像。

这个流程可以分为两个主要阶段:训练阶段和测试阶段。
训练阶段:
-
肿瘤区域注释:首先,由两名病理学家对肿瘤区域进行注释,使用绿色多边形边框标出。
-
图像分割与颜色标准化:接着,将这些肿瘤区域分割成小块,并进行颜色标准化处理,以便进行后续分析。
-
特征提取:
- 多尺度局部二值模式(LBP):对灰度图像块应用不同尺度的LBP算法,这是一种用于图像纹理分析的技术,可以捕捉图像的局部结构信息。
- 亲和力传播(AP)算法:用于在不需要预定义聚类数量的情况下,从图像块中获取中心块,这是一种聚类算法,有助于发现图像中的模式。
-
深度学习模型:使用预训练的Xception模型通过迁移学习提取特征。Xception模型是一个深度学习架构,原本在ImageNet等大型图像识别任务中预训练。在这个过程中,模型的参数被固定,最后一个全连接层被丢弃,以提取有用的特征。
-
特征降维:通过主成分分析(PCA)将提取的特征降维,选择前20个主成分作为最终分类器的输入。
-
分类器训练:使用减少的特征集训练支持向量机(SVM)分类器,以预测免疫治疗的状态。
测试阶段:
- 模型预测:使用在训练阶段训练好的模型来预测未见过的样本的临床结果。
这个流程图说明了如何利用深度学习技术从H&E图像中直接预测患者对抗PD-1疗法的反应。这种方法的创新之处在于,它尝试通过分析常规的组织学图像来预测免疫治疗的反应,而不是依赖于分子层面的生物标志物,这可能为临床实践提供一种新的、成本效益高的预测工具。
2-3:与TILs和其他深度学习模型的比较
为了计算每张图像上的肿瘤浸润淋巴细胞(TILs)的百分比,我们基于VGG-16[17]构建了一个TILs识别的深度学习模型。
知识点补充:计算每张图像上的肿瘤浸润淋巴细胞(TILs)的百分比有什么研究价值
研究价值和临床意义:
-
预测治疗反应:TILs的存在通常与患者对抗肿瘤免疫治疗的反应相关。高比例的TILs可能预示着患者对某些免疫治疗药物,如免疫检查点抑制剂(例如抗PD-1/PD-L1疗法),有更好的反应。
-
预后评估:TILs的水平可以作为癌症患者预后的一个指标。在某些类型的癌症中,高水平的TILs与较好的生存率和较低的复发风险相关。
-
个性化医疗:通过评估TILs的分布和密度,可以帮助医生为患者定制更个性化的治疗方案,以最大化治疗效果和最小化副作用。
-
了解肿瘤微环境:TILs的分析有助于更好地理解肿瘤微环境的复杂性,包括免疫细胞如何与肿瘤细胞相互作用,以及这些相互作用如何影响疾病进程。
-
新疗法的开发:TILs的研究可以促进新疗法的开发,特别是那些旨在增强或重新激活免疫系统对抗癌症的疗法。
-
临床试验设计:在设计临床试验时,TILs的水平可以作为患者选择的一个标准,以确保研究纳入最有可能受益的患者群体。
-
治疗监测:在治疗过程中监测TILs的变化可能有助于评估治疗效果,并及时调整治疗方案。
-
研究肿瘤免疫逃逸机制:分析TILs的分布和功能状态有助于揭示肿瘤如何逃避免疫监视,这对于开发克服肿瘤免疫逃逸的策略至关重要。
-
跨癌种研究:TILs的分析可以跨不同癌症类型进行,以探索免疫细胞浸润在多种肿瘤中的共性和差异性。
-
经济价值:相比于一些需要复杂分子检测的生物标志物,TILs的评估通常成本较低,更容易在常规病理诊断中实施。
将组织切片划分为100×100的非重叠瓦片。这些瓦片经过颜色标准化后,作为卷积神经网络(CNN)模型的训练数据。随后,我们预测每个瓦片是否为TILs瓦片。整张图像中TILs的百分比被确定下来,并用于计算曲线下面积(AUC)。
此外,我们还评估了六个其他深度学习模型,以比较它们的预测准确性。所有模型的AUC仅在黑色素瘤数据集上计算。使用Python中的scikit-learn库来计算AUC。通过bootstrap方法进行1000次迭代,估计了95%置信区间(CIs)。
三、结果
Fig. 2 展示了深度学习模型在黑色素瘤和肺癌患者数据集上的预测性能,包括模型的辨别能力、患者的生存分析以及预测概率的可视化。
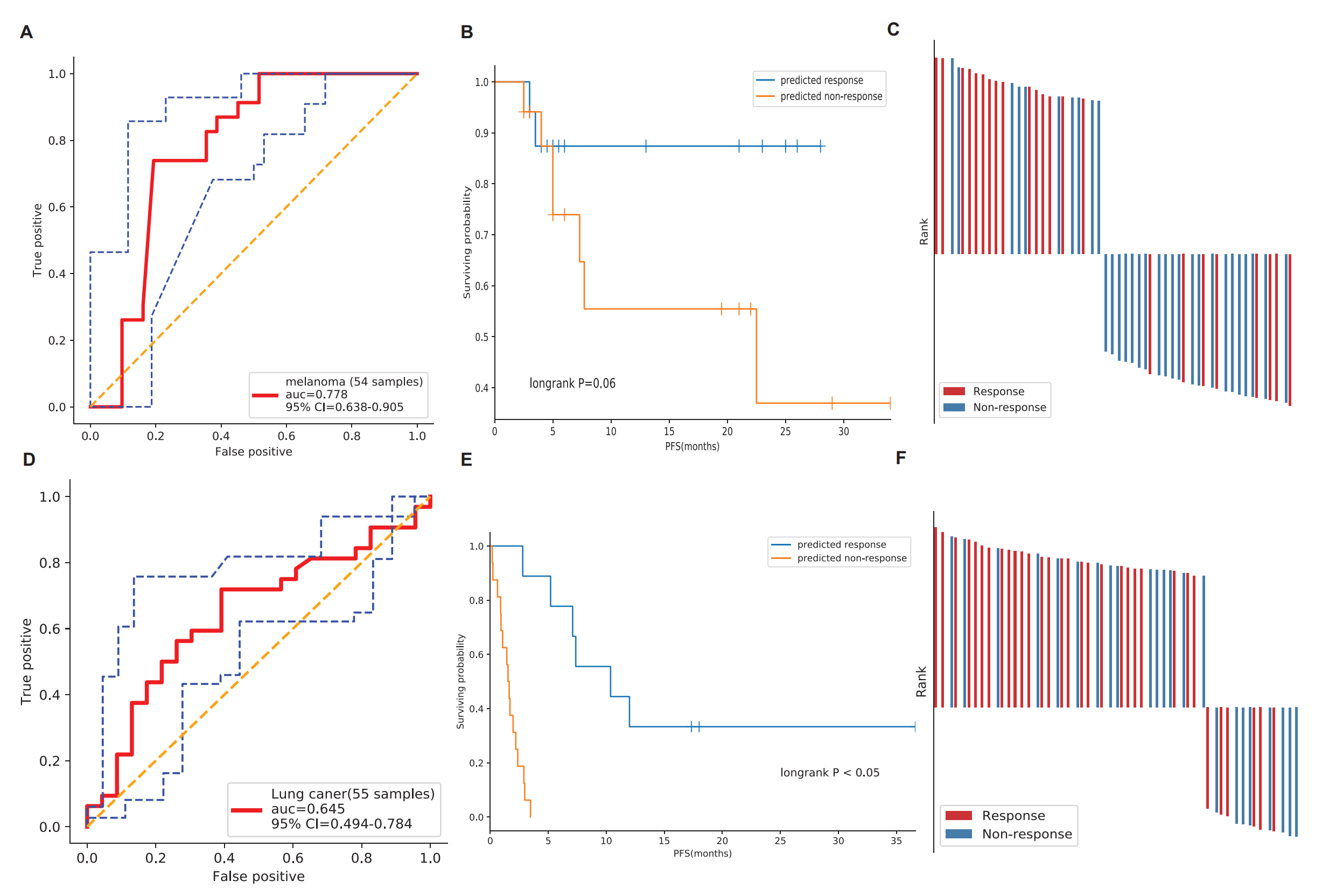
以下是对每个子图的分析:
A) 黑色素瘤测试集的AUC值 (n=54)
- 这部分展示了黑色素瘤测试集(包含54个样本)的接收者操作特征曲线(ROC曲线)下的面积(AUC)。
- AUC值是评估分类模型好坏的一个重要指标,其值介于0到1之间,值越大表示模型的预测性能越好。
- 一个AUC值接近1意味着模型具有很好的区分能力,而AUC值接近0.5则表示模型的预测性能与随机猜测相当。
B) 黑色素瘤患者无进展生存期(PFS)
- 这部分通过生存曲线展示了应答者(responders)和非应答者(non-responders)在黑色素瘤患者中的无进展生存期的差异。
- 无进展生存期是指患者从开始治疗到疾病进展或者患者死亡的时间长度。
- 如果应答者的生存曲线在非应答者之上,这表明对治疗有反应的患者生存期更长。
C) 黑色素瘤样本的预测概率瀑布图
- 瀑布图是一种数据可视化方法,用于展示每个黑色素瘤样本的预测概率分数。
- 通常,这些分数表示了模型预测患者为应答者的概率。
- 瀑布图可以快速识别出哪些患者更有可能从治疗中受益。
D) 肺癌数据集的AUC曲线 (n=55)
- 类似于A),这部分展示了肺癌测试集(包含55个样本)的AUC值。
- 这个指标同样用来评估肺癌患者中模型的预测性能。
E) 肺癌患者应答者和非应答者的PFS差异
- 这部分通过生存曲线展示了肺癌患者中应答者和非应答者的无进展生存期的差异。
- 与黑色素瘤部分相似,这个图表用来比较不同反应状态下患者的生存期。
F) 肺癌患者的预测概率瀑布图
- 与C)类似,这部分展示了肺癌样本的预测概率分数。
- 这个瀑布图可以帮助医生和研究人员快速识别出在肺癌患者中哪些个体更有可能对治疗产生反应。
总体而言,Fig. 2 提供了深度学习模型在不同癌症类型中的预测性能的全面评估,包括模型的辨别能力、患者的生存分析和个体化治疗反应的预测。这些结果对于临床决策和个性化医疗具有重要意义。
在54例黑色素瘤测试样本中
实现了0.778的AUC(95% CI: 63.8%−90.5%),其中15例(65.2%)应答者和23例(74.2%)非应答者被正确分类(图2A、C)。
根据我们的预测结果,应答者组的无进展生存期(PFS)明显长于非应答者组(对数秩检验,p=0.06)(图2B),这表明结合深度学习的组织学图像是一种有效的免疫检查点阻断(ICB)生物标志物。
在肺癌数据集上
获得了0.645的AUC(95% CI: 49.4%−78.4%),这表明深度学习模型可以推广到其他癌症(图2D、F)。我们观察到应答者的PFS显著长于非应答者(图2E)。值得注意的是,肺癌患者的组织病理学图像是核心针活检样本,而不是我们训练集中的手术样本。这可能是我们模型性能略有下降的原因。
使用TILs来预测抗PD-1反应的AUC在黑色素瘤数据集中仅为0.58。这证明了与传统的免疫检查点生物标志物相比,我们深度学习模型的优越性。
Fig. 3 展示了在全切片图像中,对抗PD-1治疗有反应(responder)和无反应(non-responder)的黑色素瘤患者的肿瘤浸润淋巴细胞(TILs)的例子。这些结果与这些患者使用免疫组化(IHC)的T细胞染色结果一致。

以下是对图3的分析:
- 图像展示:图3左边展示有反应者的例子,右边展示无反应者的例子。
- TILs标注:在有反应者和无反应者的图像中,TILs被标注为红色点。这种直观的标注方法有助于观察者快速识别和比较不同患者样本中TILs的分布和密度。
- 响应者与非响应者对比:通过比较有反应者和无反应者的TILs分布,研究人员可以评估TILs的存在与抗PD-1治疗反应之间的相关性。
- 研究意义:通过这种可视化方法,研究人员可以更直观地理解TILs在肿瘤微环境中的空间分布,以及它们与患者对特定免疫治疗的反应之间的关系。
- 临床应用:这些图像可以帮助病理学家和临床医生评估TILs的分布模式,并可能指导他们制定更精确的治疗决策。
总的来说,Fig. 3 通过可视化的方式提供了对TILs在肿瘤组织中的分布以及它们如何与治疗反应相关联的直观理解。这种分析有助于推动对肿瘤免疫微环境的深入研究,并可能促进个性化医疗策略的发展。
此外,对于n=141个TCGA SKCM样本,我们计算了全外显子测序(WES)得到的TMB值与CNN模型预测得分之间的皮尔逊相关值。相关值为0.05,这表明基于CNN的模型与分子衍生的签名,如TMB,是完全独立的生物标志物(补充图A)。
四、讨论
免疫治疗改变了肿瘤学的格局,但确定哪些患者可能从免疫检查点阻断剂(ICBs)中受益仍然是一个严峻的挑战。当前生物标志物不足以有效识别可能对ICBs产生反应的患者。例如,50%的微卫星不稳定性(MSI)结直肠癌(CRC)最终会进展。过去的研究表明,高肿瘤突变负荷与白人晚期黑色素瘤患者对抗PD-1治疗反应相关,但对于肢端型和粘膜型黑色素瘤,肿瘤突变负荷较低[23]。
基于TILs的预测结果,一些被预测为高密度TILs(肿瘤区域中9.2%为TILs)的黑色素瘤患者实际上是无效应答者,反之,也存在低密度TILs(肿瘤区域中0.2%为TILs)的应答者。这反映了TILs作为预测生物标志物的局限性,由于肿瘤微环境的复杂性。因此,黑色素瘤和肺癌患者需要一种有效的生物标志物。
此外,我们发现Resnet-50、Inception-V3、VGG-19、Nasnet、Desnet和Mobilenet[18-22]的AUCs远低于我们提出的CNN模型,相应的AUCs范围从0.55到0.71(补充图B)。
深度学习已经发展了几十年,在许多图像分类任务中超过了人类的表现,例如预测多种癌症的临床分级和分期[24],以及非小细胞肺癌的基因突变[25]。然而,由于缺乏足够的训练数据,CNN的预测能力有限。
样本量对于深度学习模型避免过拟合至关重要。在训练数据集较小的情况下,模型可能在训练数据上取得良好的AUC分数,但对测试数据的泛化能力较差。我们的方法中,我们从TCGA数据集中选择了190例干扰素-γ表达值位于最高和最低20%的SKCM患者作为训练队列,并进一步使用主成分分析(PCA)来减少过拟合。在这一发现中,我们将传统的文本特征与通过迁移学习从ImageNet预训练的深度模型提取的特征相结合。将4个尺度半径(r=2, 4, 6, 8)的局部二值模式(LBPs)转化为提取边界区域的信息。
在本研究中,训练数据标签是从INFG水平推断出来的。肿瘤微环境中的免疫细胞分泌的INFG会引起生长停滞,上调MHC I类表达,有助于效应细胞的招募,导致T-reg脆弱性,并协调先天性和适应性抗肿瘤反应的过程。同时,相同的INFG信号会破坏抗肿瘤免疫力并激活PD-1活性。INFG通过增加STAT1信号和减少STAT3激活来诱导PD-L1的表达。
在一些研究中,INFG与ICB反应之间有很强的相关性报道[26]。在一项关于非小细胞肺癌(NSCLC)和尿路上皮癌(UC)的研究中,INFG特征与TMB特征相关[27]。由于遗传生物标志物TMB已被证明与微卫星不稳定性相关,INFG也可能与MSI状态相关[28]。
知识点补充:INFG
干扰素-γ(Interferon-γ,INFγ或IFNγ)是一种由免疫细胞(主要是T细胞和自然杀伤细胞)产生的细胞因子,它在免疫反应和抗肿瘤活动中起着关键作用。在临床研究和实践中,评估INFγ水平对于了解患者对免疫治疗的潜在反应和预后具有重要意义。
以下是判断INFγ水平的几种方法:
-
基因表达分析:通过提取肿瘤组织或血液样本中的RNA,利用基因表达谱分析(如高通量测序或微阵列技术)来定量INFγ基因的表达水平。
-
蛋白水平检测:使用酶联免疫吸附试验(ELISA)、酶联免疫斑点法(ELISPOT)或流式细胞术等免疫学方法来测定血清、血浆或细胞培养上清液中的INFγ蛋白浓度。
-
免疫组化(IHC):通过免疫组化染色在组织切片上直接观察INFγ或其受体的蛋白表达情况,以此来评估肿瘤微环境中INFγ的活性。
-
多重免疫荧光(mIHC):这是一种先进的技术,可以在单细胞水平上同时检测多种蛋白的表达和空间分布,包括INFγ。
-
细胞因子芯片:利用细胞因子芯片技术可以同时检测多种细胞因子,包括INFγ,来评估免疫状态。
-
质谱分析:通过质谱技术可以精确测量血液中的INFγ蛋白水平。
-
免疫细胞功能分析:通过体外刺激免疫细胞(如T细胞)并测量它们产生的INFγ量,可以评估特定免疫细胞群的功能状态。
-
基因变异分析:在某些情况下,通过基因测序分析INFγ或其受体的基因变异,可以预测INFγ信号通路的活性。
-
临床评估:在临床研究中,INFγ水平的评估通常与患者对特定治疗(如抗PD-1/PD-L1治疗)的反应和无进展生存期(PFS)相关联。
在实际应用中,选择哪种方法取决于研究目的、可用样本类型、所需信息的详细程度以及成本效益等因素。在某些情况下,可能需要结合多种方法来全面评估INFγ水平。
在我们的研究中,训练数据是从TCGA下载的,其中大部分是欧洲血统的皮肤型黑色素瘤,而我们收集的测试数据包含亚洲患者,其黑色素瘤亚型以粘膜型和肢端型为主。然而,所提出的模型在我们的评估中展示了良好的泛化能力。
先前的研究也表明,干扰素-γ相关基因表达水平在决定西方和亚洲黑色素瘤人群对ICB治疗反应方面起着非常相似的作用,这也支持了将模型推广到不同患者人群的想法[29]。在未来,进一步检验所开发模型对其他癌症类型的适用性将是非常有趣的。
据我们所知,我们的深度学习模型首次使用H&E图像来确定某些患者是否可能从抗PD-1免疫治疗中受益。我们的方法对来自不同癌症中心的黑色素瘤患者样本具有鲁棒性,并且还有潜力预测其他癌症类型的免疫治疗反应。
五、局限性
尽管我们的方法获得了优越的预测性能,但还需要进一步的研究来确认我们机器学习模型的稳健性和泛化能力。考虑到TCGA上没有免疫治疗反应数据,在本研究中,训练数据集中的临床结果是从IFNG评分推断出来的,其中将INFG值位于最高和最低20%的患者视为应答者和非应答者。
这种方法的有效性在54例来自BMS的黑色素瘤患者中得到了验证(AUC=0.82)。我们计划从未来的临床研究中添加更多的训练数据,以确保提取关键纹理特征,并帮助优化和稳定我们的预测模型,使其最终能够在日常临床实践中用于免疫肿瘤治疗的患者筛选。
此外,许多近期研究表明,肿瘤内异质性在塑造抗肿瘤免疫反应中也起着重要作用[32]。高异质性的肿瘤可能因为亚克隆的生长而逃避免疫监视。因此,在我们未来的工作中,我们将在来自不同肿瘤部位的组织上应用所提出的模型,以了解不同肿瘤部位TILs的分布和变化,这将进一步提高对免疫治疗反应的预测。
六、总结
综上所述,基于深度学习的模型可能仅从常规H&E切片就能确定哪些患者可能对免疫检查点阻断剂(ICB)产生反应,最终能够以时间敏感和成本效益的方式有效地识别可能从免疫治疗(如抗PD-1)中获益的患者。

























 328
328

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








