AbMole(https://www.abmole.cn/)精研抑制剂十年,最新的科研动态不断与您分享。
解痉多肽表达化生(SPEM)是肠上皮化生(IM)的肿瘤前前体,在慢性萎缩性胃炎(CAG)和胃癌(GC)的发生发展中起重要作用。然而,对SPEM发病机制的致病靶点仍知之甚少。作为线粒体呼吸链复合体I的重要亚基,与类视黄酮-IFN诱导死亡19(GRIM-19)相关的基因随着人类CAG的恶性转化而逐渐丢失,但关于GRIM-19丢失与CAG发病机制之间的潜在联系尚不清楚。
在这里,我们发现较低的GRIM-19与CAG病变中较高的NF-кBRelA/p65和NLR家族3(NLRP3)水平相关。在功能上,GRIM-19缺乏不能直接驱动人GES-1细胞在体外分化为IM或SPEM样细胞系,而壁细胞(PCs)特异性GRIM-19敲除会扰乱胃腺分化,促进小鼠无肠道特征的自发性胃炎和SPEM发病。从机制上说,GRIM-19的丢失导致慢性粘膜损伤,并通过活性氧(ROS)介导的氧化应激导致NRF2(核因子-红细胞2相关因子2)- HO-1(血红素加氧酶-1)的异常激活,通过IKK/IкB伴侣诱导p65核易位导致NF-кB异常激活,而NRF2-HO-1的激活通过NRF2-HO-1正反馈回路促进GRIM-19丢失驱动的NF-кB激活。
此外,GRIM-19的丢失并未导致明显的PCs丢失,但通过ROS-NRF2-HO-1-NF-кB轴触发PCs中的NLRP3炎性体激活,导致NLRP3依赖性IL-33表达,这是SPEM形成的关键介质。
此外,腹腔注射NLRP3抑制剂MCC950可显著减轻体内GRIM-19损失驱动型胃炎和SPEM。研究表明,线粒体GRIM-19可能是SPEM发病的潜在致病靶点,其缺失通过ROS-NRF2-HO-1-NF-кB轴通过NLRP3/IL-33途径促进SPEM。这一发现不仅提供了GRIM-19缺失与SPEM发病机制之间的因果关系,而且为早期预防肠GC提供了潜在的治疗策略。

CDCA(Abmole,M2507,纯度>98%)(https://www.abmole.cn/products/chenodiol.html)是一种天然存在的人体胆汁酸。
NAC(Abmole,M5385,纯度为100%)(https://www.abmole.cn/products/acetylcysteine.html)是ROS抑制剂,拮抗多种蛋白酶体抑制剂的活性。它还是肿瘤坏死因子TNF的抑制剂。
ML-385(Abmole,M8692,纯度为100%)(https://www.abmole.cn/products/ml385.html)是一种特异性的 NRF2 抑制剂,IC50 为1.9 μM。ML385通过结合Neh1抑制Nrf2转录因子的活性。
VX-765(Abmole,M3532,纯度>99%)(https://www.abmole.cn/products/vx-765.html)是一种是有效的选择性的 caspase-1 抑制剂,对 caspase-1的Ki值为 0.8 nM。
PDTC(Abmole,M4005,纯度>99%)(https://www.abmole.cn/products/pdtc.html)是一个有效的NF-κB抑制剂,它可以抑制IκB的磷酸化、阻止NF-κB易位入核并减少下游细胞因子的表达。

Fig. 3. GRIM-19 deletion induces gastric mucosa injury by ROS-driven oxidative stress in vitro and in vivo.
接下来,我们研究了GRIM-19缺乏对慢性黏膜损伤的影响,慢性黏膜损伤是引发SPEM的关键因素。如图3A-D所示,我们观察到,在体外和体内,GRIM-19缺失显著增加了细胞内ROS和mROS,以及ROS诱导的DNA损伤标志物 8-OHdG。此外,我们进一步观察到,在体外和体内,GRIM-19缺失显著降低GSH/GSSG比值,增加NADP+/NADPH比值(图3E和F),表明GRIM-19缺失通过ROS诱导的氧化应激导致胃粘膜损伤。
鉴于NRF2抗氧化应激的主要靶点,我们研究了GRIM-19缺失是否会导致NRF2异常激活。正如预期的那样,我们发现GRIM-19缺陷显著增加了NRF2在体外和体内的激活(图3G和H),而ROS清除剂NAC显著减弱了GRIM-19缺陷诱导的NRF2、p-NRF2及其下游HO-1水平以及GES-1细胞中NRF2的转录激活(图3I),表明GRIM-19缺陷诱导了ROS依赖性NRF2的激活。综上所述,这些数据表明,在体外和体内,GRIM-19缺乏可引起ROS诱导的氧化应激对胃粘膜的损伤和NRF2-HO-1的异常激活。
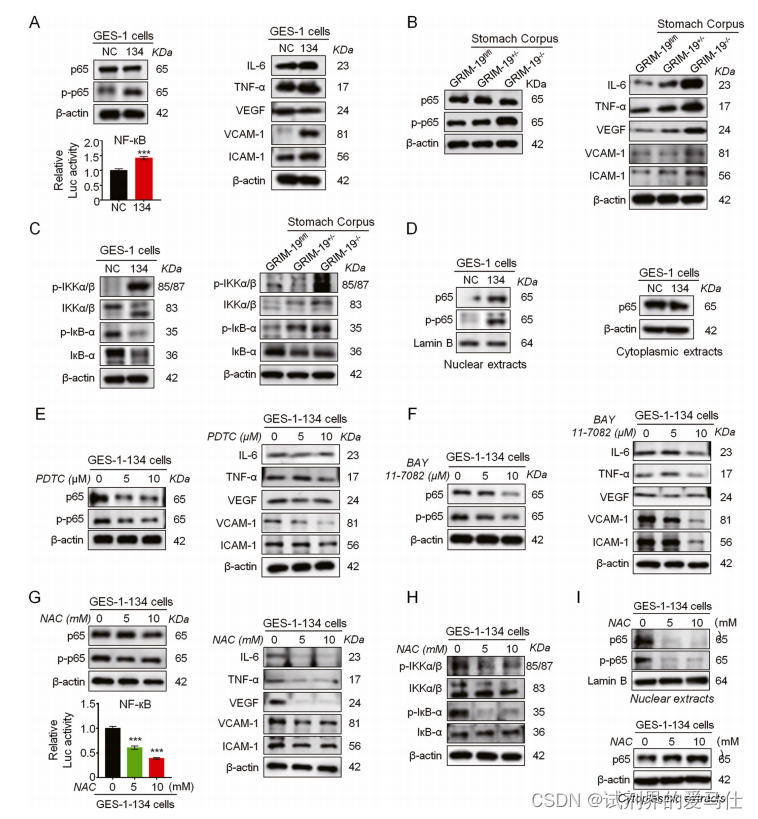
Fig. 4. GRIM-19 loss drives ROS-dependent NF-кB activation by promoting p65 nuclear translocation via an IKK/IкB partner.
鉴于ROS在氧化应激和信号转导中的双重作用,我们研究了GRIM-19缺乏对NF-кB激活的影响,NF-кB是黏膜炎症的关键转录因子。我们发现GRIM-19缺失没有改变p65的总水平,但显著提高了p-p65活性和NF-кB响应靶点水平(图4A和B)。
我们还发现GRIM-19缺失不仅显著改变了NF-κB调节蛋白p-IKKα/β、IKKα/β、p-IкB-α和IкB-α(图4C),还显著诱导了GES-1细胞中的p65核易位(图4D)。NF-кB抑制剂PDTC和BAY11-7082显著消除了GES-1细胞中GRIM-19缺陷驱动的p65激活及其下游靶标水平(图4E和F),表明GRIM-19缺陷通过IKK/IкB合作伙伴促进p65核转运,从而诱导NF-κB-p65激活。
为了进一步确定ROS在GRIM-19缺失驱动的NF-кB激活中的作用,我们接下来应用ROS清除剂NAC来评估ROS抑制是否可以逆转GRIM-19缺失驱动的NF-кB p65激活。我们发现,NAC处理显著减弱了GRIM-19缺失驱动的p65激活(图4G)和NF-кB下游靶标水平(图4H)。同时,NAC处理显著逆转了GRIM-19缺陷诱导的NF-кB调节蛋白(图4I)。因此,这些结果表明,GRIM-19缺失通过IKK/ IкB合作伙伴促进p65核易位,从而驱动ROS依赖性NF-кB激活。
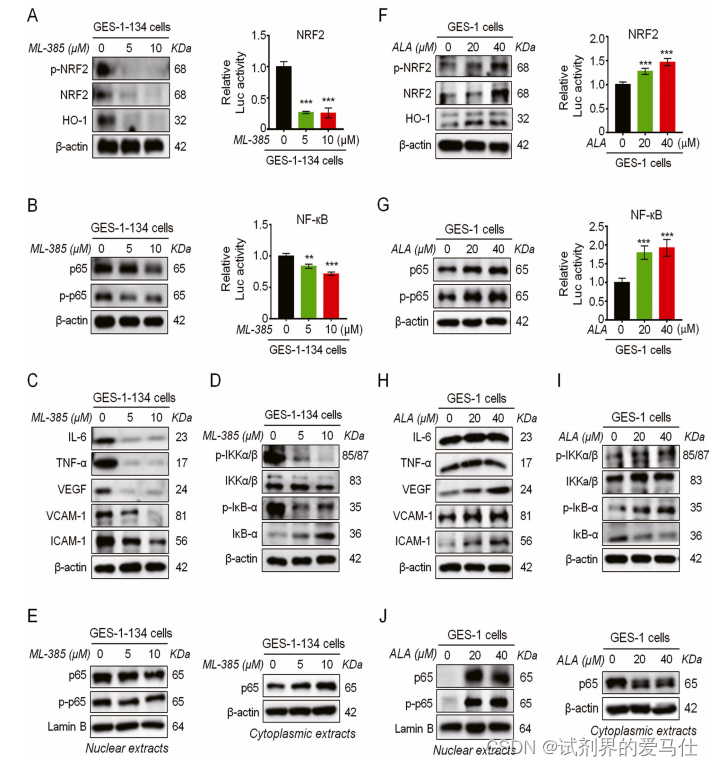
Fig. 5. NRF2 activation is essential for ROS-driven NF-кB activation in GRIM-19-deficient GES-1 cells.
考虑到GRIM-19缺失的GES-1细胞中存在NRF2异常,我们进一步研究了NRF2激活是否对GRIM-19缺失驱动的NF-кB激活至关重要。使用NRF2特异性抑制剂ML-385,我们发现NRF2抑制显著降低了GRIM-19缺失诱导的NRF2激活(图5A)和p65激活(图5B)。
此外,NRF2抑制不仅逆转了GRIM-19缺陷驱动的NF-кB下游靶标(图5C)和NF-кB调节蛋白水平(图5D),还明显减弱了GRIM-19缺失诱导的p65核易位(图5E)。这表明NRF2激活对于GRIM-19损失驱动的NF-кB激活至关重要,通过IKK/IкB伙伴诱导p65核易位。
接下来,我们使用NRF2激活剂ALA来研究NRF2激活对亲代GES-1细胞中NF-кB p65激活的影响。我们发现ALA处理增强了GES-1细胞中NRF2(图5F)和p65的激活(图5G),并显著改变了NF-кB下游靶标(图5H)和NF-кB调节蛋白水平(图5I)。此外,ALA处理后核p65水平明显升高(图5J)。因此,这些数据表明NRF2激活通过在GES-1细胞中通过IKK/IкB诱导p65核易位来促进NF-кB激活。
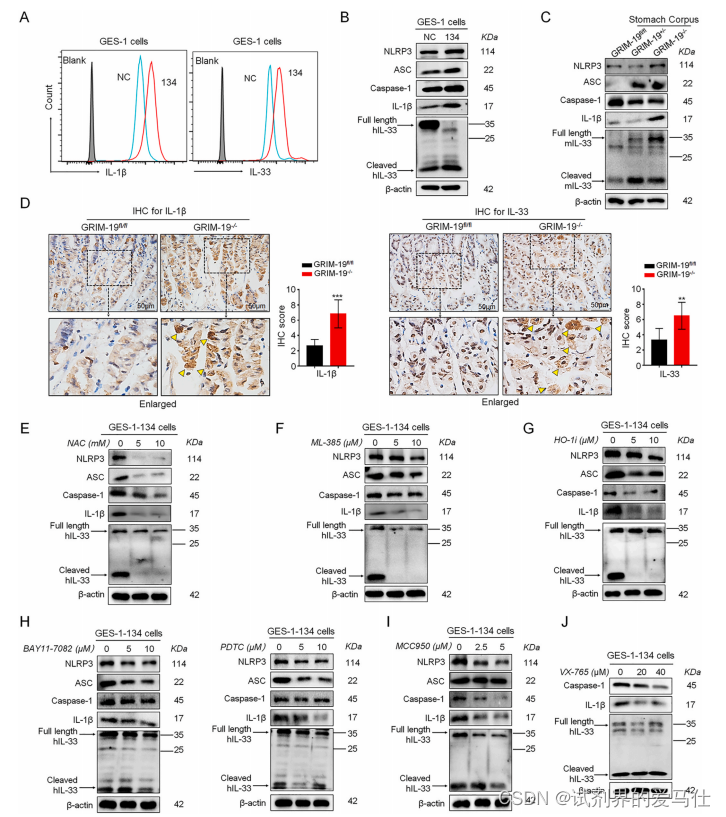
Fig. 7. GRIM-19 loss triggers NLRP3/IL-33 activation via a ROS-NRF2-HO-1-NF-кB axis.
鉴于异常IL-33在SPEM发病机制中的关键作用,我们试图了解IL-33是否参与了GRIM-19丢失诱导的SPEM。通过FACS和Western blot分析,我们观察到GRIM-19缺失在体外和体内显著增加IL-1β和IL-33水平以及NLRP3炎性体的激活(图7A-D)。然后,特异性抑制ROS(图7E)、NRF2(图7F)、HO-1(图7G)或NF-кB(图7H)分别显著降低了GRIM-19损失驱动的NLRP3炎症小体、IL-1β和IL-33水平,表明ROS-NRF2-HO-1-NF-кB轴对GRIM-19损失驱动的NLRP3炎症小体激活以及IL-1β和IL-33表达至关重要。
接下来,我们探讨了NRF2-HO-1反馈回路在GRIM-19损失驱动的NLRP3炎症小体中的确切作用。我们发现NRF2激活剂ALA明显增强了GES-1细胞中NLRP3炎性小体的激活以及IL-1β和IL-33水平,而HO-1抑制可以显著减弱这种激活,这表明NRF2-HO-1反馈回路在GRIM-19损失驱动的NLRP3炎性小体、IL-1β和IL-33表达中起着重要作用。因此,这些结果表明,GRIM-19的缺失通过ROS-NRF2-HO-1-NF-кB轴驱动NLRP3的激活。
接下来,我们使用NLRP3抑制剂MCC950或caspase-1抑制剂VX-765进一步确定NLRP3复合物在GRIM-19损失驱动的IL-1β和IL-33加工中的作用。如图7I和J所示,MCC950和VX-765处理均显著降低了GRIM-19缺陷驱动的IL-1β水平,而只有MCC950而不是VX-765显著消除了GRIM-19缺失诱导的IL-33表达,这表明GRIM-19缺失诱导了NLRP3炎症小体介导的IL-1β成熟,但NLRP3依赖性IL-33在GES-1细胞中的加工。
总的来说,这些结果表明,GRIM-19缺失通过ROS-NRF2-HO-1-NF-кB轴触发NLRP3/IL-33的异常激活。
鸣谢:Xin Zeng, et al. Free Radic Biol Med. 2023 Mar 27;202:46-61.





















 161
161











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








