
塑造荷兰人肠道微生物组的环境因素
Environmental factors shaping the gut microbiome in a Dutch population
DOI:https://doi.org/10.1038/s41586-022-04567-7
发表日期:2022-04-13
第一作者: R. Gacesa1,2, A. Kurilshikov2
通讯作者:J. Fu (傅静远)2,3(j.fu@umcg.nl), A. Zhernakova2(sasha.zhernakova@gmail.com) & R. K. Weersma1(r.k.weersma@umcg.nl)
合作作者: A. Vich Vila, T. Sinha, M. A. Y. Klaassen, L. A. Bolte, S. Andreu-Sánchez, L. Chen, V. Collij, S. Hu, J. A. M. Dekens, V. C. Lenters, J. R. Björk, J. C. Swarte, M. A. Swertz, B. H. Jansen, J. Gelderloos-Arends, S. Jankipersadsing, M. Hofker, R. C. H. Vermeulen, S. Sanna, H. J. M. Harmsen, C. Wijmenga,
主要单位:
1 荷兰格罗宁根大学医学中心,胃肠病学和肝病学系(University of Groningen and University Medical Center Groningen, Department of Gastroenterology and Hepatology, Groningen, The Netherlands)
2 荷兰格罗宁根大学遗传学系(University of Groningen and University
Medical Center Groningen, Department of Genetics, Groningen, The Netherlands)
3 荷兰格罗宁根大学医学中心儿科(Department of Pediatrics, University of Groningen and University Medical Center Groningen, Groningen, The Netherlands)
摘要
肠道微生物与多种疾病相关,但尚未确定健康或不健康微生物组的普遍特征,需要了解遗传、暴露组、生活方式和饮食如何塑造健康和疾病中的微生物组。在此,我们对来自2756个荷兰家庭三代人的队列的8208名参与者的肠道微生物组中的细菌组成、功能、抗生素耐药性和毒力因子进行了分析。我们将这些与241种宿主和环境因素相关联,包括身心健康、用药、饮食、社会经济因素以及儿童期和当前暴露组。我们发现微生物组主要是由环境和共同居住关系决定的。只有约6.6%的分类群是可遗传的,而约48.6%的分类群的变异可以用共同居住现象来解释。通过识别微生物组与健康之间的2856种关联,我们发现看似不相关的疾病有一个共同的微生物组特征,该特征与合并症无关。此外,我们确定了微生物组特征与饮食、社会经济因素以及生命早期和当前暴露之间的7519种关联,许多生命早期和当前因素与微生物组功能和组成显著相关。总体而言,本研究全面概述了肠道微生物组以及遗传力和暴露组的潜在影响,这将有助于未来微生物组靶向疗法的发展。
介绍
肠道微生物组成和功能的改变与广泛的人类健康疾病有关,包括胃肠疾病、代谢疾病以及精神疾病。肠道细菌和微生物通路对宿主代谢和免疫的影响,以及微生物组可以调控的事实,提高了人们对开发微生物组靶向疗法的兴趣,多种微生物组靶向疗法目前也正在临床试验中。然而,健康微生物组的特征在很大程度上仍不清楚,肠道微生物组受内在因素(如遗传)驱动的程度与可改变的环境因素(如污染物、饮食或生活方式)或健康相关因素(如肠道疾病或体重指数(身体质量指数))驱动的程度也不清楚,这些因素可能适用于微生物组靶向治疗。
定义健康微生物组的能力因研究之间粪便样本处理的差异以及微生物组成的巨大个体间差异而受到阻碍。基于人群的研究表明,个体间差异部分是由饮食、生活方式、宿主遗传和环境因素(包括早期暴露)造成的。然而,对具有明确表型的大型标准化队列的深入整合分析仍然很少,尽管这种整合视角对于理清有意义的宿主-微生物组关联和确定针对微生物组的干预的潜在目标至关重要。
荷兰微生物组计划
为了解决这些问题,我们在Lifelines(一个来自荷兰北部、具有明确表型的三代人的队列和生物库)内发起了荷兰微生物组项目(Dutch Microbiome Project, DMP)。在DMP,我们对8208名个体(年龄范围为8-84岁,57.4%为女性,99.5%为荷兰欧洲血统;其中4745人被归入2756个家庭;图1a)。数据集(由Metaphlan2和HUMAnN2处理)包含1253个分类群(4个界,21个门,35个纲,62个目,128个科,270个属,733个种)和564个代谢通路,包括257个古细菌和细菌分类群以及277个通路,相对丰度高于0.01,存在于5%以上的个体中。
我们的样本量使我们能够涵盖通过自展分析估计的预期微生物功能特征总数的90%以上:574.4个(标准误差 = 4.2)预期的MetaCyc通路中的564个,190个(标准误差 = 0.05)毒力因子中的190个,303个(标准误差 = 0.03)抗生素抗性基因中的303个,以及136.5个(标准误差 = 2.7)科水平或更高水平的微生物分类群中的128个(图1b)。通过对队列进行子采样(subsampling),我们估计当对队列中至少40%的样本(约3300个样本)进行采样时,这些微生物特征的存在率(presence rates)就变得相对稳定(在整个队列中观察到的数量的90%以内)。然而,随着样本量的增加,发现的微生物物种数量继续在增加,当样本为25000个时,种群中的物种总数估计为600(标准误差 = 27),表明其他稀有微生物物种仍未被发现(图1b)。肠道微生物组成在整个人群中变化很大,例如拟杆菌(Bacteroidetes)的相对丰度在5%至大于95%。最丰富的微生物通路的可变性明显小于大多数门(单侧方差F检验,FDR < 0.05)。
图1:荷兰微生物组总结
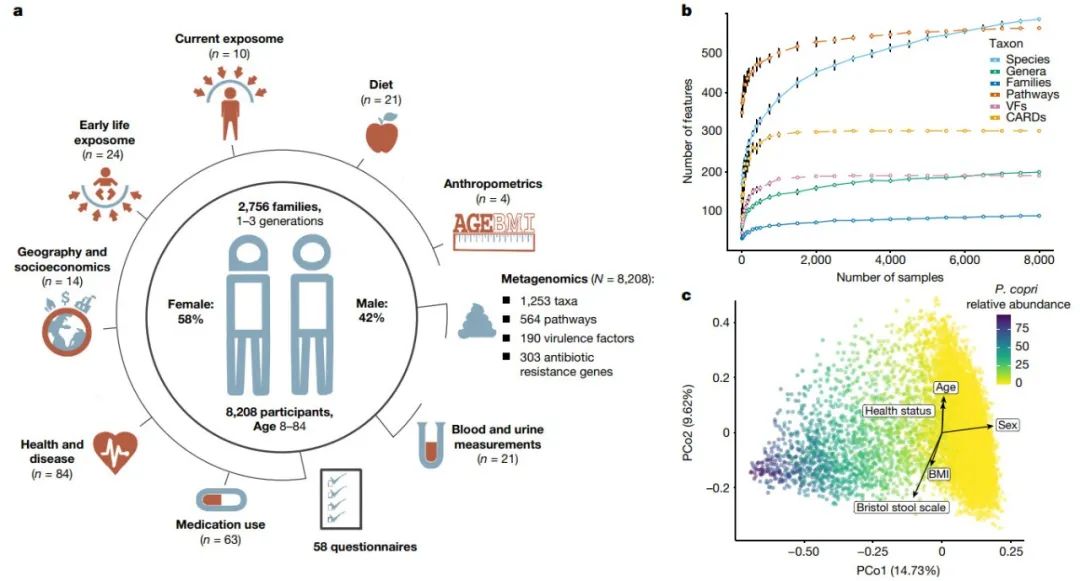
a, 队列的图形总结和可用元数据概述(n = 收集的变量数,N = 样本量)。
b, 相对于样本量发现的微生物特征数量。点表示平均值。误差线显示100次重采样的标准差。
c, PCoA可视化队列的β多样性。颜色表示P. copri的相对丰度。箭头表示自报健康、人体测量和粪便样本元数据的影响。
CARDs,来自综合抗生素耐药性数据库的抗生素耐药性基因家族(antibiotic resistance gene families from the Comprehensive Antibiotic Resistance Database);PCo,主坐标;VFs,细菌毒力因子(bacterial virulence factors)。
核心物种和基调(keystone)物种
为了查明可能对肠道生态系统的组织和维持至关重要的微生物物种和通路,我们对队列中超过95%的个体中存在的微生物分类群(我们将这些称为“核心微生物(core microbes)”)和形成微生物共丰度网络(co-abundance networks)(称为“基调特征(keystone features)”)中的中心节点的分类群进行了研究。我们鉴定了9个核心种(Subdoligranulum sp., Alistipes onderdonkii, Alistipes putredinis, Alistipes shahii, Bacteroides uniformis, Bacteroides vulgatus, Eubacterium rectale, Faecalibacterium prausnitzii 和Oscillibacter sp. ),这一结果与在英国、美国、欧洲和非西方人群中发现的结果高度一致。我们还确定了28个物种和53种通路为潜在的基调特征(keystone features),分别由超过109和337个显著共丰度定义(经验FDR < 0.05)。由这些特征定义的网络显示物种重叠度为20.2%,通路重叠度为25.3%。
9种已鉴定的核心微生物中的5种(A. putredinis, A. shahii, F. prausnitzii, Oscillibacter sp. 和Subdoligranulum sp.)也是基调物种(keystone species),这意味着它们在荷兰人群的肠道微生物生态系统中扮演了中枢的角色。例如,F. prausnitzii (一种在许多慢性病中都已衰竭的主要生产丁酸盐的细菌)与大多数拟杆菌属(Bacteroidetes)和双歧杆菌(Bifidobacterium)物种表现出显著的共丰度(significant co-abundance)。然而,我们还确定了流行率低(≤10%)的潜在关键菌种,包括Ruminococcus gnavus 和梭菌属(Clostridium)的多种菌种,它们与多种疾病呈正相关,与先前的研究一致。
Prevotella copri 定义聚类
我们使用主坐标分析(PCoA)检查了队列中的微生物组数据的聚类,并确定第一个主坐标由Prevotella copri 驱动 (Spearman r = 0.68,P值 = 3.6×10-180;图1c)。这种细菌在我们的队列中呈双峰分布,并根据其存在与否定义了两个簇。如先前研究所示,我们观察到P. copri 丰度较高的聚类与肠易激综合征(IBS)风险较低相关(odds ratio = 0.72,95%置信区间为0.61–0.86)。我们还发现P. copri与一般健康状况呈正相关(odds ratio = 1.24,95%置信区间为1.11–1.40,FDR < 0.05)。尽管先前的研究报告了以Bacteroides, Prevotella 和Ruminococcaceae 为主的不同肠型,但我们仅观察到两种这样的簇,这可能是因为我们的队列在人种上是统一的,并且来自于有限的地理区域
功能潜能的PCoA与多种通路而非单个通路高度相关,解释差异的首要特征是queuosine生物合成、肽聚糖生物合成和L-异亮氨酸生物合成通路。与通路相似,毒力因子的PCoA与编码多种细菌功能的多个基因家族相关,包括参与肠道细胞细菌侵袭的鞭毛蛋白(基因家族VF0114,Spearman r = -0.60,P ≈ 0.0),细菌铁载体(siderophores)(VF0136,VF0228和VF0256,Spearman r值分别为0.55、0.58和0.51;p < 1.0×10-100),a分泌系统(a secretion system)(VF0333,Spearman r = 0.76,P ≈ 0.0)和细菌粘附因子(bacterial adherence factors)(VF0221和VF0404,Spearman r值分别为0.581和0.561;p < 1.0×10-100)。相比之下,抗生素耐药性基因的PCoA仅由三个赋予四环素抗生素耐药性的基因家族主导:编码核糖体保护蛋白的ARO_30001914和ARO_3000191的基因家族(Spearman r值分别为0.81和-0.68;P ≈ 0.0)和编码外排泵的基因家族ARO_3000567 (Spearman r = 0.50,P ≈ 0.0)。
共同居住支配着遗传力
接下来,我们探索了家庭结构、共同居住和其他暴露因素在塑造肠道微生物组中的相对贡献。 我们使用队列中的多代家族结构来估计微生物分类群的遗传力,并在经FDR校正的经验P值< 0.1(使用30000个排列确定)下确定了17个可遗传的分类群(试验分类群的6.6%)(图2a)。观察到的遗传力最高的是变形菌(Proteobacteria)(h2 = 0.308,其中h =狭义遗传力(由加性遗传效应引起的微生物分类单元丰度的方差比例)),其次是Akkermansia muciniphila(h2 = 0.302)和它较高级别的分类单元拟杆菌科(Bacteroidaceae)(h2 = 0.299)、拟杆菌科的物种Parabacteroides goldsteinii(h2 = 0.266)和Bacteroides coprocola (h2 = 0.228), 长双歧杆菌(Bifidobacterium longum)(h2= 0.247)、Phascolarctobacterium属(h2 = 0.245)和梭状芽孢杆菌(Clostridiales)目的一个属级聚类(h2 = 0.237)。在微生物通路中,只有7种在经FDR校正的经验P值 < 0.1时是可遗传的,包括脂质IVA生物合成通路(NAGLIPASYN-PWY)、吡哆醛5-磷酸生物合成的两种通路(PWY0-845和PYRIDOXSYN-PWY)、异亮氨酸生物合成II通路(PWY-5101)和醌生物合成前通路(PWY-6703)。通路和分类群的遗传力表现出一定程度的一致性:NAGLIPASYN-PWY与变形菌(Proteobacteria)高度相关(R = 0.64),其他可遗传通路大多与拟杆菌科(Bacteroidaceae)和部分拟杆菌科(Bacteroidaceae)物种相关。
以前的研究已观察到了其中一些分类群的遗传力。据报道,在一项针对英国双胞胎的研究中,Akkermansia和双歧杆菌(Bifidobacterium)以及梭菌目(Clostridiales)的一些属是可遗传的;在一项针对加拿大人群的家族分析中,报告了Bacterioidaceae科成员(包括拟杆菌(Bacteroides)和类杆菌(Parabacteroides))的可遗传性。我们的结果没有复制这些研究中的一些可遗传分类群,可能是由于所用技术(使用16S与宏基因组测序和不同的DNA分离方法)或参考数据库的差异——比如,参考数据库中不存在某些分类群(如Metaphlan2数据库中的Christensenellaceae),未通过5%的存在阈值(presence threshold)(Turicibacter属),或由于存在率低而显示出很低的检测遗传力的能力(使用Metaphlan3数据库分析时的Euryarchaeota, Christensenellaceae)。
共同居住的影响比遗传力大得多,257个分类单元中有125个(48.6%)受到共同居住的显著影响,共同居住史解释了22个分类单元(8.6%)中的显著差异。 无论参与者的关联如何,共同居住参与者的微生物组也比分开生活的参与者的微生物组更相似,父母-子女关系、兄弟姐妹关系和没有关联的伴侣的微生物组都比非共同居住参与者的微生物组更相似 (图2c–e,基于排列的Wilcoxon检验,FDR < 1.0×10-5)。我们进一步观察到微生物通路(毒力因子和抗生素抗性基因)的组成模式相似。
这些结果表明,整个微生物组的组成受共同居住关系的显著影响,而遗传学的作用较小,尽管一小部分微生物物种——如A. muciniphila, B. longum和Bacteriodaceae——具有显著的遗传性,并显示出一定程度跨队列的的复制。然而,考虑到我们队列的设置以及观察到的几种分类群和通路具有较大的共同居住效应,因此我们的遗传力估计可能略有夸大。
图2:共同居住对肠道微生物组的遗传性和影响
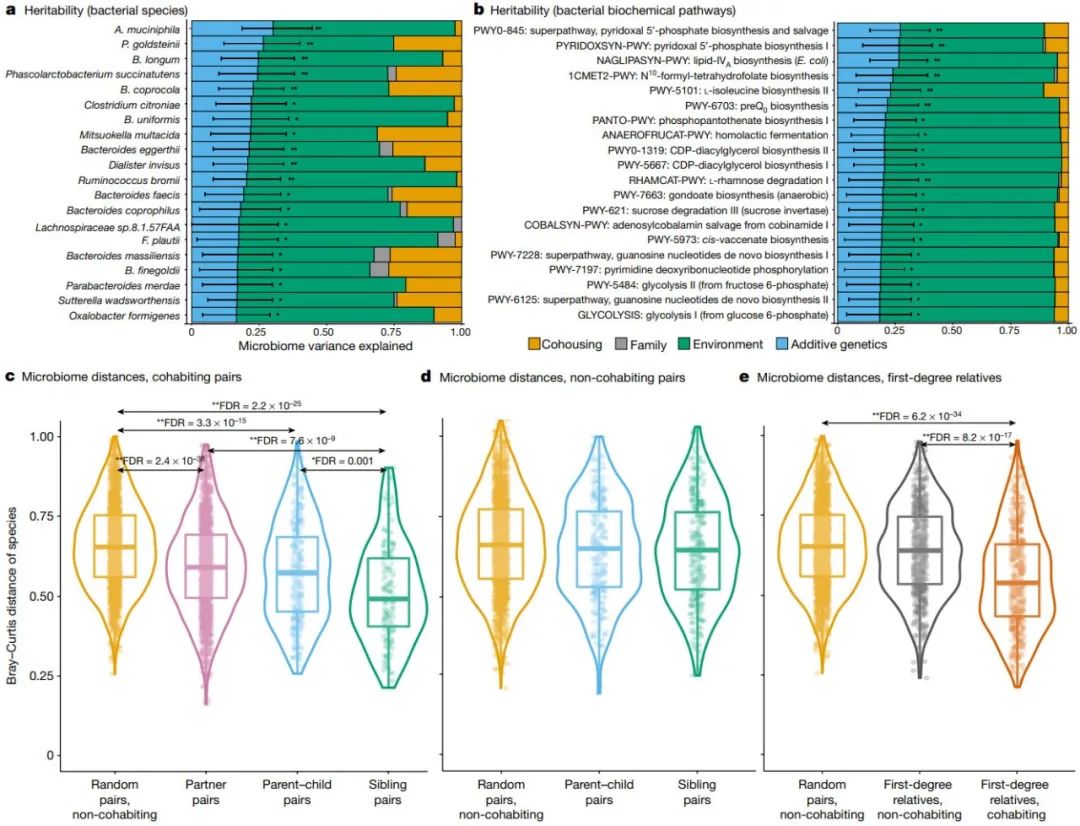
a, 前20个可遗传物种。
b, 前20个可遗传通路。* 在FDR < 0.1时可显著遗传的分类群; 具有名义显著遗传力(nominally significant heritability)的分类群(P < 0.05)。误差线表示遗传力的95%置信区间。a、b中的结果是从1432个家庭的3571名不同个体中计算得出的。
c–e, 成对微生物组距离的比较。中心线为中位值,框限表示上四分位数和下四分位数,须显示1.5×四分位数之间的范围,点表示异常值,轮廓显示数据的分布。Bray-Curtis相异度是使用随机非同居对(n = 2000)与共同居住伙伴(n = 1710)、父母-子女成对(n = 285)和兄弟姐妹成对(n = 144) (c)、随机对(n = 2000)与非共同居住父母-子女成对(n = 301)和兄弟姐妹成对(n = 299) (d)以及随机成对(n = 2000)与非共同居住组的微生物物种计算得出的
在c–e中,* FDR < 1.0×10-5, FDR < 0.05(基于排列的双侧Wilcoxon检验)。
关联关系的概述
我们探索了微生物特征与241项测量结果的相关性,包括技术因素、人体测量(anthropometrics)、生命早期和当前暴露组、饮食、自报疾病(self-reported diseases)和药物使用、医学测量和社会经济因素。这些表型解释了12.9%的微生物组分类组成和16.3%的微生物组功能,最大的贡献来自技术因素、粪便特征、疾病、药物使用和人体测量(图3b)。
校正技术因素后,我们观察到4530种表型与分类群的关联,5224种与功能通路的关联,1848种与抗生素抗性基因的关联,385种与毒力因子的关联。 就个体而言,关联数量最多的是基调(keystone)和核心分类群,包括Flavonifractor salivarius, F. prausnitzii, Alistipes senegalensis和 Clostridium和Subdogranulum的物种。过去的研究中报道过,A. senegalensi 与克罗恩病和乙型肝炎病毒相关的急性慢性肝功能衰竭有关。在我们的队列中,A. senegalensi 与43种表型相关(FDR < 0.05),这突出了其在多种疾病中的潜在作用。同样,与二型糖尿病(T2D)、高血压和强直性脊柱炎相关的天冬氨酸梭菌(Clostridium asparagiforme),与另外23种互不相关的疾病相关(FDR < 0.05)。我们将在下面接着讨论更多的关联关系。
在我们的β多样性个体间变异分析中,年龄、性别和身体质量指数(BMI)名列前茅,分别解释了0.6%、0.53%和0.32%的个体变异。 Bristol粪便量表解释了β多样性的最大比例(R2 = 0.77%,FDR = 0.012),采样季节也解释了显著比例的方差(R2 = 0.36%,FDR = 0.012),同时强调了评估粪便一致性和采集时间框架效应在微生物组研究中的重要性。在这些结果的基础上,我们将年龄、性别、身体质量指数、Bristol粪便量表和采样季节的校正值与技术因素的校正值一起纳入我们的关联模型。
图3:微生物组-表型的关联关系
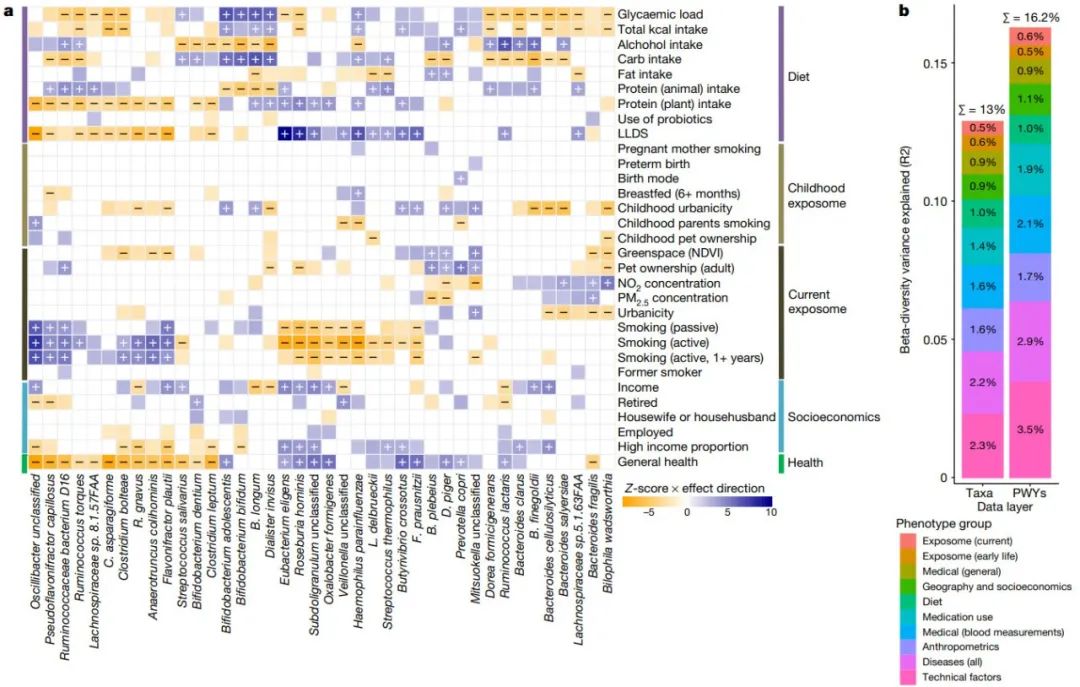
a,微生物组-与健康微生物组特征相比,饮食、儿童期和当前暴露组与社会经济因素的表型关联。具有最高数量的显著关联的前40种微生物物种通过使用分层聚类的关联Z评分进行聚类,并按作用方向着色(蓝色,正相关;橙色,负相关),在研究范围FDR < 0.05时显著关联,分别用正和负相关标记。无标记的颜色关联表示名义上显著的关联(P < 0.05)。
b、多元PERMANOVA分析中由表型组解释的微生物组成和功能的差异。NDVI(Normalized Difference Vegetation Index),归一化差异植被指数;pwy,pathway 通路。
定义健康和不健康的微生物组
为了定义健康和疾病的微生物组特征,我们将微生物组的特征与自我报告的健康状况和至少包含20例患者的81种疾病相关联。这确定了1206个与细菌分类群的显著关联,1182个与微生物通路的显著关联,390个与抗生素抗性基因的显著关联,76个与细菌毒力因子的显著关联(FDR < 0.05) 。 不同的疾病有不同数量的关联,观察到最强的信号是心血管和代谢疾病,如非酒精性脂肪性肝病和T2D,以及胃肠疾病,包括炎症性肠病和肠易激综合征。我们在大多数疾病中观察到一致的微生物组-疾病模式(图4a),这使我们能够查明不相关疾病之间共有的微生物组特征以及定义健康(即无疾病)微生物组的特征。
共有的疾病微生物组特征主要包括:Anaerotruncus, Ruminococcus, Bacteroides, Holdemania, Flavonifractor, Eggerthella 和 Clostridium物种增加, 以及Faecalibacterium, Bifidobacterium, Butyrivibrio, Subdoligranulum, Oxalobacter, Eubacterium 和Roseburia物种减少。在互不关联的疾病中共享的肠道微生物通路主要包括L-鸟氨酸、泛醌醇和甲萘醌、肠细菌共同抗原、Kdo-2-脂质-A和钼辅因子的生物合成增加,以及氨基酸、脱氧核糖核苷酸和核苷酸、厌氧能量代谢和发酵成短链脂肪酸(主要是丁酸)的生物合成减少。在包括T2D病和胃肠疾病在内的一些疾病中,毒力因子增加,对细菌粘附和铁摄取因子的影响最大(VF036、VF0228、VF0236、VF0404和VF0394)。我们通过构建预测36种最常见疾病的L1/L2正则化回归模型(L1/L2 regularized regression models)进一步验证了这些信号,并通过关联分析确定了高度的一致性,模型选择的31种物种中有22种与5种以上疾病相关。尽管我们队列中的疾病合并症较低,但预测特征显示出高度相关性(图4b)。
最后,我们计算了最近开发的肠道微生物组健康指数(Gut Microbiome Health Index, GMHI),发现健康和不健康个体之间存在显著差异(P = 6.16×10-22)。我们的健康微生物组特征在属或种水平复制了50个GMHI信号中的43个。此外,我们确定了55种在GMHI研究中未发现的微生物组-健康状况的关联,包括Butyrivibrio, Akkermansia 和 Prevotella物种,这些物种以前与胃肠疾病有关,但与其他疾病无关。
图4:健康和疾病的微生物组特征
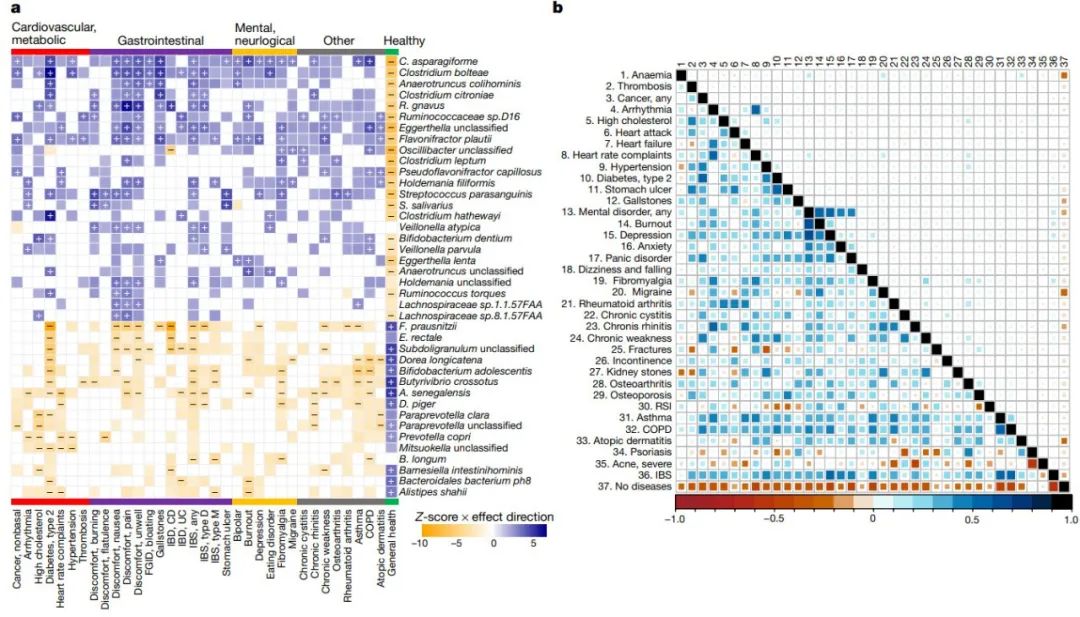
a, 与疾病类别和健康状况相关的微生物种类热图。疾病按疾病类型分类和标记。具有最高关联数量的前40种微生物物种采用分层聚类法按关联Z评分(由颜色强度表示)进行聚类。关联按效果方向着色(蓝色,阳性;橙色,阴性),在研究范围FDR < 0.05时关联显著,分别用正和负相关标记。无标签的有色关联表示名义上显著的关联(P < 0.05,无多次检测校正)。
b, 预测疾病的特征(左下三角)与队列中这些疾病的合并症(右上三角)之间的Pearson相关性比较。
CD(Crohn’s disease),克罗恩病;COPD(chronic obstructive pulmonary disease),慢性阻塞性肺病;IBD(inflammatory bowel disease),炎症性肠病;IBS(irritable bowel syndrome),肠易激综合征;RSI(repetitive strain injury),重复性劳损;UC(ulcerative colitis),溃疡性结肠炎。
微生物组反映了疾病和治疗
我们观察到常见非传染性疾病的微生物组效应与用于治疗这些疾病的药物高度一致。其中,我们确定了质子泵抑制剂(proton pump inhibitors, PPI)、抗生素、双胍类抗糖尿病药(biguanide antidiabetics)、渗透缓泻剂(osmotic laxatives)和肠道抗炎剂的最强作用(分别与84、56、47和32个与微生物分类群关联,FDR < 0.05)。为了理清疾病和药物的影响,我们对三种常见疾病及其相应的常用药物进行了多元线性回归:T2D的抗糖尿病药、抑郁症的选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors, SSRIs)以及功能性胃肠疾病和肠易激综合征的PPI。我们观察到,疾病和相应药物的影响与微生物组高度一致,即使相互制约,也表明不健康的肠道微生物组特征反映了疾病和相关的药物。
儿童期与成年期微生物组有关
由于2至3岁对微生物组的发育至关重要,我们研究了生命早期(小于4岁)因素对成年期微生物组的影响。我们确定了106种与分类群的关联,30种与通路的关联,22种与抗生素耐药基因的关联,2种与毒力因子的关联(FDR < 0.05),仅观察到分娩方式、母乳喂养和早产的轻微影响(图3b)。儿童期生活环境(比例尺表示从1:农村到5:高度城市化)与成年期微生物组显著相关(FDR时分别与分类群、通路和CARDs相关54、8和7,p < 0.05),尽管儿童期与成年期城市化之间的相关性非常低(Spearman r < 0.015)。
农村儿童环境与各种细菌的增加有关,包括P. copri, F. prausnitzii, Rothia mucilaginosa 以及Bifidobacterium和Mitsuokella的物种,其丰度也与总体健康状况的增加有关。相比之下,在城市儿童环境中,Bacteroides, Alistipes和Biophila 的多种物种的肠道丰度降低。
父母吸烟与其子女的微生物组相关 (FDR < 0.05时,分别确定了15、9和4种与分类群、通路和CARDs的关联)。在此,我们观察到父母吸烟与Veillonella, Oscillibacter 物种和 P. copri丰度降低之间的关联(R2 = 0.0012,FDR = 0.033),与当前正在吸烟的参与者(current smokers)的观察结果一致。最后,儿童期是否拥有宠物与成年期微生物组相关(7种关联,FDR < 0.05),包括在有儿童期宠物的受试者中观察到的Alistipes finegoldii, Lactobacillus delbrueckii 以及Dialister和Bilophila菌种减少。
暴露组与肠道微生物组有关
我们研究了采样时的环境因素,并确定了健康微生物组特征与是否拥有宠物、农村生活环境和生活环境中的绿地表面积的共同关联模式 (图3b),包括P. copri, Bacteroides plebeius, Desulfovibrio piger 和Mitsuokella物种的增加,以及Bacteroides fragilis和Bilophila wadsworthia的减少。这些信号与NO2和小颗粒物质污染物测量值增加的微生物组关联形成对比,后者与健康呈负相关。吸烟表型,包括当前主动吸烟和被动吸烟以及吸烟史,显示了与微生物组关联的一致的方向,这也与微生物组-疾病关联的特征相匹配。主动吸烟与41种物种和84种通路相关(FDR < 0.05,图3b),其中60%还与吸烟史相关,表明吸烟的长期影响。值得注意的是,其中15例还与被动吸烟相关,这突出表明有必要在疾病风险模型中考虑被动吸烟。
我们观察到社会经济因素(例如,月收入和邻里收入)与肠道微生物组之间有220种关联(FDR < 0.05),其中72种是细菌丰度与月收入之间的关联;较高的收入与健康的微生物组特征有关。收入与邻里绿地面积、农村生活环境和LLDS(Lifelines diet score)的相关性较低,但具有显著性(Spearman相关性分别为0.22、0.17和0.07;相关性检验FDRs < 1.0×10-6),表明微生物组-收入关联可能反映了多种因素,包括更健康的饮食和生活方式以及不太城市化的生活环境。这些结果支持了以下假设:肠道微生物组可能是社会经济范围内众所周知的健康差异的中介因素。
我们确定了20种饮食因素与82种物种之间的378种关联。在食物频率问卷(FFQ)收集和粪便取样之间的5年期间,还发现饮食相对稳定,在各测量值中代表主要饮食项目和饮食趋势的30个FFQ项目保守性超过95%,其余项目保守性超过50%。
以国际营养文献(international nutrition literature)为基础的饮食评分LLDS(Lifelines diet score)显示出最高的相关性(79个与分类群相关,44个与通路相关,20个与抗生素耐药基因相关,8个与FDR < 0.05时的毒力因子相关),其次是酒精总摄入量、血糖负荷、蛋白质饮食评分(反映蛋白质的数量和来源)和碳水化合物总摄入量。LLDS评分和蛋白质摄入评分显示的关联模式与总体健康状况改善的微生物组信号重叠——例如,Clostridia物种减少,Butyrivibrio 和Roseburia增加,以及参与泛醌和甲萘醌合成的通路增加。相比之下,总膳食碳水化合物摄入量和血糖负荷显示出相反的相关性(图3b)。
讨论
除了确认已知微生物组与年龄、性别和身体质量指数关联外,我们的结果还强调了与粪便样本(粪便一致性)、采样季节和样本处理(DNA浓度或测序批次)相关的经常被忽略的混杂因素的重要性。当研究年龄、性别、身体质量指数和粪便一致性与疾病相关的疾病或探索具有季节性变化的表型(如饮食、体力活动和过敏、流感和普通感冒等疾病)时,这一点尤为重要。
我们的观察结果表明,微生物组主要与共同居住和环境相关,而不是与遗传相关。这一结果证实了先前的研究,即确定了有限的总体微生物组遗传性、共同居住家庭成员及其宠物之间共有的微生物组模式以及停止共同居住的双胞胎中的微生物差异。这些结果表明,具有低遗传力的细菌,如Ruminococcus, Streptococcus 和Veillonella 物种,可能比具有更多遗传力的细菌,如Akkermansia, Collinsella 和 Bacteroides物种,更容易受到改变微生物组疗法的影响。
通过比较微生物组、健康和各种疾病之间的相关性,我们确定了肠道生物异常的共同信号(图4a),这在很大程度上与先前的研究一致。共有菌群失调的存在对微生物组研究和以微生物组为靶点的诊断和治疗具有重要意义。共有的生物异常意味着肠道微生物组是一般健康的生物标志物(以如我们的预测模型和先前研究所支持的),但也使基于微生物组的个体疾病诊断变得复杂化。由于单一疾病模型可能会被互不相关的疾病间共享的信号混淆,因此在混合疾病队列中测试此类模型的特异性将是临床手段实施前的一个重要步骤。共享的微生物组特征也表明微生物组靶向干预可以改善人类整体的健康。我们的观察结果支持了这一观点,即通常被视为健康的生活方式因素——例如,遵守当前的饮食建议和不吸烟——与微生物组模式相关,与一般健康的状况相关。尽管微生物组-药物相互作用已在体外得到很好的描述,并已在体内对抗生素、PPI和抗糖尿病药进行了表征,但我们的结果表明,一般微生物组失调是药物和疾病共同作用的结果,这意味着许多目前研究不足的药物,如SSRIs,可能对肠道微生物组有负面影响。
未报告疾病或药物使用的参与者中存在疾病样(disease-like)微生物组特征,表明人群中存在临床前“隐藏”的疾病,并表明肠道微生物的失调可能先于慢性疾病(如T2D病)的临床发作。尽管这一假设需要长期纵向队列的实验验证或分析,但我们的观察结果表明,肠道微生物组可用于监测长期健康状况和检测临床前阶段的疾病。
将健康和不健康微生物组特征与儿童期和当前暴露组、饮食和社会经济因素联系起来,我们观察到,更健康的饮食、儿童时期和当前暴露于农村环境和宠物、暴露于绿色空间和较高收入与健康微生物组特征共享信号。这些观察结果支持微生物组多样性假说(也称为卫生假说),即微生物组暴露组的减少会导致自身免疫性疾病和过敏性疾病的发生率增加。值得注意的是,尽管经典的卫生学假设侧重于病原体和早期暴露,但我们的结果表明,成年期暴露对形成健康或不健康的微生物组模式有贡献,环境塑造了一生的微生物组,这意味着微生物组靶向疗法可能在个体的一生中都是有效的。此外,我们确定了饮食评分、宠物和农村环境与机会性病原体(如Clostridia species)的负相关关系,以及与共生菌(如Bacteroides, Alistipes 和Faecalibacterium的丁酸盐生产者)的正相关关系,这意味着暴露于病原体和环境中的共生菌对建立健康的肠道生态系统具有重要作用。
我们还观察到,吸烟、高碳水化合物饮食以及暴露于NO2和小颗粒物质(PM2.5)与疾病相关的Clostridia和Ruminococcus物种呈正相关。尽管空气污染物与肠易激综合征等胃肠道疾病有关,并已显示会影响小鼠的肠道微生物组,但其对人类肠道微生物组的影响在很大程度上仍未被探索。我们的结果与之前在美国队列中进行的空气污染相关性分析一致,并表明空气污染物会对人类肠道微生物组产生负面影响,并可能通过导致全身菌群失调而增加胃肠道疾病的风险。我们的观察结果进一步支持了这一观点,即肠易激综合征的存在与PM2.5污染物相关(Spearman r = 0.15),而污染物与其他疾病、社会经济因素和饮食之间的相关性非常低(Spearman r < 0.05)。
我们发现,儿童时期暴露于吸烟、宠物和农村环境与成年期微生物组有关。尽管这些关联的效应大小低于当前暴露组,但效应方向和模式是一致的,表明环境暴露可能具有长期效应,微生物组反映了个体的暴露史。我们的发现进一步支持了这一观点,即曾经的吸烟者仍然表现出与当前吸烟者相似的微生物组关联,尽管效应大小较低。
我们测量了241种表型,但仅能解释微生物组成和功能约15%的个体间差异,这与之前的大规模研究一致。这意味着肠道微生物组高度个体化,可能包含难以从数据中分离出来的稀有分类群,并且我们目前对肠道微生物组形成因素的理解仍然有限。这种低解释力也可能反映了以数据库为中心的微生物组分类的使用一方面有助于研究的标准化和低假阳性率,但另一方面排除了未编目微生物(uncatalogued microbes)的鉴定。“缺失的差异(missing variance)”的未来量化(可能通过基于组装和数据库独立的方法以及纵向研究进行)将在微生物靶向诊断和治疗的发展中发挥关键作用。
总结
我们生成并分析了一个大的多代肠道微生物组队列,该队列是在高度标准化的情况下收集和分析的,并将其与广泛的表型数据联系起来。我们定义并描述了多种疾病共有的肠道菌群失调,并确定了这种菌群失调与遗传性、儿童期和当前暴露组、生活方式和社会经济因素之间的联系。本研究证明了大规模、表型良好的队列在剖析肠道微生物组、健康、遗传和环境之间的联系方面的力量,并为微生物组指导干预的未来研究提供了丰富的资源。
引文
R. Gacesa, A. Kurilshikov, A. Vich Vila, T. Sinha, M. A. Y. Klaassen, L. A. Bolte, S. Andreu-Sánchez, et al. 2022. Environmental factors shaping the gut microbiome in a Dutch population. Nature https://doi.org/10.1038/s41586-022-04567-7
延伸阅读
本文的扩展图片:https://www.nature.com/articles/s41586-022-04567-7/figures/5
Rothschild, Daphna, et al. “Environment dominates over host genetics in shaping human gut microbiota.” Nature 555.7695 (2018): 210-215. Link: https://www.nature.com/articles/nature25973.
Goodrich, Julia K., et al. “Human genetics shape the gut microbiome.” Cell 159.4 (2014): 789-799. Link: https://www.sciencedirect.com/science/article/pii/S0092867414012410
Goodrich, Julia K., et al. “Genetic determinants of the gut microbiome in UK twins.” Cell host & microbe 19.5 (2016): 731-743. Link: https://www.sciencedirect.com/science/article/pii/S1931312816301536
Turpin, Williams, et al. “Association of host genome with intestinal microbial composition in a large healthy cohort.” Nature genetics 48.11 (2016): 1413-1417. Link: https://www.nature.com/articles/ng.3693
编译:吴季秋
责编:马腾飞 南京农业大学
审核:刘永鑫 中科院遗传发育所
猜你喜欢
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature Cell专刊 肠道指挥大脑
文献阅读 热心肠 SemanticScholar Geenmedical
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。PI请明示身份,另有海内外微生物相关PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。

学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
点击阅读原文,跳转最新文章目录阅读




















 116
116











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








