性别差异的肠道微生物是结直肠癌性别二态性的潜在原因
Male-Biased Gut Microbiome and Metabolites Aggravate Colorectal Cancer Development

Article, 2023-07-04, Advanced Science, [IF 15.1]
DOI:10.1002/advs.202206238
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202206238
第一作者:Ling Wang (王玲);Yi-Xuan Tu (涂懿璇)
通讯作者:Zhen-Xia Chen (陈振夏);Xin-Jun Liang (梁新军)
主要单位:
湖北洪山实验室(Hubei Hongshan Laboratory, Wuhan 430070, China)
华中农业大学交叉科学研究院生命科学与技术学院,农业生物信息湖北省重点实验室(Hubei Key Laboratory of Agricultural Bioinformatics, College of Life Science and Technology, Interdisciplinary Sciences Institute, Huazhong Agricultural University, Wuhan 430070, China)
华中农业大学生物医学与健康学院(College of Biomedicine and Health, Huazhong Agricultural University, Wuhan 430070, China)
华中农业大学深圳营养与健康研究所(Shenzhen Institute of Nutrition and Health, Huazhong Agricultural University, Shenzhen 518000, China)
广东省岭南现代农业实验室,农业部基因组分析实验室,中国农业科学院深圳农业基因组研究所(Shenzhen Branch, Guangdong Laboratory for Lingnan Modern Agriculture, Genome Analysis Laboratory of the Ministry of Agriculture, Agricultural Genomics Institute at Shenzhen, Chinese Academy of Agricultural Sciences, Shenzhen 518000, China)
- 摘要 -
男性结直肠癌(CRC)的发病率和死亡率较女性高。本研究旨在从性别差异的肠道微生物和代谢物的角度阐释这种性别二态性在CRC中的潜在原因。结果显示,在ApcMin/+小鼠和azoxymethane(AOM)/dextran sulfate sodium(DSS)处理的小鼠中观察到CRC的性别二态性,雄性小鼠具有更大和更多的肿瘤,并伴有更严重的肠道屏障功能受损。此外,灌胃来自雄性小鼠或男性患者的粪便样本的伪菌小鼠显示出更严重的肠道屏障损伤和更高水平的炎症。在雄性CRC模型小鼠或者是灌胃雄性CRC小鼠或男性CRC患者粪便的伪无菌小鼠粪便样本中检测到肠道微生物组成的变化,病原菌Akkermansia muciniphila增加,有益菌Parabacteroides goldsteinii减少。性别偏好性的肠道代谢物主要通过甘油磷脂代谢途径对CRC肿瘤发生中的性别二态性发挥作用。综上所述,性别二态性的肠道微生物和代谢物对CRC的性别二态性具有重要的作用,通过调节性别二态性的肠道微生物和代谢物可成为潜在的针对性别的CRC治疗策略。
- 引言 -
结直肠癌是全球排名第三和致死率第二的肿瘤。值得注意的是,每年男性患CRC和死于CRC的人数比女性多。在CRC患者中,男性被诊断的年龄较早,平均比女性年轻4-6岁。这种性别二态性的CRC生存差异引起了广泛关注,因为它可能意味着男性和女性在癌症发生和对治疗方面存在差异。然而,现有的CRC筛查或治疗指南并未考虑性别二态性。这可能是因为在动物研究中,由于雌激素信号的可能影响,大多数动物研究都使用了雄性小鼠来诱导CRC。因此,揭示CRC动物模型中性别差异的机制对于精确药物的临床应用非常重要。
性别偏好性的肠道微生物可能对CRC的性别二态性具有影响作用。CRC是一种多因素性疾病,目前已经确定的影响CRC的因素有生活方式、遗传和环境因素等。肠道微生物也可能参与了CRC的发生与发展。肠道微生物通过肠脑轴(gut-brain axis)影响中枢神经系统(CNS),在胃肠道和CNS之间传递双向的生化信号。健康人群与CRC患者之间的肠道微生物组成存在显著差异。此外,健康对照组的微生物多样性显著高于CRC患者。与男性相比,绝经前的女性肠道微生物多样性更高,并且富含多种对宿主新陈代谢有益的物种。然而,性别偏好性的肠道微生物与CRC性别二态性之间的关系还不太清楚。因此,筛选影响CRC性别差异的肠道微生物具有十分重要的研究价值。性别偏好性的肠道微生物可能成为有价值的癌症治疗靶点和预后标志物。
各种小鼠模型,包括基因工程小鼠模型(GEMM)和致癌物诱导模型(CIM),已经在临床前研究中开发出来,以重现人体中结直肠癌。ApcMin/+小鼠模型是广泛使用的GEMM,用于了解家族性腺瘤性息肉病相关CRC的发生和发展的分子过程。而AOM/ DSS诱导的CRC小鼠模型更广泛用于研究炎性结肠癌。尽管已经在CRC患者中证明了性别二态性差异,但在小鼠模型中尚未报道。在本研究中,我们使用这些CRC小鼠模型来研究CRC的性别二态性差异,并评估了性别偏好性的肠道微生物对CRC进展的影响。此外,我们发现从雄性CRC小鼠或人患者的粪便中提取的物质,在伪无菌小鼠中促进了肠道屏障功能障碍和肠道炎症,表明性别偏好性的肠道微生物对CRC的发展起到了一定的贡献。调节性别偏好性的肠道微生物和代谢产物可能是一种潜在的精准性别靶向治疗策略,用于预防和治疗性别偏好性的CRC。
- 结果 -
1. 结直肠癌小鼠模型肿瘤发生中的性别二态性
Sexual dimorphism in tumorigenesis of CRC mouse models
为了验证CRC小鼠模型是否显示与CRC患者相似的性别二态性差异,从而可以用于研究CRC患者的性别二态性,我们使用了转基因CRC小鼠模型ApcMin/+,并将雌性和雄性ApcMin/+小鼠在标准饮食下与野生型C57BL/6L小鼠进行了对比(对照组)(补充图1A)。结果表明,雌性小鼠(260天)的平均存活时间比雄性小鼠长24天,平均存活时间增加了18.1%(补充图1B)。雄性ApcMin/+小鼠比雌性小鼠表现出更多和更大的结直肠肿瘤(补充图1C)。对结肠切片进行组织学检查显示,雄性小鼠的腺癌、高级别和低级别的畸形比例较雌性小鼠更高(补充图1D)。雄性小鼠的结肠切片中显示的Ki-67阳性细胞数量显著多于雌性小鼠,表明雄性小鼠中癌细胞增殖增加(补充图1E)。杯状细胞是结肠中形成黏液屏障所必需的特殊上皮细胞。对结肠组织进行Periodic-Acid Schiff(PAS)染色显示,每个腺窝中杯状细胞的平均数目在雄性小鼠中较雌性小鼠更少(补充图1F)。这些数据表明,在CRC小鼠模型中存在与CRC患者相似的性别二态性。
性别差异可能与特定的膳食模式相关。为了探索不同膳食模式下CRC发展中的性别二态差异,我们使用了高脂饮食的ApcMin/+小鼠模型(图1A)。与标准饮食的ApcMin/+模型小鼠的结果一致,雌性小鼠(159天)的平均存活时间比雄性小鼠长39天,平均存活时间增加了35.1%(图1B)。同时,雄性小鼠也比雌性小鼠表现出更多更大的肿瘤(图1C),更高比例的腺癌、高级别和低级别的畸形(图1D),更多的Ki-67阳性细胞(图1E),以及更少的腺体细胞(图1F),这表明在高脂饮食的ApcMin/+小鼠中,CRC的性别二态差异更为明显。
此外,我们还使用了另一个CRC小鼠模型(经AOM/DSS处理的C57BL/6L小鼠),以确定性别二态差异是否仅出现在特定的CRC小鼠模型中(补充图2A)。同样,雌性小鼠(199天)的平均存活时间比雄性小鼠长44天,平均存活时间增加了42%(补充图2B)。雄性小鼠也表现出比雌性小鼠更严重的症状(补充图2C-F),这与ApcMin/+模型小鼠的结果一致,表明至少在两个小鼠模型中存在性别二态差异。
以上所有结果表明,CRC雄性小鼠比雌性小鼠表现出更严重的CRC症状,正如CRC患者报告的一样,因此上述的CRC小鼠模型适用于进一步研究CRC性别二态差异的机制。由于转基因ApcMin/+小鼠接受的处理较少,并且在高脂饮食条件下在CRC发展中显示出更明显的性别二态差异,我们选择采用高脂饮食的ApcMin/+模型来研究CRC发展中性别二态差异的机制。
性别偏好性的肠道微生物对小鼠CRC发展中的性别二态差异起到了一定的贡献。雄性ApcMin/+小鼠中更严重的CRC症状可能源于其较差的肠道屏障功能。为了探索雄性和雌性ApcMin/+小鼠的肠道屏障功能是否存在差异,我们通过测量血清脂多糖(LPS)水平来检查性别对小鼠结肠细胞间隙渗透性的影响。结果显示,与雌性小鼠相比,雄性小鼠的血清LPS浓度升高(图1G)。与此同时,雄性和雌性野生型小鼠之间的血清LPS浓度没有显著差异(图1H)。此外,紧密连接蛋白(肠道屏障完整性的关键组成部分)ZO-1、Occludin和Claudin-3的表达在雄性小鼠中明显降低(图1I-M)。一致的是,透射电子显微镜下观察到的肠道屏障结构显示,雄性小鼠的结肠细胞间隙存在异常,如较宽的细胞间隙,表明雄性小鼠的屏障功能受损更严重(图1N)。考虑到肠道微生物会影响肠道屏障功能,这些结果暗示肠道微生物参与了CRC肿瘤发生中的性别二态差异。
为了评估性别偏好性的肠道微生物对CRC肿瘤发生性别二态差异的影响,我们使用抗生素联合治疗方案来清除雄性和雌性ApcMin/+小鼠的肠道微生物。在ApcMin/+小鼠经抗生素处理后,雄性和雌性之间的结直肠肿瘤数量、体积差异、腺癌比例和畸形程度差异消失(补充图3A-F)。我们还对AOM/DSS小鼠进行了相同的实验,并获得了类似的结果(补充图3G-I)。这些结果表明,肠道微生物在调节CRC发展中的性别二态差异中可能发挥着重要作用。
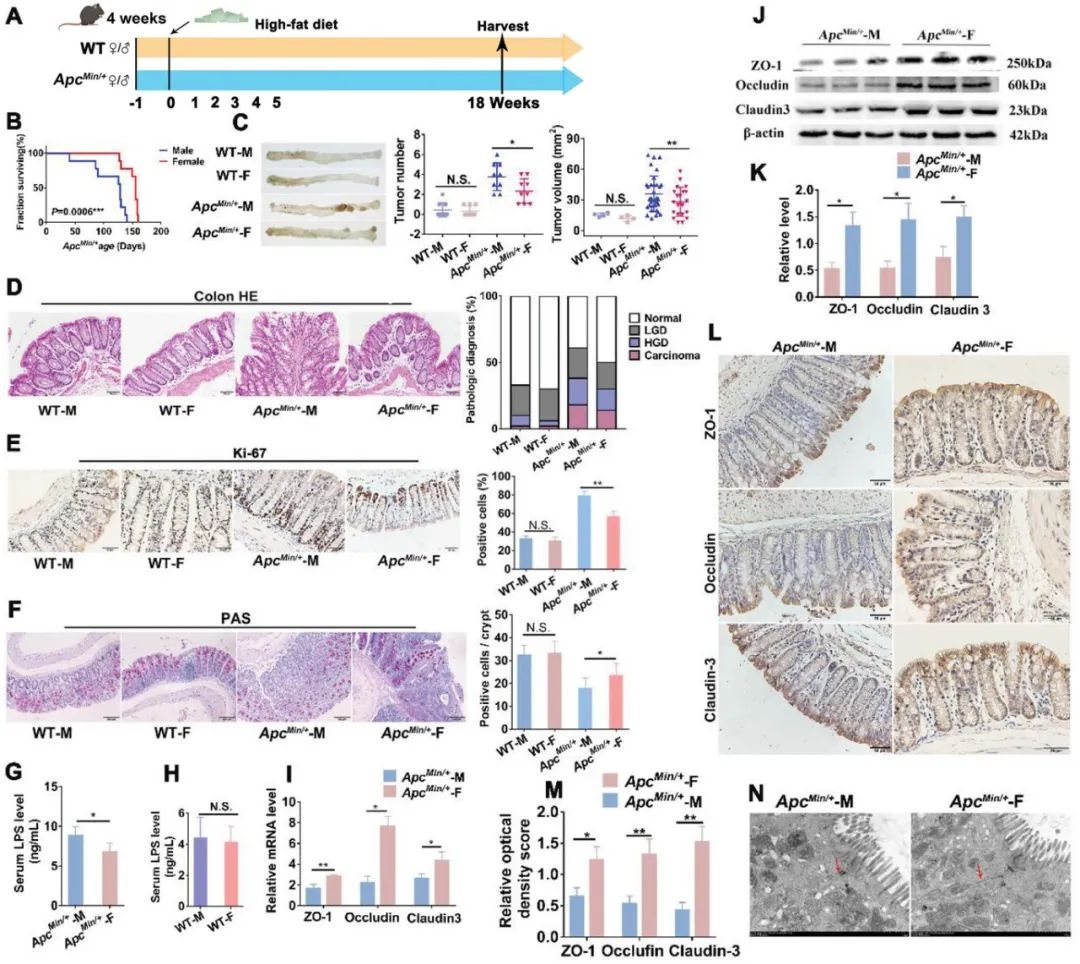
图1. 高脂饮食下ApcMin/+小鼠模型中的性别二态差异在肿瘤发生中的表现。
(A)ApcMin/+小鼠模型和高脂饮食下的野生型小鼠的实验设计。(B)雌性小鼠与雄性小鼠相比具有更长的存活时间。(C)牺牲时结肠的代表性图像。WT-M、WT-F、ApcMin/+-M、ApcMin/+-F小鼠的肿瘤数量和肿瘤体积。(D)HE染色对小鼠结肠进行病理诊断。(E)Ki-67的免疫组织化学染色及定量分析小鼠结肠中的Ki-67指数。(F)腺体细胞数量通过PAS染色进行评估。(G)ApcMin/+-M和ApcMin/+-F小鼠血清中的LPS浓度。(H)WT-M和WT-F小鼠血清中的LPS浓度。(I)ApcMin/+-M和ApcMin/+-F小鼠结肠组织中肠道屏障相关蛋白ZO-1、Occludin和Claudin-3的表达水平,使用qRT-PCR进行定量分析。(J-K)通过Western blot进行定量分析。(L-M)免疫组织化学染色分析ApcMin/+-M和ApcMin/+-F小鼠结肠组织中粘附分子ZO-1、Occludin和Claudin-3的分布情况及定量分析。(N)透射电子显微镜下ApcMin/+-M和ApcMin/+-F小鼠结肠细胞间隙的代表性图像。
2. 来自雄性结直肠癌小鼠及男性患者的肠道微生物加速受体伪无菌小鼠的肠道屏障功能受损
Gut microbes from male CRC mice and pacients contribute to impaired gut barrier function in recipient pseudo germ-free mice
为了进一步验证性别偏好性的肠道微生物对CRC肿瘤发生中性别二态差异的影响,我们将高脂饮食下的ApcMin/+小鼠的粪便微生物移植(FMT)到接受抗生素治疗的伪无菌小鼠中(图2A)。小鼠随机接受来自雄性ApcMin/+小鼠的粪便(FMT-AM,包括雄性受体组和雌性受体组)或雌性ApcMin/+小鼠的粪便(FMT-AF,包括雄性受体组和雌性受体组)。伪无菌小鼠接受抗生素处理2周。我们随机选取了五个粪便样本进行16S rRNA基因扩增测序。结果显示,伪无菌小鼠的肠道微生物序列读数、OTUs和Shannon多样性显著降低(图2B)。FMT没有改变伪无菌小鼠的体重(图2C)。然而,FMT-AM小鼠的血清LPS浓度高于FMT-AF小鼠(图2D)。与此同时,接受相同粪便样本的雄性和雌性伪无菌小鼠之间的LPS水平没有显著差异(图2D)。透射电子显微镜下观察到的肠道屏障结构异常,如FMT-AM小鼠中较宽的细胞间隙(图2E)。一致的是,与FMT-AF相比,FMT-AM小鼠中观察到更多分散的小肿瘤和高级别畸形(图2F)。此外,与FMT-AF小鼠相比,FMT-AM小鼠中观察到增加的Ki-67阳性细胞(图2G),减少的腺体细胞(图2H)和降低的紧密连接蛋白(ZO-1,Occludin和Claudin-3)的表达(图2I-J)。慢性炎症是CRC的已知风险因素之一。ELISA结果显示,FMT-AM组中炎症介质TNF-α的表达上调(图2K),而FMT-AF组中抗炎细胞因子IL-10的表达上调(图2L)。综上所述,这些结果表明CRC小鼠中的性别偏好性的肠道微生物通过损害肠道屏障功能影响结直肠肿瘤发生。
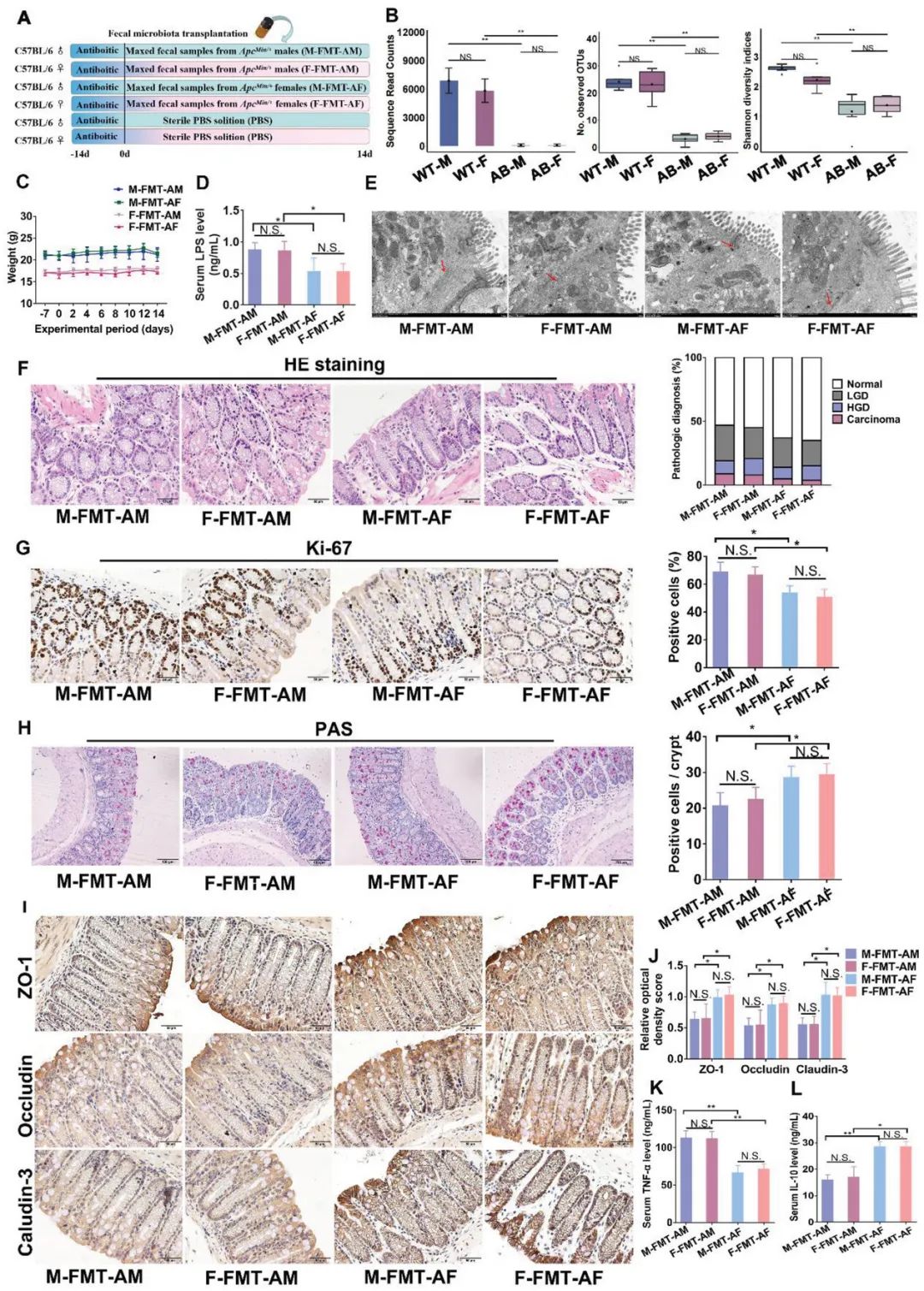
图2. 雄性CRC小鼠的肠道微生物加速伪无菌小鼠中的结直肠肿瘤发生。
(A)伪无菌小鼠的粪便微生物移植实验设计。(B)伪无菌小鼠肠道微生物序列读数、OTUs和Shannon多样性的观察结果。(C)每组小鼠的体重。(D)M-FMT-AM(雄性小鼠接受来自雄性ApcMin/+小鼠的粪便)、F-FMT-AM(雌性小鼠接受来自雄性ApcMin/+小鼠的粪便)、M-FMT-AF(雄性小鼠接受来自雌性ApcMin/+小鼠的粪便)和F-FMT-AF(雌性小鼠接受来自雌性ApcMin/+小鼠的粪便)小鼠血清中的LPS浓度。(E)透射电子显微镜下M-FMT-AM、F-FMT-AM、M-FMT-AF和F-FMT-AF小鼠结肠细胞间隙的代表性图像。(F)小鼠结肠HE染色进行病理诊断。(G)伪无菌小鼠结肠切片Ki-67的免疫组织化学染色及定量分析。(H)通过PAS染色评估结肠腺体细胞的数量。通过溶菌酶免疫组织化学染色评估Paneth细胞的数量。每个切片随机选择6个组织来计算每个腺窝阳性细胞的百分比。(I-J)伪无菌小鼠结肠组织中粘附分子ZO-1、Occludin和Claudin-3的免疫组织化学染色及定量分析。(K)伪无菌小鼠血清中TNF-α的浓度。(L)伪无菌小鼠血清中IL-10的浓度。
3. 结直肠癌小鼠模型肠道微生物组存在性别偏好性
Gut microbiome is sex-biased in CRC mouse model
为了确定与CRC发展相关的性别偏好性微生物,我们对接受高脂饮食的雄性和雌性ApcMin/+小鼠以及野生型小鼠的粪便样本进行了全基因组测序。与野生型小鼠相比,ApcMin/+小鼠的细菌多样性降低,细菌丰富度减少。同时,与雄性小鼠相比,雌性ApcMin/+小鼠的细菌多样性增加(图3A)。同样,主坐标分析(PCoA)结果显示,WT-M、WT-F、ApcMin/+-M和ApcMin/+-F小鼠的微生物β多样性存在显著差异(图3A)。在雄性和雌性ApcMin/+小鼠中观察到不同的微生物组成,并且野生型小鼠也存在这种情况。在WT小鼠和ApcMin/+小鼠中各鉴定出29种和21种性别偏好性的细菌物种(补充表2)。筛选出在雄性和雌性ApcMin/+小鼠之间存在特异性差异的15种细菌物种(图3B)。潜在的致病菌物种Alistipes inops和Akkermansia muciniphila在雄性小鼠中的丰度明显高于雌性小鼠(图3C和补充图4),而益生菌物种Parabacteroides goldsteinii20、Lactobacillus taiwanensis和Lactobacillus fermentum在雄性小鼠中减少。使用定量聚合酶链反应研究了Akkermansia muciniphila和Parabacteroides goldsteinii在雄性与雌性小鼠之间的差异丰度(补充图5)。共培养实验证明,P.goldsteinii抑制细胞生长,而A.muciniphila促进了CRC细胞系(SW620和HCT116)的生长(图3D)。
与此同时,我们检查了接受粪便微生物移植的伪无菌小鼠的肠道微生物组成。全基因组测序结果显示,FMT-AM小鼠和FMT-AF小鼠的肠道微生物组成存在显著差异。FMT-AM小鼠的细菌多样性和丰富度均低于FMT-AF小鼠(图3E)。同时,接受来自雌性小鼠的粪便样本的伪无菌小鼠的OTU数量明显高于接受来自雄性小鼠的粪便样本的伪无菌小鼠(图3F)。主坐标分析(beta多样性)显示M-FMT-AM、F-FMT-AM、M-FMT-AF和F-FMT-AF小鼠的肠道微生物具有显著不同的聚类方式(图3G)。FMT-AM小鼠和FMT-AF小鼠之间观察到不同的微生物组成。其中,大肠杆菌和黏膜层A.muciniphila丰度增加,而B.pseudolongum、B.animalis和P.goldsteinii等对肠道有益的细菌在FMT-AF小鼠中减少(图3H)。潜在的致病菌物种A.muciniphila在FMT-AM小鼠中的丰度显著高于FMT-AF小鼠,而益生菌物种P.goldsteinii在FMT-AM小鼠中减少(图3I)。与此一致的是,ApcMin/+-M小鼠中A.muciniphila的丰度显著高于ApcMin/+-F小鼠,而P.goldsteinii在ApcMin/+-M小鼠中减少。综上所述,这些结果表明雌性ApcMin/+小鼠中有益菌的丰度增加,有害菌的丰度减少。

图3. CRC小鼠模型中的肠道微生物具有性别偏好性。
(A)WT-M(n=10)、WT-F(n=11)、ApcMin/+-M(n=8)和ApcMin/+-F小鼠(n=9)的OUT和Shannon多样性的α多样性分析,以及肠道微生物组的PCoA分析(β多样性)。(B)WT-M、WT-F、ApcMin/+-M和ApcMin/+-F小鼠肠道微生物组的热图。保护性细菌物种以蓝色表示,潜在致病性细菌物种以红色表示。(C)WT-M、WT-F、ApcMin/+-M和ApcMin/+-F小鼠中Akkermansia muciniphila和Parabacteroides goldsteinii的丰度。(D)HCT116和SW620 CRC细胞与P.goldsteinii、A.muciniphila、大肠杆菌和空白对照的共培养生长曲线。(E)Source-M(接受来自雄性ApcMin/+小鼠的粪便样本)、Source-F(接受来自雌性ApcMin/+小鼠的粪便样本)、M-FMT-AM、F-FMT-AM、M-FMT-AF和F-FMT-AF小鼠的肠道微生物OUTs的α多样性分析。(F)Source-M、Source-F、M-FMT-AM、F-FMT-AM、M-FMT-AF和F-FMT-AF小鼠的肠道微生物Shannon多样性的α多样性分析。(G)M-FMT-AM、F-FMT-AM、M-FMT-AF和F-FMT-AF小鼠的肠道微生物组的PCoA分析(β多样性)。(H)M-FMT-AM、F-FMT-AM、M-FMT-AF和F-FMT-AF小鼠肠道微生物组的热图。保护性细菌物种以蓝色表示,潜在致病性细菌物种以红色表示。(I)Source-M、Source-F、M-FMT-AM、F-FMT-AM、M-FMT-AF和F-FMT-AF小鼠中Akkermansia muciniphila和Parabacteroides goldsteinii的丰度。
4. 性别偏好性的代谢物LPC促进细胞增殖和细胞连接损伤
Sex-biased gut metabolite LPC enhances cell proliferation and cell junction impairment
肠道微生物可以通过介导代谢产物的作用促进CRC的发展。为了揭示性别偏好性引起的代谢变化,我们对摄取高脂饮食的雄性和雌性ApcMin/+或WT小鼠的粪便样本进行了代谢组学分析。主成分分析(PCA)显示雄性和雌性ApcMin/+或WT小鼠的肠道代谢产物存在显著差异(图4A)。我们在WT小鼠中鉴定出了267个性别偏好性的代谢产物,在ApcMin/+小鼠中鉴定出了286个(图4B)。其中,磷脂酰胆碱(PC)和LPC(PC的下游代谢产物)都是雄性小鼠中上调的异常代谢产物(图4B)。L-精氨酸和α-亚麻酸都是雄性小鼠中下调的代谢产物(图4B)。在ApcMin/+小鼠中,鉴定出了23个与菌群起源有关的性别偏好性代谢产物,而在WT小鼠中没有发现(图4C,附表3)。在ApcMin/+小鼠中,性别偏好性代谢产物富集的途径中,甘油磷脂代谢是变化最大的顶级途径之一(图4D)。PC和LPC都包括在甘油磷脂代谢途径中。
我们进行了综合分析,以确定雄性和雌性ApcMin/+小鼠中性别偏好性的肠道微生物与代谢产物之间的潜在关联(图4E)。我们发现A.muciniphila的富集与LPC呈正相关,而与L-精氨酸呈负相关(图4F)。此外,P.goldsteinii的减少与LPC呈正相关,而与L-精氨酸呈正相关(图4G)。
为了探索性别偏好性代谢产物在CRC发展中的潜在功能作用,我们将差异性和非差异性代谢产物应用于两种CRC细胞系(SW620和HCT116)。作为阴性对照,使用了不偏好性于雄性或雌性的代谢产物肌苷酸。共培养实验显示LPC显著促进了CRC细胞系的增殖(图4H),而L-精氨酸显著抑制了2种CRC细胞系的增殖(图4I)。细胞周期分析显示,与对照组相比,LPC处理加速了HCT116和SW620细胞从G1期到S期的细胞周期进程(图4J-K)。与这些观察结果一致,LPC处理后在CRC细胞系中检测到了增加的增殖细胞核抗原(PCNA)和细胞周期蛋白D1的蛋白表达(图4L)。此外,我们还检查了LPC是否会影响上皮屏障功能。与对照相比,在LPC处理的HCT116和SW620细胞中,显著降低了ZO-1和Occludin的蛋白表达,表明LPC可能损害屏障功能(图4M)。这些结果表明,肠道微生物的改变以及其相关的代谢产物均加速了与雄性相关的结直肠癌的发展。
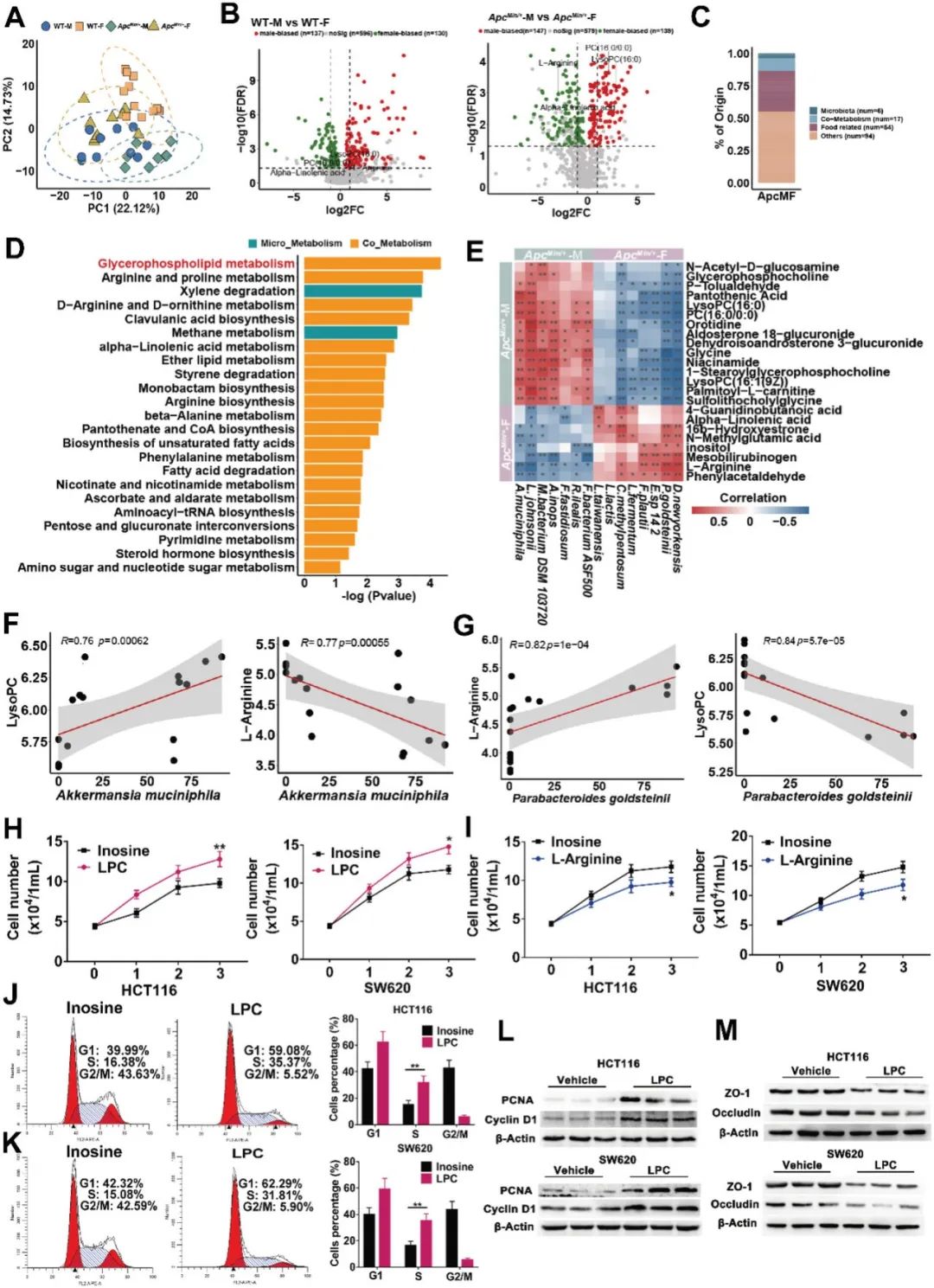
图4. 性别差异的肠道代谢产物LPC促进细胞增殖和细胞连接损伤。
(A) PCA图展示了WT-M(n=10)、WT-F(n=11)、ApcMin/+-M(n=8)、ApcMin/+-F(n=9)小鼠的肠道代谢组学分析。(B) 比较WT-M与WT-F小鼠或ApcMin/+-M与ApcMin/+-F小鼠之间的差异代谢物的火山图。(C) ApcMin/+-M和ApcMin/+-F小鼠之间差异代谢物的来源,除了在WT小鼠中的差异。(D) ApcMin/+-M和ApcMin/+-F小鼠中微生物来源差异富集代谢物的通路分析。(E) 性别差异微生物和代谢物相关性的相关分析。(F) A.muciniphila与LPC呈正相关,而与L-Arginine呈负相关。(G) P.goldsteinii与LPC呈正相关,而与L-Arginine呈正相关。(H) 使用LPC和肌苷(作为负对照)处理CRC细胞系HCT116和SW620的细胞生长曲线。(I) 使用L-Arginine和肌苷处理CRC细胞系HCT116和SW620的细胞生长曲线。(J-K) LPC处理和未处理的HCT116细胞和SW620细胞使用碘化丙啶(PI)染色并通过流式细胞术进行分析。(L) LPC和肌苷处理的HCT116细胞和SW620细胞中细胞增殖和细胞周期相关蛋白质PCNA和Cyclin D1的表达水平。(M) LPC处理和未处理的HCT116细胞系和SW620细胞系中与肠道屏障功能相关蛋白质ZO-1和Occludin的表达水平。
5. 性别偏好性的肠道微生物在CRC患者中也对肠道屏障功能和炎症的性别差异发挥作用
Sex-biased gut microbes in CRC patients also contributed to sexual dimorphism in gut barrier function and inflammation
然后我们比较了小鼠和人类之间以及不同CRC患者群体之间的性别偏好性微生物,以确定对人类CRC肿瘤发生有潜在贡献的共同微生物。
为了调查结直肠癌(CRC)患者的肠道微生物是否存在性别偏好性,我们收集了来自健康人和CRC患者的12个shotgun宏基因组测序数据集,并进行了元分析(图5A)。由于这些数据集在生物学和技术上有所不同,我们对与微生物组成有关的群体因素的影响进行了量化。我们将“群体”因素与其他潜在混杂因素(年龄、BMI、位置等)进行了比较,并发现“群体”因素对比较性别偏好性的微生物组成有主要影响(图5B),主要是由于不同人群和DNA提取协议的差异。24-26为评估男性和女性CRC患者的微生物组差异,我们通过整合12个shotgun宏基因组测序数据集进行了元分析,并将“群体”因素视为混杂因素。在整合数据后,我们观察到M-C和F-C组之间的α多样性存在显著差异(图5C)。通过PcoA分析(beta多样性),我们观察到健康男性、健康女性、男性CRC患者和女性CRC患者之间的微生物组成差异(图5D)。我们主要研究了CRC患者中的性别偏好性肠道微生物。在男性与女性CRC患者的比较中,我们发现20种肠道微生物的丰度存在差异(图5E)。包括Collinsella aerofaciens和Desulfovibrionaceae bacterium在内的4种潜在致病性细菌物种的丰度在男性CRC患者中显著高于女性患者(图5F)。
为了进一步研究人类性别偏好性的肠道微生物组成差异对CRC肿瘤发生的影响,我们将男性或女性CRC患者的粪便移植到伪无菌小鼠的肠道(补充图6A)。粪便微生物移植(FMT)并未改变伪无菌小鼠的体重(补充图6B)。然而,与接受女性CRC患者粪便的小鼠(FMT-CF,包括雄性受体组F-FMT-CM和雌性受体组F-FMT-CF)相比,接受CRC男性患者粪便的小鼠(FMT-CM,包括雄性受体组M-FMT-CM和雌性受体组F-FMT-CM)的血清LPS浓度更高(补充图6C)。同时,接受相同粪便样本的男性和女性伪无菌小鼠的LPS水平没有显著差异(补充图6C)。一致的是,与FMT-CF小鼠相比,FMT-CM小鼠中观察到更多分散的小息肉和高级别异型增生(补充图6D)。此外,与FMT-CF小鼠相比,FMT-CM小鼠中观察到Ki-67阳性细胞增多(补充图6E),杯状细胞减少(补充图6F),细胞间隙扩大(补充图6G),以及紧密连接蛋白(ZO-1,Occludin和Claudin-3)表达降低(补充图6H)。ELISA结果显示,抗炎细胞因子IL-10在FMT-CF组中上调表达(补充图6I),而促炎细胞因子TNF-α在FMT-CM组中上调表达(补充图6J)。总的来说,这些结果表明男性CRC患者的肠道微生物组,就像ApcMin/+小鼠中的情况一样,通过破坏肠道屏障功能和增加炎症加速了结直肠肿瘤发生,这与小鼠FMT实验的结果一致。
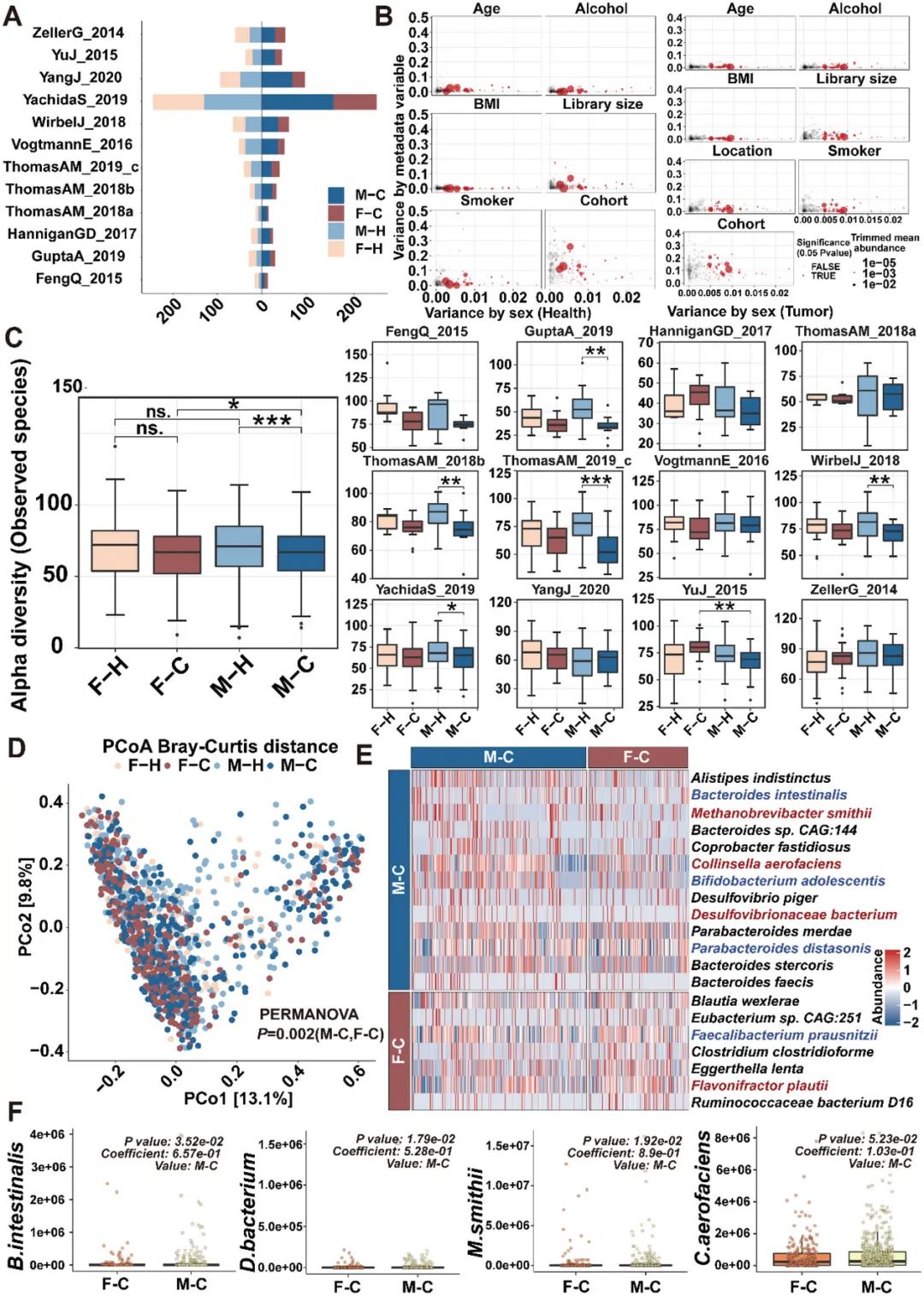
图5. CRC患者肠道微生物存在性别差异。
(A) 在12个队列的代谢组学数据中,四个组中的样本数量。(B) 患者特征对个体微生物物种相关性的潜在混杂影响。性别解释的变异度与不同潜在混杂因素(年龄、BMI、性别、队列或其他因素)解释的变异度进行比较。每个物种由一个点代表,其大小与其丰度成比例;在元分析中鉴定的核心微生物标记以红色突出显示。(C) 所有队列中计算的α多样性,通过观察到的物种数量进行测量。使用双侧Wilcoxon检验计算P值,而整体P值使用双端Wilcoxon检验进行计算。(D) 基于Bray–Curtis距离的所有十二个队列样本的主坐标分析(PCoA),显示微生物组成在F-H、F-C、M-H和M-C之间存在差异。(E) F-C和M-C的肠道微生物热图。保护性细菌物种以红色着色,潜在致病性细菌物种以蓝色着色。(F) F-C和M-C中B.intestinalis、D.bacterium、M.smithii和C.aerofaciens的丰度。
我们通过对粪便样本进行宏基因组测序进一步研究了受体伪无菌小鼠的肠道微生物组成,并发现FMT-CM小鼠和FMT-CF小鼠之间存在明显的肠道微生物组成差异。与FMT-CF小鼠相比,FMT-CM小鼠的细菌多样性和丰富度没有显著差异(图6A)。然而,PCoA分析显示M-FMT-CM、F-FMT-CM、M-FMT-CF和F-FMT-CF的粪便样本的β多样性存在显著差异(图6B)。FMT-CM小鼠和FMT-CF小鼠之间存在不同的微生物组成,包括一些差异的细菌种类(图6C)。其中,潜在致病细菌种类D.bacterium和C.aerofaciens的丰度在M-FMT-CM小鼠中显著高于M-FMT-CF小鼠(图6D)。
所有上述结果表明,与女性患者相比,受体伪无菌小鼠接受男性患者粪便后的肠道屏障功能受损更严重,这可能部分归因于加重的肠道微生物失调。因此,可以得出结论,虽然性别偏好性的肠道微生物组成因物种和队列而异,但它们参与了CRC肿瘤发生中的性别二态性。

图6. 从CRC患者接受粪便样本的假擬无菌小鼠中,肠道微生物存在性别差异。
(A) Shannon多样性和Simpson多样性的α多样性分析,以及(M-FMT-CM(n=9;雄性小鼠接受来自男性患者的粪便), F-FMT-CM(n=7;雌性小鼠接受来自男性患者的粪便), M-FMT-CF(n=9;雄性小鼠接受来自女性患者的粪便)和F-FMT-CF(n=8;雌性小鼠接受来自女性患者的粪便)) 小鼠的PCoA图(β多样性)。(C) M-FMT-CM,F-FMT-CM,M-FMT-CF和F-FMT-CF小鼠的肠道微生物热图。保护性细菌物种以红色着色,潜在致病性细菌物种以蓝色着色。(D) M-FMT-CM,F-FMT-CM,M-FMT-CF和F-FMT-CF小鼠中B.intestinalis、D.bacterium、M.smithii和C.aerofaciens的丰度。
6. 在人和小鼠中,男性(雄性)偏好性的肠道代谢物通过甘油磷脂代谢途径加速了结直肠肿瘤的发生
Male-biased gut metabolites aggravated colorectal tumorigenesis through the glycerophospholipid metabolism pathway in both human and mouse
在小鼠和人类肠道性别偏好性的菌群中,共同的贡献使性别差异在CRC中产生,这可以通过不同性别偏好性的菌群生成的相同功能性别偏好性的肠道代谢物来解释。为了验证这一推测,我们比较了接受人类和小鼠CRC模型粪便的假无菌小鼠的性别偏好性的肠道代谢物。我们对接受来自雄性或雌性ApcMin/+小鼠粪便的假无菌小鼠的肠道代谢物进行了代谢组学分析。正交偏最小二乘判别分析显示,FMT-AM小鼠的粪便代谢谱与FMT-AF小鼠的代谢谱显著不同(图7A)。在FMT-AM小鼠与FMT-AF小鼠之间的比较中,鉴定出了差异代谢物(图7B)。其中,有43个代谢物源自肠道微生物(图7C,附表4)。性别偏好性的代谢物在不同的代谢信号通路中富集或耗竭。在这些通路中,甘油磷脂代谢是FMT-AM小鼠中富集的顶级通路之一,与雄性ApcMin/+小鼠中的通路类似(图7D)。已有报道指出甘油磷脂是监测CRC患者的生物标志物。为了揭示菌群与代谢物之间的潜在关系,我们通过部分Spearman相关性进行了细菌和代谢物的相关性分析,发现FMT-AM中的潜在致病菌A.muciniphila与LPC呈正相关(图7E)。
为了揭示CRC患者中性别引起的代谢变化,我们对F-FMT-CM、M-FMT-CM、M-FMT-CF和F-FMT-CF小鼠的粪便样本进行了代谢组学分析。无监督的PCA结果显示,接受来自男性或女性患者粪便的假无菌小鼠的肠道代谢物明显不同(附图7A)。在FMT-CM小鼠与FMT-CF小鼠之间的比较中,鉴定出了差异代谢物(附图7B)。我们还确定了这些差异代谢物的来源。其中,有19个代谢物来源于肠道微生物(附图7C,附表5)。FMT-CM小鼠和FMT-CF小鼠之间的差异代谢物在不同的代谢信号通路中富集。其中,甘油磷脂代谢也是FMT-CM小鼠中富集的通路之一(附图7D),与FMT-AM小鼠代谢组中富集的通路一致。此外,我们进行了综合分析,以探究肠道微生物和代谢物之间的潜在关系(附图7E)。
甘油磷脂代谢通路是唯一一个在人类和小鼠中都富集了男性偏倚代谢物的保守代谢通路。激活甘油磷脂代谢通路加速结直肠癌的进展。磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)在结直肠癌患者中异常积累。为了研究甘油磷脂在CRC发展中的作用,我们测量了ApcMin/+小鼠结肠组织中PC和PE的水平。我们的结果显示,男性ApcMin/+小鼠结肠组织中的PC和PE水平明显高于雌性小鼠(图7F-G)。此外,关键的甘油磷脂代谢速率限制酶PCTYT1α和PCYT2的蛋白表达在雄性ApcMin/+小鼠中显著升高(图7H)。甘油磷脂代谢在结直肠癌细胞的增殖和肿瘤进展中发挥重要作用。阻断癌细胞中的甘油磷脂代谢已成为结直肠癌的潜在治疗方法。在本研究中,我们选择了甘油磷脂代谢途径抑制剂D609,研究其对两种结直肠癌细胞系(HCT116和SW620)增殖的影响。结果显示,D609显著降低了PC和PE的水平(图7I-L),抑制了CRC细胞系的增殖(图7M-N)。此外,在裸鼠的肿瘤形成实验中,我们发现D609显著抑制了裸鼠皮下肿瘤的形成(图7O)。这些结果表明,肠道代谢物在人类和小鼠的CRC模型中存在性别偏倚,并且男性偏倚的肠道代谢物通过甘油磷脂代谢通路加剧了结直肠肿瘤发生。
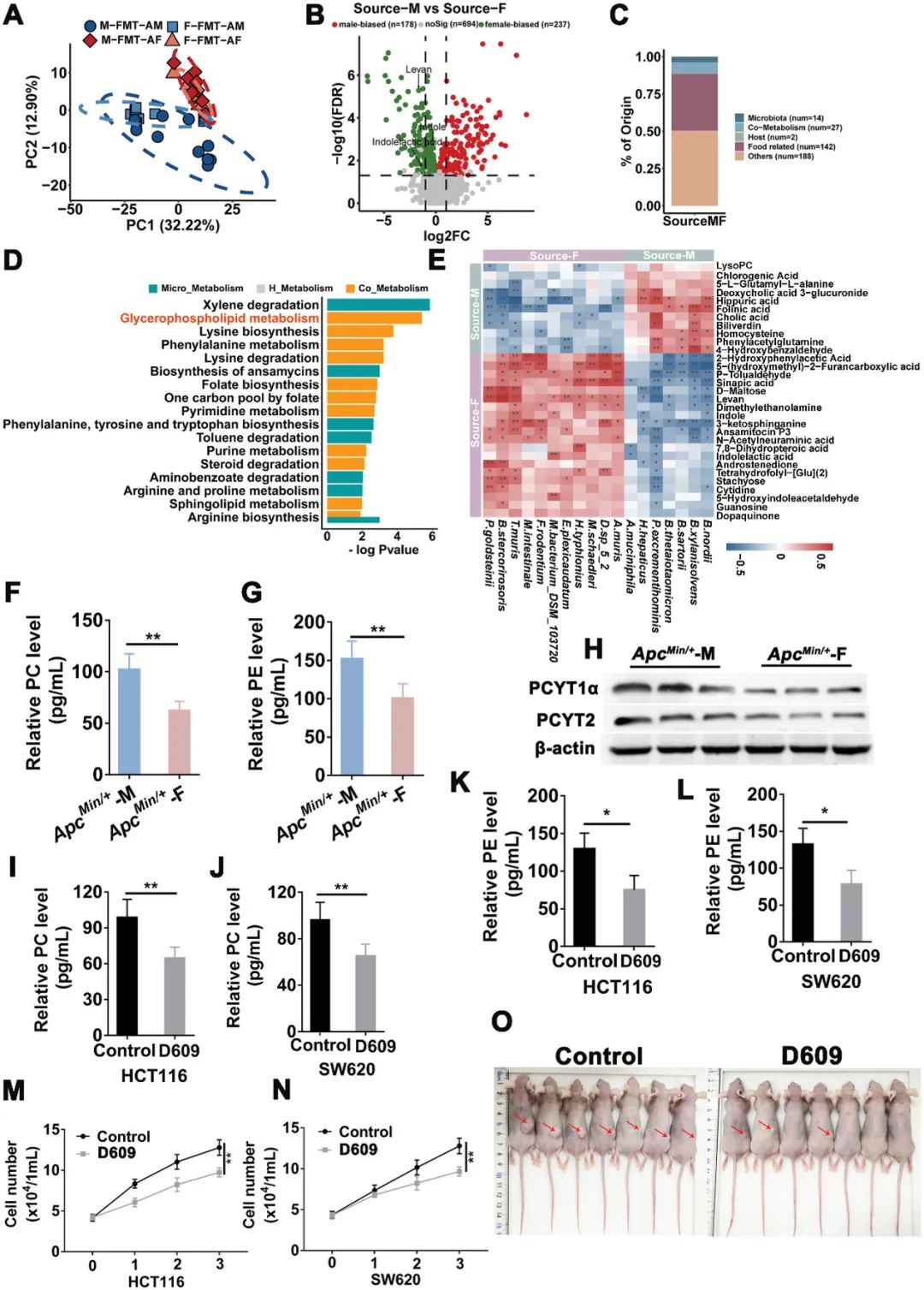
图7. 通过甘油磷脂代谢通路,雄性偏好性的肠道代谢物加重了结直肠肿瘤发展。
(A) M-FMT-AM,F-FMT-AM,M-FMT-AF和F-FMT-AF小鼠(每组n=10)的肠道代谢组学分析的PCA图。(B) Source-M(接受来自雄性ApcMin/+小鼠的粪便)和Source-F(接受来自雌性ApcMin/+小鼠的粪便)小鼠之间的差异代谢物的火山图,筛选出在两性中稳定的差异起源的代谢物作为候选物。(C) 所选候选物中的差异代谢物的起源。(D) Source-M和Source-F小鼠中差异富集的微生物源代谢物的通路分析。(E) Source-M和Source-F小鼠中性别差异菌群和代谢物的相关性分析。(F-G) 使用ELISA检测ApcMin/+-M和ApcMin/+-F小鼠结肠组织中PC和PE的表达水平。(H) 使用ELISA检测ApcMin/+-M和ApcMin/+-F小鼠结肠组织中PCYT2和PCYT1α的蛋白表达水平。(I-L) CRC细胞系在Vehicle(对照)和D609处理下的PC和PE的表达水平。(M-N) CRC细胞系HCT116和SW620在Vehicle和D609处理下的细胞生长曲线。(O) 裸鼠(每组n=7)在Vehicle和D609处理下肿瘤形成的代表性图像。
- 讨论 -
该研究探究了CRC发病率和死亡率的性别差异与性别偏好的肠道微生物群和代谢物的关系,揭示了结直肠癌性别差异的潜在原因。此外还发现男性(雄性)偏好的肠道代谢物通过甘油磷脂代谢途径加速结直肠肿瘤的发展。针对性别偏好因素,为结直肠癌精准治疗的潜在策略。
- 参考文献 -
Wang, L., Tu, Y.-X., Chen, L., Zhang, Y., Pan, X.-L., Yang, S.-Q., Zhang, S.-J., Li, S.-H., Yu, K.-C., Song, S., Xu, H.-L., Yin, Z.-C., Yue, J.-Q., Ni, Q.-L., Tang, T., Zhang, J.-L., Guo, M., Zhang, S., Yao, F., Liang, X.-J., Chen, Z.-X., Male-Biased Gut Microbiome and Metabolites Aggravate Colorectal Cancer Development. Adv. Sci. 2023, 2206238. https://doi.org/10.1002/advs.202206238
- 作者介绍 -
第一作者

中国农业科学院
深圳农业基因组研究所
华中农业大学
生命科学技术学院
王玲
联培博士后
博后期间主要从事肠道微生物与结直肠癌发生与发展的相关研究。目前以第一作者或共同第一作者身份在Advanced science、Clinical translational and medicine、Journal of cellular physiology等杂志发表论文5篇。

华中农业大学
生命科学技术学院
涂懿璇
博士研究生
擅长联合多组学探究不同饮食影响的肠道微生物与宿主代谢变化与器官细胞衰老的关系。目前以第一作者在国际学术期刊Advanced science、Water Biology and Security发表论文3篇。
通讯作者

华中农业大学
生命科学技术学院
生物医学与健康学院
陈振夏
教授、博士生导师
华中农业大学生命科学技术学院、生物医学与健康学院教授、博士生导师,Briefings in Bioinformatics 副主编(Deputy Editor)。2011年在北京大学获得生物信息学博士学位;2011-2016在美国国立卫生研究院从事博士后研究。现主要开展营养基因组学研究,采用“果蝇-小鼠-人”比较基因组学研究策略,通过动物和人类营养健康的多组学数据整合分析,评估“基因-膳食-表型”的关联及其分子机制。迄今以通讯或第一作者发表Advanced Science, Genome Biology, Genome Research, Nucleic Acids Research, Molecular Biology and Evolution, Briefings in Bioinformatics等SCI论文18篇。

湖北省肿瘤医院
梁新军
主任医师,教授
湖北省肿瘤医院主任医师,教授,湖北省抗癌协会理事兼学术部长,任湖北省抗癌协会肿瘤分子标志及转化医学专业委员会(第一届)委员,武汉市医学会第十八届肿瘤专业委员会委员,入选武汉市中青年医学骨干人才。擅长肺癌、消化道肿瘤、乳腺癌、淋巴瘤等恶性肿瘤的诊断和规范化治疗,并对肿瘤的靶向治疗和生物免疫治疗有深入的研究,已发表学术论文30余篇,其中以第一作者及通讯作者发表SCI论文8篇。
猜你喜欢
iMeta简介 高引文章 高颜值绘图imageGP 网络分析iNAP
iMeta网页工具 代谢组MetOrigin 美吉云乳酸化预测DeepKla
iMeta综述 肠菌菌群 植物菌群 口腔菌群 蛋白质结构预测
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature
一文读懂:宏基因组 寄生虫益处 进化树 必备技能:提问 搜索 Endnote
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流快速解决科研困难,我们建立了“宏基因组”讨论群,己有国内外6000+ 科研人员加入。请添加主编微信meta-genomics带你入群,务必备注“姓名-单位-研究方向-职称/年级”。高级职称请注明身份,另有海内外微生物PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
点击阅读原文,跳转最新文章目录阅读
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








