肠道共生菌小克里斯滕森氏菌通过产酰基胆酸调控宿主代谢
Gut commensal Christensenella minuta modulates host metabolism via acylated secondary bile acids

Article,2024-01-17,Nature Microbiology, [IF 28.3]
DOI:10.1038/s41564-023-01570-0
原文链接:https://www.nature.com/articles/s41564-023-01570-0
第一作者:Chang Liu (刘畅);Meng-Xuan Du (杜梦璇);Li-Sheng Xie (谢莉生)
通讯作者:Shuang-Jiang Liu(刘双江);Hong-Wei Liu(刘宏伟);Changtao Jiang(姜长涛)
主要单位:
山东大学微生物技术研究院 (State Key Laboratory of Microbial Technology, Shandong University, Qingdao, P. R. China)
中国科学院微生物研究所 (State Key Laboratory of Microbial Resources & State Key Laboratory of Mycology, Institute of Microbiology, Chinese Academy of Sciences, Beijing, P. R. China)
河北大学生命科学学院(College of Life Science, Hebei University, Baoding, P. R. China)
北京大学基础医学院(Department of Physiology and Pathophysiology, School of Basic Medical Sciences, State Key Laboratory of Vascular Homeostasis and Remodeling, Peking University, Beijing, P. R. China)
- 摘要 -
大量肠道菌群宏基因组队列研究表明肠道微生物与宿主的健康与疾病状态存在密切关联和潜在的因果关系。然而,我们对于调控肠道微生物与宿主相互作用的潜在功能与机制知之甚少。在本研究中,我们发现肠道共生菌小克里斯滕森氏菌(Christensenella minut)在宿主体内通过3-O-酰基化修饰胆汁酸,生成一类全新的次级胆汁酸并特异性抑制肠道法尼醇X核受体(FXR)激活,从而缓解宿主糖脂代谢异常。具体来说,首先通过对多个代谢类疾病人群队列的肠道宏基因组数据进行整合分析,鉴定到170余个肠道菌种在代谢类疾病人群中丰度显著下降,随后对其中的88个可培养的菌种进行胆酸转化谱表征,发现以小克里斯滕森氏菌(Christensenella minuta)为代表的5个菌属、9个菌种可以对胆酸进行3-O-酰基化修饰,产生一类全新的次级胆汁酸——酰基胆酸。动物实验表明,灌胃C. minuta可以显著改善模型小鼠的糖脂代谢异常,同时伴随着回肠酰基胆酸的显著增加。体外实验随后证明酰基胆酸为一类全新的肠道特异性法尼醇X核受体(FXR)天然拮抗剂;在机制上,C. minuta通过产酰基胆酸靶向抑制肠FXR,调控肠肝信号轴发挥缓解糖脂代谢异常的功能表型,且这种益生效果在肠上皮FXR特异性敲除小鼠中完全消失。最后,我们通过人群队列实验证明,3-O-酰基胆酸在健康人粪便中广泛存在,在II型糖尿病(T2D)患者中明显降低。这一工作证明了小克里斯滕森氏菌和酰基胆酸在代谢性疾病的治疗与预防中具有应用前景。
- 引言 -
越来越多基于队列的肠道宏基因组研究揭示了特定肠道微生物类群与代谢性疾病之间的大量相关性,这背后可能存在新的肠道微生物与宿主代谢之间的因果关系。然而,阐明观察到的宿主-微生物关联的相互作用机制长期以来一直是一个挑战。许多研究表明,肠道共生体通过产生微生物特异性代谢产物,如次级胆酸,通过与宿主代谢结合到特定受体,如法法尼醇X受体(FXR)和G蛋白偶联膜受体5(TGR5; GPBAR1)调控宿主代谢。现有证据表明,次级胆酸主要是通过五种不同的微生物修饰方式:解偶联/水解、脱氢、去羟基化、差向异构化和最近识别的24'-羧基端重偶联。然而,从胆酸的化学结构分析,理论上存在更多微生物对胆汁酸的生物修饰模式,有望被进一步发现。此外,尽管已经发现了上百种肠道微生物转化的次级胆汁酸,但目前研究人员仅对其中极少数的次级胆汁酸,如脱氧胆酸(DCA)、石胆酸(LCA)、3-oxo-LCA和isoallo-LCA等的生理功能、产生菌和合成途径进行了较为系统的研究;对于其他绝大多数的次级胆汁酸的了解仍然很有限。随着越来越多参与调节宿主代谢的肠道共生菌株被成功培养和深入研究,“肠道微生物-胆汁酸-宿主代谢”轴的更多生理功能与作用机制有望被进一步揭示。
大量免培养组学研究表明,Christensenellaceae及其代表菌种Christensenella minuta与更健康的代谢表型呈正相关,包括相对较低的身体质量指数(BMI)、较低的血脂水平和更低的内脏脂肪率。在此前和本研究中均发现,部分代谢性疾病患者肠道中C. minuta的相对丰度相较于健康人显著降低。此外,已有若干基于动物模型的实验研究表明,C. minuta灌胃可以缓解代谢异常的病理症状;证明该菌有望成为治疗代谢性疾病的潜在功能益生菌。然而,C. minuta对代谢紊乱产生有益影响的机制目前仍然不清楚,这极大地阻碍了将该菌作为新微生态制剂进行应用开发和安全评估的进程。本研究证明以C. minuta为代表的肠道共生菌通过酰基化修饰初级胆汁酸,产生一类全新的次级胆汁酸,后者做为天然FXR拮抗剂发挥调节宿主代谢的功效。我们的发现揭示了C. minuta和酰基胆酸在治疗T2D和其他代谢性疾病方面具有应用前景。
- 结果 -
新型次级胆汁酸的发现
Identification of previously-unknown secondary bile acids
我们收集7个公开的代谢性疾病(如T2D、肥胖、NAFLD和CVD)肠道宏基因组数据集,获得了2,248有效的数据样本。通过整合分析,确定了来自5个门的175个肠道微生物物种在代谢疾病队列中显著降低,在健康人群中特异富集。通过与前期构建的人类肠道微生物菌株资源库(hGMB)比对,我们有其中88个物种的可培养菌株,代表了5个门中的51个属(图1a和1b)。这88种微生物在人类肠道微生物组中占据主导地位,其丰度占54.1±0.3%,流行率(prevalence)为99.73%(图1a)。随后,我们利用这些可培养菌株对胆酸进行基于培养的体外转化实验,并通过负源模式(-H)的液相色谱-质谱(LC-MS)分析表征了胆酸的转化谱。我们发现了一系列以前未知的胆酸衍生物,其m/z为449.3、463.3、477.3和491.3(图1c),这些衍生物由9个菌种(Parabacteroides distasonis、Parabacteroides hominis、Phocaeicola dorei、Bacteroides difficilis、Gehongia tenuis、Lawsonibacter faecis、Christensenella minuta、Christensenella hongkongensis和Blautia segnis)产生。值得注意的是,在这些微生物产生者中,2个Christensenella物种同时转化了所有4种衍生物,且产量最高。为了进一步检查观察到的胆酸生物转化在Christensenella属菌株中的普遍性,我们分离和培养了代表C. tenuis(1株)、C. massiliensis(2株)、C. hongkongensis(3株)和C. minuta(4株)4个种的10株肠道微生物菌株,并表征了新型胆汁酸的合成情况。结果表明,除了C. massiliensis的2株菌株外,其他8株经过测试Christensenella菌株均具有生物转化胆酸产生未知衍生物的活性。我们因此选择C. minuta作为进一步研究胆酸新修饰及其生理功能的代表。
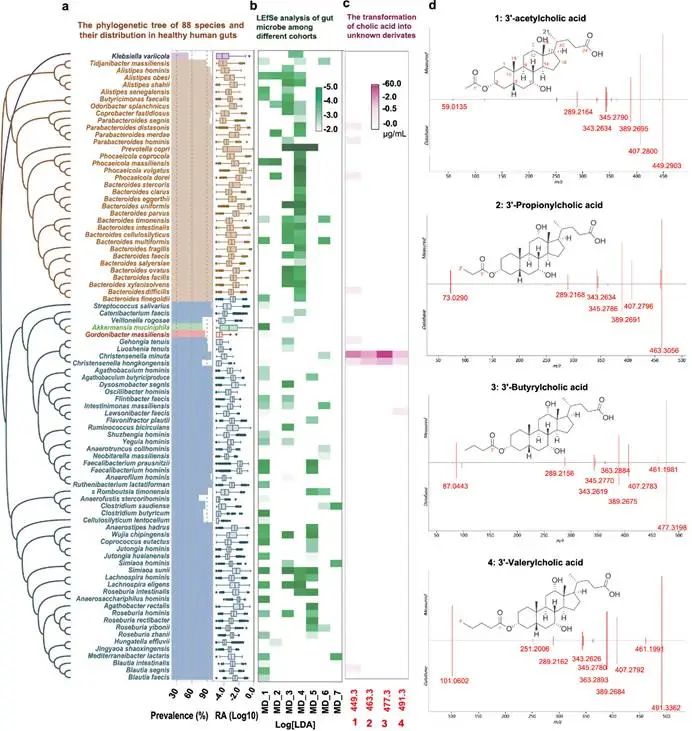
图1 肠道微生物介导的胆汁酸转化为新型的3-O-酰基胆酸。
a,88种肠道微生物物种的系统发育树。树的颜色根据每个节点的门来着色;紫色:变形菌门,橙色:拟杆菌门,蓝色:厚壁菌门,绿色:梵谷微生物门,红色:放线菌门。条形图展示了来自7个队列研究中每个物种的流行率(%);箱线图显示了每个物种在所有样本中的相对丰度(RA),以Log 10 格式表示。
b,热图显示了88种在健康队列与疾病对照组中显着富集的物种的LDA分数。
c,热图显示了9种肠道微生物将胆汁酸转化为先前未知衍生物的情况。
d,4种酰化胆汁酸的化学结构和它们在C. minuta培养中的LC-MS/MS碎片图谱的光谱匹配(测得)与标准(数据库)对比。
C. minuta将胆酸转化为3-O-酰基胆酸
C. minuta converts CA into 3-O-acyl-CAs
随后,我们对具有m/z值为449.3、463.3、477.3和491.3的先前未知胆酸衍生物进行了串联质谱(MS/MS)分析。结果显示,除了与胆酸部分对应的389.3 m/z的共同特征碎片外,对于化合物1-4,还检测到了具有59.0、73.0、87.0和101.0的m/z比值的子离子,这表明存在乙酰、丙酰、丁酰或戊酰基团。接下来,我们分离和纯化了每个衍生物,并进行核磁共振分析以确定这些未知胆酸衍生物的化学结构。核磁谱解析结果表明,上述衍生物为3-乙酰胆酸(Ac-CA)、3-丙酰胆酸(Prp-CA)、3-丁酰胆酸(Buty-CA)和3-戊酰胆酸(Val-CA)。然后,我们仔细比较了纯化标准和C. minuta培养中每种化合物的化学结构、保留时间(RT)、准确质量和MS/MS光谱以进一步确认(图1d)。以上证据显示,C. minuta通过对胆酸的3'-羟基末端进行特异性酰基化修饰得到一系列新的次级胆汁酸。
C. minuta可减轻肥胖小鼠的代谢紊乱
C. minuta alleviates metabolic disorders in obese mice
接下来,我们对高脂饮食诱导的肥胖(DIO)小鼠进行了C. minuta活菌灌胃试验,以评估C. minuta及其产生的3-O-acyl-CAs的体内生理功能。在未处理的DIO小鼠模型对照组中未检测到C. minuta定植,而C. minuta灌胃显著增加了处理组小鼠盲肠内容物中C. minuta的丰度,达到8.4 ± 2.5 x 106 cell/mg DNA(图2a)。有趣的是,尽管在对照组DIO小鼠中未检测到C. minuta,但在正常饮食的C57BL/6J小鼠中检测到C. minuta,浓度为2.7 ± 1.1 x 104 cell/mg的元基因组DNA(图2a),这与人体研究中观察到的C. minuta与代谢健康的正相关性相一致。8周的C. minuta灌胃未影响DIO小鼠的食物摄入和体重(图2b-c)。与模型对照组(DIO_CK)相比,给予DIO小鼠C. minuta显著缓解了病理性高血糖(图2d-2i)和脂代谢紊乱(图2j-o),降低了肝内和结肠炎症(图2p和图3c),恢复了与巨噬细胞浸润、脂肪沉积和部分肝细胞球形变相关的脂肪肝样病变(图2n-p,图3a-b),并改善了肠上皮的完整性(图2q)。C. minuta灌胃后,血浆内毒素(LPS)未增加,相反,在C. minuta治疗后,肠道内Toll样受体4(TLR4)表达量显著减少(图3c)。为了进一步表征C. minuta对宿主代谢的机制作用,我们重复了使用DIO小鼠进行C. minuta灌胃试验,并测定了血液中与代谢相关的多个重要激素的水平。C. minuta处理组DIO小鼠在液体饮食刺激后30分钟表现出活性GLP-1分泌的显著增加,血清中胰岛素轻度增加。此外,我们还观察到C. minuta处理的DIO小鼠血浆中糖原和GIP水平略有下降,瘦素和胃饥饿素略有增加,尽管这些变化没有统计学意义。
此外,通过盲肠内容物的16S rRNA基因扩增子测序,我们验证了C. minuta灌胃对DIO小鼠肠道菌群的分类学多样性(α多样性)和总体组成(β多样性)没有显著影响。只有Christensenellaceae和少数几个扩增子序列变体(ASVs)在C. minuta处理的DIO小鼠中富集,这表明C. minuta发挥益生效果不依赖于对肠道菌群的剧烈扰动。
我们随后测量了C. minuta胃灌的DIO小鼠、对照组DIO小鼠和正常饮食C57BL/6J小鼠的回肠内容物中4种新型3-O-acyl-CAs和10种先前已知的胆汁酸代表性成分的含量。结果表明,与未经处理的DIO小鼠相比,Prp-CA、Buty-CA、Val-CA和总的3-O-acyl-CAs的浓度在C. minuta胃灌组小鼠回肠中显著富集(图3d-h)。说明体内3-O-acyl-CAs的水平与DIO小鼠改善的代谢特征之间存在正相关。
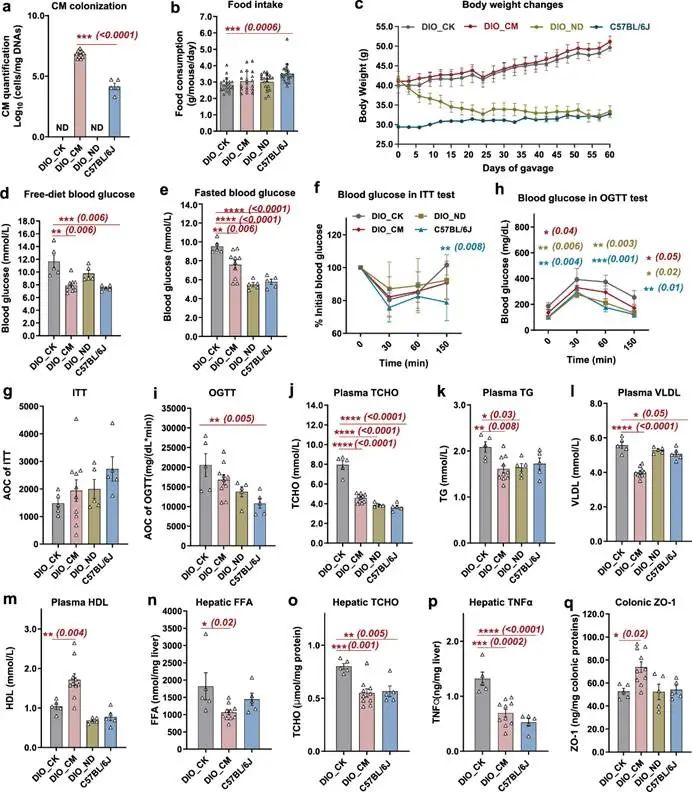
图2 C. minuta对DIO小鼠宿主新陈代谢的影响。
a,每组盲肠内容物中C. minuta拷贝的qPCR绝对定量;
b,每只老鼠每天的平均食物摄入量;
c,8周治疗期间体重的变化;
d,自由饮食血糖;
e,禁食饮食血糖;
f和g,胰岛素耐量试验(ITT)期间的血糖曲线(f)和曲线下面积(AOC)(g);
h和i,口服葡萄糖耐量试验(OGTT)期间的血糖曲线(h)和AOC(i);
j,血浆总胆固醇(TCHO);
k,血浆甘油三酯(TG);
l,血浆极低密度脂蛋白胆固醇(VLDL);
m,血浆高密度脂蛋白胆固醇(HDL);
n,肝脏游离脂肪酸(FFA);
o,肝脏总胆固醇(TCHO);
p,肝脏肿瘤坏死因子α(TNFα);
q,结肠紧密连接蛋白ZO-1。

图3 C. minuta对DIO小鼠肠道FXR肠肝信号通路的影响。
a,每组肝脏组织切片的H&E和Oil Red O染色的代表图像,比例尺=200 μm;
b,肝细胞球形化得分;
c,结肠Toll样受体4(TLR4);
d-h,条形图显示DIO_CK、C57BL/6J和DIO_CM组小鼠回肠内容物中;d,3'-乙酰胆酸(Ac-CA)的浓度,;
e,3'-丙酰胆酸(Prp-CA);
f,3'-丁酰胆酸(Buty-CA);
g,3'-戊酰胆酸(Val-CA);
h,总3-O-酰基-胆酸(Acyl-CA),每组n=5个生物独立样本;
i,肝脏中Cyp7a1蛋白的浓度;
j,血浆总胆汁酸(TBA);
k,肝总胆汁酸(TBA);
l,回肠中Smpd3的转录水平;
m,回肠中Sptlc2的转录水平;
n,血浆中各种碳数的鞘氨醇浓度在DIO_CK和DIO_CM组中;
o,回肠内容物中的鞘氨醇浓度;
p,肝脏中葡萄糖-6-磷酸酶(G6Pase)的浓度。
3-O-acyl-CAs是法尼醇X受体的拮抗剂
3-O-acyl-CAs are antagonists of farnesoid X receptor
令人惊讶的是,通过检测肠道中与胆汁酸相关的基因的表达,我们发现C. minuta组中肠道中Fxr调控的Fgf15基因的表达显著受到抑制。然而,代谢物分析表明,除了新发现的3-O-acyl-CAs(具有未知功能)外,先前已知的FXR拮抗胆汁酸,如牛磺胆酸和牛磺β鼠胆酸(TUDCA和TβMCA)均未显著增加。因此,我们推测C. minuta生成的3-O-acyl-CAs是否作为靶向FXR的信号分子。为验证我们的推测,我们采用双荧光素酶酶活性测定法测试了Acyl-CAs对FXR的影响。结果显示,3-O-acyl-CAs抑制了CDCA诱导的FXR活化(图4a),而这种抑制作用与剂量有关(图4b和4c)。以Ac-CA和Buty-CA为例,它们在浓度高达200 μM时不具有细胞毒性。Ac-CA和Buty-CA测定的半数最大抑制浓度(IC50)分别为49.73和33.60 μM(图4d和4e)。随后,通过TR-FRET FXR方法,又进一步确认了3-O-acyl-CAs的FXR拮抗作用。在20 μM CDCA存在下,Buty-CA在抑制FXR方面表现出显著的活性,IC50值为32.35 μM(图4f),而在激活FXR方面则没有任何效果(图4g)。此外,我们还通过双荧光素酶法检测了3-O-acyl-CAs对TGR5的影响,并通过细胞培养实验检测了对VDR、PXR和CAR的影响,结果表明,上述提到的以胆汁酸作为效应物的宿主转录调控因子对Buty-CA处理均无响应(图4h)。
随后,我们通过动物灌胃试验确定3-O-acyl-CAs是微生物介导转化的次级胆汁酸,而不是由宿主产生的内源性胆汁酸;因为在无菌小鼠中未检测到酰基胆酸(图4i),但在常规小鼠的肠道中可检测到(图4j)。此外,acyl-CAs是肠道特异性的,因为它们仅在常规小鼠和灌胃了3-O-acyl-CAs的无菌小鼠的胃肠道而在循环血、肝脏或胆囊中无检出(图4i和4j)。最后,我们观察到3-O-acyl-CAs经口灌胃到无菌小鼠显著增加了CA在循环和胆汁酸库中的水平,但对其他监测的胆汁酸,包括先前已知的FXR拮抗剂没有影响。进一步的体外生物催化实验表明,acyl-CAs可以被十二指肠内容物降解为胆酸。
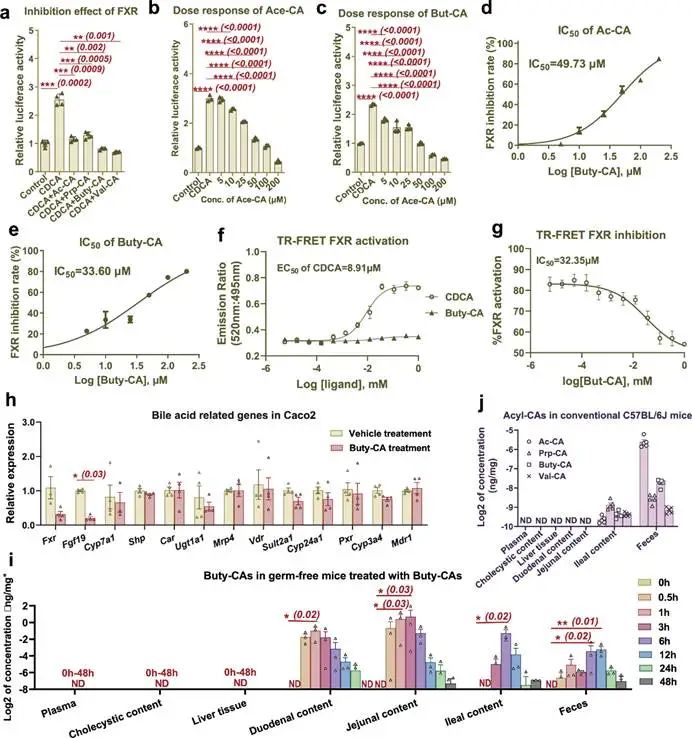
图4 3-O-酰基-胆酸的细胞培养基于生理功能的鉴定和基于无菌小鼠的简单药代动力学。
a,Dual-luciferase assay显示Acyl-CAs衍生物对FXR的抑制作用;
b和c,Ac-CA(b)和Buty-CA(c)对FXR的剂量响应抑制;
d和e,Ac-CA(d)和Buty-CA(e)对FXR的半数最大抑制浓度(IC50);
f和g,TR-FRET FXR辅助活化剂招募法评估Buty-CA对FXR的激动作用,其中CDCA作为阳性激动剂对照(f),以及Buty-CA对FXR在CDCA存在下的拮抗作用(g);
h,Caco-2细胞在50μM Buty-CAs处理8小时后的胆汁酸相关基因的转录水平;
i,用10 mg/kg体重Buty-CAs灌胃的无菌小鼠在不同时间段后的分布;
C. minuta靶向调控FXR-肠肝信号轴
C. minuta regulates the FXR–enterohepatic signalling axis
根据上述结果,我们进一步推测C. minuta灌胃是否会对肠道FXR-肠肝信号轴进行调控。我们随后分析了动物组织样本中,两个经典肠道FXR信号轴的基因表达和代谢物标志物水平:两个通路分别为1)调节胆汁酸和胆固醇的代谢FXR-FGF15-Cyp7a1通路,以及2)影响肝葡萄糖异生、脂肪变性、动脉粥样硬化和胰岛素抵抗的FXR-Smpd3-鞘氨醇轴。在C. minuta处理的DIO小鼠中,FXR-FGF15-Cyp7a1轴发生了变化,我们检测到了回肠中Fgf15水平的降低和肝组织中Cyp7a1浓度的显著增加(图3i)。对FXR-FGF15-Cyp7a1轴的调节有助于总胆汁酸的增加(图3j和3k),并解释了灌胃C. minuta后血液和肝脏中总胆固醇的降低(图2j和2o)以及次级胆汁酸增加等功能表型。对于FXR-Smpd3-ceramide轴,C. minuta处理的DIO小鼠中,编码鞘磷脂磷酸二酯酶3的Smpd3水平(图3l)以及血浆和回肠内容中C16:0 ceramide的浓度(图3n和3o)显著降低。此外,神经酰胺重头合成的限速酶Sptlc2的转录水平未显著改变(图3m),这证实了C16:0 ceramide的减少主要归因于受肠道FXR信号调控的补救途径被调节,而非重头合成途径受到影响。C. minuta处理的DIO小组中减弱的FXR-Smpd3- ceramide轴可能进一步抑制了肝脏葡萄糖异生,因为肝组织中糖异生限速酶G6Pase的含量显著减少了(图3p)。正如先前强调的,循环C16:0 ceramide的减少还可能解释了C. minuta处理的DIO小鼠中观察到的高血糖(图2d-i)和肝病变现象(图3a和3b)的缓解。以上结果揭示了C. minuta衍生的“3-O-acylated CA-intestinal FXR”肠肝信号轴的调节对C. minuta在DIO小鼠模型中观察到的治疗效果的贡献。
C. minuta的功效依赖于肠上皮FXR的存在
The efficacy of C. minuta depend on intestinal FXR
为了进一步验证C. minuta、3-O-acyl-CAs和肠道FXR信号之间的机制联系,我们分别对肠道FXR敲除C57BL/6J小鼠(FxrΔIE)和野生型对照小鼠(Fxrfl/fl)进行为期8周的高脂饮食(HFD)喂养和C. minuta 灌胃。结果显示,C. minuta灌胃显著阻止了Fxrfl/fl小鼠因HFD引起的肥胖进展(图5a和5b),病理性高血糖(图5c-f),血脂紊乱(图5g-k)和肝损伤(图5l和5m),但在FxrΔIE小鼠中并没有显示出任何治疗效果。此外,如图5n-q所示,C. minuta治疗的Fxrfl/fl小鼠的肠肝FXR信号通路发生了与前期DIO动物灌胃实验相同的调节效果(图3i-p)。以上结果表明,肠道FXR信号可能是C. minuta发挥有益效果于宿主代谢的唯一关键靶点。
我们还进行了不同胆酸化合物的C. minuta体外生物转化实验,以表征C. minuta对3-酰基化修饰的底物特异性。实验使用了不同的胆酸(CA、CDCA、UDCA、DCA、LCA、GCA、TCA、TCDCA和GCDCA)和短链脂肪酸混合物作为底物。除了LCA和UDCA外,对所有测试的胆酸都显示出酰化活性。此外,对牛磺胆酸盐(TCA和TCDCA)和DCA的催化活性较弱,而对甘氨酸胆酸盐(GCA和GCDCA)、CA和CDCA的催化活性较强。因此,C. minuta表现出对特定胆酸的选择性酰化活性。
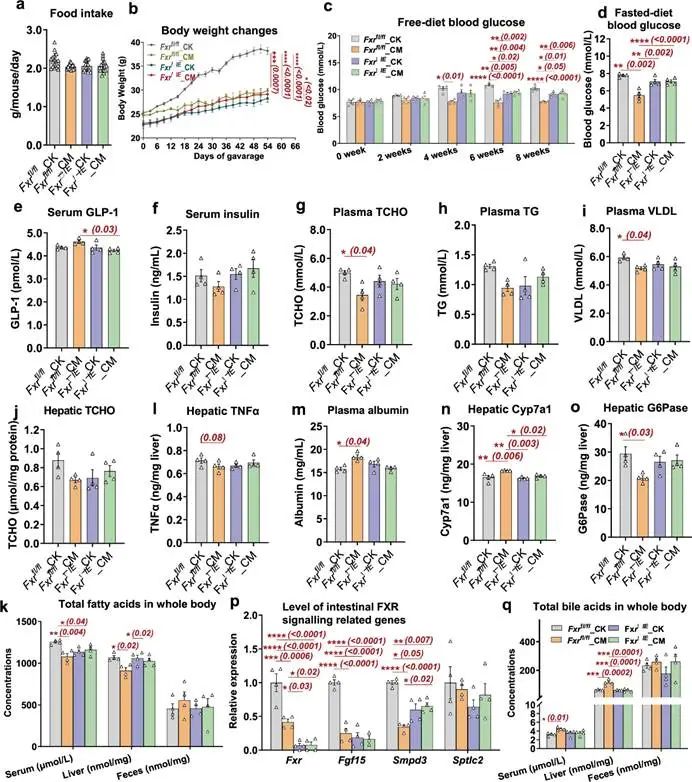
图5 C. minuta对高脂饮食诱导的肠FXR敲除C57BL/6J小鼠(Fxr△IE)和野生型对照小鼠(Fxr fl/fl)的影响。
a,每只小鼠每天的平均食物摄入量;
b,8周治疗期间体重的变化;
c,自由饮食血糖;
d,禁食血糖;
e,血清胰高血糖素样肽-1(GLP-1);
f,血清胰岛素;
g,血浆总胆固醇(TCHO);
h,血浆甘油三酯(TG);
i,血浆极低密度脂蛋白胆固醇(VLDL);
j,肝脏总胆固醇(TCHO);
k,不同身体部位的总游离脂肪酸;
l,肝脏肿瘤坏死因子α(TNFα);
m,血浆白蛋白;
n,肝脏中Cyp7a1蛋白的浓度;
o,肝脏中葡萄糖-6-磷酸酶(G6Pase)的浓度。
p,回肠中FXR信号通路相关基因的转录水平;
q,不同身体部位的总胆汁酸浓度。
3-O-acyl-CAs在II型糖尿病人群中显著降低
3-O-acyl-CAs are depleted in a type 2 diabetes cohort
已知C. minuta和Christensenellaceae在II型糖尿病等代谢性疾病人群的肠道菌群中丰度显著降低(图1)。然而,尚不清楚3-O-acyl-CAs是否在人群中与代谢紊乱呈负相关。我们招募了46名志愿者,包括28名II型糖尿病患者和18名健康对照者,并收集其粪便样本,进行3-O-acyl-CA含量的检测。结果表明,在所有46个粪便样本中均检出全部4种3-O-acyl-CAs,表明3-O-acyl-CAs在人类肠道中广泛存在(图6a)。然而,健康队列中的3-O-acyl-CAs的平均浓度(Ac-CA、Prp-CA、Buty-CA和Val-CA分别为213.82±42.23、537.12±168.88、268.73±44.99和119.97±13.72 pg/mg干粪便)比II型糖尿病队列中的浓度高1.4到3.7倍(分别为67.19±14.80、143.91±21.12、97.96±12.98和85.43±5.87 pg/mg干粪便)。II型糖尿病组中粪便3-O-acyl-CA含量的显著减少(图6b)表明,在代谢紊乱的临床队列人群中,除了C. minuta等有益肠道共生菌群丰度降低,酰化胆酸等具有代谢调控作用的功能化合物也在显著减少。
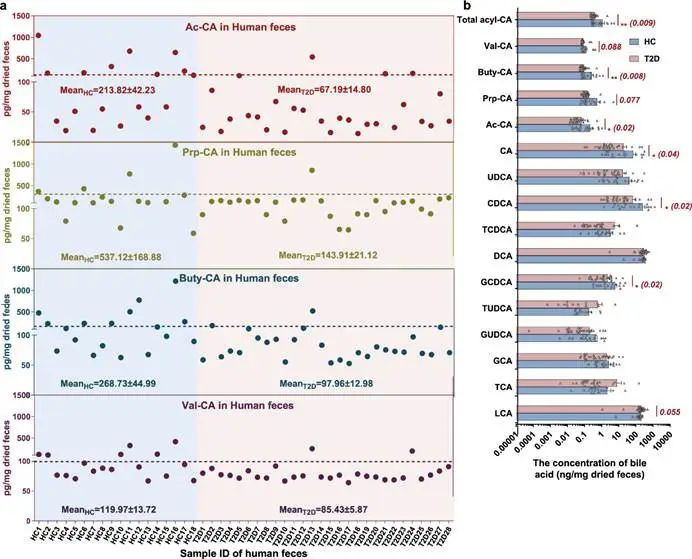
图6 在II型糖尿病队列的粪便中新鉴定的4种3-O-酰基-胆酸和12种常见胆汁酸的分布和浓度。
a,散点图显示II型糖尿病患者(浅红色背景)和健康对照(浅蓝色背景)粪便中Ac-CA(红色),Pro-CA(橄榄色),But-CA(蓝色)和Val-CA(紫色)的患病率和浓度(pg/ng干粪);
b,直方图显示II型糖尿病队列(T2D)和健康对照(HC)中胆汁酸的分布。
- 讨论 -
在这项研究中,我们揭示了一类以3-O-酰基化为特征的新型次级胆汁酸,它是肠道FXR的天然拮抗剂,并阐明了以C. minuta为代表的酰基胆酸产生菌株通过 “肠道微生物-3-O-acyl-CA-肠道FXR”肠肝信号轴调控宿主代谢的新机制。由于C. tenuis、C. hongkongensis和Gehongia tenuis等菌株也产生酰基胆酸,因此Christensenellaceae家族可能通过与C. minuta相同的机制影响宿主代谢。这项研究提出了一个通用的功能机制,可以解释自2014年以来许多基于队列研究所发现的Christensenellaceae家族与宿主代谢健康之间的正相关性。尽管C. minuta的治疗效果主要归因于对肠道FXR的有针对性抑制,但我们还注意到C. minuta的灌胃同时引发了肠道代谢产物的其他副产品变化。GI中短链脂肪酸(SCFA)的减少可以通过C. minuta灌胃引起的3-O-acyl-CA的增加来解释。此外,通过16S rRNA基因扩增子测序鉴定,DIO_CM组富集的9个ASV中的5个(ASV 291、274、286、178和38)属于Lachnospiraceae和Oscillospiraceae两个主要的家族,用于肠道微生物驱动的第二代BA的生产,这可能有助于观察到的LCA和DCA的增加。ASV和代谢物的进一步相关网络分析证实了这样的推断。类似地,处理过的小鼠盲肠内容物中富集的PUFA也不是由C. minuta产生的,根据相关网络,ASV38、ASV178、ASV182和ASV723与C. minuta处理的DIO小鼠中PUFA的增加呈正相关。此外,由于C. minuta管理在GI内通过改变BA池的组成,也有可能导致游离脂肪酸的增加,包括PUFA。然而,这些副产品变化不太可能对C. minuta的有益效果产生贡献,因为C. minuta灌胃使Fxr△IE小鼠的粪便中总胆酸和脂肪酸略微增加,但并未改善HFD诱导的病理表型。
除了Christensenellaceae家族的成员之外,与代谢性疾病呈负相关的其他6种肠道微生物种群(Parabacteroides distasonis,Parabacteroides hominis,Phocaeicola dorei,Bacteroides difficilis,Blautia segnis和Lawsonibacter faecis)也表现出胆酸酰基化修饰活性(图1),其中一些菌种已被先前的研究证实通过其他机制改善宿主代谢。例如,P. distasonis已被我们之前的研究36报告为通过产生琥珀酸,LCA和DCA来缓解代谢性疾病。本研究表明“酰基胆酸-肠道FXR” 轴也可能部分介导了P. distasonis的益生效果。肠道共生菌通过多种途径与宿主相互作用的概念也得到了其他一些关于肠道微生物的原因与结果研究的支持,比如Akkermansia muciniphila。因此,Christensenellaceae的成员,包括C. minuta,可能还具有其他有益功能和机制,而不仅仅是通过靶向肠道FXR改善葡萄糖和脂质代谢。这些推测还需要更多有关宿主-微生物相互作用的研究来逐步揭示。
这项研究中鉴定的3-O-acyl-CAs是一类以前未知的肠道微生物衍生的次级胆汁酸,其在肠道中表现出特异性分布并作为肠道FXR的专一拮抗剂。实际上,先前的研究已经验证,有针对性地抑制肠道FXR是治疗肥胖,糖尿病和非酒精性脂肪肝等代谢性疾病的有效治疗策略,然而,许多证据表明肝脏中FXR信号的激活有助于宿主维持葡萄糖和脂质代谢平衡,并缓解脂肪肝和胆汁淤积的症状。这些看似矛盾的结果是因为FXR调节多种下游靶基因,FXR的生理功能通常是组织特异性的。例如,靶向抑制肠道FXR会通过不依赖SHP的肠肝信号轴抑制肝脏糖异生,而通过FXR-SHP-HNF4/Foxo1途径激活肝脏FXR会在肝脏通过抑制脂质合成固醇调节元件结合蛋白1(SREBP-1c)和正调节PPARα46上产生相同的有益效果。因此,为了评估FXR激动剂或拮抗剂的体内生理功能,主要是考虑其在不同组织中的组织特异性和“净效应”。先前已知的FXR拮抗胆汁酸,如GUDCA,TUDCA和T-βMCA,都是内源性的,并在宿主多个组织部位都可检测到。因此,它们的作用靶点是多组织的而非肠特异性的。类似地,一些FXR激动剂,如GW4604和obeticholic acid(OTA),也已经验证为多靶点和多功能性的。因此,这种内源性FXR效应物的体内功效通常是对不同组织中的FXR信号途径调节后的“净效应”,这可能导致不同研究的结论在某些情况下不一致。与这些内源性胆酸不同,3-O-acyl-CAs在肠道中特异地存在和发挥作用,明确的作用靶点使得它们有望成为治疗代谢疾病的潜在药物前体。然而,由于一些研究报道抑制肠道FXR与肠癌和炎症性肠病(IBD)相关,因此其成药性和安全性有待进一步评估。我们还注意到,在口服灌胃期间,3-O-acyl-CAs可能在上胃肠道中被胰腺酶降解。因此,未来的动物和临床研究最好以肠溶性形式给予3-O-acyl-CAs。
总的来说,通过这项研究,我们展示了C. minuta和3-O-acyl-CA生物产物在治疗代谢性疾病,包括T2D方面的治疗潜力,这在小鼠模型中得到了证实,并得到了队列调查的支持。进一步开展临床试验对于C. minuta和3-O-acyl-CAs作为先前未知的代谢性疾病生物疗法的发展至关重要。
参考文献
C. Liu#, MX. Du#, LS. Xie#, WZ. Wang, BS. Chen, CY. Yun, XW. Sun, X. Luo, Y. Jiang, K. Wang, MZ. Jiang, SS. Qiao, M. Sun, BJ. Cui, HJ. H, SP. Qu, CK. Li, DL. Wu, LS. Wang, CT. Jiang*, HW. Liu* and SJ. Liu*. Gut commensal Christensenella minuta modulates host metabolism via a new class of secondary bile acids, Nature Microbiology, DOI 10.1038/s41564-023-01570-0.
- 作者简介 -
第一作者

山东大学
刘畅
研究员
刘畅,山东大学微生物技术研究院,研究员,硕士生导师,泰山学者青年专家、山东省优青。博士毕业于中国科学院大学,先后在中科院微生物研究所和山东大学从事科研工作。主要从事厌氧微生物培养组学及肠道新功能菌挖掘和机制研究;先后构建了人与模型动物肠道微生物菌株资源库;并基于纯培养菌株和模型动物实验,阐明多个新肠道共生菌调控宿主代谢的功能表型与作用机制。以一作和通讯作者(含共同)在Nat Microbial, Nat Metabol,Nat Commun,Microbiome等杂志发表相关文章10余篇,文章他引790 余次,申请专利6 项,技术转化2 项,承担国家级项目课题6 项。

山东大学
杜梦璇
博士
杜梦璇,山东大学微生物技术研究院,博士研究生,主要研究方向为肠道微生物分离、培养、保藏和功能菌株的机制研究。目前以第一作者(含共同)在Nature Microbiology和Microbiome发表文章2篇。

河北大学
谢莉生
硕士
谢莉生,河北大学生命科学学院,硕士研究生,主要关注肠道微生物分离培养与肠道功能菌株的机制研究。目前以共同第一作者在Nature Microbiology发表文章1篇。
通讯作者

中国科学院微生物研究所
刘双江
研究员
刘双江,中国科学院微生物研究所研究员、山东大学微生物技术研究院特聘教授,博士/硕士生导师。1991年于清华大学获博士学位,中国科学院“百人计划”入选者,国家杰出青年基金获得者;全国优秀科技工作者。中国生物物理学会肠道菌群分会会长;中国生物工程学会副理事长,中国微生物学会环境微生物专业委员会副主任委员;《iMeta》期刊主编,《Fundamental Research》、《Applied and Environmental Microbiology》、《Archives of Microbiology》、《Microbes and Environments》等杂志编辑。研究领域是肠道微生物组学,主要开展肠道微生物资源收集和开发、功能评价,包括肠道微生物分离培养、多样性;肠道微生物组及其与宿主的互作。先后以首席身份主持国家科技部“863”,“973”项目,国家自然科学基金重点项目、中科院重点部署项目等多项科研任务,已在国内外重要期刊发表文章200余篇,获授权发明专利多项。

中国科学院微生物研究所
刘宏伟
研究员
刘宏伟,中国科学院微生物研究所二级研究员/教授、博士生导师;中国科学院特聘研究员;微生物组与微生态技术研究室主任,入选百千万人才国家级人选(2019),“中青年有突出贡献专家”;享受国务院政府特殊津贴专家(2020);中国微生物学会微生物组专委会主任委员;中国菌物学会常务理事、副秘书长。任《iMeta》、《Frontiers in Microbiology》、《Food Science and Human Wellness》、《Chinese Journal of Natural Medicine》编委。刘宏伟研究员团队近年来主要开展人体肠道微生物组与机体糖脂代谢调控方面的基础研究和靶向调控肠道微生物组的微生态新产品开发。以通讯/共通讯作者在本领域知名刊物Nat. Microbiol., Nat. Metab., Nat. Commun., Cell Rep., Angew. Chem. Int. Ed., Nat Prod Rep., Gut Microbes等发表论文110余篇,ESI高被引论文2篇。获得授权专利22项,转让实施9项。获河南省医学科技奖一等奖、西藏自治区科学技术一等奖、二等奖和中国科学院优秀导师奖等。

北京大学
姜长涛
教授
姜长涛教授,北京大学长聘教授、博雅特聘教授,基础医学院副院长,国家杰出青年科学基金获得者、科学探索奖获得者。从事肠道共生菌与代谢性疾病的研究。提出“代谢性疾病肠治”新理论:首次提出肠道菌源宿主同工酶新概念,发现降解尼古丁的肠道共生菌,揭示宿主反向调控肠道菌群代谢的新范式;发现菌源DPP4、BSH等多个代谢性疾病干预的新靶标。近5年在Science(2023)、Nature(2022)、Nature Microbiology(2024)、Nature Cardiovascular Research(2023)、Nature Medicine(2019)、Cell Metabolism(2021a, 2021b, 2019)等杂志发表SCI论文二十余篇,其中4篇入选高被引论文,1篇获F1000最高等级推荐,8篇得到国际知名学者推荐及同期评述,受邀在Nature Reviews Endocrinology、Cell Host & Microbe等期刊发表综述或述评8篇,入选Cell Metabolism杂志编委。获授权发明专利7项,成立“北大医学—蒙牛集团营养与代谢健康联合实验室”、“北大医学—康为世纪前沿技术联合实验室”。获得2023年度中国生命科学十大进展、北京市自然科学一等奖(第一完成人)、中国青年科技奖、谈家桢生命科学创新奖、树兰医学青年奖等奖励;主持基金委重点项目、国家重点研发计划等十余项基金,作为PI获创新研究群体项目。
宏基因组推荐
猜你喜欢
iMeta高引文章 fastp 复杂热图 ggtree 绘图imageGP 网络iNAP
iMeta网页工具 代谢组MetOrigin 美吉云乳酸化预测DeepKla
iMeta综述 肠菌菌群 植物菌群 口腔菌群 蛋白质结构预测
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature
一文读懂:宏基因组 寄生虫益处 进化树 必备技能:提问 搜索 Endnote
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流快速解决科研困难,我们建立了“宏基因组”讨论群,己有国内外6000+ 科研人员加入。请添加主编微信meta-genomics带你入群,务必备注“姓名-单位-研究方向-职称/年级”。高级职称请注明身份,另有海内外微生物PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
点击阅读原文,跳转最新文章目录阅读























 1985
1985

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








