点击蓝字 关注我们
鼠李糖乳杆菌GG致损斑马鱼肠道揭示其宿主依赖的益生作用

iMeta主页:http://www.imeta.science
研究论文
● 原文链接DOI: https://doi.org/10.1002/imt2.181
● 2024年3月25日,中国农业科学院饲料所周志刚团队在iMeta在线发表了题为 “Lactobacillus rhamnosus GG triggers intestinal epithelium injury in zebrafish revealing host dependent beneficial effects” 的研究文章。
● 本研究证明鼠李糖乳杆菌GG的菌毛蛋白SpaC通过诱导斑马鱼肠上皮细胞焦亡和肠道菌群紊乱导致鱼体肠道损伤,提示宿主依赖性的有益/有害作用机制是应用非宿主来源益生菌时需要关注的关键安全问题。
● 第一作者:张震
● 通讯作者:周志刚(zhouzhigang03@caas.cn)、丁倩雯(dingqianwen@caas.cn)
● 合作作者:张洪玲、阳大海、郝强、杨宏伟、孟德龙、Willem Meindert de Vos、Le-Luo Guan、刘树彬、Tsegay Teame、高辰辰、冉超、杨雅麟、药园园
● 主要单位:中国农业科学院饲料研究所农业农村部饲料生物技术重点实验室;加拿大不列颠哥伦比亚大学,土地与粮食系统学院;中国农业科学院饲料研究所中国-挪威鱼类消化道微生物联合实验室;华东理工大学,生物反应器工程国家重点实验室;荷兰瓦赫宁根大学,微生物学实验室;芬兰赫尔辛基大学医学院,人类微生物组研究计划;埃塞俄比亚提格雷农业研究所
亮 点
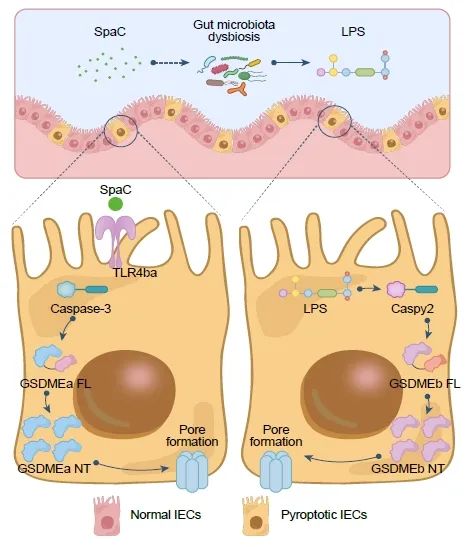
● SpaC是LGG诱导斑马鱼肠道上皮损伤的效应因子;
● 饲用SpaC通过激活GSDMEa直接诱导斑马鱼肠细胞焦亡;
● SpaC继发性地诱导肠道菌群紊乱,LPS产生菌的丰度显著增加;
● 菌群来源的LPS介导Gaspy2-GSDMEb途径加剧肠细胞焦亡。
摘 要
鼠李糖乳杆菌GG(LGG)是一株人类来源的明星益生菌菌株,具有维持哺乳动物的肠道稳态、调节免疫和抵御胃肠道病原体等益生功效。然而,本研究证明LGG的菌毛蛋白SpaC通过诱导斑马鱼肠上皮细胞焦亡和肠道菌群紊乱导致鱼体肠道损伤。饲用SpaC直接激活斑马鱼肠上皮中的Caspase-3−GSDMEa通路,诱导肠道细胞焦亡;肠道损伤继发性地诱导肠道菌群紊乱,导致LPS产生菌的丰度显著增加,而菌群来源的LPS介导Gaspy2-GSDMEb途径加剧肠道细胞焦亡;进一步研究发现,SpaC对斑马鱼TLR4ba的物种特异性识别触发Caspase-3−GSDMEa信号通路激活。本研究揭示SpaC诱导宿主肠上皮细胞焦亡的物种特异性,提示宿主依赖性的有益/有害作用机制是应用非宿主来源益生菌时需要关注的关键安全问题。
视频解读
Bilibili:https://www.bilibili.com/video/BV14F4m1K7hh
Youtube:https://youtu.be/8hfd6-dMhnI
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
益生菌广泛应用于人类和养殖动物。目前人源性的益生菌在畜禽养殖动物上多有使用,同时水产动物也有应用陆生动物源益生菌的强烈倾向。然而,目前尚未明确非宿主来源的益生菌是否可以在人类和养殖动物中跨物种使用且不引起安全问题。特别是,针对动物饲料和人类食品中益生菌的安全使用仍然缺少公认的监管方法或规则,也未见安全性数据的报道。
鼠李糖乳杆菌 GG(LGG)是一株人源性的益生菌,在维持哺乳动物肠道稳态、免疫调节和防御胃肠道病原体方面益生效果显著,其表面被称为“菌毛”的蛋白聚合物,通过其与上皮细胞外基质和黏液的结合促进LGG的粘膜粘附。LGG菌毛主要由SpaA、SpaB和SpaC三个亚基组成,它们介导与肠上皮细胞(IECs)的免疫调节作用,其中菌毛蛋白亚基SpaC作为粘附因子与粘膜表面结合。鉴于其突出的益生作用,LGG在人类和多种养殖动物上广泛使用。然而,我们前期研究发现,用107 CFUs/mL LGG浸浴斑马鱼14天后,LGG未能增强斑马鱼对嗜水气单胞菌NJ-1(Aeromonas hydrophila NJ-1)的抗感染能力,此外,鱼体肠道出现明显损伤,据此推测,LGG在斑马鱼的病原体抗性作用和肠道健康方面存在宿主特异性,并且,在斑马鱼模式识别受体可能与LGG的宿主特异性效应有关。
最近研究表明,细胞焦亡介导程序性细胞死亡的促炎途径参与肠上皮细胞(IECs)死亡。细胞焦亡广泛发生于脊椎动物中,包括哺乳动物和硬骨鱼,其特点是细胞裂解和促炎因子的释放,这是由损伤相关的分子模式和病原体相关的分子模式引起的。细胞焦亡受炎性小体激活调节,而成熟形式的白细胞介素-1β(IL-1β)也被用作细胞焦亡的标志物。细菌感染诱导炎性小体形成并触发半胱氨酸天冬氨酸特异性蛋白酶(caspases)的自激活,进一步激活切割GSDMs(一类执行细胞焦亡的胞内蛋白质)产生N端片段并在质膜上穿孔导致细胞裂解,最终导致细胞焦亡。细胞焦亡通过清除受损细胞,在抗微生物宿主防御中发挥重要作用,但细胞焦亡的过度激活会损害组织完整性,甚至导致宿主死亡。
我们推测细胞焦亡可能参与了LGG对斑马鱼的宿主特异性作用。在斑马鱼中,目前仅鉴定到一对GSDMEs(a和b)。斑马鱼的GSDMEa可以将肿瘤坏死因子(Tnf)诱导的Hela细胞凋亡转变为细胞焦亡,并且斑马鱼的GSDMEa氨基酸序列中存在Caspase-3切割位点。细胞焦亡的非经典炎性小体Caspy2−GSDMEb通路在斑马鱼活体上已被证实,但Caspase-3−GSDMEa介导细胞焦亡的证据在斑马鱼活体未见报道。因此,本研究采用常规养殖斑马鱼、无菌斑马鱼和细胞模型等,评估LGG菌毛蛋白 SpaC亚基诱发斑马鱼肠道损伤的物种特异性效应及其作用机制。
结 果
菌毛蛋白SpaC亚基与斑马鱼肠道损伤有关
使用107 CFUs/mL野生型LGG或其突变菌株PB22(缺失SpaCBA菌毛的突变菌株)浸浴一月龄斑马鱼7或14天(图1A),观察到LGG浸浴组斑马鱼肠道出现明显的组织病理学损伤(图1B-C),且LPS水平显著升高(图1D),然而PB22浸浴组斑马鱼肠道损伤程度和血清LPS水平明显低于LGG浸浴组(图1B-D)。此外,LGG浸浴组斑马鱼IECs细胞核发生染色凝集、核固缩及核膜起泡,标志着IECs死亡(图1E)。表达并纯化SpaCBA菌毛蛋白SpaA,SpaB或SpaC亚基,浸浴斑马鱼(图1F,图S1A),发现仅SpaC亚基显著增加了斑马鱼血清LPS水平(图1G)。这些结果表明,菌毛蛋白SpaC亚基是LGG诱导斑马鱼肠上皮损伤的效应成分。
为了确定IECs是否发生了促炎型焦亡,我们检测了LGG浸浴组斑马鱼肠道IL-1β表达并观察到其成熟形式(图S1B);此外,在SpaC浸浴的斑马鱼中观察到Caspase-3、GSDMEa-N、Caspy2和GSDMEb-N的切割(图1H)。这些结果共同表明,焦亡参与了SpaC诱导的肠道粘膜损伤效应。

图1. 菌毛蛋白SpaC亚基与斑马鱼肠上皮损伤有关
(A)将一月龄斑马鱼在107 CFUs/mL野生型LGG或PB22中浸浴7或14天;(B)通过 H&E 染色获得代表性肠道组织学图像,比例尺100μm;(C)衡量 7 天和14天时肠道损伤严重程度的组织学总评分(7天:F 2,6 = 16.545;14天:F 2,6 = 13.971;n = 3);通过以下指标获得定量数据:无序的微绒毛、水肿或固有层炎症浸润、IEC的液泡变性、细胞脱落和坏死;(D)血清LPS水平(7天:F 2,6 = 5.185;14天:F 2,6 = 37.515;n = 3,每个样品3条斑马鱼);(E)14天时肠道切片的代表性电子显微照片,上图比例尺 2 μm,下图比例尺 1 μm,箭头表示垂死或死亡的肠上皮细胞,三角形箭头表示微绒毛损伤;(F)将1月龄斑马鱼分别浸泡在浓度为10 μg/mL的重组SpaA、SpaB或SpaC中7或14天;(G)血清LPS水平(7天:F 3,24 = 13.562;14天:F 3,20 = 2.543;n = 6 or 7,每个样品3条斑马鱼);(H)具有代表性的蛋白质印迹,显示 Caspase-3 活化、GSDMEa 裂解、Caspy2 活化和 GSDMEb 裂解。在小提琴图上标记了生物学独立样本的数量,水平线表示小提琴图中的中位数;统计学:单因素方差分析邓肯检验;在顶部标有不同字母的图中,处理表示具有统计学意义的结果(p < 0.05)。LGG,鼠李糖乳杆菌 GG;CFUs,菌落数;H&E、苏木精和伊红;IECs,肠上皮细胞;LPS,脂多糖;Caspase,半胱氨酰天冬氨酸特异性蛋白酶;GSDM,gasdermin。
饲源性SpaC诱导斑马鱼肠道焦亡和肠道菌群失调
我们设计了三周的SpaC的饲添评价试验,以进一步验证SpaC对斑马鱼IECs焦亡的影响(图2A)。鉴于SpaC浸浴组斑马鱼血清LPS水平较高,同时还设置了LPS饲添组(LPS:0.2mg/g饲料)(图2A)。与SpaC浸浴结果一致,SpaC饲添组和LPS饲添组斑马鱼均表现出明显的肠道损伤组织病理学特征(图2B-C,表S3),说明饲添SpaC和LPS均会导致肠上皮损伤;此外,WB结果显示,饲添SpaC导致斑马鱼肠道Caspase-3、GSDMEa、Caspy2和GSDMEb切割(图2D),而饲添LPS仅导致Caspy2和GSDMEb切割(图2D)。这些结果表明,饲添SpaC能够激活斑马鱼IECs Caspase-3−GSDMEa和Caspy2−GSDMEb焦亡通路,而LPS只能激活Caspy2−GSDMEb焦亡通路。
与对照组(基础日粮,Ctrl)斑马鱼相比,SpaC饲添组斑马鱼血清LPS水平显著增加(图2E)。鉴于血清LPS的升高与变形菌门丰度过度增加相关,因此我们通过16S rDNA测序分析肠道菌群组成。稀释曲线和主坐标分析结果表明SpaC0.5、SpaC1.0和LPS0.2饲添组斑马鱼肠道微生物在物种多样性和组成上与Ctrl组差异显著(图2F,图S2A-B);与Ctrl组相比,SpaC1.0组和LPS0.2组变形菌门相对丰度均显著增加(图2G);进一步分析发现SpaC1.0组肠杆菌科相对丰度显著增加,而LPS组的孢子菌属、不动杆菌属、脱硫弧菌属和胃球菌科相对丰度显著增加(图S2C-D);KEGG富集分析结果显示饲添SpaC1.0和LPS组使具有LPS产生能力的操作分类单元(OTU)显著增加(图2H)。这些结果表明,饲添SpaC和LPS均会导致肠道菌群失调和血清LPS升高。
同样,LGG和PB22浸浴也导致斑马鱼肠道菌群发生类似的变化(图2I)。在不影响肠道内细菌总数的情况下,LGG浸浴显著增加斑马鱼肠道中变形菌门和肠杆菌科的相对丰度(图2I),而PB22浸浴组斑马鱼肠道中变形菌门和肠杆菌科的相对丰度虽然显著高于对照组但显著低于LGG浸浴组(图2I)。这些结果表明,LGG浸浴和饲添SpaC通过相同的方式改变了肠道菌群的结构,说明SpaC是诱导斑马鱼肠道菌群结构改变的关键因素。

图2. 日粮SpaC和LPS诱导斑马鱼肠道焦亡和肠道菌群失调
(A)以补充0.5和1.0 mg/g SpaC的日粮和补充0.2 mg/g LPS的日粮饲喂1月龄斑马鱼3周;(B)通过H&E染色获得代表性的肠道组织学图像;(C)衡量肠损伤严重程度的组织学总评分(值为平均值,F 3,20 = 65.490;n = 6);(D)具有代表性的WB结果显示Caspase-3活化、GSDMEa切割、Caspy2激活和 GSDMEb切割;(E)血清LPS水平(F 3,25 = 9.826;n = 6−9,每个样品3条斑马鱼);(F)α多样性指数(ACE:F 3,20 = 17.869;Chao1:F 3,20 = 20.649;Simpson:F 3,20 = 3.273;Shannon:F 3,20 = 11.611;n = 6,每个样品6条斑马鱼);(G)肠道菌群门水平(n = 6,每个样本6条斑马鱼);(H)产LPS细菌的相对丰度(F 3,20 = 5.907;n = 6);(I)用 LGG或PB22浸泡14天(n = 5−6)的1月龄斑马鱼肠道菌群的细菌总数(F 3,20 = 2.332)、变形菌门(F 3,20 = 18.276)和肠杆菌科(F 2,14 = 22.373)数量。在小提琴图上标记了生物学独立样本的数量;方框表示中位数±四分位距,箱形上下线条表示1.5×四分位距;统计学:单因素方差分析邓肯检验;小提琴图或箱形图中的不同字母代表统计学显著(p < 0.05)。
肠道菌群部分介导了饲源性SpaC诱导的IECs焦亡
为探究肠道菌群在SpaC诱导的肠道焦亡中的作用,分别使用10 μg/mL SpaC和2 μg/ mL LPS浸浴无菌(GF)斑马鱼3天(图3A)。发现SpaC浸浴仅导致Caspase-3和GSDMEa切割(图 3B),即在无肠道菌群参与的情况下,SpaC激活Caspase-3−GSDMEa通路,而不影响Caspy2−GSDMEb通路(图3B);而LPS浸浴仅导致Caspy2和GSDMEb切割(图3B)。这些结果表明肠道菌群在Caspy2−GSDMEb通路激活过程中发挥重要作用。
为明确斑马鱼Caspase-3−GSDMEa和Caspy2−GSDMEb途径激活之间是否存在联系,使用10 μg/mL SpaC或LPS浸浴casp3a-/-斑马鱼(未消除肠道菌群)3天(图2C)。发现SpaC浸浴无法激活GSDMEa和GSDMEb的切割(图3D)。这些结果表明在肠道菌群存在的情况下,Caspase-3a对于SpaC诱导的GSDMEa和GSDMEb切割至关重要。前者为直接阻断Caspase-3−GSDMEa通路的结果,后者可能与阻断“Caspase-3−GSDMEa焦亡诱导的肠道菌群紊乱”相关。
随后通过菌群转接模型验证了肠道菌群对Caspy2−GSDMEb通路激活的影响,向GF斑马鱼转接LPS和SpaC饲添组斑马鱼肠道菌群,均观察到Caspy2和GSDMEb的切割(图3F),表明饲添SpaC介导肠道菌群通过Caspy2−GSDMEb途径激活肠道焦亡。
在保留肠道菌群的斑马鱼中敲降caspy2,发现caspy2敲降阻断了由SpaC或LPS浸浴引起的GSDMEb切割,但不影响SpaC诱导的GSDMEa切割(图3G-H),即Caspy2仅影响SpaC处理的斑马鱼中GSDMEb的切割,而不影响GSDMEa,表明在保留肠道菌群的情况下,SpaC对Caspase-3−GSDMEa通路的激活先于Caspy2−GSDMEb通路。
为了验证GSDMEa和GSDMEb分别在SpaC和LPS诱导的细胞焦亡中的作用,分别用特异性siRNA敲降斑马鱼成纤维细胞(ZF4)gsdmea和gsdmeb(图 3I,S3A-B)。敲降24小时后,继续使用10 μg/mL SpaC或LPS处理ZF4细胞24小时,发现敲降gsdmea显著抑制SpaC诱导的细胞焦亡,而敲降gsdmeb显著抑制LPS诱导的细胞焦亡(图3J-K)。此外,gsdmea或gsdmeb敲降未影响细胞凋亡率(图3K,S3C)。这些结果进一步验证了GSDMEa和GSDMEb分别介导SpaC和LPS诱导的细胞焦亡。

图 3. SpaC和LPS以肠道菌群非依赖性和依赖性方式诱导细胞焦亡
(A)将GF斑马鱼(4-dpf)用10 μg/mL SpaC或LPS浸浴 3天;(B)WB结果显示GF斑马鱼的Caspase-3活化、GSDMEa裂解、Caspy2活化和GSDMEb裂解;(C)将casp3a-/-斑马鱼(4-dpf)用10 μg/mL SpaC或LPS浸浴3天;(D)WB结果显示casp3a-/-斑马鱼的GSDMEa切割和 GSDMEb切割;(E)将饲喂SpaC或LPS的斑马鱼肠道菌群转移到GF斑马鱼中3天;(F)将饲喂SpaC1.0或LPS0.2饲料3周的一月龄斑马鱼的肠道菌群转GF斑马鱼中,WB结果显示Caspy2激活和GSDMEb裂解;(G)将caspy2敲降的斑马鱼(4-dpf)用10 μg/mL SpaC或LPS浸泡3天。(H)WB结果显示caspy2敲降后斑马鱼的GSDMEa切割和 GSDMEb切割;(I)沉默编码 GSDMEa或GSDMEb的基因后用10 μg/mL SpaC或LPS处理ZF4细胞;(J)细胞焦亡/凋亡率代表性图;(K)处理24小时后的焦亡率(对照siRNA:F2,27 = 4.954;gsdmea:F 2,27 = 4.067;gsdmeb:F 2,27 = 2.449;n = 10)。在小提琴图中,方框表示中位数±四分位距,箱形上下线条表示 1.5×四分位距;统计:Student's t 检验;标有不同字母的图结果表示具有统计学意义(p < 0.05)。GF,无菌;dpf,出生后天数;siRNA,特异性小干扰RNA。
SpaC通过与斑马鱼toll样受体4ba(TLR4ba)互作启动肠道焦亡
菌毛蛋白SpaC亚基是一种微生物相关分子模式(MAMP),因此,进一步在斑马鱼肠道中鉴定可以识别SpaC的特异性受体。将带有His标签的SpaC作为诱饵蛋白,通过Pull-down技术获得其潜在的互作蛋白(图S4A),并通过液相色谱-质谱(LC−MS/MS)分析进行鉴定(图S4B),共鉴定出685种潜在的相互作用蛋白(表S4),包括TLR4ba。SpaC浸浴7天能够显著上调斑马鱼的肠道TLR4ba表达(图4A,图S4D);通过双分子荧光互补(BiFC)技术,SpaC和斑马鱼TLR4ba的细胞外结构域(zTLR4ba)在HEK293细胞中形成双分子荧光复合物,进一步证明了TLR4ba和SpaC之间存在相互作用(图 4B)。此外,在GF斑马鱼中,敲降TLR4ba能够消除SpaC浸浴引起的GSDMEa切割(图4C-D)。这些结果表明,TLR4ba对SpaC诱导的焦亡至关重要。

图4. LGG的菌毛蛋白亚基SpaC通过与斑马鱼TLR4ba互作触发肠道焦亡
(A)将1月龄斑马鱼浸浴在浓度为10 μg/mL的重组SpaC中7天,通过qRT-PCR检测斑马鱼肠道中编码TLR2、TLR4ba和TLR4bb的基因的相对mRNA表达(TLR2:F 1,8 = 0.116;TLR4ba:F 1,10 = 18.075;TLR4bb:F 1,6 = 0.912;n = 6);(B)BiFC表征SpaC与斑马鱼TLR4ba之间的相互作用;(C)在斑马鱼幼鱼中使用MO敲降TLR4ba。(D)敲降TLR4ba后用SpaC浸泡,WB结果显示斑马鱼幼鱼的GSDMEa和GSDMEb切割。在小提琴图上标记了生物学独立样本的数量;方框表示中位数±四分位距,箱形上下线条表示 1.5×四分位距;统计:Student's t 检验;p < 0.01,**。TLR,toll样受体;qRT-PCR,实时荧光定量PCR反应;BiFC,双分子荧光互补;阴性 Ctrl(非转染)、模拟(共转染pBiFC-VC155和pBiFC-VN173)、阳性Ctrl(共转染pBiFC-bFosVC155和pBiFC-bjunVN173)、实验组(共转染pBiFC-VN173-SpaC和pBiFC-VC155-zTLR4ba)。
斑马鱼和人类TLR对SpaC的差异化应答
为了进一步研究SpaC在不同宿主中的差异化效应,使用SpaC亚基处理斑马鱼ZF4细胞和人类Caco-2细胞(图5A),发现SpaC增加ZF4细胞焦亡率,而对Caco-2细胞焦亡率无显著影响(图 5B-C)。同样,SpaC亚基诱导ZF4细胞GSDMEa的切割(图5D),而对Caco-2细胞GSDME的切割无影响(图5E)。SpaC可能仅在斑马鱼中诱导细胞焦亡,而在人类中则不然。此外,SpaC处理显著上调ZF4细胞TLR4ba的表达(图5F),但对Caco-2细胞Toll样受体4(TLR4)无显著影响,却显著上调Caco-2细胞Toll样受体2(TLR2)的表达(图 5G)。这些结果表明,SpaC可能是斑马鱼中zTLR4ba的物种特异性配体之一。
Sullivan等人提出,斑马鱼TLR4ba和TLR4bb的胞外结构域可能与其配体识别的转变相关,而非Toll/IL-1受体(TIR)结构域,因此,我们构建了zTLR4ba或zTLR4baEC-hTLRIC质粒(融合zTLR4ba胞外结构域与hTLR4的跨膜和胞内结构域),并在Caco-2细胞中表达(图5H)。过表达pcDNA3.1-zTLR4ba或 pcDNA3.1-zTLR4baEC-hTLRIC显著增加SpaC诱导的Caco-2细胞焦亡率(图5I)。这些结果表明,zTLR4ba的胞外结构域对SpaC的物种特异性识别中的重要贡献。此外,通过微量热泳动(MST)测量纯化的SpaC和TLR蛋白之间的相互作用强度(结合亲和力),进一步验证SpaC与zTLR4ba的物种特异性结合,然而hTLR4和SpaC之间没有观察到亲和反应(图5J),同时发现SpaC对人类TLR2(hTLR2)的亲和力高于zTLR4ba(图 5J)。这些结果表明,SpaC可以与zTLR4ba和hTLR2发生相互作用,而非hTLR4。

图5. SpaC诱导斑马鱼ZF4细胞焦亡而非人Caco-2细胞焦亡
(A)用浓度递增的SpaC(0、5、10和20 μg/mL)处理细胞24小时;(B)用不同剂量的重组SpaC蛋白处理24小时后的ZF4细胞的流式细胞术结果;(C)用不同剂量的重组SpaC蛋白处理24小时后的Caco-2细胞的流式细胞术结果;(D)WB显示ZF4细胞中GSDMEa和GSDMEb切割;(E)WB显示Caco-2细胞中GSDME切割;(F)ZF4细胞中编码TLR2、TLR4ba和TLR4bb的基因的相对mRNA表达(TLR2:F 1,4 = 0.024;TLR4ba:F 1,4 = 5.550;TLR4bb:F 1,4 = 0.062;n = 3);(G)Caco-2细胞中编码TLR2和TLR4基因的相对mRNA 表达(TLR2:F 1,4 = 12.387;TLR4:F 1,4 = 0.953;n = 3)。(H)将表达zTLR4ba或zTLR4baEC-hTLRIC的质粒转染到Caco2 细胞中;(I)用10 μg/mL SpaC蛋白处理24小时的Caco-2细胞或过表达zTLR4ba或zTLR4baEC-hTLRIC的Caco-2细胞的流式细胞术结果。在小提琴图上标记了生物学独立样本的数量;方框表示中位数±四分位距,箱形上下线条表示 1.5×四分位距;统计:Student's t 检验;p < 0.05,*。ZF4,斑马鱼成纤维细胞;zTLR4ba,斑马鱼TLR4ba;zTLR4baEC-hTLRIC,zTLR4ba的胞外结构域与hTLR4的跨膜和胞内结构域的融合;MST,微量热泳动。
讨 论
本研究从人类来源的益生菌LGG通过其菌毛蛋白SpaC诱导斑马鱼肠上皮细胞焦亡和肠道菌群失调的角度揭示了LGG对斑马鱼肠道健康的负面影响(图6)。本研究证实SpaC诱导细胞焦亡的关键是SpaC对TLR4ba的物种特异性识别;随后GSDMEa蛋白引发细胞焦亡和肠道菌群紊乱,继而通过肠道菌群产生LPS并激活GSDMEb细胞焦亡途径。
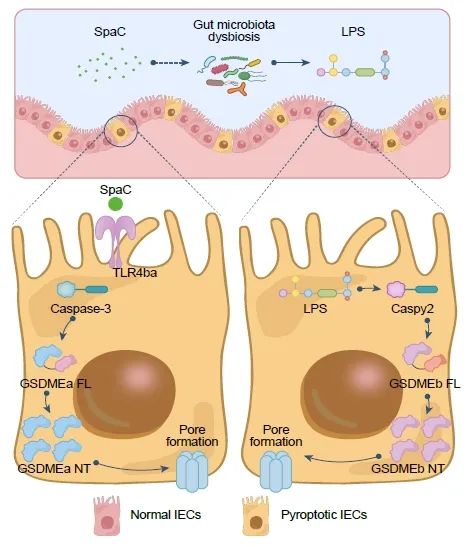
图6. SpaC激活肠道焦亡的机制示意图
LGG 的菌毛蛋白SpaC亚基通过物种特异性激活 TLR4ba 诱导肠上皮细胞损伤,TLR4ba启动Caspase-3−GSDMEa焦亡,并通过肠道菌群失调继发性激活Gaspy2−GSDMEb焦亡。
在本研究中,LGG和PB22对肠道组织学和血清LPS水平的差异化影响表明SpaCBA菌毛是LGG损伤斑马鱼肠道黏膜的主要组成成分;此外,SpaA、SpaB和SpaC菌毛蛋白亚基对血清LPS水平的差异化影响表明SpaC是导致斑马鱼肠道损伤的原因。LPS的肠上皮细胞旁渗透与肠上皮紧密连接和肠道屏障功能破坏。肠道屏障受损主要是因为上皮细胞的过度丢失和/或再生能力下降,因此,本研究以血清LPS水平作为肠道屏障完整性的指标。LPS是变形菌门胞壁的主要成分,可以释放到周围环境中,因此,血清LPS的升高除了作为肠道屏障完整性的指标外,也是变形菌门丰度过度增加的指标。16S rDNA测序结果显示SpaC引起肠道菌群失调,其特征是增加了变形菌门丰度。此外,KEGG分析表明SpaC诱导的肠道菌群具有较强的LPS生物合成功能。因此,除肠道屏障受损外,产LPS的肠道菌群的丰度增加可能与SpaC饲喂组斑马鱼血清LPS升高相关,在LGG浸浴或饲喂组斑马鱼中也观察到类似的结果。进一步分析Caspases和Caspase依赖性焦亡的执行蛋白表明,SpaC可能是一种激活斑马鱼肠道焦亡的LGG的MAMP。
饲用方式是微生物及相关成分的常见应用途径。例如,在小鼠高脂日粮中补充3或5 μg阿克曼氏菌(Akkermansia muciniphila)外膜蛋白Amuc_1100能够显著改善肥胖和糖尿病小鼠的脂质代谢。在本研究中,斑马鱼每天摄入约5或10 μg的SpaC可导致斑马鱼肠道黏膜损伤和焦亡。胰蛋白酶处理可降解SpaC,且其降解产物可能不具有其完整形式的活性或功效。因此,我们推测SpaC在斑马鱼肠道中的降解产物不参与诱导斑马鱼肠道黏膜损伤和焦亡。同时,鲤科鱼类的蛋白质表观消化系数为47%−90%。这意味着部分SpaC可以在胃肠道中保持其完整结构,并与肠黏膜结合激活焦亡途径。
LPS会引起斑马鱼肠道损伤,但与SpaC激活焦亡的途径不同。因此,饲源性SpaC可能通过增加肠道内产生LPS的肠道菌群的丰度,从而激活Caspy2−GSDMEb焦亡途径;而在没有肠道菌群的情况下,SpaC仅激活Caspase-3−GSDMEa通路;在GF斑马鱼中,LPS激活Caspy2−GSDMEb通路,间接支持了产生LPS的细菌在SpaC诱导的肠道焦亡中的作用,SpaC饲喂组斑马鱼的肠道菌群转接激活Caspy2-GSDMEb通路也进一步证实了这一点。
在保留肠道菌群的斑马鱼中,敲除caspase-3a阻断了GSDMEa切割,这表明斑马鱼Caspase-3对于GSDMEa切割是必不可少的,与哺乳动物Caspase-3的功能相一致。有趣的是用SpaC处理后,敲除caspase-3a也终止了GSDMEb的切割,说明在保留肠道菌群的斑马鱼中,Caspase-3−GSDMEa和Caspy2−GSDMEb通路的激活存在联系。然而当caspy2被敲除后,SpaC仍然能够激活Caspase-3−GSDMEa通路,但不能激活Caspy2−GSDMEb通路。据此推测,SpaC可能首先激活肠上皮细胞Caspase-3−GSDMEa焦亡,从而导致肠道菌群失调和肠道中产生LPS的细菌丰度增加,随后产生并向肠道环境释放LPS,激活Caspy2−GSDMEb焦亡途径。这些结果进一步证明了Caspy2−GSDMEb通路的激活是SpaC诱导的Caspase-3−GSDMEa通路的继发性结果。即使caspase-3a被敲除,LPS仍然可以激活Caspy2−GSDMEb通路,这一结果支持了产生LPS的肠道微生物及LPS是SpaC激活的两种焦亡通路的重要枢纽。在ZF4细胞中,通过敲除GSDMEa和GSDMEb分别揭示二者在SpaC和LPS诱导的焦亡中发挥重要作用,也表明Caspase-3−GSDMEa与Caspy2−GSDMEb通路在分子水平上不存在直接联系。综上所述,肠道菌群在LGG菌毛蛋白SpaC诱导的肠道上皮细胞焦亡中起着重要作用。GSDMs是依赖Caspase的焦亡执行蛋白。哺乳动物,如小鼠,具有一组GSDM蛋白(A−E)执行焦亡,病原体相关分子模式和双链DNA均可通过炎症小体Caspase-1/4/5/11−GSDMD通路激活焦亡。虽然斑马鱼只有一对GSDME(GSDMEa/b),但本研究表明,LPS对GSDMEb的激活在哺乳动物和硬骨鱼中是保守的。此外,本研究在斑马鱼活体中报道了Caspase-3−GSDMEa焦亡通路的激活。
一般来说,肠道菌群的正向调节是益生菌功效的一个指标,其主要特征是抑制有害菌生长和促进有益菌生长。然而,本研究提出了一个反向案例,揭示LGG通过其SpaC菌毛蛋白负向调节肠道菌群,增加变形菌门的相对丰度。Shin等人(2015)发现,肠道中变形菌门丰度的增加是肠道菌群失调的标志之一。Petersen和Round(2014)将其描述为功能性微生物的丧失、致病微生物的增殖或微生物多样性的丧失。在本研究中肠道菌群失调是SpaC触发的Caspase-3−GSDMEa焦亡通路的结果。因此,肠道菌群失调不仅可以作为疾病或健康受损的指标,而且还可以作为评价外源性刺激安全性的指标。我们的研究结果表明肠道菌群失调可以作为反映益生菌安全性的综合指标。
宿主肠道中的特定模式识别受体(PRRs)负责识别MAMPs。SpaC既是LGG的粘附因子,也是一种MAMP。在哺乳动物中,SpaCBA的免疫调节作用依赖于TLR2介导的信号通路,TLR2识别LGG并启动信号通路来协调免疫应答。同时,LGG不能缓解TLR2缺陷小鼠的由鼠齿动物柠檬酸杆菌(Citrobacter rodentium)诱导的结肠炎。在哺乳动物中,TLR2参与识别MAMPs,如脂蛋白、脂磷壁酸、肽聚糖和酵母酶。一般来说,哺乳动物TLR2与TLR6形成异二聚体,感应脂蛋白和脂磷壁酸。而斑马鱼基因组缺失编码TLR6的基因。因此,斑马鱼TLR2可能无法感知和识别LGG。
在本研究中,使用Pull-down结合LC−MS/MS技术鉴定可能与SpaC相互作用的受体。本研究共鉴定、筛选出7个膜受体,包括TLR4ba。在这些受体中,现有的报道表明TLR4被报道控制哺乳动物的细胞焦亡。zTLR4ba对SpaC诱导的焦亡的重要性也通过敲除zTLR4ba得以验证。抑制或激活TLR4信号通路可以抑制或激活哺乳动物的肠道细胞焦亡。因此,斑马鱼和哺乳动物TLR4信号与细胞焦亡之间的因果关系是保守的。但斑马鱼的2个TLR4亚基(TLR4a和TLR4b)与人类的TLR4(hTLR4)是旁系同源的,而非直系同源。不同于hTLR4,斑马鱼TLR4a/b对人类TLR4典型配体LPS的敏感性较低。这可能是由于斑马鱼中TLR4a和TLR4b胞外结构域在进化水平上的变异,改变了斑马鱼TLR的配体特异性。虽然斑马鱼TLR4a/b的配体尚未得到阐明,但本研究发现的SpaC与zTLR4ba的相互作用表明SpaC可能是zTLR4ba的配体。SpaC诱导ZF4细胞和Caco-2细胞焦亡并激活相关焦亡通路也支持SpaC是zTLR4ba的潜在配体,而非hTLR4。综上所述,SpaC可能是斑马鱼zTLR4ba的种特异性配体。在本研究中,SpaC和zTLR4ba之间的强亲和性也进一步证实了这一点。配体特异性识别的转变可能与斑马鱼TLR4a和TLR4b的胞外结构域相关,而非Toll/IL-1受体(TIR)结构域,且本研究也支持了zTLR4ba的胞外结构域在SpaC的物种特异性识别中的贡献。因此,zTLR4ba对SpaC的物种特异性识别决定了SpaC诱导的肠道损伤的宿主特异性。
据报道,表面菌毛不仅存在于LGG上,而且也存在于其他益生菌上,如双歧杆菌(Bifidobacteria)和乳酸乳球菌(Lactococcus lactis)。虽然在家畜中使用双歧杆菌或乳球菌菌株未见肠道表面损伤等安全问题的报道,但饲喂乳酸乳球菌3-C-18(1010 CFUs/kg)对鱼类健康产生负面影响。这些证据表明,非宿主源益生菌的应用可能通过不同的机制影响目标动物的健康。例如,菌毛粘附的特性可能会影响菌毛粘附与宿主细胞膜受体之间的相互作用,进一步促进益生菌的宿主特异性。
结 论
综上所述,本研究首次从物种特异性的角度报道了益生菌的安全性问题。LGG菌毛蛋白SpaC通过物种特异性激活TLR4ba诱导肠上皮损伤,从而启动Caspase-3−GSDMEa焦亡,然后通过肠道菌群失调激活Gaspy2−GSDMEb焦亡。本研究提高了对益生菌的宿主特异性有益/有害机制的理解,需要进一步研究测试来自其他动物物种的不同乳酸菌菌株,以得出更为广泛的结论。为了减轻非宿主来源的益生菌的潜在风险,推荐两种方法:第一个是针对特定的物种开发益生菌菌株,而不是直接将从一个物种分离出来的益生菌菌株应用于另一个物种;其次,基因编辑技术将有助于从特定的益生菌菌株中剔除危险因素。尽管这项研究提出了一个特定物种的益生菌安全问题的案例,但鉴于对人类健康的潜在威胁,异源益生菌的安全评价至关重要并且应该得到更多的关注。虽然益生菌通常被认为是非致病性且对宿主安全,但益生菌的安全性问题在某些特定情况下仍然存在,益生菌的应用导致全身感染,有害的代谢活动和胃肠道副作用在一些人类易感个体中时有发生,这些风险呼吁进一步的研究来描述与益生菌相关的不良事件的发生率和严重程度。据已报道的人类案例以及我们的结果,我们应谨慎对待益生菌的选择和应用。
方 法
菌株
LGG(ATCC53103)购自中国工业微生物菌种保藏管理中心。LGG突变株PB22由荷兰瓦赫宁根大学微生物实验室提供。
实验动物
野生型AB系斑马鱼繁育并饲养于中国农业科学院饲料研究所。饲养温度保持在25−28℃,溶解氧>6.0 mg/L,pH值7.0−7.5,氨氮含量<0.50 mg/L,亚硝酸盐含量(如NO2)<0.02 mg/L,室内环境光/暗周期14:10。GF斑马鱼依据中国农业科学院饲料研究所专利技术制备。casp3a-/-斑马鱼(ZKO331)购自中国斑马鱼资源中心。
细胞系
ZF4细胞(ATCC®CRL-2050™)培养基组成为含有10%胎牛血清的DMEM/F-12培养基。培养温度为28℃、培养气体为5% CO2。HEK293细胞(ATCC®CRL-3216™)培养基组成为10%胎牛血清的DMEM。Caco-2细胞(ATCC®HTB-37™)培养基组成为含有10%胎牛血清的EME培养基。HEK293和Caco-2细胞培养温度为37℃,培养气体为5% CO2。
在大肠杆菌中制备重组SpaC、SpaB和SpaA蛋白
提取LGG菌株的基因组DNA,然后用于扩增基因spaC、spaB 和 spaA。将基因spaC、spaB或spaA插入线性化的pET28a(+)载体中以构建重组表达载体。将 pET28a-SpaC、pET28a-SpaB 或 pET28a-SpaA 载体转化到大肠杆菌 BL21(DE3)感受态细胞,扩大培养至OD600 = 0.6−0.8时,使用异丙基-β-D-硫代吡喃半乳糖苷(0.5mM)诱导蛋白表达,16°C 诱导12 小时后,收集细菌并用bugbuster蛋白提取试剂裂解,采用镍柱琼脂糖色谱法纯化目的蛋白。
肠道菌群分析
养殖试验结束,斑马鱼最后一次饲喂4小时后采集鱼体肠道内容物,每个肠道内容物样本取自6条鱼。使用Fast DNA SPIN Kit for Soil(MP Biomedicals)提取细菌DNA。采用以下引物扩增16S V3−V4区:338F:5′-ACTCCTACGGGAGGCAGCA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′。基因测序由百迈客使用illumina novaseq6000平台进行。使用BMKCloud (www.biocloud.net)进行数据分析。利用群落系统发育研究软件PICRUSt2,基于KEGG 3级水平预测了肠道菌群的LPS生物合成能力。首先,利用PICRUSt2软件比对16S测序数据中获得的物种组成信息,对OTUs进行标准化。然后,结合OTUs对应的KEGG家族信息,计算KEGG的丰度,分析组间功能差异。
细胞焦亡和凋亡分析
使用膜联蛋白(Annexin)V-荧光素异硫氰酸酯(FITC)试剂盒检测细胞焦亡和细胞凋亡。在SpaC或LPS处理后,收集ZF4或Caco-2细胞,并与AnnexinV−FITC和碘化丙啶(PI)在室温下在黑暗中孵育10分钟,使用流式细胞仪进行检测。使用绿色(525 nm)和红色(690 nm)滤光片在测量激发波长为488 nm处的荧光强度。使用 FlowJo(10.8.1)进行数据分析。Annexin V-FITC通过识别暴露在细胞膜外小叶上的磷脂酰丝氨酸对凋亡细胞进行染色,也通过识别由于膜破裂而暴露在内小叶上的磷脂酰丝氨酸对焦亡细胞进行染色。右上方的点状图所占比例代表细胞焦亡率(Annexin V阳性,PI阳性)。
SpaC与zTLR4ba相互作用可视化BiFC实验
采用BiFC法直接观察SpaC与zTLR4ba蛋白相互作用。BiFC检测的克隆载体(pBiFC-VN173、pBiFC-VC155、pBiFC-bJun-VN173和pBiFC-bFos-VC155)购自GeneCopoeia公司。通过PCR扩增LGG SpaC(GenBank:FM179322.1,locus_tag = LGG_00444)和斑马TLR4ba(NCB参考序列:XM_009307228.3)的编码区,分别连接到pBiFC-VN173和pBiFC-VC155(HA-tag)载体上。使用Lipofectamine™ 3000转染试剂(Thermo Fisher Scientific),将pBiFC-VN173-SpaC和pBiFC-VC155-zTLR4ba融合表达载体共转染HEK293细胞。转染后24小时,使用倒置荧光显微镜(Leica DMIL-LED)检测荧光信号的强度。
质粒pcDNA3.1-zTLR4ba和pcDNA3.1-zTLR4baEC-hTLR4IC的构建
为了构建zTLR4ba质粒,将编码zTLR4ba的基因序列(NCBI参考序列:XM_009307228.3)克隆到pcDNA3.1(-)载体上,并利用NheI和HindIII酶切位点进行克隆。同时,将编码zTLR4ba胞外结构域、人跨膜结构域和胞内结构域的基因序列(NCBI参考序列:NM_138554.5)通过限制性内切位点NheI和HindIII克隆到pcDNA3.1(-)质粒中,构建了zTLR4baEC-hTLR4IC融合表达质粒。pcDNA3.1(-)载体购自Detaibio公司。使用LipofectamineTM 3000(Thermo Fisher Scientific)转染pcDNA3.1-zTLR4ba或pcDNA3.1-zTLR4baEC-hTLR4IC重组载体至Caco-2细胞。以pcDNA3.1(-)载体转染的细胞为阴性对照。转染后的Caco-2细胞再用10 μg/mL的SpaC处理24小时,然后用流式细胞术检测细胞死亡(凋亡/焦亡)。
微量热泳动分子相互作用(MST)分析
将zTLR4ba胞外结构域的编码序列(zTLR4ba,NCBI参考序列:XM_009307228.3)、hTLR4胞外结构域的编码序列(NCBI参考序列:NM_138554.5)和hTLR2胞外结构域的编码序列(NCBI参考序列:XM_017008573.1)分别利用限制性位点NheI和HindIII克隆到pET30a载体中,构建表达质粒。SpaC和TLR蛋白(zTLR4ba、hTLR4和hTLR2)的相互作用通过Monolith NT.115仪器(NanoTemper Technologies)检测。利用仪器的红色通道记录热泳的荧光强度信号。采用MO. Affinity Analysis v2.3软件(Nano Temper Technologies)的KD Fit进行曲线拟合和解离常数(KD)的计算。试验重复进行,至少有3个生物重复。
基因敲降
利用Gene Tools公司合成的morpholino oligonucleotides(MO)对斑马鱼幼鱼进行基因敲低。MO对斑马鱼caspy2和TLRba的序列分别参考Yang等和Zhang等。用100 nmol的对照组MO、caspy2或TLR4ba morpholino浸浴处理斑马鱼幼鱼3天后,用10 μg/mL SpaC浸浴。对于ZF4细胞,采用GenePharma公司设计合成的siRNA进行基因敲低。阴性对照(无义siRNA,NC)和靶向斑马鱼gsdmea和gsdmeb的siRNA序列列于表S7。首先将ZF4细胞接种于六孔板,培养24小时后,用LipofectamineTM RNAiMAX转染试剂(Invitrogen,13778930)转染无义siRNA或靶向gsdmea和gsdmeb的siRNA。转染后24小时用qRT-PCR或免疫印迹法检测siRNA的效率。
统计分析
所有统计分析均在GraphPad Prism Version 8(GraphPad Software)和ImageGP软件中进行。采用Levene检验数据的方差齐性。涉及两组以上的数据采用单因素方差分析和邓肯检验进行分析。两组间比较采用student’s t检验进行分析。P < 0.05的差异被认为是显著的。
引文格式:
Zhen Zhang, Hong-Ling Zhang, Da-Hai Yang, Qiang Hao, Hong-Wei Yang, De-Long Meng, Willem Meindert de Vos, Le-Luo Guan, Shu-Bin Liu, Tsegay Teame, Chen-Chen Gao, Chao Ran, Ya-Lin Yang, Yuan-Yuan Yao, Qian-Wen Ding, Zhi-Gang Zhou. 2024. Lactobacillus rhamnosus GG triggers intestinal epithelium injury in zebrafish revealing host dependent beneficial effects. iMeta 3: e181. https://doi.org/10.1002/imt2.181
作者简介

张震(第一作者)
● 博士,中国农业科学院饲料研究所副研究员,硕士生导师。
● 研究工作聚焦鱼类饲用益生菌挖掘。先后主持国家自然科学基金青年项目、面上项目及国家重点研发计划子课题等。以第一或通讯作者(含共同)在iMeta, Gut Microbes, Communications Biology, Review in Aquaculture, Journal of Nutrition等期刊发表论文30余篇,参编英文著作1部,获授权国家发明专利9项(含PCT 专利1 项)。

周志刚(通讯作者)
● 博士,中国农业科学院饲料所二级研究员,博士生导师,水产微生物与饲料创新团队首席,农业农村部饲用生物技术重点实验室主任,国家杰出青年基金项目获得者。
● 在水产领域从业20多年,研究方向为水产动物营养与饲料科学/水产动物消化道微生物学。担任《水生生物学报》编委、《Aquaculture》副主编。主持国家杰出青年科学基金、国家自然科学面上基金、973项目、国际(地区)合作与交流项目等20余项,成果以排名第一曾获第二十一届中国专利优秀奖与大北农科技成果奖一等奖等。获授权发明专利38项(含PCT专利3项),转让10项。发表SCI论文120余篇,收录期刊包括iScience、Gut Microbes、Environmental Microbiology、Journal of Nutrition(系列)等,连续4年荣获爱思唯尔高被引学者榜单。主编专著4部,其中英文专著3部。

丁倩雯(通讯作者)
● 博士,中国农业科学院饲料研究所水产微生物与饲料创新团队,毕业于挪威科技大学生物学专业。
● 研究工作聚焦肠道微生物协同细胞应激调控鱼类肝、肠健康与营养代谢。先后以第一作者、共同一作在iScience、Journal of Nutrition、Aquaculture、Frontiers in Nutrition上发表学术论文7篇,获授权发明专利1项,制定团体标准2项。
更多推荐
(▼ 点击跳转)
iMeta | 引用7000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
2卷2期封底
2卷4期封底

3卷2期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、50万用户的社交媒体宣传等。2022年2月正式创刊发行!目前期刊已经被ESCI、Scopus等数据库收录。
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:office@imeta.science




































 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








