点击蓝字 关注我们
肠道亚油酸介导嗜黏蛋白阿克曼菌在小鼠模型中抗李斯特菌感染

iMeta主页:http://www.imeta.science
研究论文
● 原文链接DOI: https://doi.org/10.1002/imt2.196
● 2024年4月27日,大连工业大学夏效东团队在iMeta在线发表了题为 “Intestinal linoleic acid contributes to the protective effects of Akkermansia muciniphila against Listeria monocytogenes infection in mice” 的研究文章。
● 本研究旨在探讨嗜黏蛋白阿克曼菌对正常饮食小鼠李斯特菌感染的影响,并确定潜在的作用机制。
● 第一作者:金童
● 通讯作者:夏效东(foodscixiaodong@dlpu.edu.cn)
● 合作作者:张莹莹、杨艳鹏、滕跃、闫春红、单忠国、孟江洪
● 主要单位:大连工业大学海洋食品加工与安全控制全国重点实验室、西北农林科技大学食品科学与工程学院、马里兰大学食品科学与营养系
亮 点
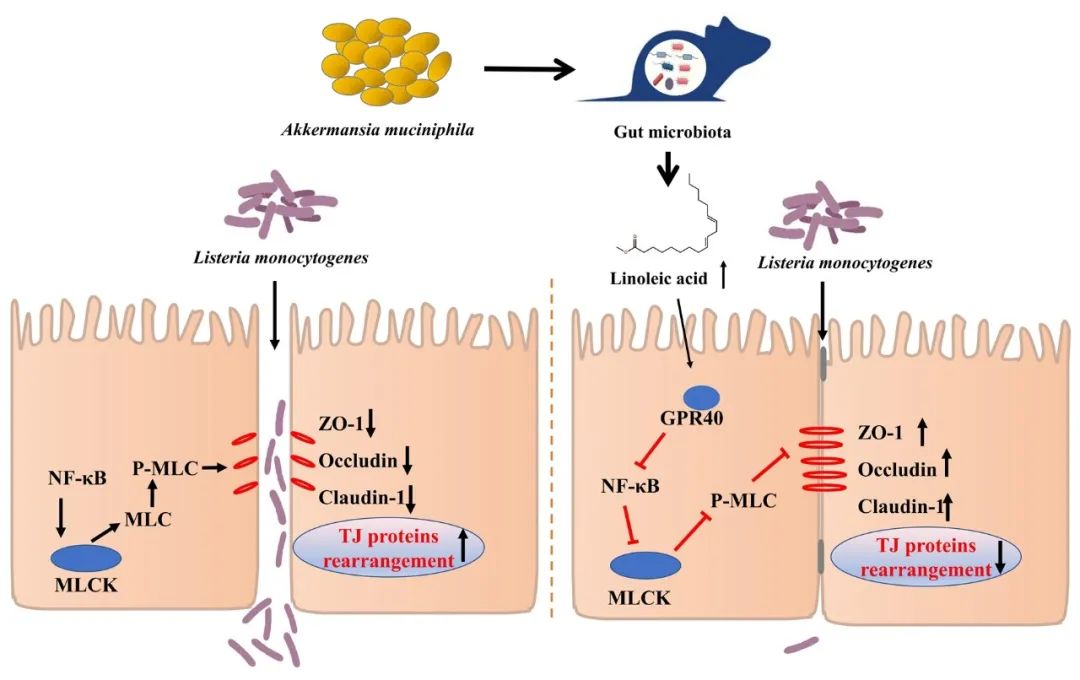
● 嗜黏蛋白阿克曼菌预处理减轻小鼠单增李斯特菌感染;
● 嗜黏蛋白阿克曼菌改善肠道微生物群,并显著提高小鼠肠道亚油酸水平;
● 亚油酸依赖GPR40调节NF-κB/MLCK通路,增强肠道上皮屏障。
视频解读
Bilibili:https://www.bilibili.com/video/BV1cr421u7HT/
Youtube:https://youtu.be/pZ-nljkcQtM
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
单核增生李斯特菌(Listeria monocytogenes)是一种革兰氏阳性细菌,人类感染该菌后可产生一系列症状,包括轻度胃肠炎到严重的全身性疾病如败血症和脑膜炎。该菌的易感人群包括婴儿、孕妇、老年人和免疫功能受损者。李斯特菌在自然界普遍存在,主要通过受污染的食品产品感染人类,因此,该菌是食品工业和公共卫生系统中备受关注的食源性致病菌之一。目前尚缺乏有效的李斯特菌疫苗,病人出现严重的李斯特病感染后通常需要采用抗生素治疗。鉴于系统性李斯特菌感染相对高的死亡率和耐药菌株的不断涌现,探索新的安全有效的预防李斯特病的策略至关重要。
肠道中的共生菌群通过多种机制保护肠道抵抗病原菌感染。它们可以结合肠道细胞上的受体,阻止病原体-上皮细胞相互作用,或通过营养竞争或产生细菌素及其他抗菌物质直接抑制肠道病原体。例如梭菌目(Clostridiales)的共生菌可通过直接抑制病原体生长来提高小鼠对李斯特菌感染的抵抗力。肠道共生菌也可以通过刺激宿主防御系统(如肠粘膜屏障和肠道免疫细胞)来限制感染。例如粪肠球菌(Enterococcus faecium)可通过刺激抗菌肽RegIII的分泌来增强宿主屏障功能,从而限制小鼠中的伤寒沙门氏菌感染。
嗜黏蛋白阿克曼菌(Akkermansia muciniphila)是一种具有广泛应用前景的下一代益生菌。由于其与代谢性疾病(如肥胖症、2型糖尿病和非酒精性脂肪肝病)密切相关,最近引起研究人员的高度关注。尽管其发挥有益功能的确切机制尚未完全阐明,但其很多的功能与该菌影响粘液代谢和肠道屏障功能的能力相关。由于穿越肠道屏障是李斯特菌侵入循环系统并引起全身性感染的重要步骤,因此阐明嗜黏蛋白阿克曼菌是否增强肠道屏障从而增强小鼠能对李斯特菌感染的保护作用具有重要的意义。最近有研究表明活的嗜黏蛋白阿克曼菌能通过调节局部炎症减轻高脂饮食小鼠对李斯特菌的敏感性,但是活的或巴氏灭活的嗜黏蛋白阿克曼菌如何影响正常饮食小鼠的李斯特菌感染以及其具体机制尚未有探讨。因此,本研究旨在探讨嗜黏蛋白阿克曼菌对正常饮食小鼠李斯特菌感染的影响,并确定潜在的作用机制。
结 果
活的嗜黏蛋白阿克曼菌减轻了小鼠李斯特菌感染
为了确定嗜黏蛋白阿克曼菌预处理是否影响小鼠对李斯特菌感染的敏感性,我们分别给小鼠口服活的和巴氏灭活的细菌10天,然后进行感染。结果显示,活的嗜黏蛋白阿克曼菌减轻了李斯特菌感染导致的动物体重减轻,而巴氏灭活的嗜黏蛋白阿克曼菌几乎没有保护作用(图S1)。此外,与L. monocytogenes(Lm)组相比,活的嗜黏蛋白阿克曼菌显著降低了器官(回肠、结肠、肠系膜淋巴结、肝脏、脾脏)和粪便中的李斯特菌负荷(p < 0.01),而巴氏灭活的嗜黏蛋白阿克曼菌没有展现类似的保护效果(p > 0.05)(图1A)。因此,后续试验只关注活的嗜黏蛋白阿克曼菌。
在炎症反应方面,活的嗜黏蛋白阿克曼菌预处理降低李斯特菌诱导的血清IL(白细胞介素)-6和IL-1β水平(图1B)。此外,RT-qPCR(实时定量聚合酶链反应)显示,李斯特菌上调了回肠(图1C)和结肠(图1D)中IL-6、IL-1β的表达,而嗜黏蛋白阿克曼菌显著下调了这些基因的表达(p < 0.05)。嗜黏蛋白阿克曼菌还降低了李斯特菌诱导的回肠和结肠中炎症相关基因(TNF-α、iNOS)的表达。此前有研究表明活的嗜黏蛋白阿克曼菌能通过减轻肠道炎症缓解高脂饮食小鼠对李斯特菌感染的敏感性,而在本研究中,我们系统研究了活的和巴氏灭活的嗜黏蛋白阿克曼菌对正常饮食小鼠的李斯特菌感染的影响,并证明了活的细菌具有有效的保护作用。这两项研究的发现相辅相成,共同表明在不同饮食喂养的小鼠模型中,嗜黏蛋白阿克曼菌可能通过不同作用机制发挥发挥抗李斯特菌感染的作用。
嗜黏蛋白阿克曼菌减轻李斯特菌诱导的肠道上皮屏障功能障碍
由于肠道上皮细胞是对李斯特菌等肠道病原体的第一道防线,我们首先通过检测活的小鼠FITC-葡聚糖(荧光异硫氰酸酯-葡聚糖)的血清浓度来确定小鼠的肠道上皮屏障的完整性。结果显示,李斯特菌感染增加了血清中FITC-葡聚糖的浓度,而活的嗜黏蛋白阿克曼菌预处理显著降低了其水平。通过RT-qPCR评估了回肠和结肠中与肠道屏障相关的基因的转录水平。与对照组相比,李斯特菌降低了回肠中ZO-1(图1E-F)、Occludin和Claudin 1的水平,而嗜黏蛋白阿克曼菌预处理减轻了病原体引起的这些基因的下调(p < 0.05)。这些结果表明,嗜黏蛋白阿克曼菌能通过调节连接蛋白的表达增强小鼠的肠道上皮屏障。
嗜黏蛋白阿克曼菌通过肠道菌群发挥其抗李斯特菌感染的作用
我们通过16S rRNA测序分析了嗜黏蛋白阿克曼菌预处理对李斯特菌感染小鼠肠道菌群的影响,结果显示,与对照组相比,李斯特菌导致小鼠肠道菌群的失调,细菌组成和结构发生变化,而嗜黏蛋白阿克曼菌的预处理显著调节李斯特菌感染小鼠的菌群构型。肠道菌群的组成和相对丰度如图1G所示。在门水平上,与对照小鼠相比,嗜黏蛋白阿克曼菌处理小鼠的肠道中Verrucomicrobia的丰度显著增加,而Firmicutes、Proteobacteria、Epsilonbacteraeota、Lactobacillus和Eubacterium的丰度显著减少(p < 0.05)。然而,李斯特菌感染导致小鼠的Bacteroidetes和Verrucomicrobia的丰度下降,而Firmicutes和Epsilonbacteraeota的丰度显著增加(p < 0.05)。与Lm组相比,AKK+Lm组的Bacteroidetes丰度增加,而Firmicutes和Epsilonbacteraeota的丰度减少(p < 0.05)。
我们接着进行粪便菌群移植(FMT)验证,以确定肠道菌群是否在嗜黏蛋白阿克曼菌预防李斯特菌感染中发挥重要作用。与接受对照组小鼠粪便的小鼠相比,接受AKK组小鼠粪便的小鼠病原菌负载减少,同时肠道上皮屏障功能得到改善(p < 0.01)(图1H-I)。这些数据表明,嗜黏蛋白阿克曼菌预处理可以调节正常饮食小鼠的肠道微生物群,从而提高对李斯特菌感染的抵抗力。

图1. 活的嗜黏蛋白阿克曼菌通过增强肠道上皮屏障和调节肠道菌群缓解小鼠的李斯特菌感染
(A) 小鼠经口灌服活的嗜黏蛋白阿克曼菌(AKK)或灭活的嗜黏蛋白阿克曼菌(HK-AKK)十天,随后经口接种李斯特菌。通过平板计数分析小鼠回肠、结肠、粪便、肠系膜淋巴结(MLNs)、肝脏和脾脏中的李斯特菌(Lm)载量(Lm组和HK-AKK+Lm组各有10只小鼠,AKK+Lm组因打斗损失一只小鼠,有9只小鼠)。(B-D) 嗜黏蛋白阿克曼菌减轻了李斯特菌在小鼠中引起的炎症反应。(B) 小鼠血清中促炎细胞因子IL-6和IL-1β的浓度。(C) 小鼠回肠中炎症相关基因IL-6、IL-1β的相对mRNA水平。(D) 小鼠结肠组织中炎症相关基因IL-6、IL-1β的相对mRNA水平。(E-F) 嗜黏蛋白阿克曼菌改善李斯特菌引起的肠道上皮屏障功能障碍,提高了ZO-1基因在小鼠回肠(E)和结肠(F)中的相对mRNA水平(每组n = 6)。(G) 不同组小鼠粪便菌群在门水平上的相对丰度。(H-I) 嗜黏蛋白阿克曼菌改善后的肠道菌群处理减少小鼠器官和粪便中的李斯特菌负载,并减轻李斯特菌引起的肠道屏障功能障碍(每组n = 10)。数据以平均值和SEM表示。*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001。NS表示无显著差异。
嗜黏蛋白阿克曼菌调节李斯特菌感染小鼠肠道亚油酸水平
我们通过进一步的试验确定某些代谢产物是否介导嗜黏蛋白阿克曼菌的保护作用。首先,对小鼠盲肠内容物进行了非靶向代谢组学分析。主成分分析(PCA)和热图分析能有效区分不同组的样本。如图2A-B所示,亚油酸代谢途径在不同组之前具有显著的差异p < 0.05)。另外,我们通过HPLC-MS测定盲肠内容物中的亚油酸的浓度(图2C)。与对照小鼠相比,李斯特菌感染显著降低肠道亚油酸水平,而嗜黏蛋白阿克曼菌处理组其水平显著升高(p < 0.05)。AKK+Lm组小鼠中的亚油酸水平恢复到几乎与对照组相同的水平。这些数据表明,嗜黏蛋白阿克曼菌补充能有效地增加小鼠肠道中的亚油酸水平。
亚油酸干预能预防小鼠李斯特菌感染,并增强Caco-2细胞屏障
由于亚油酸在AKK处理组中富集,我们进一步探讨亚油酸是否介导了嗜黏蛋白阿克曼菌的保护作用。给予小鼠亚油酸处理显著降低了小鼠中的李斯特菌负载(p < 0.01)(图2D),并减轻李斯特菌肠道上皮屏障的损伤(p < 0.01)(图2E)。
此外我们采用体外Caco-2细胞模型进一步探讨亚油酸对宿主肠道上皮屏障的影响,并解析可能的作用机制。亚油酸预处理降低单增李斯特菌穿越Caco-2细胞屏障(p < 0.05)。跨上皮电阻(TEER)和体外FITC-葡聚糖渗透性试验也表明,亚油酸减轻单增李斯特菌诱导的屏障功能损伤。这些结果表明亚油酸可能通过增强肠道上皮屏障来缓解单增李斯特菌感染。
亚油酸以GPR40依赖的方式发挥其保护作用
我们接下来试图阐明亚油酸如何与上皮细胞相互作用以增强上皮屏障功能。之前有报道表明亚油酸是G蛋白偶联受体40(GPR40)受体的内源性激动剂,我们猜想亚油酸是否能通过激活GPR40途径增强肠道上皮屏障。如图2F-H和S5D所示,尽管李斯特菌并未改变GPR40的表达,但亚油酸处理显著激活Caco-2细胞中的GPR40(p < 0.01)的表达,这与嗜黏蛋白阿克曼菌处理组小鼠回肠和结肠中GPR40转录表达增加的结果一致(图2G-H)。GPR40抑制剂(DC260126)的加入削弱了亚油酸对李斯特菌诱导的Caco-2细胞屏障损伤的保护作用,具体表现为穿越屏障的细菌的数量和屏障功能均未得到改善。亚油酸处理增强了Caco-2细胞的屏障功能,并抑制李斯特菌诱导的炎症相关基因的表达。此外,亚油酸并未减少李斯特菌诱导的Caco-2细胞凋亡水平,表明亚油酸可能不是通过抑制肠上皮细胞凋亡来改善屏障功能。与体外结果一致,DC260126也消除了亚油酸对小鼠李斯特菌感染的保护作用(图2I-J)。已有研究报道,李斯特菌可以通过激活NF-κB和肌球蛋白轻链激酶(MLCK)诱导肠道屏障功能障碍,导致连接蛋白的细胞内重分布和细菌易位。亚油酸减轻了Caco-2细胞中因李斯特菌感染引起的ZO-1、Occludin、Claudin-1和IκBα的减少。亚油酸还抑制了MLCK的激活和MLC的磷酸化。免疫荧光染色显示,亚油酸下调了NF-κB p65的核转移,并减轻了李斯特菌诱导的连接蛋白的异常分布。然而,这些亚油酸诱导的保护作用在加入DC260126后均消失。这些数据表明,亚油酸至少部分通过GPR40通路来发挥其抗感染和增强屏障的功能。
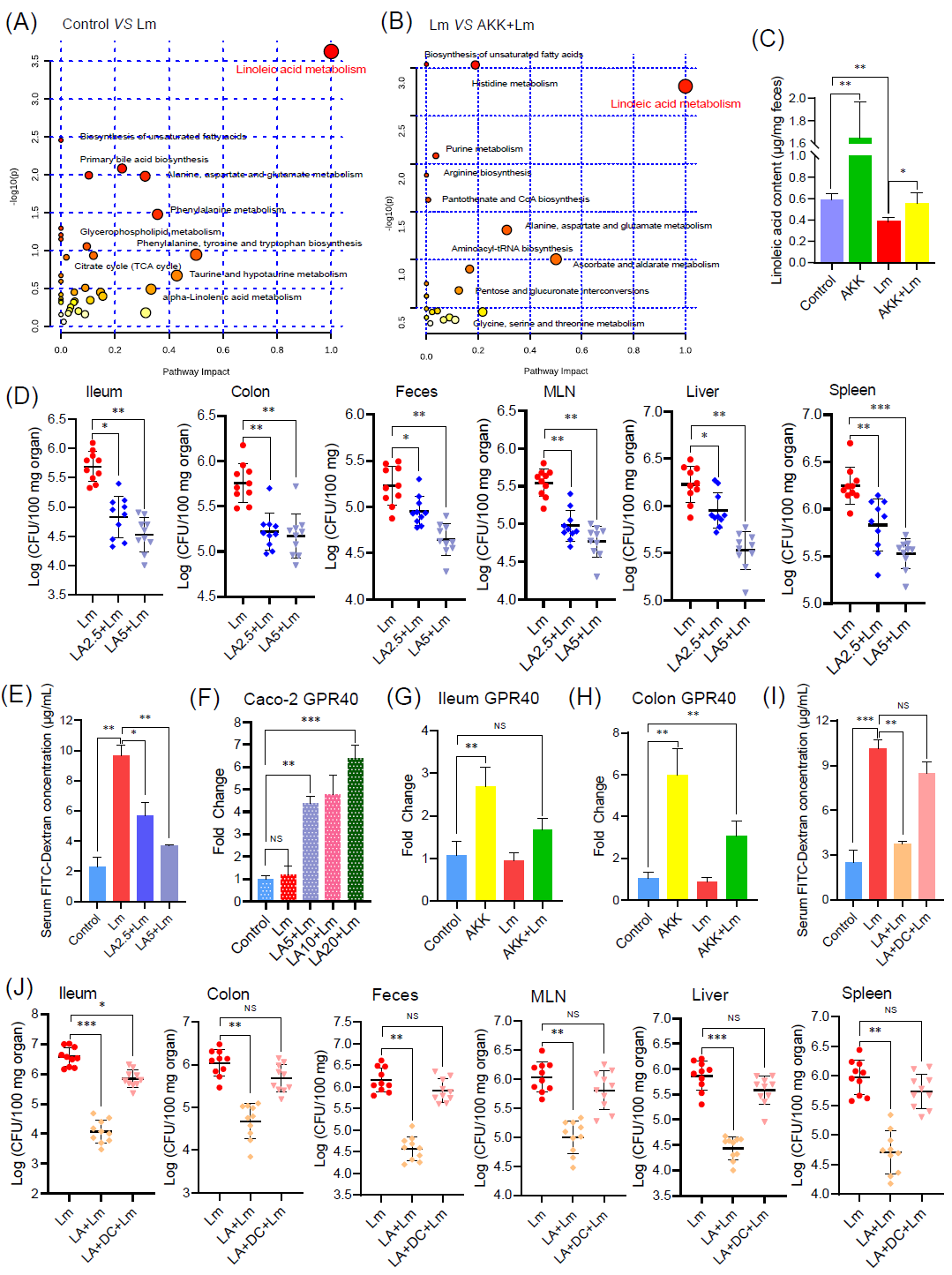
图2. 肠道代谢物亚油酸(LA)通过GPR40依赖的方式增强上皮屏障,减轻李斯特菌感染
代谢组学分析不同组之间代谢物的通路(A:对照组&Lm组,B:Lm组和AKK+Lm组)。(C)不同组小鼠粪便样本中亚油酸(LA)的定量测量(每组n = 5)。(D)亚油酸(5 g/kg或2.5 g/kg)降低小鼠器官和粪便样本中的李斯特菌负载。(E)通过血清中FITC-葡聚糖的浓度评估亚油酸处理的小鼠肠道上皮屏障的通透性。(F)亚油酸增加L. monocytogenes感染后的 Caco-2细胞中GPR40的相对mRNA水平。(G-H)嗜黏蛋白阿克曼菌增加小鼠回肠(G)和结肠(H)中GPR40的mRNA水平。(I-J)小鼠经亚油酸(5 g/kg)和GPR40抑制剂(DC260126,DC)(20 mg/kg)处理后,检测器官及粪便中李斯特菌的负载量(J)和血清中FITC-葡聚糖的浓度(I)(每组n = 10)。*p < 0.05,**p < 0.01,***p < 0.001。NS表示无显著差异。
结 论
总之,本研究阐明嗜黏蛋白阿克曼菌能提高小鼠肠道中的亚油酸水平,而亚油酸可通过GPR40途径增强肠道屏障功能,从而促进小鼠抵抗单增李斯特菌感染。本项工作揭示了一条嗜黏蛋白阿克曼菌增强肠道屏障的新的途径,并为将来开发基于嗜黏蛋白阿克曼菌或亚油酸的抗单增李斯特菌感染的策略奠定基础。
方 法
菌株及其培养条件
在本研究中使用的单增李斯特菌(10403S InlAm)菌株在37°C下在脑心浸液(BHI)培养基中过夜生长,并在pH 7.4的PBS中重悬。嗜黏蛋白阿克曼菌(ATCC BAA 835)在含有来自猪粘蛋白(Sigma-Aldrich)(0.5%)和L-半胱氨酸(Sigma-Aldrich)(0.03%)的BHI培养基中,在37°C的厌氧室中培养48小时后,在pH 7.4的厌氧PBS中制成悬液。
小鼠模型
特定病原体无菌(SPF)的雄性C57/BL6小鼠(6周龄)从西安交通大学购得(SCXK 2013-003)。小鼠用灭菌的饮食和水饲养,并置于适宜的饲养环境中(21–23°C,30–70%湿度,12/12小时的光/暗循环)。动物实验的操作获得大连工业大学动物伦理委员会批准(DLPU2022082)。在适应环境一周后,小鼠被随机分成六组(每组10只小鼠),分别是:(1)对照组,(2)Lm组,(3)AKK组,(4)AKK+Lm组,(5)(热杀)HK-AKK组以及(6)HK-AKK+Lm组。从第1天到第10天,对照组和Lm组的小鼠通过口服给予PBS。AKK组和AKK+Lm组的小鼠经口服给予2×108 cfu活的嗜黏蛋白阿克曼菌。HK-AKK组和HK-AKK+Lm组的小鼠经口服给予巴氏灭活的嗜黏蛋白阿克曼菌(嗜黏蛋白阿克曼菌悬液在70°C加热30分钟)。在第11天,Lm组、AKK+Lm组和HK-AKK+Lm组的小鼠经口服给予2×109 cfu单剂量的单增李斯特菌,并进行为期3天的监测,对照组的小鼠给予PBS。AKK组和HK-AKK组的小鼠在第11天无感染时处死,对照组、Lm组、AKK+Lm组和HK-AKK+Lm组的小鼠在第14天处死。
小鼠肠道通透性试验
为评估肠道通透性,小鼠经口服4 kDa FITC-Dextran(FD4,Sigma-Aldrich)。经过4小时后,小鼠被麻醉,采集血液并分离血清。使用多模式微孔板读取器(Spark)在485/528 nm(激发/发射)处测量血清的荧光强度。通过标准曲线计算血清中FITC-Dextran的浓度。
小鼠器官菌体定植量检测
无菌收集小鼠组织(回肠、结肠、肠淋巴结、肝脏和脾脏)和粪便,置于含有1% Triton X-100(1:10,w/v)的冷PBS中均质。连续稀释,并在37°C孵育24小时后接种于李斯特菌染色培养基平板上,以确定菌落总数(cfu)。
小鼠炎症反应检测
使用酶联免疫吸附法(ELISA) 收集小鼠血清并按照ELISA试剂盒方案分析测量白细胞介素IL-6和IL-1β的水平。
RNA提取和实时定量聚合酶链反应(RT-qPCR)
使用SteadyPure通用RNA提取试剂盒II AG21022(Accurate Biotechnology)从结肠、回肠、肝脏和脾脏或Caco-2细胞中提取总RNA,使用Evo M-MLV RT Premix for qPCR(AG11706,Accurate Biotechnology)按照说明将其逆转录为cDNA。使用SYBR® Green Premix qPCR试剂盒(AG11701,Accurate Biotechnology)在Bio-Rad iQ5 PCR系统(Bio-Rad)上进行定量实时PCR。RT-PCR的引物序列见表S1,使用GAPDH作为内参基因。所有反应均进行45个循环,并通过Ct值分析相对mRNA水平。
微生物基因组DNA提取和16S rRNA基因测序
从小鼠盲肠内容物样本(50 mg)中提取微生物基因组DNA,使用PureLinkTM微生物DNA纯化试剂盒(Thermo Fisher Scientific)。使用引物338 F(5ʹ-ACTCCTACGGGAGGCAGCAG-3ʹ)和806 R(5ʹ-GGACTACHVGGGTWTCTAAT-3ʹ)通过PCR扩增每个样本中细菌16S rRNA基因的V3-V4区域。纯化的V3-V4扩增子文库以等摩尔量混合,并在Illumina MiSeq平台上进行成对末端测序(2 × 300)。使用Prinseqlite v.0.20.4过滤原始读取,删除平均质量分数低于20的序列(长度小于300 bp或未修剪的序列)。使用PEAR(v.0.9.10)程序重叠处理成对末端读取。通过Usearch(版本7.0)将预处理序列分配到操作分类单元(OTUs),相似度阈值为97%。基于主坐标分析(PCoA)计算β-多样性,以确定样本之间的微生物差异。β-多样性的统计分析使用vegan R软件包函数Adonis进行,其默认值为999次排列(https://cran.r-project.org/web/packages/vegan/index.html)。计算微生物群落的丰度,以确定各处理的平均比例之间的差异。使用线性判别分析效果大小(LEfSe)分析确定组间相对丰度分类的显著性。
非靶向代谢组学
杭州联川生物进行基于气相色谱-质谱联用(GC-MS)的盲肠内容物代谢组学分析。样品上清液转移到含有内标的GC瓶中,在轻柔氮气流下干燥,并与吡啶中的盐酸甲氧基胺混合。经过充分涡旋后,将产生的混合物在37°C下孵育90分钟,并添加含有1% TMCS的BSTFA进行衍生化。使用安捷伦技术的Agilent 7890A气相色谱系统与Agilent 5975C惰性MSD系统对样品进行分析。衍生物通过使用HP-5MS熔融二氧化硅毛细管柱分离。氦气作为载气通过柱子以恒定流速进行分离。样品以随机顺序进行分析,并根据m/z值和标准化迁移时间对峰进行对齐。通过对内标进行归一化,计算峰面积,并通过根据m/z值和标准化迁移时间进行数据库搜索来确定代谢物。差异代谢物通过综合考虑PLS-DA模型的变量重要性(VIP)值(>1)和两侧学生t检验的p值(<0.05)对归一化峰强度进行确定。使用MetaboAnalyst 5.0进行差异代谢物的结构鉴定,包括保留时间和质谱图、安捷伦Fiehn GC/MS代谢组学RTL库和代谢组数据库。
亚油酸定量检测
采用液相色谱法(LC)对粪便中的亚油酸水平进行定量测量。小鼠粪便样品按照先前描述的顺序通过水和乙腈进行溶剂提取。使用Shimadzu LC-30AVP系统(Shimadzu)进行分析。色谱分离采用Zorbax SB-C18柱(4.6 mm × 50 mm,1.8 μm,Agilent Technologies),温度为30°C,流速为0.3 mL/min,注射体积为6 μL。移动相A由水中的0.1%(v/v)甲酸组成。移动相B由乙腈中的0.1%(v/v)甲酸组成。二元泵的梯度洗脱为:最初0-2分钟线性梯度40-45% B;2-30分钟线性梯度45-85% B;30-35分钟85% B;35-36分钟线性梯度85-95% B;36-37分钟线性梯度95-40% B,然后在下一次注射前37-40分钟保持40% B。MS检测使用AB Sciex的API 5500 Qtrap三重四极质谱仪进行。检测在正负电离模式下进行多反应监测(MRM)。离子源参数如下:离子喷雾电压为-4500 V,离子源温度为600°C,帘气(氮气)为25 psi,离子源气体1为45 psi,离子源气体2为40 psi。Analyst软件1.6.1(AB Sciex)用于定性和定量分析。
粪菌移植验证(FMT)
小鼠连续21天口服ANVM抗生素混合物(1 g/L氨苄青霉素,0.5 g/L万古霉素,1 g/L新霉素,1 g/L甲硝唑溶于饮用水中)(Abmole Bioscience)。从供体小鼠收集新鲜的粪便,并在无菌PBS中均质化。通过口服灌胃(每个小鼠受体200 μL)给予受体小鼠粪便悬浮液,持续10天。在感染单增李斯特菌3天后,检测小鼠器官中的李斯特菌定植量和小鼠的肠上皮屏障通透性。
亚油酸对细胞渗透性的影响测定
采用Transwell插入物进行Caco-2细胞渗透性测定。将Caco-2细胞种植在24孔Transwell插入物的上层室(孔径大小为3.0 μm的聚碳酸酯滤膜),持续培养21天,直到单层细胞密度达到紧密连接结构。细胞用一系列浓度的亚油酸(20、10、5、2.5 μg/mL)处理24小时。然后,将单增李斯特菌悬浮液(2×107 cfu,500 μL)加入上层室,向基底室加入新鲜的无FBS DMEM(800 µL)。孵育3小时后,基底室中的侵袭性单增李斯特菌通过LB平板计数。使用MillicellR ERS-2仪器测量跨上皮电阻(TEER)值。在Transwell插入物的上层室中加入FD4(1 mg/mL)分析FD4通量。孵育4小时后,收集基底室中的培养基,使用多模式微孔板读取器(Spark)测量荧光(Ex: 485 nm;Em: 520 nm)。
RT-qPCR
Caco-2细胞经相同于Western blotting的处理方法处理亚油酸并感染李斯特菌。随后,根据SteadyPure通用RNA提取试剂盒II AG21022(Accurate Biotechnology)的操作说明从Caco-2细胞中提取总RNA。按照先前所述方法进行定量实时PCR,检测G蛋白偶联受体40(GPR40)、肿瘤坏死因子1(TNFR1)和肿瘤坏死因子2(TNFR2)的相对mRNA水平(RT-PCR的引物序列见表S1)。
亚油酸对于单增李斯特菌感染小鼠的干预
小鼠接受亚油酸(Sigma)预处理(2.5 g/kg和5 g/kg体重)10天,然后依据先前描述的方法感染单增李斯特菌。感染后3天,检测小鼠器官中的病原体载量和肠上皮屏障通透性。为验证GPR40在介导亚油酸的保护中的作用,小鼠经口灌胃亚油酸(Sigma)预处理(剂量为5 g/kg体重)10天,按照先前描述的方法感染单增李斯特菌。在给予亚油酸前,将DC260126(20 mg/kg)通过腹腔注射到小鼠体内。感染后3天,对小鼠器官中的病原体负载和肠上皮屏障通透性进行检测。
亚油酸对体外肠上皮屏障的保护作用及GPR40通路的作用
作为GPR40激活的评价指标,采用荧光方法评估细胞内Ca2+水平。Caco-2细胞单层培养于6孔板中,经DC260126和亚油酸处理后,感染单增李斯特菌,随后使用Fluo-3 AM(Beyotime)染色以及Hoechst 33342染色处理单层培养物。使用荧光显微镜观察细胞内Ca2+活性。为验证GPR40信号通路的激活是否对亚油酸在李斯特菌感染中的保护作用有所贡献,使用GPR40抑制剂DC260126(25 μM)进行验证。在进行DC260126处理后,对Caco-2细胞的紧密连接模型感染单增李斯特菌,如前所述检测细菌转位、TEER和FD4通量。此外,使用Annexin V-FITC凋亡检测试剂盒(C1062)检测Caco-2细胞凋亡水平,并使用流式细胞术(CytoFLEX)进行测量。
Western blotting和免疫荧光
采用含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液(Beyotime)提取经过不同处理的细胞中的蛋白质。取相等数量(30 mg)的蛋白样品进行10-15%的SDS-聚丙烯酰胺凝胶电泳分离,转移到0.45 μm的硝酸纤维素膜上。在TBST中5% BSA阻断后,将膜与一抗在4°C过夜孵育。随后,用TBST三次洗膜,并在室温下用辣根过氧化物酶结合的二抗孵育90分钟。最后,用TBST洗膜后,使用ECL试剂(Solarbio)处理,用ChemiDoc XRS系统(Bio-Rad)捕获和分析带。
通过免疫荧光染色分析检测Claudin-1、Occludin和NF-κB p65的细胞分布。将Caco-2细胞在24孔板中的圆形玻璃爬片上进行培养,细胞形成紧密连接单层结构后,经亚油酸和/或DC260126处理并感染李斯特菌,采用与Western Blot相同的方法。感染4小时后,单层培养物固定并按照说明书用缓冲试剂盒(Beyotime)进行阻断。在4°C过夜孵育后,使用1:100稀释的一抗,室温下使用1:500稀释的Cy-3标记的二抗孵育1小时。用PBS洗净载玻片上的样品,并用带有DAPI的抗荧光淬灭试剂制备显微镜载玻片。使用荧光显微镜(Leica DMi8,德国)获取Caco-2单层中紧密连接蛋白表达和分布的图像。
统计分析
使用SPSS软件(版本22.0;SPSS,Inc.,芝加哥,伊利诺伊州)进行统计分析。数据以平均值±标准误差(SEM)的形式呈现。采用单因素方差分析(ANOVA)进行多组间的差异分析,随后进行Tukey的多重比较检验。p值小于0.05被视为统计学上显著差异。
代码和数据可用性声明
本研究生成的原始测序数据已存储在国家生物技术信息中心(NCBI)序列读取存档(SRA)数据库中,存取编号为BioProject PRJNA867493。补充资料(方法、图表、表格、脚本、图形摘要、幻灯片、视频、中文翻译版本和更新材料)可在在线DOI或iMeta Science网站http://www.imeta.science/找到。所有的补充材料(文本、图、表、中文翻译版本或视频)也可从线上获取。
引文格式:
Tong Jin, Yingying Zhang, Yanpeng Yang, Yue Teng, Chunhong Yan, Zhongguo Shan, Jianghong Meng, Xiaodong Xia. 2024. Intestinal linoleic acid contributes to the protective effects of Akkermansia muciniphila against Listeria monocytogenes infection in mice. iMeta 3, e196. DOI: 10.1002/imt2.196
作者简介

金童(第一作者)
● 大连工业大学与西北农林科技大学联合培养博士研究生。
● 主要研究方向为食源性致病菌与宿主相互作用及机制,相关学术成果已发表于iMeta、Food Microbiology、Food & Function、Frontiers in Microbiology等期刊。

夏效东(通讯作者)
● 大连工业大学教授,博士生导师。
● 研究方向为食品微生物特性及控制技术、食品肠道菌群互作与健康。已在iMeta、Cancer Research、Journal of Advanced Research、Food Hydrocolloids等期刊发表学术论文100余篇,主持国家自然科学基金、国家科技支撑计划课题等。
更多推荐
(▼ 点击跳转)
iMeta | 引用7000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
2卷2期封底
2卷4期封底
3卷2期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、50万用户的社交媒体宣传等。2022年2月正式创刊发行!目前期刊已经被ESCI、Scopus等数据库收录。
联系我们
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science







































 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








