点击蓝字 关注我们
肠道菌群靶向纳米药物治疗结直肠癌的挑战与机遇

iMeta主页:http://www.imeta.science
综 述
● 原文链接DOI: https://doi.org/10.1002/imt2.213
● 2024年6月10日,首都医科大学陈汉清团队在iMeta在线发表了题为 “The challenge and opportunity of gut microbiota-targeted nanomedicine for colorectal cancer therapy” 的文章。
● 本研究表明,通过应用纳米医学手段,靶向递送和刺激响应的药物释放,可以开创肠道微生物群调节的新时代,旨在实现精确的微生物群编辑和结直肠癌治。
● 第一作者:魏耀华、沈峰、宋慧东、赵瑞芳
● 通讯作者:陈汉清(chenhq@ccmu.edu.cn)
● 合作作者:丰伟悦、潘越、李晓波、余焕玲、Giuseppe Familiari、Michela Relucenti、 Michael Aschner、石汉平、陈瑞、聂广军
● 主要单位:首都医科大学公共卫生学院、国家纳米科学中心、上海交通大学医学院附属新华医院、广州市第十二人民医院
亮 点
● 肠道微生物群是结直肠癌微环境的一个重要组成部分,与结直肠癌的发生、进展和治疗结果密切相关;
● 我们回顾了利用纳米技术调节肠道微生物群的最新进展,并讨论了其设计策略和机制;
● 对于未来的纳米药物设计,我们提出了CRC治疗中个性化纳米药物应遵循的5I原则。
摘 要
结直肠癌(CRC)是第三大最常见的恶性肿瘤,由于其复发和转移,已成为临床上极具挑战的疾病,同时也是全球癌症相关死亡的第二大原因。肠道微生物群,尤其是病原微生物及其代谢物,是肿瘤微环境的重要组成部分。最新研究表明,肠道微生物群与结直肠癌的发生和发展密切相关。因此,迫切需要开发针对结直肠癌的新型病生理学导向的肠道微生物群靶向疗法,以精确清除致癌致病菌或促进益生菌的肠道定植。在本文中,我们表明目前传统药物用于肠道微生物群调节面临多重挑战,如肠道部位的渗透、益生菌的定植、肿瘤细胞的靶向和免疫效应的产生等。通过应用纳米医学手段,靶向递送和刺激响应的药物释放,可以开创肠道微生物群调节的新时代,旨在实现精确的微生物群编辑和结直肠癌治疗。
视频解读
Bilibili:https://www.bilibili.com/video/BV1a7421R7Qo/
Youtube:https://youtu.be/royVx5bPiMg
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
结直肠癌 (CRC) 是全球第三大最常见的恶性肿瘤,并且由于其高复发率和转移性,已成为临床上的一大挑战。CRC也是全球癌症相关死亡的第二大原因。近期研究表明,肠道微生物群,特别是致病菌及其代谢产物,构成了肿瘤微环境的重要组成部分,并与CRC的发生和进展密切相关。尽管个体之间的肠道微生物多样性存在显著差异,但对CRC宏基因组的大规模多队列分析显示,具有致癌功能的特定微生物群在患病人群中一致富集,表明微生物群在肿瘤进展中具有重要作用。例如,常见的肠粘膜相关病原菌的异常增殖与炎症性肠病 (IBD) 的进展及CRC的发生密切相关。此外,特定微生物群的过度增殖也可能削弱传统治疗效果并促进肿瘤的发生。例如,致瘤菌具核梭杆菌 (Fusobacterium nucleatum, Fn) 在健康人的下消化道中很少发现,但在CRC患者中却常常富集。其存在不仅促进了CRC患者对奥沙利铂和5-氟尿嘧啶 (5-FU) 的化疗耐药性,还与患者的预后不良相关。除了其致瘤的致病功能外,一些临床前和临床研究还强调,肠道微生物群及其代谢产物在提高CRC患者对化疗、放疗和免疫治疗的抗肿瘤反应和治疗效果中起着关键作用。最近的临床前研究表明,通过口服给予肠道共生菌(如拟杆菌目、双歧杆菌和阿克曼氏菌)调节肠道微生物群,可以增强一线化疗的效果,并提高CTLA-4或PD-L1介导的CRC免疫治疗效果。因此,通过抗生素、粪便微生物移植 (FMT)、益生菌、益生元和饮食调整来调节肠道微生物群及其代谢产物,成为抑制结直肠癌发生和提高CRC治疗效果的有前景的方法。FMT是通过逆转肠道微生物失调和改善肠道炎症,以提高癌症免疫反应和抗癌治疗效果的最直接方法。益生菌和/或益生元的补充可以抑制肠道肿瘤的发展,并增强CRC患者对化疗和免疫治疗的反应。肠道微生物群通过调节特定细菌来源的短链脂肪酸 (SCFA) 对肠道微环境的变化作出反应。SCFA指导的调节在小鼠和人类CRC模型中增强了抗癌反应和效果。然而,目前用于治疗CRC的肠道微生物群调节方法无法特别操纵肿瘤内微生物群以增强抗肿瘤效果。单独的抗生素治疗缺乏对肿瘤和细胞内的靶向性,限制了它们对肿瘤相关细菌的有效性。同时,肠道解剖生理的复杂性和多重物理屏障阻碍了通过传统手段精确调控微生物群。纳米技术在过去的几十年中显著改变了CRC治疗的格局。因此,迫切需要开发新的病理生理学导向的肠道微生物群靶向疗法,以精确去除致癌病原菌或促进有益物种的肠道定植。
针对CRC治疗的肠道微生物群靶向纳米药物
纳米药物递送系统的优势在于能够解决药物溶解性差和易受恶劣化学或生物条件(如胃酸pH值和肠道酶)影响的问题,并且能够增强肿瘤靶向积累,减少药物的全身暴露。在CRC的进展和治疗过程中,肠道微生物群的多样化功能为科学家精确调控微生物群提供了多种途径,使得通过应用纳米技术将药物载体引导至肿瘤来调控CRC中的肠道微生物群成为可能。这些新兴的智能纳米载体提供了按需调节肠道微生物群的可行性,如表1所示。针对CRC微生物群的最直接策略是使用纳米药物直接干扰肿瘤定植或肿瘤内微生物群。具核梭杆菌 (Fn) 的膜蛋白Fap-2与结直肠肿瘤细胞上高表达的D-半乳糖-β-(1-3)-N-乙酰-D-半乳糖胺 (Gal-GalNAc) 之间的强烈相互作用促进了Fn在肿瘤的定植,并显著降低了免疫检查点抑制剂(ICB)的效果,这在临床样本和动物模型中均有证明。Dong等人将银纳米粒子 (AgNP) 装配在M13噬菌体上 (M13@Ag),以精确清除Fn并重塑肿瘤免疫微环境。口服或静脉注射叠氮修饰的噬菌体纳米颗粒可显著抵消Fn引起的化疗耐药性,并增强小鼠CRC模型中亚叶酸-5-FU-伊立替康化疗的活性。最近有报告称,一种独特的Fn谱系Fna C2主导了CRC的进展。因此,采用Fna C2膜构建的纳米药物可以实现靶向微生物消除而不影响肠道生态。除了Fn外,其他如产肠毒素脆弱拟杆菌 (ETBF) 也在CRC患者中被发现,并与较差的预后相关。因此,未来的纳米药物应设计成消除广泛的致瘤病原体,而不是仅靶向单个菌种。Jiang等人提出了一种纳米催化肿瘤免疫治疗方法,通过选择性分解肿瘤相关细菌 (TAB) 触发原位先天免疫,协同增强治疗效果。与抗生素不同,这种方法在交变磁场诱导的热疗下,通过纳米催化产生原位的芬顿反应生成细胞毒性羟基自由基。尽管可以使用噬菌体或细菌膜材料实现特定的Fn靶向,但几乎没有发现任何CRC相关细菌的靶向配体。因此,纳米药物在精确调节CRC相关微生物群方面的主要挑战是实现细菌靶向药物(如抗生素)的高效递送,或在纳米颗粒上修饰新发现的细菌靶向配体以进行靶向递送。
除了肿瘤定植细菌外,越来越多的证据表明肿瘤细胞内存在微生物群,通过介导肿瘤免疫逃逸和激活肿瘤微环境(TME)中的免疫抑制通路来破坏免疫监视。因此,将化疗药物与抗生素结合是一种新型的疗法,旨在清除肿瘤细胞和细胞内的微生物。Gao等人通过结合甲硝唑(MTZ)和氟尿嘧啶(5-FU)合成了一种两亲性小分子,其在高水平谷胱甘肽(GSH)浓度时可响应裂解,同时释放化疗药物和抗生素。类似的,Chen等人开发了一种含有MTZ和5-FU的AB-Gel,通过肠灌注抑制肿瘤细胞的原位生长。通过CRC相关微生物群调节和致病菌Fn的清除,可以提高化疗效果,有效抑制原位小鼠模型中的CRC生长和转移。最近的研究提出,瘤内微生物的存在提供了新的肿瘤抗原。选择性杀死肿瘤内的这些细菌可能暴露微生物表位,可以作为癌症相关新抗原的替代来源。Wang等人设计了包含抗生素银-甲硝唑复合物 (LipoAgTNZ) 的脂质体,以消除原发性肿瘤和肝转移中的肿瘤相关细菌,同时保持肠道微生物群的稳定。在两种感染Fn的CRC模型中,接受LipoAgTNZ治疗的小鼠展示出超过70%的长期生存率。此外,抗生素治疗产生的微生物新抗原激活了抗肿瘤CD8+ T细胞,使其能够识别感染的和未感染的肿瘤。总之,无论是针对细胞内还是肿瘤微环境中的微生物的纳米抗生素,均利用了纳米颗粒的优势,如增强的稳定性、靶向能力和改善的生物利用度,以提升CRC的治疗效果。同时,纳米材料可作为有前景的抗菌材料,通过与人类肠道细菌的直接相互作用治疗肠道失调相关疾病,包括IBD和CRC。这些最新发现也为按需靶向微生物消除铺平了道路,因其响应性。
最近发现,通过调节肠道粘膜免疫屏障和致病生理结构,纳米技术可以提高针对异常增生病原菌的药物递送效率。肠道屏障在维持肠道稳态和宿主健康中起着重要作用。Liu等人设计了包裹在仿生膜中的自热泳纳米颗粒 (CTPB),该体系可以精确定位于CRC的肠段。在近红外激光照射下,CTPB的肠粘液穿透效率提升2.7倍,并同时减少3.5倍的致病菌拦截,显著提高了原位CRC小鼠中的药物递送效率。此外,除了消除致瘤微生物群,可以定植于CRC肿瘤的生物工程益生菌也为CRC的治疗提供了新的策略。益生菌菌株已证明其安全性,并在临床前模型和人类试验中作为癌症的生物治疗剂进行了研究。然而,当前的益生菌治疗在肿瘤特异性、独特肿瘤微环境、药物渗透和剂量可调性方面等扔面临障碍。工程化的肿瘤定植E. coli Nissle 1917专门针对肿瘤靶向粘附蛋白硫酸乙酰肝素蛋白多糖,可以导致>95%的CRC细胞增殖抑制,并在体内减少~50%的CRC荷瘤负担。工程化的乳酸杆菌Pediococcus pentosaceus携带治疗蛋白P8可以改善受损的肠道微生物群,并促进CRC消退。同时,给予的益生元可以丰富特定细菌属及其代谢产物,如SCFAs和环状二腺苷单磷酸(cyclic-di-AMP),分别增强细胞毒性CD8+ T细胞和激活先天免疫。Zheng等人利用宿主-客体相互作用制造了益生元封装的益生菌孢子(孢子-葡聚糖),其中利用了商业化的酪酸梭菌(Clostridium butyricum)和化学修饰的葡聚糖之间的相互作用。口服后,孢子-葡聚糖选择性积累在结肠癌中,在那里葡聚糖被酪酸梭菌发酵,产生抗癌SCFAs。此外,口服给予的卡培他滨负载的益生元木聚糖-硬脂酸纳米颗粒在CRC小鼠模型中将抗肿瘤免疫治疗效果从5.29%显著提高至71.78%,并将生存时间从14天延长至33.5天,通过促进益生菌增殖和SCFA生产。
表 1. 用于调节肠道微生物群以预防和治疗结直肠癌(CRC)的代表性纳米药物

通过个性化纳米药物调节肠道微生物群治疗CRC的展望
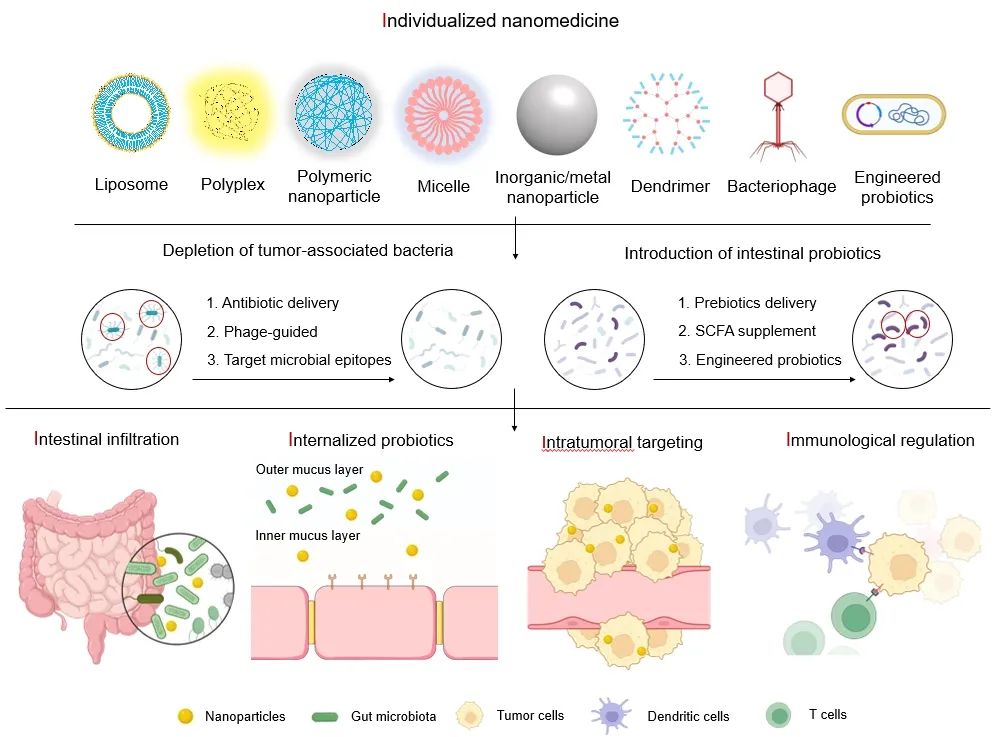
由于纳米技术在通过消除肿瘤相关病原体和引入肠道益生菌来治疗CRC中的潜力。个性化纳米药物在肠道渗透、益生菌内化、肿瘤靶向和免疫调节(5I)等方面的关键挑战需要得到解决(图1)。1. 个性化纳米药物:肿瘤微生物群由肿瘤特异性微生物组成,与CRC进展、化疗和免疫治疗的反应密切相关。因此,靶向肿瘤和肠道微生物群的纳米治疗应个性化。2. 肠道渗透:与传统静脉注射的纳米药物严重依赖于增强渗透和滞留(EPR)效应不同,口服纳米药物通常面临由于胃肠道(GIT)复杂的物理化学和生物屏障而导致的低生物利用度的挑战。因此,未来的口服纳米药物应设计为克服这些屏障并选择性地将药物递送到肿瘤部位。3. 益生菌内化:益生菌治疗在未来是一种安全且有效的CRC预防和治疗策略。通过纳米技术工程化益生菌提供了减少患者CRC发生率和提高生活质量的新策略。4. 肿瘤内靶向:肿瘤相关细菌是CRC患者特有的生态系统,随着饮食、环境、药物和其他因素的变化而动态变化,因此应个性化应用肠道微生物群靶向纳米治疗干预,以靶向和消除肿瘤类型特异性和/或患者特有的微生物群。5. 免疫调节:肠道失调会降低宿主介导的抗癌免疫反应,导致免疫耐药性和临床效果差;肠道微生物群靶向纳米药物通过结合肠道微生物群调节和免疫治疗提供了一种有前途的CRC治疗方法。

图1. 肠道微生物靶向纳米药物在结直肠癌(CRC)治疗中的挑战和机遇
通过消除与肿瘤相关的病原体和诱导肠道益生菌来预防和治疗CRC的未来展望。抗生素递送、噬菌体引导的纳米载体以及病原体表位相互作用可能作为新的策略,用于靶向和对抗CRC治疗中的肿瘤相关细菌。益生元递送、短链脂肪酸(SCFA)补充和工程化益生菌可能提供新的策略,以增强肠道益生菌的定植潜力,并改善CRC的预防和治疗。同时,个性化纳米药物面临的关键挑战,包括肠道渗透、内化益生菌、肿瘤内靶向和免疫调节(5I),需要在肠道微生物群靶向CRC管理中得到解决。因此,纳米药物将引领肠道微生物群调控的新时代,通过靶向递送和刺激响应的药物释放,旨在实现精准的微生物群编辑和随后的CRC治疗。
结 论
如前所述,在应用纳米药物加强CRC治疗中的肠道微生物群调节方面已取得重大进展。消除致病菌,补充益生菌或益生元,或与化疗药物结合,都提供了利用纳米药物在CRC治疗过程中满足多方面需求的可行性。因此,纳米药物将开启肠道微生物群调节的新时代,通过靶向递送和刺激响应的有效载荷释放,旨在实现精确的微生物群编辑和随后的CRC治疗。
引文格式:
Yaohua Wei, Feng Shen, Huidong Song, Ruifang Zhao, Weiyue Feng, Yue Pan, Xiaobo Li, Huanling Yu, Giuseppe Familiari, Michela Relucenti, Michael Aschner, Hanping Shi, Rui Chen, Guangjun Nie, Hanqing Chen. The Challenge and Opportunity of Gut Microbiota-Targeted Nanomedicine for Colorectal Cancer Therapy. iMeta, 2024, 3: e213. https://doi.org/10.1002/imt2.213
作者简介

魏耀华(第一作者)
● 国家纳米科学中心特别研究助理。
● 主要研究方向为肿瘤微环境免疫调控的纳米策略,发表论文21篇,其中以第一作者(含共同)在Advanced Materials、iMeta、Theranostics、Journal of Controlled Release等杂志发表论文8篇。

沈峰(第一作者)
● 上海交通大学医学院附属新华医院消化内科主任医师。
● 担任上海市医学会消化内镜专科分会青年委员会副主任委员,中国医师协会肝病科普专业委员会委员(秘书),中国中西医结合学会胶囊内镜及肠病专家委员会委员,中华医学会消化内镜分会消化道早癌协作组青年委员,上海市医学会内科专科分会青年委员,上海市医学会食管和胃静脉曲张治疗分会青年委员。同时担任《实用肝脏病杂志》编委,曾获上海市科技进步二等奖(2017年)、上海医学科技二等奖(2022年)、天津市科技进步二等奖(2022年)。

宋慧东(第一作者)
● 广州市第十二人民医院消化内科主任医师,广州医科大学硕士研究生导师。
● 目前是广东省医学会肝病学分会、消化内镜学霸分会委员,广州市医学会职业病学分会主任委员,消化病学分会、肝病学分会常务委员,广州市医师协会消化内镜分会副主任委员,广州地区消化疾病质量控制中心专家委员会成员。毕业于中山医科大学, 从事消化内科工作20余年,擅长消化系统疾病的临床、内窥镜、介入的诊治,其中以慢性肝病的诊治为主要研究方向,消化道早癌的综合诊治为专业特长。获广东省中医药局、广州市科技局等级课题多项,在国内外医学杂志发表论文十余篇,曾获广州市科技进步奖。

赵瑞芳(第一作者)
● 国家纳米科学中心副研究员,2017年在国家纳米科学中心参加工作,历任助理研究员、副研究员。
● 研究领域主要包括纳米医学、肿瘤免疫学、纳米生物技术和纳米生物效应等。国家重点研发计划课题负责人(2019-2022),主持及参与多项国家级项目和课题研究工作,入选北京市科技新星计划、中科院创新领域青年团队等。以一作和通讯作者在Science Translational Medicine、Nature Protocols、Nature Communications、Nature Protocol、Advanced Materials、iMeta、Nano Today、ACS Nano、Small、Science Bulletin等发表多篇研究论文,申请和授权多项发明专利,转化1项国际专利、1项中国专利。科技部专家库专家,国家自然科学基金通讯评审专家,并担任Nano Today、Nano Letter 等学术期刊审稿人。

陈汉清(通讯作者)
● 首都医科大学公共卫生学院营养与食品卫生学系,教授,博士生导师。
● 长期从事消化系统疾病的发病机制及精准干预新策略研究,发表论文70余篇,其中以第一或通讯作者在iMeta、Hepatology、ACS Nano、Nano Today等杂志发表论文35篇。主持各项项目11项,入选北京市海外高层次人才青年项目、广州市高层次人才青年后备人才、广州市高层次卫生人才医学骨干人才等。担任《iMeta》执行副主编,《Journal of Clinical and Translational Hepatology》和《广州医药》编委,《iMeta》和《Hepatobiliary & Pancreatic Diseases International》青年编委等。担任中国毒理学会青年委员会常委、中国营养学会营养流行病分会专业委员会委员、中国环境诱变剂学会环境表观遗传学专业委员会委员等。
更多推荐
(▼ 点击跳转)
iMeta | 引用7000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
2卷2期封底
2卷4期封底
3卷2期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、50万用户的社交媒体宣传等。2022年2月正式创刊发行!目前期刊已经被ESCI、PubMed、Scopus等数据库收录。
联系我们
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science






































 1083
1083

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








