点击蓝字 关注我们
综述:用于肝细胞癌治疗的新兴纳米医学策略

综 述
● 原文链接DOI: https://doi.org/10.1002/imo2.12
●2024年7月4日,首都医科大学陈汉清、中国科学院高能物理研究所陈俊团队在iMetaOmics在线联合发表了题为“Emerging nanomedicine strategies for hepatocellular carcinoma therapy”的文章。
● 本综述旨在探讨纳米粒子药物传递系统在肝肿瘤管理中的应用,特别强调配方、针对肝肿瘤的特定靶向策略以及各种药物释放方法。通过提供关于纳米粒子药物传递系统在肝肿瘤治疗领域利用的见解,致力于帮助读者探索其广阔的潜力。
● 第一作者:郭晨、张佳宇
● 通讯作者:陈汉清(chenhq921@163.com, chenhq@ccmu.edu.cn)、陈俊(chenjun@ihep.ac.cn)
● 合作作者:蔡霄梦、窦瑞、唐嘉若、黄政远、王雪婷、郭艳
● 主要单位:华南理工大学、中国科学院高能物理研究所、首都医科大学
亮 点
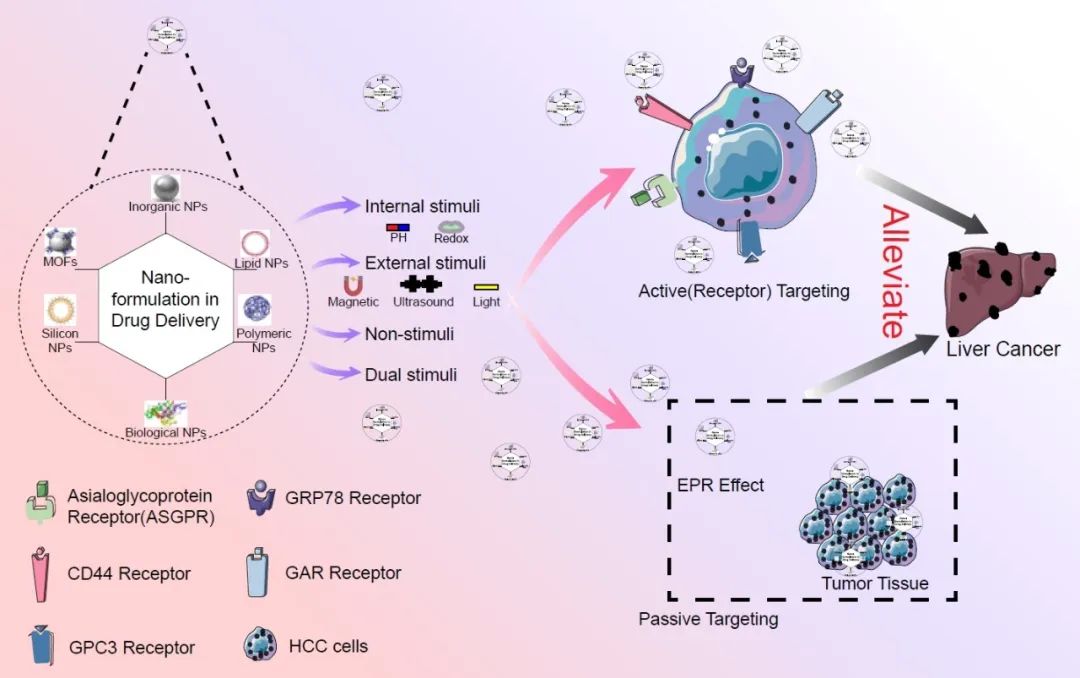
● 全面综述纳米药物递送系统在肝肿瘤治疗中的应用;
● 强调了纳米药物传递系统的制剂以及针对肝肿瘤的特定靶向策略;
● 探讨了各种药物释放方法,旨在为纳米粒子药物传递系统在肝肿瘤治疗中的潜力提供有价值的见解。
摘 要
肝细胞癌(HCC)是一种常见的恶性肿瘤,具有一系列的危险因素,包括病毒感染、酒精性肝病、暴露于真菌毒素、肥胖和2型糖尿病。尽管早期检测和治疗取得了进展,但HCC仍然表现出高复发率,晚期患者预后不佳,癌症转移后的存活率明显较低的情况。因此,迫切需要新的治疗策略。纳米医学具有独特的优势,如靶向给药和对肿瘤微环境内药物释放的响应性。这些系统通过促进多种治疗药物的输送,在HCC治疗中展现出潜力。这份全面综述旨在探讨纳米粒子药物传递系统在肝肿瘤管理中的应用,特别强调配方、针对肝肿瘤的特定靶向策略以及各种药物释放方法。通过提供关于纳米粒子药物传递系统在肝肿瘤治疗领域利用的见解,这份综述致力于帮助读者探索其广阔的潜力。
视频解读
Bilibili:https://www.bilibili.com/video/BV124421U7GZ/
Youtube:https://youtu.be/r1_p2J2tpUU
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/imetaomics/
全文解读
引 言
肝细胞癌(HCC)是一种日益普遍的恶性肿瘤,主要风险因素包括病毒感染、酒精性肝病、真菌毒素、肥胖和2型糖尿病。尽管进行了早期诊断和治疗,该疾病仍然表现出高复发率。对于处于中至晚期的患者,预后更加不利,如果癌症已扩散到附近的淋巴结,仅有5%的5年生存率。当癌症转移至其他器官时,5年生存率进一步降至仅为3%。由于缺乏有效的治疗选择,迫切需要探索新的HCC治疗方法。纳米医学传递系统提供了改进的药代动力学特性、针对肿瘤的传递能力和响应性固定点药物释放等优势。这些特性有助于增强协同抗肿瘤效果,并具有重要的临床应用潜力。纳米药物可以携带各种治疗剂,如用于化疗的小分子、用于基因治疗的DNA或RNA、用于热疗的产热分子或纳米颗粒,以及用于放射治疗的放射性同位素。这种多功能性突显了纳米医学传递系统可以促进的广泛治疗方式。因此,在HCC治疗中利用纳米医学传递系统具有巨大的潜力。在本综述中,我们将讨论纳米医学传递系统在肝肿瘤治疗中的应用。我们将首先简要概述在肝癌治疗中使用的几种制剂,包括基于脂质和基于天然物质的纳米颗粒,这些在近年来越来越受欢迎。接下来,我们将深入探讨使用纳米医学针对肝癌的策略,重点放在主动靶向肝肿瘤表面过度表达的受体上。最后,我们将探讨不同的药物释放方法,包括内部和外部刺激。
结 果
配方/制剂
脂质体纳米颗粒(LNPs)
2018年,美国食品药品监督管理局批准了帕蒂西兰作为首个使用LNP技术传递的核酸药物。此后,LNPs已经成为备受关注的高度有前途的药物传递载体,在该领域引起了相当大的关注。LNPs由四种脂质成分组成,其中离子化脂质负责静电结合核酸。其他三种成分的功能如下:胆固醇稳定纳米粒结构并通过低密度脂蛋白受体介导的内吞作用增强细胞摄取;辅助脂质加速纳米粒在细胞内的结构转化并促进药物释放;聚乙二醇(PEG)脂质增强LNPs的整体稳定性并延长其在血液循环中的持续时间。由于血清中载脂蛋白E(ApoE)的关联,静脉注射的LNPs往往主要在肝脏中积累,因为肝脏主要负责清除结合ApoE的脂蛋白。LNPs的主要功能是保护核酸有效载荷不受降解并促进其传递到细胞质中。在肝癌治疗领域,Yang等人通过开发一种LNP(CAR&Siglec‐GΔITIMs LNP)(图1)取得了重大进展。该LNP使两种类型的信使RNA(mRNA)传递到肝脏巨噬细胞:第一种类型表达特异靶向糖蛋白-3(GPC3)的嵌合抗原受体(CAR),增强巨噬细胞对肝癌细胞的吞噬作用;第二种类型表达不带ITIMs的Siglec-G CAR,克服了“不要吃我”的信号。研究结果表明,CAR&Siglec‐GΔITIMs LNPs表现出优异的生物相容性,能选择性激活巨噬细胞吞噬肝癌细胞。这种方法刺激抗原呈递、细胞因子分泌和免疫抑制性肿瘤微环境(TME)的矫正,最终导致肿瘤内抗肿瘤免疫反应的激活。这些LNPs显著提高了肿瘤清除率和细胞毒性,有效延长了患有肝癌的小鼠的存活时间。其他研究依赖于被动靶向,将编码抗原传递给树突状细胞(DCs),利用它们强大的抗原呈递功能来激活抗肿瘤免疫。例如,Zhang等人提取了源自肝癌细胞(Hepa1-6细胞)的全部RNA。使用薄膜水合方法制备了装载肿瘤RNA的LNPs。在体外和体内环境中,这些LNPs表现出能刺激DC成熟、展示细胞毒作用和施加抗肿瘤活性的能力。这导致了抗肿瘤免疫反应的迅速和强烈激活,有效预防和抑制了HCC的生长。除了传递核酸,LNPs也是化疗药物的理想载体。多柔比星(DOX)是癌症化疗治疗中的重要药物;然而,它具有心毒性,严重限制了其在肿瘤治疗中的使用。将DOX封装在LNPs中有效降低了其毒性并提高了临床给药的安全性。段等人旨在通过开发有针对性的治疗来增强HCC的治疗效果。他们开发了装载了修饰了N-乙酰半乳糖胺(NAcGal)的pH敏感DOX前药并与索拉非尼共同封装的LNPs。研究发现,修饰了NAcGal的LNPs的细胞摄取效率明显高于未修饰的LNPs,而在所有测试样本中,修饰了NAcGal的LNPs显示出最显著的抑制效果。结果表明,LNPs系统表现出显著的协同作用,最佳的肿瘤抑制效果和对整体身体的最小不良影响。

图1. 脂质纳米粒(LNPs)被用于肝细胞癌(HCC)的治疗
载有两种嵌合抗原受体(CAR)信使RNA(mRNA)的LNPs被用于激活治疗肝细胞癌相关的巨噬细胞。GPC3,糖蛋白-3。修改自参考文献7,https://doi.org/10.1016/j.jconrel.2023.07.021。
基于聚合物的纳米颗粒
基于聚合物的纳米颗粒提供了广泛的合成优势,可以精确控制大小、电荷和释放机制等性质。这些纳米颗粒具有多种功能,在各个领域中都有应用。其中一个重要的应用是它们能够在表面修饰配体,实现对肝细胞受体的特异性靶向,并促进肝脏定向输送。这种以肝脏为靶向的方法已经得到广泛采用。在最近的一项研究中,研究人员成功地利用1-Ethyl-3-(3-Dimethylaminopropyl) carbodiimide介导的共轭反应和冻干法合成了硫化聚合物。他们进一步利用溶剂扩散和高压均质化方法制备了纳米颗粒。这些纳米颗粒特异性地载入了从甘草中提取的具有肝细胞靶向性能的亲水生物活性化合物—甘草酸(GA)。此外,已经证明GA具有抗肝细胞瘤活性,使其成为这种双重用途系统的理想成分。该研究展示了纳米复合材料对肝癌细胞的强效细胞毒性。此外,通过对肝组织匀浆的高效液相色谱分析,证实了纳米复合材料的肝靶向能力。这种创新方法在推进肝癌治疗方面显示出巨大潜力,为该领域带来了新的希望。其他研究利用差异表达的酶实现了对HCC的靶向治疗。例如,在最近的一项研究中,研究人员利用聚(β-氨基酯)纳米颗粒将编码突变的单纯疱疹病毒1型胸苷激酶(sr39)的质粒输送到肝癌细胞中。sr39胸苷激酶使抗病毒药物甘氟鸟苷能够杀死癌细胞,并累积9-(4-F-氟-3-羟甲基丁基)鸟苷以进行体内成像。此外,输送至肝细胞的质粒完全不含CpG,使其表达受限于产生α-胎蛋白的HCC细胞。通过这种设计,实现了肿瘤的特异性输送、治疗和成像,为HCC的靶向治疗提供了先进的解决方案(见图2)。

图2. 一种能够识别健康细胞和肝癌细胞的药物输送系统
聚(β-氨基酯)纳米颗粒将含有单纯疱疹病毒1型胸苷激酶(sr39)DNA的无CpG质粒输送到人类HCC细胞中,使得由于肝细胞中α-胎蛋白的表达而实现选择性的癌细胞杀伤。PET,正电子发射断层扫描。修改自参考文献10,https://doi.org/10.1126/sciadv.abo6406。
基于无机物的纳米颗粒(INPs)
INPs是基于无机颗粒的纳米材料。INPs的典型例子包括金属、金属氧化物、碳材料和磁性纳米颗粒。尽管大多数这些纳米颗粒不可生物降解,但它们的优势在于易于控制大小和表面修饰,因此在药物输送系统中具有极高的潜力。金属有机框架材料(MOFs)是一类具有三维多孔结构的快速发展的配位聚合物,代表了一类重要的多孔材料。这些材料具有可调节的孔径和高比表面积,因此非常适用于药物输送系统,因为它们提供了诸如高药物负载能力和易于修饰等显著优势。在Xiao等人之前进行的一项调查中,他们利用掺铁(II)的沸石咪唑酸盐骨架(ZIF‐8)纳米颗粒作为二羟基青蒿素(DHA)的载体,DHA是一种抗肿瘤药物。为了实现对癌细胞的精确输送,研究人员通过将纳米颗粒嵌入癌细胞膜中开发了一种仿生系统。癌细胞膜表面对HCC肿瘤表现出异常的选择性,有助于精确靶向纳米颗粒。一旦进入癌细胞或肿瘤部位的酸性微环境,DHA被触发释放并与铁(II)相互作用,导致产生活性氧化物(ROS)并产生抗癌效果。这种策略展示了超过90%的肿瘤抑制效果。基于MOF纳米颗粒的这种方法展示了通过ROS产生实现靶向药物输送和有效癌症治疗的潜力。Zhang等人引入了RF@LA‐Fe‐MOF,这是一种利用MOF组分的新型基于铁(III)的输送系统。该系统包含肝靶向配体,并容纳两种小分子RSL3和iFSP1。在HCC的背景下,RF@LA‐Fe‐MOF中的铁(III)在由谷胱甘肽(GSH)触发的还原作用下转化为铁(II)。这种还原诱导了铁死亡,并导致RF@LA‐Fe‐MOF的解离,从而释放RSL3和iFSP1,它们分别作为GPX4抑制剂和FSP1抑制剂。同时抑制这两种抑制剂显著增强了HCC中的铁死亡。用RF@LA‐Fe‐MOF治疗经皮下癌症的小鼠导致肿瘤生长延迟和寿命延长。此外,在C5WN1小鼠的体内模型中,RF@LA‐Fe‐MOF显示出对肝肿瘤体积的有效减少和对肺转移的显著抑制。这项研究代表了一项重大突破,因为它利用了含有两种小分子铁死亡促进剂的药物输送系统,以实现对HCC中这一过程的靶向诱导和增强。
硅纳米颗粒(SiNPs)可以通过利用不同的结构引导剂使用溶胶‐凝胶化学原理制备。这使得可以合成具有不同结构和形态的SiNPs,例如具有高比表面积的坚固且热稳定的介孔二氧化硅,以及增强孔渗透性和可访问内部颗粒表面的树枝状纤维型二氧化硅纳米颗粒。此外,它还可以生产中空二氧化硅纳米颗粒,具有低密度、高比表面积和优异吸附性能。Fa等人开发了基于介孔二氧化硅(mSiO2)的核/壳材料。该材料的外壳由载有一种叫做S-硝基-乙酰-DL-青霉胺(SNAP)的氧化亚氮(NO)供体的mSiO2组成。内部核心包括NaYF4:Tm/Yb/Ca@- NaGdF4:Nd/Yb的上转换纳米颗粒(UCNPs)。当UCNPs吸收808 nm的近红外(NIR)辐射时,它们将NIR转化为紫外光,触发SNAP释放NO。通过利用这种机制,观察到了显著的治疗效果。这项研究中mSiO2和UCNPs的融合促进了NO对肝癌细胞的精确输送,导致细胞活力显著降低。这种新颖方法显示了在未来肝癌治疗中的潜力。
基于天然物质的纳米颗粒
细胞外囊泡或外泌体,直径通常在30到200纳米之间,是单层膜囊泡,对于细胞间通讯和物质运输至关重要。它们的一个显著功能是将生物活性成分,如核酸和蛋白质,传递到受体细胞的细胞质中,促进重要物质的交换。由于其高生物相容性、低免疫原性和高效的运输特性,细胞外囊泡引起了人们的极大关注。细胞在正常和病理条件下均会产生细胞外囊泡,突显了它们的广泛来源。这种广泛分布有助于细胞外囊泡的潜在临床应用,它们可作为有价值的诊断生物标志物和治疗工具。细胞外囊泡的多方面特性突显了它们在理解细胞间通讯和探索医疗干预新途径中的重要性。近年来,基于外泌体的药物输送平台取得了显著进展。这些平台已经证明具有携带和修改各种治疗分子(如小分子、核酸和蛋白肽)的能力。这一进展为开发更有效和靶向的药物输送系统带来了巨大希望。例如,Cas9/sgRNA复合物(RNP)具有较大的体积,超出了现有输送载体的负载能力。然而,外泌体以其显著的负载能力提供了强大的解决方案,能够有效地容纳和输送RNP。Wan等人通过电穿孔将基因编辑蛋白RNP加载到肝星状细胞分离的外泌体中,制备了具有肝特异性靶向和基因编辑能力的治疗性外泌体ExosomeRNP;体内实验结果表明,ExosomeRNP可以被选择性富集到小鼠肝脏,并有潜力治疗多种肝病,包括肝细胞癌。在另一项研究中,Zou等人分离了肿瘤细胞来源的外泌体。这些外泌体携带肿瘤相关抗原,可以提高树突状细胞识别肝细胞癌作为疫苗的潜力。为了增强外泌体的免疫原性,研究人员将一种强效的辅助剂,高移动性组蛋白核小体结合蛋白1,附着到外泌体上。这种策略性修改增强了树突状细胞激活T细胞的能力,从而提高了疫苗的效率,并增强了对肝细胞癌的免疫治疗。这项研究的结果表明,外泌体有望通过改善免疫治疗策略来提高治疗效果。血清白蛋白是血液中占主导地位的蛋白质,在维持胶体渗透压和调节血浆pH方面起着至关重要的作用。
血清白蛋白在癌症治疗中具有几个优势。首先,它具有高生物相容性、可降解性、非免疫原性和临床安全性。其次,血清白蛋白的化学结构和构象使其能够与各种药物相互作用,潜在地保护它们免受体内消除和代谢,从而改善它们的药代动力学特性。最后,白蛋白可以与许多疾病组织和细胞上过度表达的受体相互作用,为主动靶向疾病部位提供独特功能,而无需将特定配体添加到纳米载体中。华法林、布洛芬、紫杉醇(PTX)等药物分子可以被包含在血清白蛋白的不同结构域的空腔中,或通过疏水和静电相互作用非共价结合到蛋白质上。这使得它们能够利用血清白蛋白作为载体在体内输送。大多数抗肿瘤药物存在水溶性差、毒性高以及在体内快速降解和代谢的缺点。通过将这些药物载入基于白蛋白的纳米颗粒,可以有效解决水溶性差和致敏性问题。Thao等人进行了一项研究,他们通过将乳糖与牛血清白蛋白(BSA)偶联,合成了Lac‐BSA。他们成功地使用高压均质化制备了装载有阿霉素和紫杉醇的DOX/Pac Lac‐BSA纳米颗粒,这些纳米颗粒不仅在HepG2细胞中展示了DOX和PTX的协同细胞毒效应,而且在小鼠体内表现出增强的肝定位。基于这些发现,研究人员建议,乳糖修饰的基于白蛋白的纳米颗粒有潜力作为肝细胞癌治疗的治疗载体,利用肝细胞靶向来实现有效的治疗效果。在吴等人的一项研究中,甘草酸与人血清白蛋白结合,并利用高压均质化乳化将白蛋白内封装白藜芦醇形成纳米颗粒。这些纳米颗粒被称为甘草酸偶联的人血清白蛋白纳米颗粒,平均尺寸为1 ± 5.3纳米,具有非常均匀的粒径分布。研究人员观察到,与纯白藜芦醇相比,这些纳米颗粒对白藜芦醇的摄取速率更高,并且随着纳米颗粒浓度的增加而增加。此外,这些携带白藜芦醇的纳米颗粒展示了有效的肝肿瘤靶向和持续释放特性。
铁蛋白是生物体中广泛分布的蛋白质,在维持体内铁平衡和作为细胞抗氧化剂方面起着关键作用。它是人体内源性的蛋白质,通常由真核细胞中的24个单独亚基组成。其独特的蛋白质笼结构和自组装特性为药物载体提供了创新概念。姜等人开发了药物纳米载体HccFn‐DOX。首先,他们通过遗传工程方法在鹅肌铁蛋白Fn(HccFn)的外表面展示了葡萄糖调节蛋白78(GRP78)靶向肽SP94,然后将DOX加载到HccFn的空腔中。实验结果显示,超高剂量的DOX被封装在HccFn纳米胶囊中。与游离的DOX相比,HccFn‐DOX显著减少了化疗药物对健康器官的影响,最大耐受剂量增加了六倍。
核酸为各种独特应用提供了理想平台,利用其合成可操作性、高灵敏度和亲和性以及简单的结构修改。DNA折纸是一种利用DNA链和短DNA片段创造复杂纳米图案或结构的尖端技术,最初由Rothumend于2006年提出。DNA折纸技术使得分子在精确的纳米尺度位置上的操纵和组织成为可能,具有活性靶向、优异生物相容性和生物稳定性。姜等人开发了二维和三维形式中载荷阿霉素的DNA折纸结构,并将DNA纳米结构-阿霉素复合物应用于DOX耐药细胞亚系(res-MCF 7)。实验结果表明,游离阿霉素和载荷阿霉素双链DNA对res-MCF 7的杀伤作用不明显。相反,相同浓度的折纸结合阿霉素诱导了细胞死亡。这导致了DNA纳米结构载体有望克服阿霉素耐药性的假设。
肝脏特异性靶向策略
传统抗肿瘤药物存在诸多缺点,如生物分布不足、药代动力学不佳、靶向选择性差、药物耐药性高,以及对非靶向组织的显著毒性。肝细胞癌通常具有较长的潜伏期,导致大多数患者在中期或晚期被诊断,需要化疗作为主要治疗手段。然而,化疗常常导致严重的副作用,可能是由于高毒性传统化疗药物对癌细胞的非选择性作用,对正常细胞造成伤害,并限制活性化疗药物在肝细胞癌部位的积累,导致药物浓度不足以有效对抗肝细胞癌。此外,在肝细胞癌化疗过程中常常出现多药耐药,导致癌症复发和生活质量下降。与传统化疗药物相比,靶向疗法对肿瘤组织具有更高的特异性,并在根除癌细胞方面表现出更高的功效。此外,纳米颗粒通常基于其性质在肝脏中积聚。纳米载体通过肿瘤细胞与正常细胞之间的物理化学差异识别肿瘤区域。被动靶向也被称为“增强渗透性和滞留效应(EPR)”。EPR效应表明,特定尺寸的分子或颗粒倾向于在肿瘤组织中积聚,而不是在正常组织中,从而间接指示肿瘤的位置。主动靶向通过肿瘤细胞过度表达的表面受体确定肿瘤位置,主要指药物或其载体具有主动结合到靶点的能力。在实践中,通常同时执行这两种靶向策略,利用配体修饰的纳米药物首先依赖肝脏中的被动摄取机制,然后进行配体介导的细胞内摄取。
被动靶向
被动靶向利用药物载体的固有特性,在体内通过自然吞噬作用实现靶向。它利用EPR效应:正常微血管的内皮间隙密集且结构完整,阻碍大分子和颗粒通过血管壁。相比之下,实体肿瘤组织具有更多新形成的血管、血管壁间隙更宽、结构相对不稳定,以及缺乏淋巴引流。被动靶向利用这种差异促进大分子药物在肿瘤组织中的选择性分布,从而增强药物的功效并减少系统副作用。
主动靶向
主动靶向的主要目标是赋予药物或其载体与靶点的活性结合能力。通过纳米材料的表面功能化和配体介导方法对肿瘤表面过度表达的受体进行特异性靶向,将修饰后的纳米颗粒定向到目标器官、组织和细胞,实现药物输送过程中低毒性和高治疗效果。去唾液酸糖蛋白受体(ASGPR)是表达在肝细胞表面的内吞受体,先前的研究已确认其在HCC中的存在。它在肝细胞上丰富表达,并在体内其他部位表达有限。ASGPR可以通过格蛋白介导的内吞作用促进大分子的内吞作用。含有末端半乳糖残基的去唾液酸糖蛋白,如去唾液酸糖蛋白,被广泛用于肝靶向目的。表阿霉素(EPI)是一种用于治疗HCC的关键化疗药物。然而,其长期使用受到严重副作用的阻碍,如心肌病和充血性心力衰竭。为了解决这一挑战,Nasr等人开发了一种旨在增强化疗药物效果同时减少心脏毒性的输送策略。他们将EPI装载到与去唾液酸糖蛋白结合的壳聚糖-聚(乳酸-共-乙二醇酸)纳米颗粒中,形成EPI纳米颗粒。与游离EPI相比,EPI纳米颗粒在HepG2细胞系中显示出明显改善的抗增殖效果。EPI纳米颗粒在心脏毒性评估中表现出积极结果。它降低了前炎性细胞因子肿瘤坏死因子-α的水平,表明氧化应激诱导的心脏毒性减少。此外,脂质过氧化产物和NO水平的降低进一步证实了这一点。最终,基于生物可降解纳米颗粒的这种靶向肝细胞的疗法不仅表现出显著的疗效,而且与传统方法相比还表现出更高的安全性。
CD44是一种与透明质酸(HA)结合并促进细胞与细胞外基质配体粘附的受体,在纤维化中表达上调,而在健康肝脏中相对下调。将药物靶向CD44过表达的肝细胞具有逆转肝纤维化和抑制HCC发展的潜力。作为CD44的主要配体,透明质酸已被应用于具有肿瘤靶向性和改善细胞摄取的纳米载体的进展。为了增强Forsythiaside A(FA)的肝保护活性,Gong等人开发了HA-mExo-FA,一种将FA封装在外泌体内的纳米载体系统。这些外泌体被修饰为HA,以促进对CD44过表达细胞的靶向输送。这种方法有效地提高了FA的利用效率。体外研究表明,HA-mExo-FA降低了α-平滑肌肌动蛋白和胶原基因的表达水平,抑制了转化生长因子-β1诱导的LX2细胞增殖,并诱导了激活的LX2细胞凋亡。
Zheng等人探索了在肝癌治疗中应用反义寡核苷酸的方法。他们利用修饰有聚乙烯亚胺(PEI)和近红外荧光量子点(QDs)的HA开发了一种纳米载体平台(图3)。该平台通过静电相互作用高效地封装了反-miR-27a寡核苷酸,形成反-miR-27a/QD-HA-PEI复合物。在体外和体内研究中,该平台通过直接下调致癌转录因子FOXO1和过氧化物酶体增殖物激活受体,展示了选择性的抗癌效果。此外,该平台在细胞环境中实现了荧光猝灭,表明成功释放了反义寡核苷酸。这些发现展示了双荧光纳米颗粒作为miRNA治疗的多功能平台的潜力,实现了肝癌治疗中肿瘤成像和治疗监测的同时进行。这种基于GRP78的靶向药物输送系统被称为HccFn-DOX纳米笼。这些纳米笼由铁蛋白组成,外表面修饰有SP94肽,腔内装载有药物DOX。HccFn-DOX纳米笼通过EPR效应主动靶向细胞表面的GRP78,并通过被动作用靶向肿瘤细胞。这种纳米载体对DOX的高装载效率证明了其对HCC的药物输送非常有效。
GA受体(GAR)是GA的受体。GA源自甘草中的甘草苷(GL)的水解,是一种传统中药用于治疗肝病。GA和GL都已被用于其对肝脏的治疗效果。研究表明,肝细胞在其细胞膜上具有高度特异性的GA和GL结合位点,其中GA具有明显更高数量的结合位点。已报道GAR在肝细胞窦面上丰富表达,其表达水平比正常组织高5-4倍。因此,通过GA靶向肝细胞是一种非常有前途的治疗方法。

图3. 通过透明质酸(HA)靶向CD44的肝细胞癌治疗纳米递送系统
利用HA用于CD44靶向的多功能纳米颗粒被开发用于非侵入性追踪靶向递送抗-miR-27a寡核苷酸对肝癌的治疗。该纳米颗粒在体外和体内展示了有效和选择性的抗癌效果,下调致癌转录因子FOXO1和过氧化物酶体增殖激活受体,同时实现了肿瘤成像和追踪微RNA基调节治疗。EDC/NHS,1-(3-二甲基氨基丙基)-3-乙基羰亚胺/N-羟基琥珀酰亚胺;PEI,聚乙烯亚胺;QD,量子点。修改自参考文献34,https://doi.org/10.7150/thno.25255。
刺激响应策略
刺激响应型纳米载体可以根据外部环境中微小变化动态调整其物理行为或化学结构。这种能力使得药物能够在肿瘤部位实现精确和受控的释放,确保药物的位置、数量和释放时间固定。通过这种方式,最大限度地减少了对正常组织的潜在伤害,同时最大化了药物的治疗效果。这一突破在肿瘤研究和诊断方面取得了重大进展。刺激响应型纳米载体可以通过各种刺激目标,包括光、超声波或磁场等外部因素,以及 pH 和组织微环境等内部信号(见图4)。这些刺激有助于在靶向细胞上释放纳米粒子中的药物,从而产生高效的治疗效果。
对内部刺激响应的纳米材料
肿瘤组织由于其独特的生理特征而表现出不同的细胞微环境。由于肿瘤微环境(TME)的明显酸性与正常组织相比,pH响应性纳米颗粒在癌症免疫治疗中引起了相当大的关注。与正常组织相比,TME的高酸度引发了对癌症免疫治疗中pH响应性纳米颗粒的广泛兴趣。具有pH敏感载体的生物制药配方能够对微小的pH变化做出反应,促进溶酶体逃逸,并避免核酸或蛋白质在溶酶体中的降解。谷胱甘肽(GSH)在微环境调节中起着关键作用。研究发现,肿瘤组织中的GSH浓度至少是正常组织的四倍,而在某些多药耐药肿瘤中尤其升高。肿瘤细胞与健康细胞之间还原环境的差异为设计纳米药物载体打开了可能性。因此,我们设计了可以可还原降解的两性共聚物,利用聚(β-氨基酯)-g-聚(乙二醇)作为核心组分。在水溶液中,这些共聚物自组装形成具有核壳结构的胶束纳米粒子,有效地封装了DOX。对人类HepG2细胞系的共聚焦显微镜分析显示DOX的快速内化和在细胞质中的有效释放。与不可还原的胶束相比,这种可还原的胶束表现出较低的细胞毒性。我们进行了额外的研究,旨在通过开发pH和还原响应性双对应纳米团簇来增强癌症药物的有效性。通过迈克尔加成聚合合成了这些创新的共聚物,采用了2,2'-二硫代乙二醇丙烯酸酯、4,4'-三亚甲基二哌啶和甲氧基-PEG-NH2。这些胶束在轻微酸性环境(pH 6.5)下表现出增强的DOX释放,与较高pH值或存在浓度为5mM的还原剂DTT相比,导致药物释放加速。此外,我们观察到这些胶束表现出快速的内化,促进药物有效传递到细胞核并有效抑制细胞生长。这种方法在HepG2肿瘤细胞中显示出有希望的结果,突显了这些pH和还原双敏感纳米载体作为一种新颖有效策略的潜力。
对外部刺激响应的纳米材料
磁场等外部刺激对生物组织的影响较小,使其与磁性纳米颗粒结合时,成为在目标组织中选择性控制药物积累和释放的理想选择。这种方法显著减少了对周围组织的影响。超顺磁性氧化铁纳米颗粒(SPIONs)具有高磁稳定性和低毒性,与磁场结合后适用于相关治疗。这种组合通过增加靶位点处的局部药物浓度,提高了治疗效果,克服了传统治疗所面临的挑战。尤等人的研究开发了一种称为PEG‐PCL‐PEI‐C14‐SPIONs(PPPCSs)的传递系统,有效保护circ_0058051小干扰RNA(siRNA)免受血清降解,并有效将siRNA传递至人类肝癌细胞(SMMC‐7721)。PPPCSs/siRNA复合物的静脉注射成功抑制了皮下肿瘤模型中的肿瘤生长。
光疗法已成为肿瘤治疗的一种有前景的方法。光疗法通常利用光敏剂,在无光的情况下毒性低,但在光照下选择性诱导癌细胞死亡,最大程度减少对正常组织的损害。除了利用精心设计的光敏剂精确靶向肿瘤外,还可以实现对光的空间控制,照射肿瘤部位同时最大程度减少对健康组织的伤害。光疗法提供的这种双重选择性显著降低了与传统化疗或放疗方法相关的全身毒性。光疗法主要利用具有深层穿透能力的近红外光,并可分为三种主要类型。首先是光热疗法(PTT),即暴露于光线会产生热量,直接导致癌细胞死亡。其次,光动力疗法激活光敏剂产生活性氧物质。这些产生的活性氧物质负责杀死癌细胞。最后,光诱导的热量可以触发包封药物的释放,导致癌细胞的破坏。这三种疗法通常结合使用。
杜等人开发了一种名为NO‐DOX@PDA‐TPGS‐Gal的新型纳米粒子药物传递系统。该系统具有由d‐α‐生育酚PEG 1000琥珀酸酯(TPGS)‐半乳糖(Gal)/聚多巴胺(PDA)组成的核/壳结构。通过利用多巴胺的光热特性,可以通过近红外照射实现局部温度升高。这不仅有助于释放DOX,还触发了从N,N'‐二‐叔丁基‐N,N'‐二硝基‐1,4‐苯二胺(BNN)中释放NO的热诱导释放。因此,这种创新方法实现了结合化疗和光热疗法的双重治疗策略,用于HCC的治疗。利用NO‐DOX@PDA‐TPGS‐Gal的化疗-光热疗法(chemo‐PTT)方法在体外和体内对耐药HCC细胞展现出显著的疗效。重要的是,它在延长患有耐药肿瘤的小鼠的寿命方面表现出显著潜力,表明其有望成为一种有前景的治疗方法。
超声是一种频率超过人类听觉范围(>20 kHz)的周期性振荡机械波。在医学中,频率在20 kHz至100 kHz之间的超声波被定义为低频超声,常用于启动声穿孔和机械破坏药物载体泄漏。超声靶向微泡破裂技术是一种将超声与功能载体结合的技术,在实现固体肿瘤化疗传递方面具有明显优势。郭等人设计了一种称为FTY720@SPION/PFP/RGD‐NBs的超声敏感纳米泡(NB)药物载体。该载体具有RGD修饰的脂质体作为外壳,内部封装有全氟吡啶(PFP)、SPION和非格列酮(FTY720)。在超声介导下,它表现出增强的药物释放速率。细胞摄取实验证实,这种药物载体在HCC中有效积累,尤其在低强度聚焦超声的辅助下。

图4. 刺激响应释放策略的因素
影响刺激响应释放策略的因素包括光、pH、氧化还原电位、温度、磁场和超声波。这些刺激可以被利用来触发治疗剂从药物递送系统中的受控释放,提供潜在的应用于靶向和响应性药物递送。修改自参考文献27,https://doi.org/10.1186/s12951-022-01309-9。
响应内外部双重刺激的纳米材料
在纳米载体的设计中,通常利用内外部双重刺激来实现最佳药物释放。例如,陈等人开发了一个方便集成的名为FTY720@AM/T7‐TL的纳米平台用于HCC。该平台在酸性环境中实现电荷反转,并在近红外照射下释放药物。具体来说,该纳米平台由金-二氧化锰(Au‐MnO2)纳米颗粒组成,作为多功能组件,包括光敏剂、光热剂、过氧化物酶催化剂和T1磁共振成像剂;四苯乙烯(TPE),用作荧光成像剂;以及FTY720,用作化疗药物。这些组件被封装在混合脂质体中。进入肿瘤微环境(TME)后,酸性微环境导致纳米平台的电荷从负向正转变,促进其被细胞吞噬。一旦进入细胞内,纳米平台在近红外刺激下释放内部携带的Au‐MnO2、TPE和FTY720。这种双重刺激效应,既内部又外部,有两个优点:首先,确保药物主要与略微酸性的TME中的癌细胞结合,其次,通过控制近红外照射范围,最小化对正常组织的损伤。
杜等人开发了一个新的纳米系统,名为NO‐DOX@PDA‐TPGS‐Gal,其中包括加载了DOX的TPGS‐Gal并涂覆有PDA的NO供体BNN。该纳米系统展示了通过Gal‐ASGPR介导的识别选择性靶向肝细胞,并在肿瘤低酸性pH微环境中释放DOX的能力。此外,利用近红外辅助光热转换加速了DOX的释放,并在BNN内启动了NO的产生。联合化疗-光热疗法与NO‐DOX@PDA‐TPGS‐Gal展示了DOX、NO和热的协同效应,在体内和体外对耐药HCC细胞表现出强大的抗癌活性,并显著延长了耐药荷尔蒙小鼠的寿命。
讨论与展望
HCC是一种严重威胁人类健康的恶性肿瘤,一直是医学领域关注的焦点。随着纳米技术的发展,肝细胞癌的治疗带来了新的希望。纳米医学作为一种新型药物传递系统,可以将化疗药物封装成纳米颗粒,实现靶向输送和控制释放,从而增加药物在肿瘤细胞中的积累,并延长在体内的循环时间。一些纳米医学在临床试验中显示出显著的疗效,如Doxorubicin-Transdrug™和Thermodox®。这些例子展示了纳米医学在肝细胞癌治疗中的广阔前景。然而,在纳米医学的临床转化中仍然存在挑战。微小的改变可能会改变其生物相容性和毒性,需要更多研究来确保其安全性和有效性。此外,有必要通过临床医生的加强对纳米医学的理解和应用,以更好地在临床实践中利用它。为进一步改善纳米医学在肝细胞癌治疗中的应用,应加强对纳米材料特性的研究,以确保其稳定性和安全性。此外,需要研究纳米医学与其他治疗方法的联合应用,以探索更多治疗可能性。总之,作为一种新兴的治疗方法,纳米医学在肝细胞癌治疗中显示出巨大潜力,但需要进一步的研究和临床实践来解决面临的挑战,以更好地造福患者。
引文格式:
Chen Guo, Jiayu Zhang, Xiaomeng Cai, Rui Dou, Jiaruo Tang, Zhengyuan Huang, Xueting Wang, Yan Guo, Hanqing Chen, Jun Chen. 2024. Emerging nanomedicine strategies for hepatocellular carcinoma therapy. iMetaOmics 1: e12. https://doi.org/10.1002/imo2.12
作者简介

郭晨(第一作者)
● 华南理工大学和中国科学院高能物理研究所联合培养硕士。
● 目前就职于北京食品科学研究院,研究方向纳米医学与肿瘤抑制。

张佳宇(第一作者)
● 中国科学院高能物理研究所助理研究员。
● 研究方向为纳米生物医学,已在JACS、Nucleic Acids Research等期刊发表学术论文30余篇,主持国家自然科学基金等课题。

陈汉清(通讯作者)
● 首都医科大学公共卫生学院营养与食品卫生学系,教授,博士生导师。
● 曾任华南理工大学医学院/附属第二医院研究员,博士生导师。主要研究方向是消化系统类疾病的健康效应机制及干预新策略研究,发表论文66篇,其中以第一或通讯作者在Hepatology,ACS Nano,Nano Today等杂志发表论文30余篇。近五年主持包括2项国家自然科学基金在内的8项课题,入选北京市海聚工程青年项目、广州市高层次人才青年后备人才、广州市高层次卫生人才医学骨干人才、中国化学会高级会员。

陈俊(通讯作者)
● 中国科学院高能物理研究所研究员,博士生导师。
● 一直致力于开发新型生物医用材料的研究。在生物材料领域重要学术期刊,如Adv. Mater., Nano Lett., Nano Today, Adv. Funct. Mater., Small, Biomaterials等,共发表SCI论文60余篇,研究工作引起国际国内同行的广泛关注和评价,被引2000余次。近五年主持和参与国家自然科学基金及其他省部级项目6项。以第一发明人身份,已获授权中国发明专利5项。中国科学院青年创新促进会(中科院青促会)会员,中科院青促会数理学会第二届委员会委员,中科院青促会北京分会第二届委员会委员,中科院高能所优秀青年人才,高能所多学科中心学术委员会成员。
iMetaOmics
更多资讯
● iMeta姊妹刊iMetaOmics(定位IF>10)欢迎投稿!(2024.2.27)
● iMeta姊妹刊iMetaOmics编委招募 (定位IF>10) (2024.3.2)
● iMeta姊妹刊iMetaOmics电子版和印刷版ISSN申请获批(2024.4.1)
● iMeta姊妹刊iMetaOmics投稿系统正式上线(2024.4.17)
● iMeta姊妹刊iMetaOmics主编正式官宣(2024.4.22)
● 出版社iMetaOmics主页正式上线!(2024.4.28)
● iMetaOmics | 浙江大学宗鑫组揭示两猪种宿主-肠道菌群互作差异
● iMetaOmics | 罗鹏/袁硕峰/苗凯/程全发表STAGER: 生成式人工智能可靠性的标准化测试和评估推荐
● iMetaOmics | 徐州医科大杨欢组揭秘沙门氏菌-宿主-微生物群在免疫与代谢中的相互作
● iMetaOmics | 中科院动物所金坚石组综述16S rRNA基因扩增子测序技术的“前世今生”
● iMetaOmics | 浙大张天真组完成二倍体棉种泛基因组构建
● iMetaOmics | 张勇/李福平-先进糖蛋白组学在男性生殖研究中的潜在应用
● iMetaOmics | 暨南大学潘永勤/杨华组-炎症蛋白联合检测利于诊断甲状腺乳头状癌和结节性甲状腺肿
● iMetaOmics | 张开春组利用多组学方法揭示甜樱桃加倍后果色变化的候选基因
● iMetaOmics | 杜娟/林婷婷-慢性泪囊炎患者眼部菌群类型和纵向菌群变化
更多推荐
(▼ 点击跳转)
iMeta | 引用13000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
2卷2期封底
2卷4期封底
3卷2期
3卷3期
3卷3期封底
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百千华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!发行后相继被Google Scholar、ESCI、PubMed、DOAJ、Scopus等数据库收录!2024年6月获得首个影响因子23.7,位列全球SCI期刊前千分之五(107/21848),微生物学科2/161,仅低于Nature Reviews,同学科研究类期刊全球第一,中国大陆11/514!
“iMetaOmics” 是“iMeta” 子刊,主编由中国科学院北京生命科学研究院赵方庆研究员和香港中文大学于君教授担任,定位IF>10的高水平综合期刊,欢迎投稿!
联系我们
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science








































 637
637

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








