摘要
可检测到的乙肝表面抗原(hepatitis B surface antigen, HBsAg)的丢失被认为是慢性乙肝的一种功能性治愈方法。当然,乙肝表面抗原可以被整合到病毒粒子的包膜中,或者与宿主细胞中的脂质一起组装成亚病毒颗粒(subviral particles,SVPs)。到目前为止,还没有关于乙肝表面抗原的详细结构,已发表的SVP结构也存在争议。在这里,我们首次报道了由冷冻电子显微镜结合AlphaFold2预测确定的乙肝病毒(hepatitis B virus, HBV)及其相关土拨鼠肝炎病毒(woodchuck hepatitis virus, WHV)球形SVP的亚纳米分辨率结构。这两种结构都表现出独特的菱形双八面体对称性,24个突起的尖峰由带有4个螺旋结构域的小HBs Ag二聚体组成。SVP中的脂质部分被组织成非规范的脂膜而不是脂双层,这可以调节暴露的疏水表面并调节颗粒的稳定性。综上所述,这些发现促进了我们对病毒膜组织以及乙肝病毒和WHV球形SVP结构的了解。
Introduction
乙肝病毒感染是一个重大的全球公共卫生问题。尽管有预防新感染的疫苗,但约有2.4亿人患有慢性乙肝病毒感染,导致约88.7万人死于与乙肝病毒相关的并发症,包括纤维化、肝硬变和肝细胞癌。患者可以使用干扰素-α和/或逆转录酶(RT)抑制剂进行治疗。这两种治疗方法清除病毒的可能性都很低。RT抑制剂可显著降低病毒载量并逆转肝脏损伤。然而,停止治疗可能导致危及生命的病毒爆发。一旦开始治疗,患者可以期待终身治疗。医学上对新疗法的需求尚未得到满足,这些疗法可能导致持续抑制病毒复制和丢失乙肝表面抗原(HBs),这是乙肝病毒感染的重要血清学标志。
在慢性乙肝患者的血清中发现四种主要类型的颗粒,包括感染性病毒颗粒、无基因组的空病毒颗粒、球形亚病毒颗粒(SVP)和管状SVP。高免疫原性球形SVP的数量通常是病毒粒子的103到105倍,是迄今为止用于预防乙肝病毒感染的预防性疫苗的基础。乙肝病毒粒子含有一个二十面体的核衣壳,包裹着一个由三种不同的表面蛋白组成的脂膜,即L(大)、M(中)和S(小)。它们都从相同的开放阅读框翻译而来,但在N末端的长度是可变的。S-HBs包含S结构域,预计有四个跨膜螺旋™(图1A)。M-HBs在N端增加了一个PreS2结构域,而L-HBs则进一步将PreS1结构域添加到M-HBs中(图1A)。所有三种表面蛋白的S结构域都是糖基化的。M-HBs在其N-末端也含有第二个N-糖基化位点,但在L-HBs中不被使用,因为胞浆中的PreS(PreS1+PreS2)结构域具有共翻译保留作用。Tm1和Tm2由胞浆环(Cyl)分开,胞液环引导S-HBs在细胞内转运,对HBVSVP分泌和病毒粒子形成是必不可少的。TM2和TM3之间的残基形成病毒颗粒表面的主要抗原环(AGL)。表面蛋白L、M和S分布在病毒粒子膜上的比例(3:2:5)与管状SVP上的比例1:1:4有很大不同。球形SVP几乎全部由S-HBs组成,M-HBs约占10%,仅有少量L-HBs。
目前,虽然已经通过低温电子显微镜(cyro-EM)、原子力显微镜(AFM)和X射线散射数据获得了一些中等分辨率的模型,但对于SVP还没有高分辨率的结构。特别是,球形SVPS的颗粒几何和膜组织仍在争论中。在转基因小鼠中产生的球形SVP的Cyro-EM重建显示出两个具有八面体对称性的主要大小,并且在12ä(14)处没有明显的脂双层。曹等人。(17)最近报道,用冷冻-EM法从乙肝病毒携带者血清中获得的球形SVP是不规则的,并且含有一层脂双层。此外,酵母来源的HBs病毒样颗粒呈近似球形,由96个重组S蛋白组成。尽管分辨率限制在15Å,但作者认为,脂膜由两个离散区域组成,一个是外部均匀的脂单分子层,另一个是由非极性甘油三酯组成的内无定形层(16)。此外,从人血清中提纯的管状SVP也显示出螺旋状排列的跨脂双层突起。用S结构域和L-HBs和M-HBs(15)的PreS区的外部区域模拟了棘波。最后,SVP的生化分析表明,SVP颗粒中的脂类与蛋白质(20-22)紧密嵌入;然而,固体核磁共振、光散射和冷冻-EM的相反结果表明,SVP显示出中等刚性的脂双层(23)。这些SVP似乎在形态上是不同的,这取决于它们的来源和样品制备。
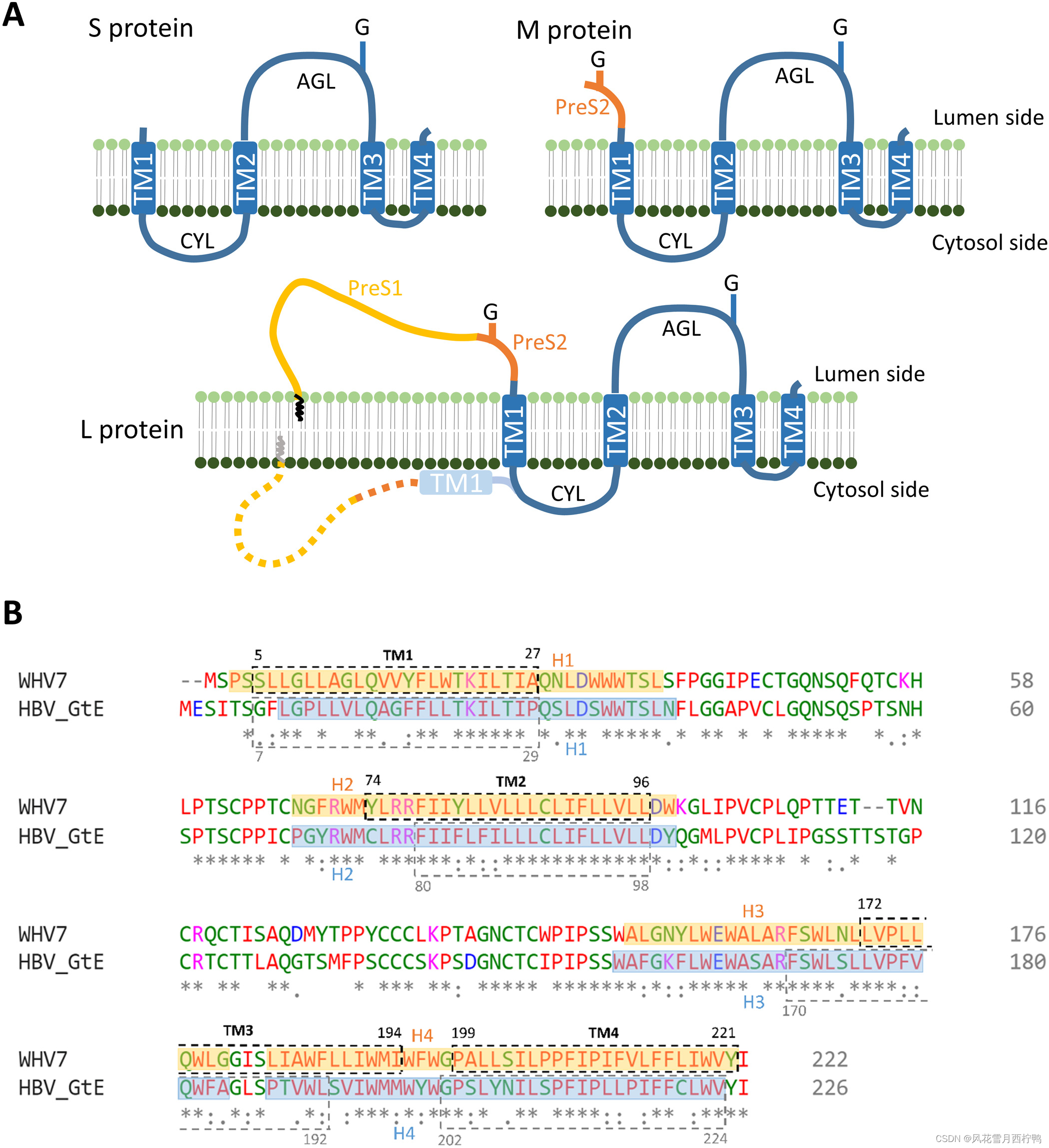
图1所示。提出了WHV和HBV的表面蛋白拓扑结构和序列比对。
(A)目前用于WHV和HBV S,M和L蛋白拓扑结构的模型。蓝框表示跨膜螺旋( TM )。L蛋白的之字形线表示n端肉豆蔻酰化。G,N-glycosylation;CYL:胞浆环;AGL,抗原环(N-terminal myristoylation. G, N-glycosylation; CYL, cytosolic loop; AGL, antigenic loop.)。
(B) WHV7和HBV基因型E (GtE)表面小蛋白序列比对。TMs由TMHMM服务器预测,用虚线框表示其指定位置。本研究的螺旋分配用透明的彩色方框表示(橙色,WHV;蓝色,HBV)和他们指定的位置。相同(*),保守(:)和半服务(.)氨基酸表示。蓝色和紫色分别表示带负电或带正电的残基。红色表示具有疏水侧链的氨基酸。
在这里,我们使用冷冻-EM技术研究了土拨鼠肝炎病毒(WHV)的球形SVP,WHV是一种在核酸序列、基因组结构、病毒粒子和衣壳形态以及感染和复制机制方面与乙肝病毒密切相关的肝炎病毒。6.5-Å三维(3D)模型显示,球形SVP呈现出一种新的菱形双子八面体对称,在颗粒表面有24个突出的尖峰。每个突起都是S表面蛋白的二聚体,具有四个螺旋。我们还发现,球形SVP含有非正则的脂组织,外层的密度由离散的无定形脂质组成,内层的密度由S结构域的蛋白质表征。为了了解来自乙肝病毒的球形SVP是否也表现出类似的结构,我们使用冷冻-EM来解析从乙肝病毒携带者的血清中纯化的球形SVP的结构,分辨率为6.3-Å。结合AlphaFold Version 2(AlphaFold2)中预测的原子模型,我们首次描述了WHV和HBVSVP的详细结构模型,并提供了球形SVP中亚单位-亚单位相互作用的机制模型。综上所述,这些结果加深了我们目前对球形SVP形态发生的理解,这可以提高基于SVP的抗乙肝抗体的有效性,并提高未来将SVP用作传递医学相关抗原序列的平台的效率。
RESULT
WHV SVP purification and reconstruction
WHV SVP的提纯与重建
感染WHV的东方土拨鼠是研究乙肝病毒感染、肝癌发生和抗病毒治疗的重要实验模型(25)。与乙肝病毒相似,WHV也编码三种囊膜蛋白,其中包含共同的C末端S结构域(6)。S结构域与乙肝病毒的氨基酸序列同源性为63%,预测有四个跨膜螺旋,每个螺旋平均由22±2个氨基酸残基组成(图1B)。高度的同源性使得S结构域可以在WHV和HBV2之间互换,而对SVP的形成影响最小(26),并可能导致大量的结构-功能保守。
用等密度梯度法从长期感染WHV7株土拨鼠的血清中提纯出WHVSVP。所选组分经天然琼脂糖凝胶电泳法(NAGE)分离,Western印迹分析,并作负染透射电子显微镜(TEM)观察。大多数表面蛋白位于F16(组分16)至F18(图2a,第7至9道)。电子显微镜图像显示,F16含有绝大多数球形SVP,而F17含有更多管状SVP,在F18开始检测到病毒粒子样颗粒(图2B)。为了进一步研究球形SVPS的结构,选择了F16,去掉了铯盐,并进行了cyro-EM单粒子分析。
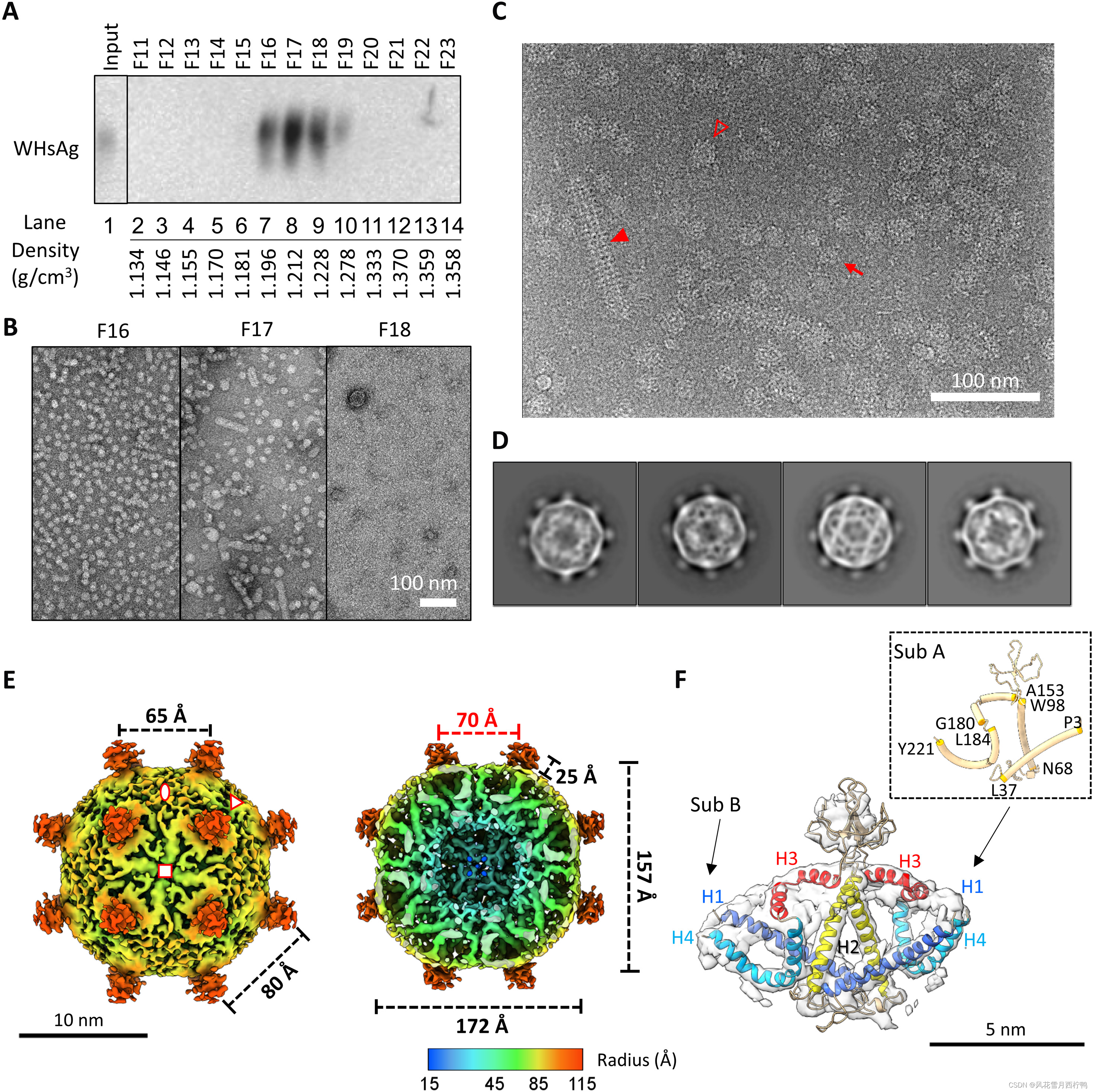
图2所示。WHV SVP的结构分析
( A ) Western blot检测WHV表面蛋白。用CsCl密度梯度对感染whv7的土拨鼠血清进行分离。选择的部分(F11至F23)通过NAGE分离,并使用针对HBsAg (ViroStat)的多克隆抗体(pAb)进行免疫印迹分析。
( B )从CsCl梯度中选择的部分的阴性染色图像。比例尺,100纳米。
( C ) F16纯化WHV SVP的Cyro-EM显微照片。小的球形粒子和大的球形粒子分别用红色箭头或空三角形表示。管状SVP用红色实三角形表示。
( D ) WHV小球面SVP二维平均。颗粒直径约23纳米。
( E ) 6.5 Å处冷冻电镜三维重建WHV小球形SVP。图的等高线在~2.5 σ处。在四重轴上观察径向彩色表面表示的前半部分(左)和后半部分(右)。不对称单元由三个符号包围。两重轴、三重轴和四重轴分别用椭圆形、三角形和正方形表示。红色数字表示颗粒内芯直径。
( F ) S-WH二聚体拟合。分割后的低温电镜图显示为透明表面。有两个亚基和螺旋1到4。插入图显示了亚基A中残基在螺旋中的位置。
冷冻水合的cyro-EM图像显示WHV SVP在形态上是不同的(图2C)。连续进行无参考的2D分类,以丢弃密度模糊和被冰污染的类别。尽管有些种类具有大直径和不完全闭合的壳,但它们都有两个共同特征:(I)从颗粒表面伸出的多个突出的尖刺和(Ii)两个不常见的致密层,其中外层似乎是无定形的,而内层包含编织的网状网(图2D和图2).S1)。我们选择了具有完全封闭壳和有序密度的类进行进一步的3D精细结构分析(图2D)。请注意,在一些类图像中,粒子显示出明显的两倍(图2D,左1至3)和四倍(图2D,右)密度的特征。使用Relion软件不对称地重建初始3D模型。这张地图显示了两重、三重和四重空间排列的总体对称特征–这是八面体对称的特征(图4)。S2A)。然后,我们应用了八面体对称,并将3D模型细化到6.5-A°(图2E和图2).S2C)
Overall structure of WHV SVP
WHV SVP 的总体结构
WHV球形SVP的三维重建类似于菱形双子八面体几何图形,从对称的顶点总共伸出24个尖峰(图2e和图2e)。S3A)。从表面测量,尖峰的高度约为2.5 nm,三轴和四轴上每个尖峰之间的距离分别为8和6.5 nm。这将产生8个三角形、6个正方形和12个矩形面片–菱形双八面体的拉长导数。从外表面观察,我们观察到两种不同类型的密度:厚实的宽密度从穗的底部向侧面投射,以及在每两个位置的缝隙中填充一片薄的短线状密度。前者的密度显示为两个V形排列的短管,并平放在粒子表面。短的线状密度与在被包裹的病毒(28)的膜中观察到的脂类的非特异性密度相当。
从下半部分看(图2E,右),多个折叠的管状密度连接在一起,形成50Å的内层厚度。每根管子的边界在高轮廓水平可见。一个弯曲的管状密度从表面下来,向外旋转,形成U形形态。另一方面,另一个直管密度跨越内层,并在末端连接,在较低的半径处形成致密层。因为根据先前的预测,S蛋白被发现具有大部分的α螺旋,所以我们假设观察到的小管密度代表蛋白质的螺旋区域。
总之,在WHV球状SVP中没有观察到常规的脂双层形态。外层含有脂块密度和蛋白质密度,内层由复杂有序的蛋白质结构组成。
Modeling of small WHs
小型WHs的建模
为了了解在当前分辨率下WHV球形SVP的分子构建块,我们跟踪了螺旋密度,定义了紧密相关的蛋白质密度之间的边界,并从整个球形SVP中分割出一个峰(图2.S3B;详情见材料和方法)。分割可以进一步分为具有几乎相同的折叠的两个单元(图2.S3B)。因此,可以将链段密度指定为两个独立的单体。观察每个单体,我们发现两个直螺旋(命名为helix 1 and helix 2)在粒子的较小半径处相互作用。螺旋2不断向外延伸,以在棘突所在的部位形成密度团块。这种密度相对较弱,在高等高线水平下迅速消失,表明该区域的蛋白质构象更具灵活性。继续,密度形成V形螺旋(helix 3),它平放在颗粒表面,不是典型的跨膜螺旋,并嵌入如前所述的脂质片中(图3)。S3B,中间)。该螺旋的一部分被定义为两亲性(31,32)。继续向内,密度排列成最后一个U形螺旋(helix 4),它在中途转向并回到表面。该螺旋与先前确定的疏水C-末端区域重叠。得到的模型类似于Suffner等人定义的预测拓扑。(31)。综上所述,我们的冷冻EM密度图表明,一个单峰是由两个S-WHS在AG1、螺旋2的C末端以及螺旋1和2的底部相互作用组成的。
为了更好地了解详细结构,我们使用AlphaFold2(33)在Silico 3D分子模型中生成,随后使用冷冻EM密度图限制预测的蛋白质构象。使用Isolde和Coot(34,35)将Cα蛋白骨架灵活地模拟到冷冻EM密度图中。得到的S-WHS结构显示了四个螺旋段和两个柔性环区(图2F和图2F.S3C)。由于预测的螺旋片段具有很高的置信度,我们可以毫不含糊地将每个螺旋分配给相应的低温电磁密度(图2F)。连接螺旋1/2和螺旋2/3的两个环区在预测中的置信度得分最低(图2F)。在AlphaFold2预测的所有五个模型中,环区显示出显著的差异(图2)。S4A)。连接螺旋1和2的第一个环区是CyL,已被证明对维持S结构域(31)的寡聚化是重要的。尽管有大量的冷冻-EM密度连接螺旋1和螺旋2,但总体积不足以容纳大约30个CyL残基(图2)。密度的缺失是蛋白质柔性区域平均化的结果。第二个环位于螺旋2和螺旋3之间,是agl,突变分析表明它独立地介导S结构域的寡聚(31)。AGL有8个半胱氨酸残基,在S结构域二聚(12,36)过程中被发现是交联的。虽然预计它包含两条短的链,但由于低温电磁密度较弱,并且该区域的局部分辨率较低,因此这些链在密度中的位置尚不清楚(图2F和图2.S2D)。
A和B亚基的重叠显示了螺旋1和螺旋4的倾斜角的细微差异(图3. S4, C和D)。因此,我们的结果表明,不对称表面小蛋白的二聚体是球形SVP的构建块。
Does HBV spherical SVPs have similar architecture?
我们对上述来自WHV球形SVP的整体分子结构感到惊讶,并想知道是否乙肝病毒球形SVP也表现出类似的空间组织,尽管早先报道了不同的结果(14-17)。为了确定乙肝病毒球形SVP的结构,我们从一名感染了E基因(GTE)的患者的血清中分离出SVP,并进行了与前面描述的WHV SVP相同的分析。正如预期的那样,大多数乙肝表面抗原位于F16至F18,密度为1.190至1.239克/厘米~3(图3A,通道7至9)。阴性染色样品的图像表明,与其他组分相比,F16具有更多的球形SVP(图3B),并用于冷冻-EM数据收集(图3C)。与WHV一样,HBVSVP在大小和形状上都是不同的(图3C)。这一观察结果与之前的发现(4,15)一致。
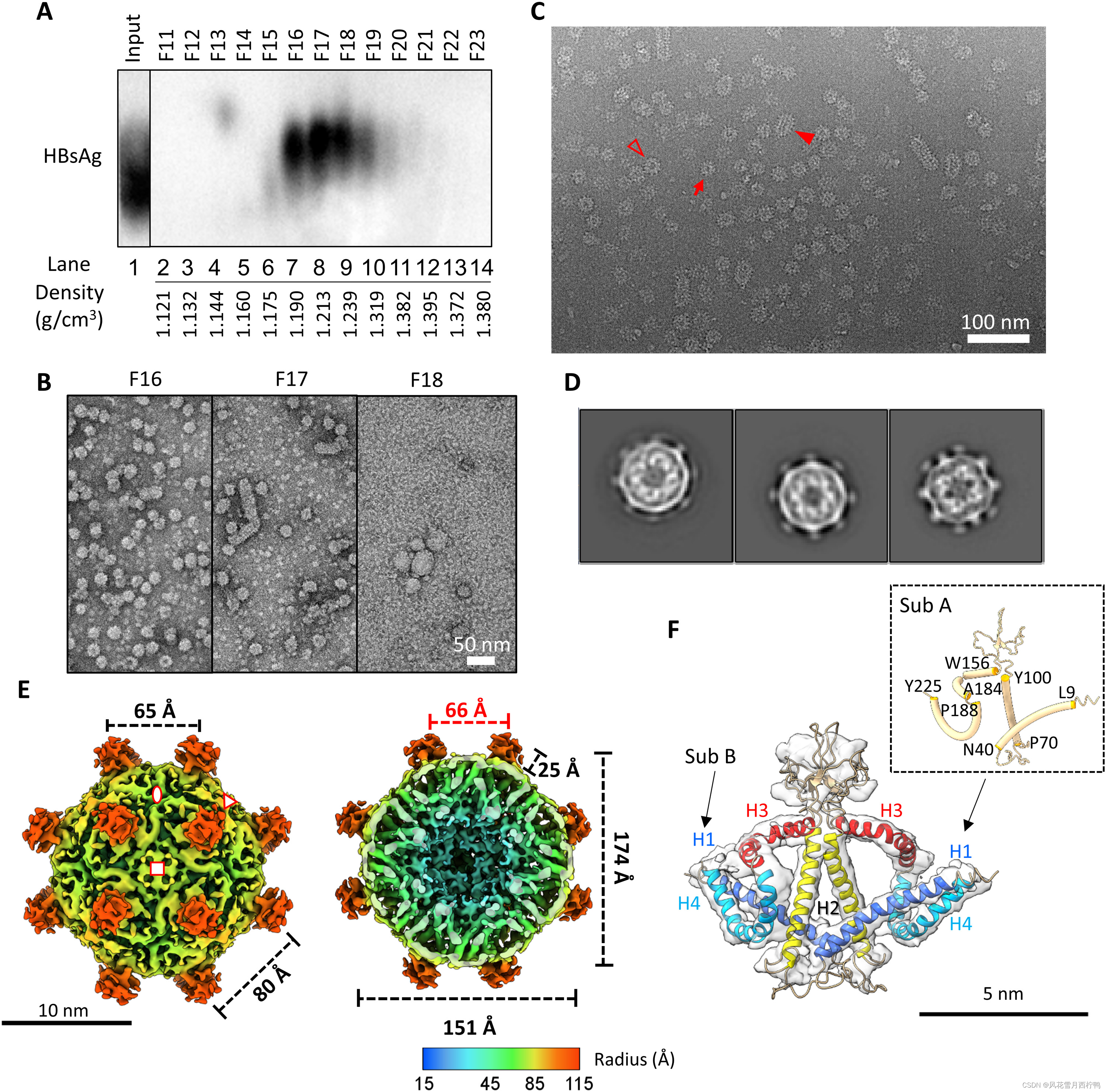
图3所示。HBV SVP的分离及Cryo-EM和3D图像处理分析。
(A) Western blot检测HBV表面蛋白。乙肝病毒感染者血清按等浓度CsCl梯度进行分离。选择的部分(F11至F23)通过NAGE进行分离,并使用针对HBsAg的pAb (ViroStat)进行免疫印迹分析。
(B)从CsCl梯度中选择的部分的阴性染色图像。比例尺,50 nm。
(C ) F16纯化HBV SVP的Cyro-EM显微照片。小的球形粒子和大的球形粒子分别用红色箭头或空三角形表示。管状SVP用红色实三角形表示。
(D) HBV小球形SVP的2D级平均值。颗粒直径约23纳米。
(E) 6.3℃时HBV小球形SVP的Cryo-EM 3D重建Å。图的等高线在~3.0 σ。在四重轴上观察径向彩色表面表示的前半部分(左)和后半部分(右)。不对称单元由三个符号包围。两重轴、三重轴和四重轴分别用椭圆形、三角形和正方形表示。红色数字表示颗粒内芯直径。
(F) S-HBs二聚体的拟合。分割后的低温电镜图显示为透明表面。有两个亚基和螺旋1到4。如图所示为亚基A中螺旋的残基位置。
二维类平均表现出与上述WHV相似的特征。所有类别均呈现两层密度(图3D);外层的密度是无定形的,而内层的密度具有复杂的蛋白质-蛋白质相互作用网络。我们选择了两个具有完整表面密度的类别进行进一步的图像分析(图2D,右侧两个类别)。通过不对称重构,我们发现HBV球形svp也具有2倍、3倍和4倍特征。在双面面上的四个尖峰以矩形排列而不是正方形排列出现(图S2B);因此,它也具有类似菱形六面体的对称。在模型细化过程中,我们进一步应用了八面体对称,并以6.3-Å分辨率获得了最终的3D重建(图S2、C和E)。
与WHV一样,HBV的球形SVP直径也为23 nm,包含24个突出的尖峰(图3E)。每个尖峰是s - hb的二聚体,包含四个螺旋片段。利用AlphaFold2预测和低温电镜密度图,我们能够生成S-HBs的第一个原子模型(图3F和图S4B)。HBV中脂质部分的未分配表面密度明显低于WHV球形svp(图2E、3E和图S5)。
Structural comparison between WHV and HBV spherical SVPs
S-HBs的结构在单体和二聚体水平上几乎与S-WHs相同,只是控制螺旋曲率的角度略有不同(图S4C)。构建块由两个亚基的二聚体组成;每个亚基含有一个AGL (WHV: Lys99-Trp152;HBV: Gln101-Ser155), CYL (WHV: Ser38-Cys67;HBV: Phe41-Cys69)和四个螺旋结构域(WHV: Pro3-Ser38、Asn68-Lys99、Ala153-Gly181和Leu184-Tyr221;HBV: Leu9-Asn40、Pro70-Tyr100、Trp156-Ala184和Pro188-Tyr225) (WHV单体A和B有一个残基差异;图1 b)。AGL和CYL都具有高度亲水性(图2.S6和S8)。
在单体中,H1和H2之间的相互作用通过盐桥、氢键、疏水相互作用和范德华力键发生在粒子内部较低半径处(表S1和图S7)。位于颗粒表面的H3具有面向颗粒外部的亲水残基(图S6)。H2和H3之间的相互作用可以帮助维持H3在表面的位置(图S7),并且在侧面暴露的疏水残基被分离的脂质部分稳定。最近的一份报告表明,部分H3 (Trp156到Arg169)在HBV svp的形态发生中起关键作用。最后,H4在U形中心形成疏水核,使CTD转向颗粒表面(图2)。S6和S7)。总的来说,我们发现与HBV相比,S-WHs在单体水平上具有更多的蛋白质-蛋白质相互作用,并且这些相互作用在两个亚基内是不对称的(表S1)。
在H1/H4和H2/H2螺旋上发现了二聚体疏水相互作用。根据文献,在AGL和CYL上形成的二硫键也有助于分子间的均齐聚化。然而,由于这两个环区的低局部分辨率和高灵活性,我们无法自信地建立相互作用的模型。二聚体在WHV和HBV球形svp中的取向不同。在WHV中,每个H3 (Gly180-181)的尖端面向三倍中心和四倍中心,而在HBV中,它面向两倍中心(图S5)。WHV和HBV之间大约有70°的旋转。因此,WHV和HBV球形svp在不同界面的二聚体之间的相互作用非常不同。
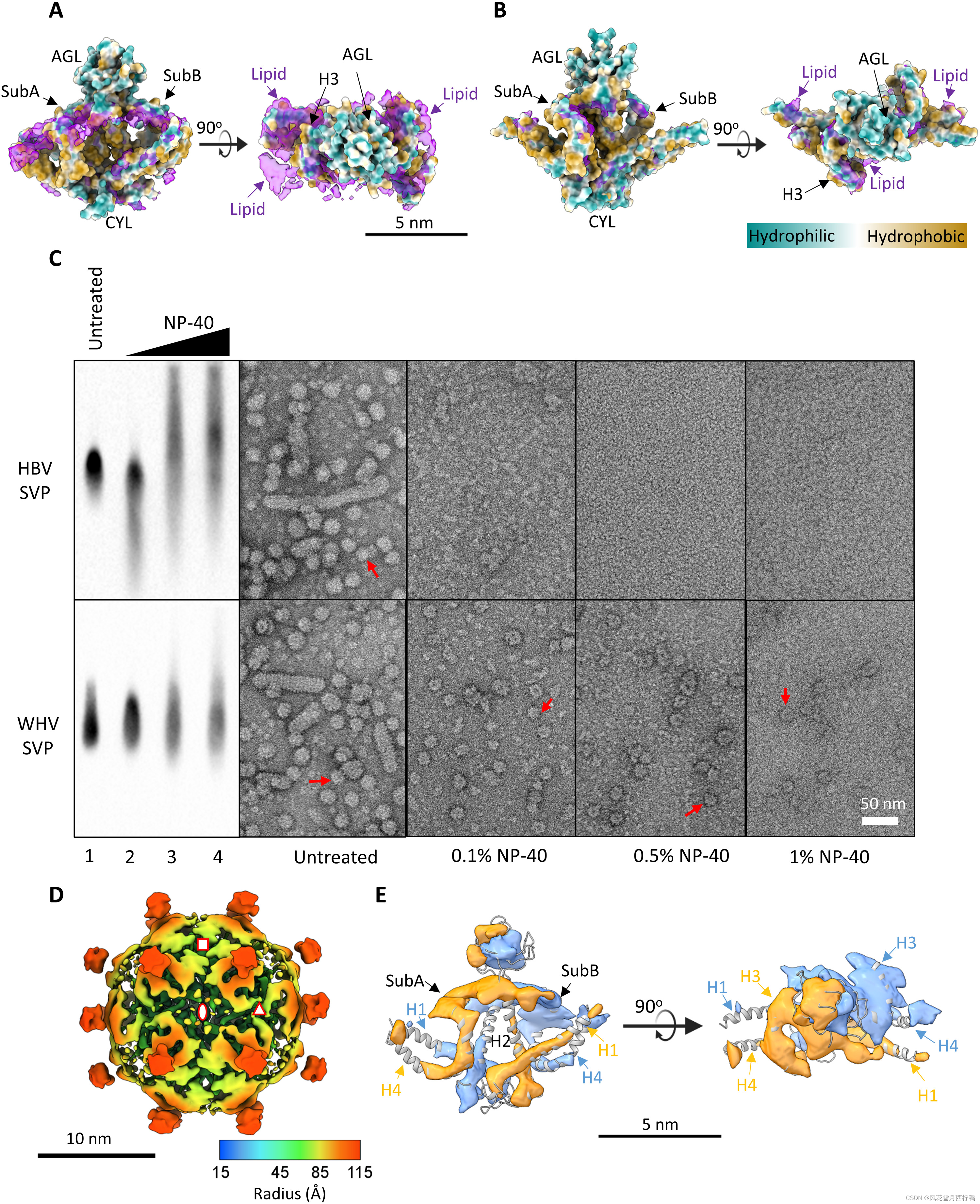
图4所示。脂类对维持WHV和HBV SVP完整性的影响。
脂质密度在WHV (A)和HBV (B) svp中的位置。S蛋白二聚体的侧(左)和上(右)视图(以局部疏水性着色)与二聚体的分割冷电镜密度图(紫色,不包括AGL区域)叠加显示WHV SVP含有更多的脂质密度。
(C )脂质去除对WHV和HBV SVP稳定性的影响。从WHV和HBV透析的含有CsCl F16的svp,未经任何进一步处理(未经处理)或在室温下用增加浓度的NP-40(0.1, 0.5和1%)处理30分钟,然后进一步分析。样品用1%的NAGE溶解,并用针对HBsAg的pAb免疫印迹(ViroStat)进行免疫印迹。用负染色电镜观察样品。比例尺,50 nm。完整的颗粒用红色箭头表示。
(D) 0.1% NP-40处理下WHV小球形SVP的Cryo-EM 3D重建。9.7-Å cryo-EM密度图呈放射状着色,并在双轴上观察。不对称单元由三个符号包围。八面体对称轴用红色符号表示:两重(椭圆形),三重(三角形)和四重(正方形)。三维重建是在电子密度覆盖原子结构的水平上绘制的。
(E) S-WH二聚体的cryo-EM密度图与原子结构配合灵活。
Lipid in the SVP of both WHV and HBV
WHV和HBV SVP中的脂质
在结构上,我们通过冷冻电镜重建观察到WHV和HBV球形svp中不同数量的脂质分布。我们的数据表明,粒子通过疏水相互作用保持(图S8)。每一个二聚体都被安排在粒子的最外和最内表面有亲水性残基暴露(图S8)。我们想知道,如果脂质被去除,粒子会发生什么变化。
为了测试脂质在颗粒稳定性中的作用,我们使用不同浓度的非离子洗涤剂Nonidet P-40 (NP-40)去除svp中的脂质,而不使蛋白质变性(图4C)。值得注意的是,通过NAGE Western blot分析和TEM阴性染色判断,NP-40降低了WHV和HBV的SVP完整性(图4C)。仅在0.1% NP-40处理下,HBV svp完全坍塌成更小的密度(图4C,顶部)。与未经处理的样品相比,蛋白质带的迁移速度略快(图4C,顶部,通道1和2)。增加的NP-40浓度进一步将这些结构分解成不同大小的更小的球状密度,导致在NAGE上的迁移更慢和更广泛(图4C,顶部,通道3和4)。一个可能的解释是,小表面抗原含有整体正电荷,如果完全暴露在拆卸的中间体中,可能会减缓蛋白质迁移。然而,随着NP-40添加量的增加,表面抗原信号明显减少(图4C),这与早期的发现一致。
与HBV相比,即使在1% NP-40处理下,一些WHV SVPs仍保持颗粒完整性(图4C,底部),定性地表明WHV SVPs中脂质含量较高或脂质更难提取。我们尝试用冷冻电镜(cryo-EM)重建0.1% NP-40处理的WHV SVP;然而,分辨率被限制在9.7 Å。低颗粒数和可能部分缺陷的表面组织可以解释最终分辨率的降低(图4D)。在螺旋区观察到明显的差异。首先,H1、H2和H4螺旋处密度较弱(图4E)。较弱的密度表明这些区域的部分螺旋结构域(H1,氨基酸3至21;H2,氨基酸80 ~ 93;和H4,氨基酸209至222)对应于一个瞬时占据构象。其次,三重轴上的螺旋(A亚基:H3和H4)与四重轴上的等效螺旋(B亚基:H3和H4)相比,脂质含量更少。一旦这些脂质被移除,螺旋结构域就变得更加灵活。综上所述,我们的研究结果表明,脂质在稳定svp结构方面起着重要作用。
DISCUSSION
多年来,HBV球形SVP的结构报道基本上是相互矛盾的(14-17)。尽管在序列、突变和生物物理分析的基础上早就提出了螺旋的密度(图1),但没有一种三维重建显示出清晰的螺旋密度。缺乏高分辨率结构阻碍了我们对表面抗原和svp的空间组织的理解。在这项研究中,我们使用冷冻电镜单颗粒分析分别检测从感染土拨鼠和患者血清样本中分离的WHV和HBV球形svp。据我们所知,这是第一个分辨率达到亚纳米分辨率的球形svp的3D模型(图2E和3E)。我们的低温电镜结构显示,这两种SVPs都被组织成直径约为23纳米的菱形六面体状颗粒。每个颗粒包含24个不对称的S表面蛋白二聚体,这些二聚体由离散的脂质斑块组装而成,这与典型的脂质双分子层组织不同。为了了解颗粒形成的机制,我们进一步使用冷冻电镜密度图对AlphaFold2的预测结构进行建模,并获得了WHV和HBV S蛋白的第一个可靠的原子结构(图2F和3F)。
S dimerization is the building block of small spherical SVP for both WHV and HBV
S二聚化是WHV和HBV小球形SVP的基础
先前的研究通过分子模拟(14)和诱变(9,31,32,40,41)假设存在S蛋白二聚化,但基于荧光相关光谱,AFM和cro - em(16,18,42)也报道了有争议的结果。我们的冷冻电镜三维重建和分割为鉴定svp中S蛋白的寡聚化状态提供了直接的可视化证据(图2F、3F和图S3B)。通过非对称重建,我们发现svp排列成具有24个突出尖峰的菱形面晶格(图S2)。类似的对称结构也存在于内质网(ER)的COPII(外壳蛋白复合物II)包被的囊泡运输机制中(43)。svp是否利用COPII囊泡运输到er -高尔基体中间室需要进一步调查(44)。通过施加八面体对称,我们能够提高最终的分辨率,并确定每个spike是由一个不对称的S蛋白二聚体组成。因此,在球形SVP中共发现48个S蛋白。我们的结果与之前报道的每颗粒70到100个S蛋白拷贝数有明显不同(14,16,18,41,42,45)。这种差异可以用SVP样本中不同程度的异质性来解释。我们观察到的颗粒尺寸范围很广(图2D、3D和图S1)。直径较大的颗粒在表面有明显的缺陷(图S1),被排除在图像分析之外。同样,具有更多表面蛋白的管状svp也被排除在外。这些颗粒可能有助于这些早期研究中S蛋白数量的计算。
结合cryo-EM密度图和预测的AlphaFold2结构,我们发现H1/H4、H2/H2、AGL和CYL参与了S蛋白二聚化接触。对S-HBs的诱变分析表明,替换残基Phe158、Trp165和其他涉及两亲螺旋疏水表面的残基(H3中的氨基酸156至169),以及Arg79和部分H2(氨基酸80至98),显著降低了SVP的分泌(10,31,32),这也被发现参与亚基内(单体)或亚基间(二聚体)的多种蛋白质相互作用(图S7)。此外,我们的结构证实了抗hbsag单克隆抗体(Mab) 4-7B识别的独特表位序列(氨基酸178至186)表面暴露在H3(46)。与我们的3D模型一致,氨基酸8至22 (H1)的突变分析,氨基酸24至28 (H1)的缺失,氨基酸178至226 (H3和H4)的缺失仍然允许SVP形成,这表明这些区域不是S蛋白寡聚化所必需的(31)。尽管AlphaFold2对四个螺旋结构域(包括平行放置在粒子表面的水平H3螺旋)的预测模型具有很高的精度,但非二级结构区域的结果需要非常谨慎地看待(图2)。S3, S4, S7和表S1)。在所有预测模型中,环流区域的空间组织高度发散,前后螺旋的角度不同。在WHV和HBV中,颗粒内S蛋白二聚体的取向不同(图2)。S4和S5)。我们推测这种差异源于AGL区域不同的蛋白质折叠。虽然AGL的蛋白质序列是可变的(图1B),但该区域的8个半胱氨酸残基是高度保守的,并直接参与二硫桥的形成和/或颗粒分泌(9,47)。内质网上的二硫异构酶可能催化了人类和土拨鼠表面蛋白质之间不同水平的分子内和分子间二硫键的形成,这允许蛋白质以不同的方式折叠,并支持这里观察到的S二聚体的旋转(图2E和3E以及图S5)。我们的低温电镜密度图没有足够高的分辨率来直接模拟环路区域,这需要在进一步的研究中澄清。
Noncanonical membrane organization of WHV and HBV spherical SVPs
WHV和HBV球形svp的非典型膜组织
我们在WHV和HBV球形svp中均未观察到典型的脂质双层结构(图2、3和图S6)。尽管二维类平均和三维重建模糊地显示了两层密度,但我们的低温电镜分析显示,外层密度由平行于颗粒表面平面的H3和位于不同螺旋之间的离散脂质斑块组成。插入内质膜时原本面向胞质侧的内层密度由H1、CYL的c端区域和H2的n端区域形成,形成高度弯曲的亲水表面(图2、3和图S8)。管状螺旋结构域的密度远高于脂质部分的质量,这使得它在更高密度阈值下轮廓时更加明显(图S3B)。
表面抗原在球形SVP中的取向使得最内层和最外层表面亲水,并将疏水螺旋包裹在中间(图S8)。这种空间排列和蛋白质相互作用使svp与低密度脂蛋白(ldl)有很大的不同。与ldl不同,球形svp具有更高的蛋白脂比(表S3)和有序的内核(图S2)(23,42)。暴露的疏水区域被脂质斑块覆盖(图4、A、B和图S6),可能是为了稳定颗粒。我们发现,通过NP-40去除脂质含量会使颗粒不稳定(图4C),并解开部分螺旋结构域(图4、D和E)。此外,电子自旋共振、原子力显微镜和时间分辨荧光光谱实验表明,脂质分子与S蛋白紧密结合,导致固定状态(14,22,41,42),不同于传统双层构象中的流体嵌合脂质分子。根据WHV和HBV svp中显示的蛋白质排列和非典型脂质斑块,我们的研究结果表明球形svp是脂质稳定的“蛋白质样”颗粒(图2E和3E)。
球形svp的形态发生始于S蛋白在内质网膜的易位、二聚体的形成、转运到内质网-高尔基体中间区以及寡聚化成颗粒(4,32,48)。一个令人困惑和没有答案的问题是,颗粒的形成是如何使内部脂质层脱落的。虽然具体的机制还有待进一步阐明,但我们可以提供一些可能的解释。由于单个S蛋白二聚体之间的横向相互作用,膜曲率使CYL区域紧密地聚集在一起,并取代了细胞质脂质(21,22)。我们的冷冻电镜结果也支持这一假设。球形svp的内核直径约为7.0 nm(体积为181 nm3),可以容纳48个亚基(体积为180 nm3)的所有CYL区域,几乎没有给脂质膜留下空间。
将原子模型与冷冻电镜密度图相结合,我们发现WHV球形svp比HBV球形svp含有更多的脂质(~25% v/v),比HBV球形svp (~20% v/v;表S3)。基于洗涤剂的脂质去除也表明,WHV球形svp对NP-40处理具有更高的抗性(图S4)。由于脂质和蛋白质的相互作用在S蛋白的功能和结构完整性中起着重要作用(41,49),去除脂质破坏了脂质-蛋白质界面,降低了螺旋含量,降低了颗粒的抗原活性,并影响了svp的组装(13,38)。在WHV中,S蛋白的亚基内和亚基间相互作用比HBV强(图S7和表S1)。不同对称轴S蛋白二聚体之间的总疏水相互作用在WHV中也高于HBV球形svp(表S2)。总之,我们的研究结果表明,WHV球形SVP比HBV更稳定。
Conformational flexibility of spherical SVP
球形SVP的构象柔性
对于WHV和HBV,我们的cyro-EM 3D重建分辨率分别限制在6.5和6.3 Å。有几个潜在的原因阻碍了在这里达成的整体解决方案,而且很可能不止一个是促成因素。首先,两个柔性环区域CYL和AGL会影响估计分辨率。AGL区域的低温电镜结构密度最低(图S3B),局部分辨率最低(图S2、D和E)。同样,AlphaFold2还预测了AGL和CYL区域具有不同二级结构元素的不同结构,置信度非常低。由于密度分辨率较差,我们无法自信地将这两个环区的结构模拟到cryo-EM密度中(图S3C)。此外,可能每个尖峰的不对称性与SVP中只有一半的agl被发现是n糖基化的;但n -聚糖在颗粒上的分布和组成仍有待确定(6,7)。
其次,M蛋白也参与球形SVP的组装,尽管其数量少于S蛋白(50,51)。PreS2结构域N端的附加残基暴露在颗粒表面(52),并可能在空间上阻碍邻近的亚基。如果粒子中只有少量M蛋白随机结合,那么在我们的数据处理过程中,它们的密度将通过应用八面体对称来平均。令人感兴趣的是,如图S1所示,具有涂抹表面的颗粒是由几个M蛋白在局部积聚而中断颗粒晶格的结果。最后,SVP上不均匀的脂质密度也影响了分辨率估计(图S2D)。脂质,其密度与螺旋相比不太明确,对稳定SVP结构很重要。尽管脂质分子与S蛋白紧密相关(21,22),但它们也具有较低的局部分辨率(图S2),这可能是因为它们的脂肪酸组成和与疏水表面相关的取向的变化。同时,表面蛋白质和脂质的构象灵活性和组成异质性可能阻碍高分辨率结构的确定。
综上所述,迄今为止,我们已经使用冷冻电镜将WHV和HBV的球形SVP的最高分辨率解决到亚纳米分辨率。结合AlphaFold2的预测,我们提出了WHV和HBV小表面抗原的详细原子结构。我们描述了由24个小表面抗原二聚体组成的球形SVP的结构和组装机理。由于纳米颗粒是现代疫苗设计的潜在有效平台(53),我们对这些机制的理解的改进可能有助于未来设计新的抗病毒策略。
MATERIALS AND METHODS
Purification and identification of SVPs
svp的纯化与鉴定
Sequence alignment and helix prediction
序列比对和螺旋预测
Negative-stain TEM
负染色透射电镜
Cryo–electron microscopy
Image processing and 3D reconstruction
使用MotionCor2进行剂量加权运动校正,使用RELION (v3.1)软件中的ctffind4估计对比度传递函数参数(27)。
WHV和HBV svp数据集采用相同的数据处理方案。一般来说,粒子是半人工挑选的,并使用RELION进行无参考的二维分类(27)。在使用C1对称为每个数据集建立初始模型后,获得低分辨率3D模型,并进一步用作RELION中所有显微照片的自动颗粒拾取的参考模板。多次进行无参考的二维分类,以丢弃密度模糊和冰污染的类别。应用于颗粒拾取的模型也被用于初始的三维分类和使用C1对称的三维细化。数据处理从bin = 8的像素大小减小开始,逐渐向上移动到bin = 2。在定义了对称性之后,随后使用三维分类结果中与八面体对称对齐的C1模型对低温电镜密度图进行了细化。细化过程继续进行,直到没有进一步的改进发生,随后是使用b因子锐化的后处理步骤。WHV SVP的最终三维重建共使用了34,520个粒子,分辨率为6.5 Å, HBV SVP的最终三维重建共使用了36,166个粒子,分辨率为6.3 Å。地图的分辨率由傅立叶壳相关准则在0.143截止点确定(图S2C)。
可视化是在UCSF ChimeraX (v1.3)中完成的,具有“隐藏灰尘”功能(WHV为4.3,HBV为6.8),以消除组成数字时的一些噪声(58)。使用ChimeraX从DeepEMhancer(59)后处理图中分割所有蛋白质亚基密度。在Relion中估计了局部分辨率。我们用平均蛋白质密度1.3 g/cm3进行体积计算。
Protein structure predictions and atomic model buildup
蛋白质结构预测和原子模型建立
在目前的分辨率下,信息不足以直接从密度建立可靠的原子模型;然而,螺旋已经可以被识别(图S3B)。使用AlphaFold2预测小的表面蛋白结构,使用谷歌Colab AlphaFold2_advanced.ipynb (33)。没有模板信息用于结构建模。多序列比对采用ColabFold的快速比对方法。对于所有目标,生成了五个模型。他们对螺旋形区域的信心得分都很高,但对环状区域的信心得分相对较低。尽管来自不同模型的螺旋的长度和构象几乎相同,但螺旋之间连接的环的取向不同(图S4, A和B)。
利用ChimeraX将S表面蛋白的预测原子模型作为一个刚体对接到分割的cro - em密度图中,以寻找最佳拟合模型。使用ISOLDE(34)和ChimeraX(58)进行柔性模型拟合。使用Coot进行额外的实空间细化(35)。侧链取向运动和原子位置根据已发表的蛋白质-蛋白质相互作用数据进行局部细化,并使用原子中心上电子密度值的加权和。Ramachandran图、键几何、转子和冲突也被优化以获得最终的3D模型。
利用优化后的模型,采用上述柔性拟合步骤,根据二聚体密度分段构建二聚体模型。使用MOLPROBITY检测侧链冲突和Ramachandran(60)。然后使用ChimeraX中的“Fit in map”功能将二聚体模型刚体拟合到完整的DeepEMhancer后处理图中。然后利用八面体对称运算生成全粒子模型。
在ChimeraX中进行亚基之间的接触和相互作用分析。脂质密度计算通过从冷冻电镜图中减去低通滤过的WHV和HBV SVP原子结构(使用molmap分别生成6.5和6.3 Å的图)来进行。计算中不包括CYL和AGL环区。在ChimeraX中完成疏水残基(Ala、Val、Ile、Leu、Met、Phe、Tyr和Trp)的掩埋表面积和表面疏水渲染。
Removal of lipid from the SVP surface
从SVP表面去除脂质
将富含HBV和WHV svp的透析CsCl馏分与NP-40在室温下孵育30分钟。在孵育开始前加入终浓度为0、0.1、0.5和1%的NP-40。如上所述,用NAGE和阴性染色检查混合物。按照上述相同的程序(表S4)对0.1% np -40处理的WHV球形svp进行冷冻电镜分析。





















 618
618











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








