文章来源于微信公众号(茗创科技),欢迎有兴趣的朋友搜索关注。
导读
经颅磁刺激(TMS)是一种有效的治疗难治性抑郁症的方法。TMS很可能诱导抑郁症中异常回路的功能连接性变化。脑电图(EEG)微状态是模拟大规模静息态网络的地形图。目前,典型微状态被认为是重度抑郁症(MDD)的标志,但尚不清楚它们是否或如何在经颅磁刺激后发生改变。本研究采用静息态EEG测量了49名重度抑郁症患者在基线和为期6周的每日经颅磁刺激后的脑电图。研究结果发现,从所有脑电图数据中识别出6种微状态(MS-1 - MS-6)。对TMS的临床反应与MS-2特征的增加有关,同时MS-3指标下降。无应答者在任何微状态下都没有发现显著变化。在经颅磁刺激治疗过程中,MS-2(增加)与MS-3(减少)的发病率和覆盖率的变化与TMS治疗过程中症状改变幅度相关。
前言
重复经颅磁刺激(rTMS或简称TMS)是治疗难治性重度抑郁症(MDD)的有效疗法,TMS能够对抑郁症症状功能失调的脑网络进行调节。影像学研究表明,TMS激活远端节点的特定功能网络,进而引发与临床改善相关的持续连通性变化。除了整体效应外,TMS重复脉冲使刺激部位的皮层振荡与刺激频率同步。这些局部动力学似乎也与TMS的作用机制有关,因为在TMS治疗期间,个体的内源性α峰值频率与刺激频率的接近同更好的治疗反应有关。
虽然经颅磁刺激疗法对没有从标准抗抑郁药物试验中受益的人群的疗效是比较稳定的,但只有大约50%的经颅磁刺激患者在6周的每日疗程中得到了改善。这些差异可能反映了广泛的抑郁症诊断中的异质性病因。功能磁共振成像(fMRI)已经将这种异质性量化为静息态功能连接的差异,但最近的研究表明,脑电图(EEG)头皮记录可以准确描述抑郁症亚型。特别是考虑到与fMRI相比,其成本相对较低、便携性和易用性,利用脑电图识别经颅磁刺激临床样本的内部诊断差异,有望通过个性化、有针对性的方案和预测治疗结果来改善疗效。
最近有研究利用脑电图微状态描述了抑郁症的大规模网络的动态变化。脑电微状态是常出现在静息态脑电中的半稳定、瞬态电压地形图。个体持续反复出现的微状态电压地形可能是由大脑连接区域的重复共激活产生的,从而产生一种持续反复出现的、暂时稳定的正、负电压模式,可以在头皮上检测到。微状态持续大约80毫秒,然后才转向另一个暂时稳定的模式。几乎所有被试都存在一组四种规范的微状态(A-D),这些状态被认为代表了大规模网络节点的同步活动。微状态提供了从整个脑电图蒙太奇中以计算优化的方法捕捉皮层活动的能力。虽然清醒脑电图中普遍存在四种典型原型,但在任何特定的研究中,都可以从脑电图记录中对微状态进行聚类,无需预先假设需要选择典型地形图的数量;相反,拟合优度指标决定了每个数据集中地形的最佳数量。这种数据驱动的方法有利于研究异常(即非典型)网络可能表现出的临床症状的脑部病变。
静息态皮层活动的时间动态异常与神经精神疾病(如精神分裂症、谵妄和多发性硬化症)中特定的脑电图微状态相关。最近,Murphy和同事发现了表征MDD的状态和特征微状态,Yan等人的研究也证实了与选择性血清素再摄取抑制剂(SSRI)介导的MDD改善相关的微状态变化。此外,某些微状态预测了同时接受磁癫痫治疗(MST)和电痉挛治疗(ECT)的难治性抑郁症患者的临床反应。描述经颅磁刺激对微状态影响的数据仅限于一项对精神分裂症患者的研究;两种微状态持续时间的变化被解释为与症状相关网络的正常化。本研究在自然环境下对接受标准的六周rTMS治疗的难治性重度抑郁症患者的微状态进行了研究,以评估与rTMS相关的可能的微状态变化及其与治疗结果的关系。研究者预测,抑郁症状改善的患者的微状态会有选择性地改变,能够反映出参与MDD病理和经颅磁刺激作用机制的大规模功能网络的调节情况。
方法
被试:所有受试者均通过临床访谈,通过经验丰富的精神科医生应用《精神疾病诊断与统计手册》(第5版)中的诊断标准,确诊为重度抑郁症。受试者在巴特勒医院TMS诊所接受标准疗程的TMS治疗。脑电图数据收集的研究方案得到了当地医院机构审查委员会的批准。所有受试者在进行任何手术前均提供知情同意。患者在接受经颅磁刺激治疗前进行常规体检,并在治疗前基线和每5次经颅磁刺激治疗后使用标准化的自我报告抑郁评估量表进行评估。
临床疗效:基于30-项/题抑郁症状量表、自我报告量表(IDS-SR)总分的变化(从治疗前基线到终点,以相对于基线的百分比表示)。分类临床“反应”被定义为在接受TMS后,IDS-SR总分下降≥50%的EEG。该测量方法被广泛应用于经颅磁刺激治疗抑郁症的临床和研究领域中。在相关和回归分析中,IDS-SR在治疗期间的变化作为基线调整终点评分。抗抑郁药物的反应可能是非线性的,因为更严重的抑郁患者在终点显示出更大的百分比变化。作为一种更适合于建模目的的症状严重程度变化的测量方法,研究者使用基线IDS-SR对TMS后IDS-SR评分进行了六节限制性三次样条回归分析。采用三次样条回归方法具体量化微状态指标显著变化与抗抑郁药变化的相关性。用这种方法从终点测量中回归出基线评分,生成一个转换后的值,以更严格地评估神经影像变化与抗抑郁药效果的关系。
经颅磁刺激治疗过程:患者在Neurostar(Neuronetics Inc.,Malvern, PA)的TMS设备上接受一系列每天一次(工作日)的TMS治疗,该设备带有带有铁芯的数字8线圈。治疗过程按照Butler TMS诊所的护理标准进行,通常对左侧背外侧前额叶皮层(DLPFC)实施10Hz或5Hz的刺激,相对于左侧静息运动阈值,每次共计3000次脉冲。在耐受性差的情况下,一些患者(n=4)在右侧DLPFC上转变为单侧1Hz刺激(每次1800次脉冲)。一个典型的TMS治疗疗程包括为期6周的30次治疗,然后是6次附加治疗,但根据临床反应和其他因素,少数患者在治疗过程中接受了较少或更多的治疗。
EEG记录与处理:以2000Hz或2048Hz采样率记录64导脑电图数据,以CPz电极为参考。在每个患者的第一个疗程(前)和6周(后)疗程结束时使用ANT TMS兼容的EEG系统(Advanced Neuro Technology [ANT]; Enschede, the Netherlands)进行记录。每次采集5 min的闭眼静息态EEG。离线预处理在MATLAB (2019b, the MathWorks Inc)的EEGLAB工具箱(v2020.0)中进行。假设双侧乳突电极点不包含神经数据,并将其移除,留下61个通道用于分析。使用EEGLAB的pop_resample抗混叠滤波器将数据采样降至200 Hz,截止频率为160Hz,过渡带宽为80 Hz,高通滤波为1 Hz,并通过EEGLAB的clean_rawdata去除大量伪迹。采用球面样条插值坏导。数据进行重参考,使用Zapline去除60Hz线路噪声。降采样和处理后的数据再使用AMICA进行独立成分分析。通过将单个等效电流偶极子拟合到头模,使用DIPFIT3 (v3.4)对成分进行定位。用两个标准识别神经成分:用ICLabel(v1.2.3)标记残差方差<15%的大脑成分。在进行进一步分析之前,去除非神经性伪迹成分。在微状态分析之前,预处理记录数据进行30Hz的低通滤波。
微状态聚类:聚类算法采用极性不敏感的改进K-means算法。根据全局解释方差和交叉验证准则在k范围上的优化值来确定原型地形图的数量。Krzanowski-Lai (KL)准则是一种附加的、常用的用于选择微状态数的测量,然而,KL不是一个极性不敏感的测量方法,因此,本研究分析未采用此方法。在选择状态数及其对应的电压图后,原型图被反拟到研究样本(n=49)的整个记录期间。采用winner-take-all方法将每个脑电信号标记为微状态,将脑电信号分割为多个微状态。最小微状态段持续时间设置为30 ms。从微状态标签时间序列中提取三个感兴趣的变量:发生率、覆盖范围和持续时间。发生率是微状态出现的频率,以状态/秒为单位;覆盖率测量由给定的微状态主导的总记录的比例;持续时间是平均长度,以毫秒为单位,微状态类在出现时保持活动状态。
源分析:利用MATLAB的Brainstorm工具箱对微状态进行源定位。提取个体脑电图数据并进行微状态连接。这些连接在一起的微状态记录被导入到Brainstorm工具箱中。将标准10-20电极位置与ICBM25模板头部MRI进行共配准,使用OpenMEEG计算边界元模型正解。标准化低分辨率电磁断层扫描(sLORETA)将头皮信号定位到皮层受限的源空间。对于每个被试,计算个体微状态源激活的平均时间。对于每个微状态,被试平均源地图进行Z分数、校正和组平均。群体平均地图的激活阈值高于95%。由于计算上的限制,源分析仅对TMS前的记录数据进行。
结果
临床疗效:在TMS治疗过程中,患者的抑郁症状显著减轻。在进行后续的EEG数据采集时,21/49(43%)符合TMS分类反应标准。有反应者和无反应者在任何基线临床特征上均无显著差异。
微状态分析:从175份聚类记录中识别出6个微状态(图1)。这些记录包括了脑电数据收集的TMS前(n=110)和TMS后(n=65)阶段,代表了在研究者的TMS诊所治疗的98个独特的MDD患者。治疗后和前的记录数据分别为65和61个。61个匹配的TMS前和后的记录数据包括52个独特的受试者,因为有一些受试者接受了多个TMS治疗疗程。3例患者的临床结果不完整,因而从数据集中删除,最终49例样本用于正式分析与TMS相关的微状态变化。

图1.微状态地形图(A);代表性样本的微状态分割(B);分析流程(C)。
这6个微状态解释了76.5%的全局方差,所有记录的交叉验证得分为0.3。单个微状态(MS1-MS6)的GEVs依次为0.31、0.19、0.095、0.093、0.064、0.051。正如预期的那样,MS-1对应典型C,MS-3对应典型D,MS-4对应典型B,MS-5对应典型A。MS-2似乎同样是典型C的衍生物。研究者使用这种视觉相似性作为与先前相关微状态调查比较的基础。
补充图.当前微状态与文献中典型微状态的比较。
与基线特征的微状态关系:在基线时,治疗前的抑郁症严重程度与MS-1覆盖率(r=0.34,p=0.02)和发生率(r=0.33,p=0.02)相关。没有其他微状态指标(覆盖率、发生率、持续时间)与抑郁自评得分相关。在基线时,年龄和性别与任何微状态指标都没有显著相关。
与TMS治疗相关的微状态变化:重复测量混合模型结果显示,时间对MS-2和MS-3的主效应显著,表现为MS-2的增加和MS-3的减少。当采用配对t检验分析TMS前和TMS后的变化,并采用多重比较校正时,合并样本(n=49)的平均变化均未达到显著性水平(图2)。
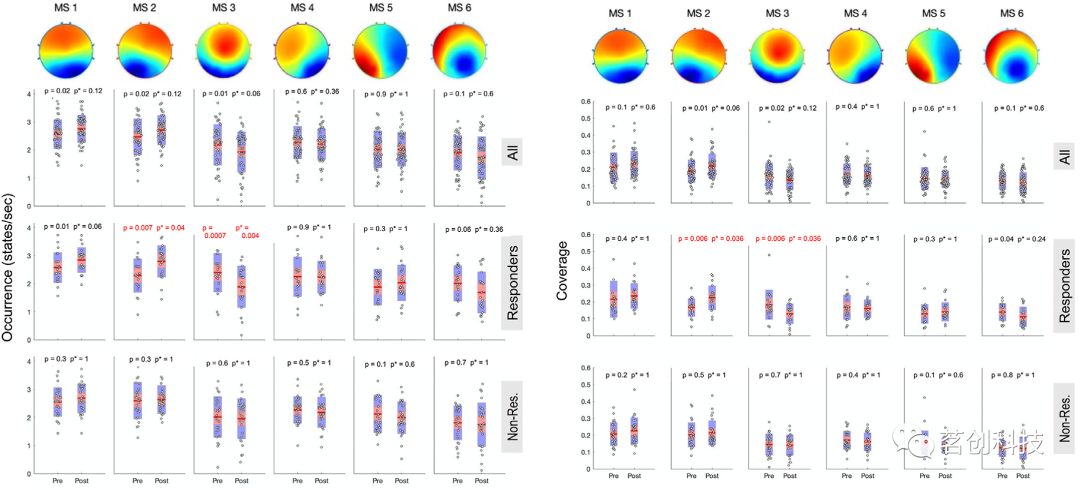
图2.TMS后的分类微状态变化。
微状态变化与TMS治疗反应相关:研究者评估了每个应答者的微状态变化,重复测量模型显示,应答者状态对MS-2的发生率有显著影响。当年龄和性别作为协变量纳入分析时,这一发现仍然显著。TMS应答者(n=21)从治疗前到治疗后的发生率和覆盖率显著增加。相比之下,无应答者(n=28)在MS-2的发生率、覆盖率或持续时间方面没有明显变化。应答者MS-2的持续时间在疗程前后没有发生明显变化。
对于MS-3,重复测量模型显示出应答者状态对发生率变化、持续时间和覆盖率的趋势水平的影响显著;在敏感性分析中,p值随年龄和性别保持不变或进一步降低。配对t检验显示,在应答者中,MS-3的发生率降低。MS-3覆盖率从基线下降到终点。应答者MS-3持续时间无显著变化。无应答者在MS-3的发生率、覆盖率或持续时间方面没有显著变化。事后检验表明,MS-2特征的增加和MS-3特征的减少是显著相关的。
微状态1、4和5显示,无论是应答组还是无应答组,在TMS治疗过程中均无显著变化。在观察MS-2和MS-3的特定应答者变化后,研究者评估了微状态变化与抑郁症状改善程度的相关关系(图3)。对每个微状态指标(发生率、覆盖率、持续时间)的时间点(前后)之间的变化与症状变化的相关性进行了检查(IDS-SR终点评分经基线校正,负值越大,抑郁症状减轻程度越高)。MS-2发生率(图3a)和覆盖率(图3b)的增加与抑郁症状的改善显著相关。反过来,MS-3发生率(图3c)和覆盖率(图3d)的大幅降低与症状改善相关。

图3.抑郁症状与微状态变化的相关性。
微状态网络定位:在fMRI/EEG联合研究中,已有多篇研究报道将典型微状态与某些功能网络联系起来,并使用各种算法实现了微状态EEG信号到皮层的源定位。微状态在神经源中重叠,同时也保留了不同的网络属性。根据观察到的MS-2和MS-3在TMS应答者中显著的相互变化,能够直观地比较其源位置。MS-2在额叶/颞叶极点、前喙扣带皮层、眶额皮层和前岛叶的激活最强烈。相比之下,MS-3表现为后扣带回、运动/前运动区和顶叶的活动。微状态1、3、4和5与之前对其相似典型微状态的定位十分类似(图4)。

图4.MS2和MS3的源定位。
讨论
虽然经颅磁刺激(TMS)是一种有效的治疗抑郁症的方法,但其作用机制仍不确定。TMS反应的异质性表明,至少在一定程度上,不同的潜在功能失调网络和MDD亚型在起作用。EEG衍生的生物标志物有望定义具有共同神经生理特征的抑郁症表型,并通过有针对性的治疗选择来改善疗效。在这项研究中,研究者确定了在一段时间内占主导地位的微状态网络,即在治疗前和治疗后的静息态EEG数据,然后评估了MDD患者在接受标准的为期6周的TMS治疗后,这些(六种)微状态的变化。
研究发现了两种特定的微状态(MS-2和MS-3)在应答者之间有显著的变化,但未发现基线微状态与治疗效果相关。然而,经过一个标准的TMS疗程后,好转的患者MS-2显著增加,MS-3显著减少。相关分析也表明,微状态2和3的变化幅度与临床改善程度显著相关。先前的fMRI/EEG研究试图将空间分辨率低的微状态网络转换成其皮层下的源。典型微状态C对应于本研究中的微状态2,且在背侧前扣带皮层(ACC)、额下皮层和右脑岛中有BOLD激活。这些区域,连同本研究中的微状态2源定位,与积极的情感回路有良好的重叠,包括眶额皮层、前额叶前部和下部以及ACC。
本研究的发现表明,在TMS应答者中,这种奖赏网络可能被激活得更频繁,时间更长,这可能有助于兴趣缺乏的改善。相比之下,微状态3在有效TMS后的覆盖率和发生率均有所下降。这一微状态对应于典型微状态D,两者都激活背侧和腹侧前额叶和顶叶皮层区域,用以支持注意和认知控制的抑郁网络。有趣的是,虽然抑郁症通常与认知控制网络连接不足有关,但其他证据表明,一些抑郁症患者确实在这个网络中存在超连接,这被认为有助于沉思,并进一步体现在该网络与默认模式网络之间的正相关关系。此外,由于抑郁症亚型可以用功能连通性差异来解释,刺激部位连通性可以预测TMS治疗结果,因此治疗引起的网络变化问题对TMS治疗的作用机制尤为重要。总而言之,本研究结果与之前的研究结果大体一致,表明背外侧前额叶皮层(刺激部位)和膝下前扣带回之间的连接与TMS治疗的结果相关,额顶神经网络在抗抑郁反应中发挥作用。这些神经调节诱导的微状态改变可能暗示了一种共同的目的性抗抑郁机制的存在。
原文:Large-scale EEG neural network changes in response to therapeutic TMS.
https://doi.org/10.1016/j.brs.2022.01.007
文章来源于微信公众号(茗创科技),欢迎有兴趣的朋友搜索关注。



























 915
915

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








