单细胞+空间转录组揭示胰腺癌中介导神经侵袭的独特细胞亚群

摘要
神经在肿瘤生物学中起着至关重要的作用,但神经周围和神经内的微环境及其在癌症神经侵袭中的作用仍鲜为人知。在此,我们对25名胰腺导管腺癌患者的62个样本进行了单细胞/单核RNA测序和空间转录组学分析,绘制了不同NI状态下细胞组成、谱系动态和空间组织的图谱。三级淋巴结构在低NI肿瘤组织中丰富,并与未侵袭的神经共定位,而在高NI组织中,NLRP3+巨噬细胞和癌相关肌成纤维细胞则环绕着被侵袭的神经。我们鉴定出一种独特的内神经膜NRP2+成纤维细胞群,并表征了三种不同的施万细胞亚群。TGFBI+施万细胞位于NI的前沿,可由转化生长因子β信号诱导,促进肿瘤细胞迁移,并与不良预后相关。我们还鉴定出具有不同形态和增强NI潜力的基底样和神经反应性恶性亚群。这一描绘肿瘤相关神经的图景突出了癌症-免疫-神经相互作用的关键作用。原位相互作用的研究为针对神经炎症的治疗开发提供了启示。
数据收集
62 samples from 25 pancreatic ductal adenocarcinoma patients
软件使用
软件包信息
工具名称 | 类型 | 应用领域 | 官方链接 | 核心功能 |
miloR | R包 | 细胞邻域分析 | bioconductor.org/packages/miloR | 基于KNN图的差异丰度分析(检测细胞群体变化) |
COMMOT | Python包 | 细胞通讯推断 | github.com/zhengli09/COMMOT | 空间细胞通讯推断(整合配-受体与空间距离) |
MistyR | R包 | 空间微环境建模 | github.com/saezlab/mistyR | 多尺度空间依赖建模(细胞内 vs. 微环境效应) |
Cell Ranger | 分析套件 | 单细胞数据处理 | 10xgenomics.com | 单细胞RNA-seq数据比对、定量与基础分析 |
Space Ranger | 分析套件 | 空间转录组 | 10xgenomics.com | Visium空间转录组数据对齐、基因计数与聚类 |

工具关系与工作流
graph LR
A[原始数据] --> B{10x平台}
B -->|单细胞| C[Cell Ranger]
B -->|空间| D[Space Ranger]
C --> E[miloR]
D --> F[COMMOT]
D --> G[MistyR]
统计方法信息
超几何检验 (Hypergeometric Test)
基本概念
·用途:评估富集显著性,检验抽样过程中”成功”次数的异常性
·应用场景:
oGO/KEGG富集分析
o差异基因/蛋白富集
o抽检质量检验
数学原理
P(X = k) = \frac{\binom{K}{k} \binom{N-K}{n-k}}{\binom{N}{n}}
双侧非配对Wilcoxon检验指南
基本概念
·统计名称:Two-sided Unpaired Wilcoxon Test
·别名:Mann-Whitney U Test / Wilcoxon Rank-Sum Test
·检验类型:非参数假设检验
·核心用途:比较两个独立组别的中位数差异
适用条件与假设
数据要求
·✓ 变量类型:连续变量或有序分类变量
·✓ 组别关系:相互独立(非配对设计)
·✓ 分布特征:不要求正态分布,但要求两组的分布形状相似
假设设定
·原假设 (H₀):两组的中位数相等(M₁ = M₂)
·备择假设 (H₁):两组的中位数不相等(M₁ ≠ M₂)
检验原理
基于秩次转换的非参数方法: 1. 将两组数据合并并按大小排序 2. 计算每组数据的秩和(Rank Sum) 3. 基于秩和计算检验统计量W
W = R_1 - \frac{n_1(n_1 + 1)}{2}
双侧对数秩检验完全指南
基本概念
·统计名称:Two-sided Log-Rank Test
·检验类型:非参数生存分析检验
·核心用途:比较两个或多个组的生存曲线差异
·别名:Mantel-Cox检验
适用条件与假设
数据要求
·✓ 数据类型:右删失生存时间数据
·✓ 终点事件:死亡、复发、疾病进展等
·✓ 组别关系:独立组别比较
关键假设
·比例风险假设:风险比(Hazard Ratio)不随时间变化
·删失机制:删失与组别无关(非信息性删失)
·独立性:观测值相互独立
检验原理
基于观察事件数与期望事件数的比较:
\chi^2 = \frac{(\sum O_i - \sum E_i)^2}{\sum \text{Var}(O_i)}
双侧Student’s t检验完全指南
基本概念
·统计名称:Two-sided Student’s t Test
·检验类型:参数检验
·核心用途:比较两个独立组的均值差异
·别名:独立样本t检验
适用条件与假设
数据要求
·✓ 数据类型:连续变量
·✓ 分布要求:近似正态分布
·✓ 方差齐性:两组的方差相近
·✓ 独立性:观测值相互独立
关键假设
·原假设 (H₀):两组的总体均值相等(μ₁ = μ₂)
·备择假设 (H₁):两组的总体均值不相等(μ₁ ≠ μ₂)
检验统计量
t = \frac{\bar{X}_1 - \bar{X}_2}{s_p \sqrt{\frac{1}{n_1} + \frac{1}{n_2}}}
实验验证方法
神经浸润单细胞分析方案
Scoring of Neural Invasion
病理评分标准
graph TB
A[组织切片] --> B{H&E染色}
B --> C[神经束识别]
C --> D{浸润程度评估}
D -->|无浸润| E[Score 0]
D -->|肿瘤接近神经| F[Score 1]
D -->|肿瘤侵入神经| G[Score 2]
D -->|神经破坏| H[Score 3]
研究成果
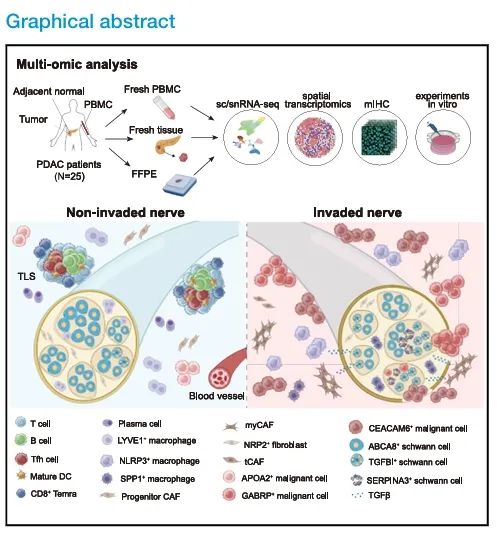
对具有低/高神经侵袭状态的人类胰腺导管腺癌组织进行单细胞和空间分辨分析
(A)工作流程示意图
(B)整合了单细胞RNA测序和单核RNA测序数据的主要细胞类型的均匀流形近似与投影可视化。
(C)显示肿瘤微环境簇的UMAP图表。
(D)基于斑点基因表达的基于空间生态位的聚类的UMAP图表。代表性样本PA#98中的空间生态位的映射。
(E)苏木精-伊红染色显示样本中侵袭的神经和未侵袭的神经。
(F)通过去卷积确定的每个空间生态位中相对细胞比例的热图。
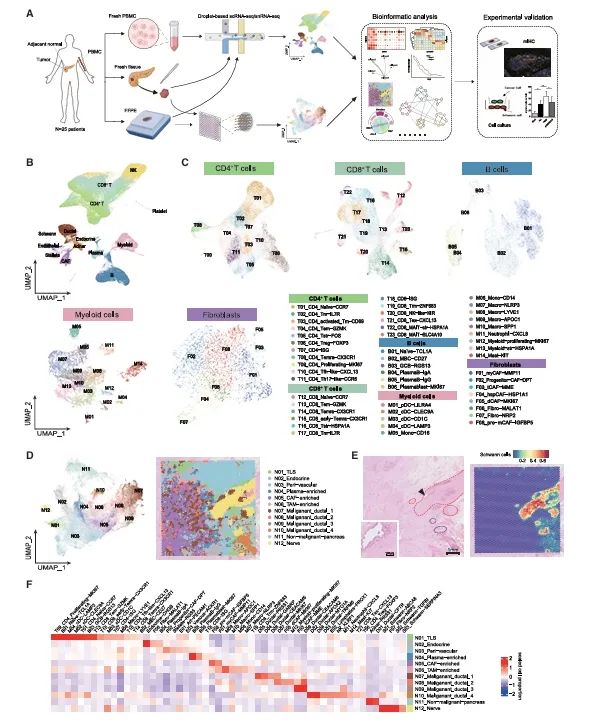
癌细胞亚群具有不同的侵袭能力
(A)导管细胞子簇的UMAP可视化图。
(B)已标注的恶性子簇与先前发表的特征的相似性比较。
(C)H&E染色展示了4个恶性子簇的形态特征。
(D)坐标图显示恶性子簇的相对丰度。
(E)脊线图展示了整个切片中空间生态位的比例。
(F)箱线图展示了恶性导管细胞亚群在恶性导管_1-4生态位中的比例,通过ST数据分析得出。
(G)通过基因本体富集分析得到富含D02_Ductal APOA2的通路。
(H)PROGENy 通路得分的热图(标签为列,行标签为行)。根据 PROGENy 通路得分进行着色。
(I)将标志性EMT基因集富集得分转换为密度得分,并映射到UMAP维度上。
(J)底部条形图显示了样本中恶性子簇的组成。
(K)H&E染色显示神经侵袭性导管细胞的形态特征。
(L)在侵袭性或非侵袭性神经的周边以及侵袭性神经内部的恶性子簇的比例。
(M)该图展示了与神经退行性疾病相关的基因得分情况,该得分是通过先前报道的与NI相关的基因的表达情况计算得出的,涵盖了恶性亚群。
(N)免疫组化染色显示,在代表性的高NI样本PA#11中,恶性细胞中GABRP和KCNN4存在共表达现象。
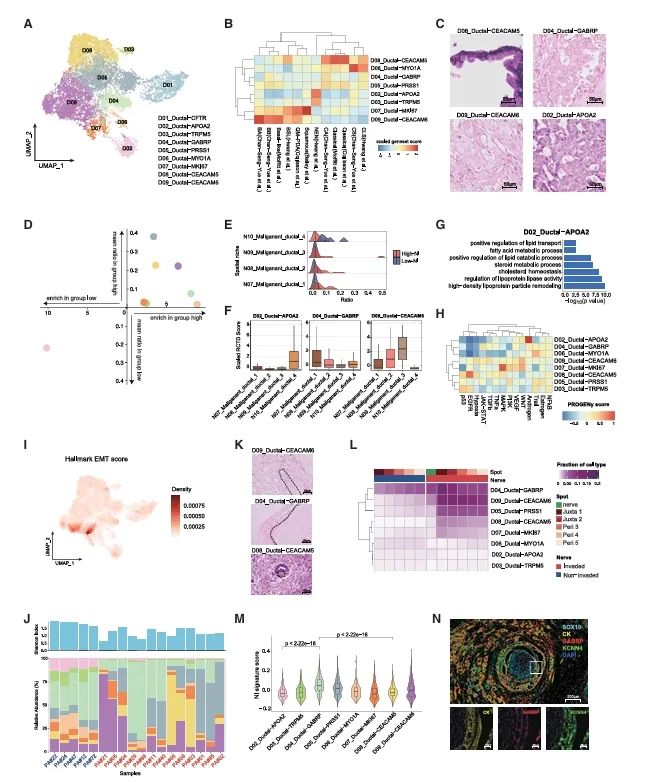
低镍型和高镍型肿瘤微环境之间细胞组成的变化
(A)通过罗/欧分析计算得出的棒状图,展示了在高NI和低NI肿瘤组织中每个免疫细胞子集和基质细胞子集的相对富集情况。
(B)比较了21个切片中高NI组和低NI组三种免疫细胞子集的比例。
(C)基于空间生态位比例对21个肿瘤样本进行主成分分析。
(D)显示整个切片中空间生态位比例的脊线图。
(E)通过STARTRAC分析展示低NI和高NI组中T细胞子簇的扩张指数和成对迁移指数的散点图
(F)雷达图展示了CD8_Temra-CX3CR1和CD8_Tex-CXCL13在不同空间生态位中的比例分布情况。
(G)免疫组织化学染色显示,在低NI的PDAC瘤样本PA#12的TLS周围,存在CD8+CX3CR1+NKG7 +T14_CD8_Temra-CX3CR1这一细胞分布区域。
(H)使用miloR制作的蜂群状图。
(I)肿瘤组织中不同子簇的共现情况。点的大小代表权威中心度。边的宽度代表每个样本中每对细胞类型比例之间的斯皮尔曼相关系数。仅显示代表斯皮尔曼相关系数大于 0.6 的边。
(J)在代表性低NI样本PA#72和代表性高NI样本PA#11中,F01_myCAF-MMP11和F02_Progenitor-CAF-DPT的定位及比例情况。
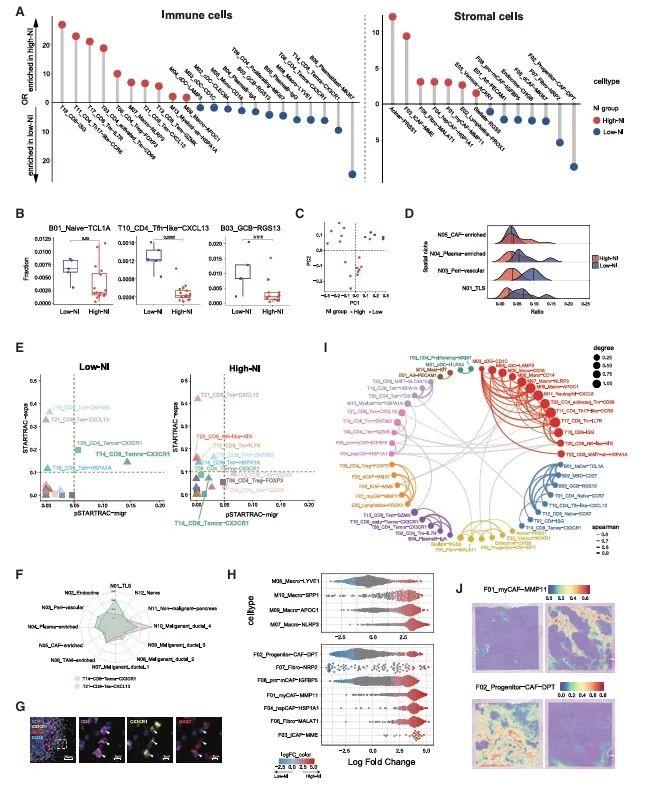
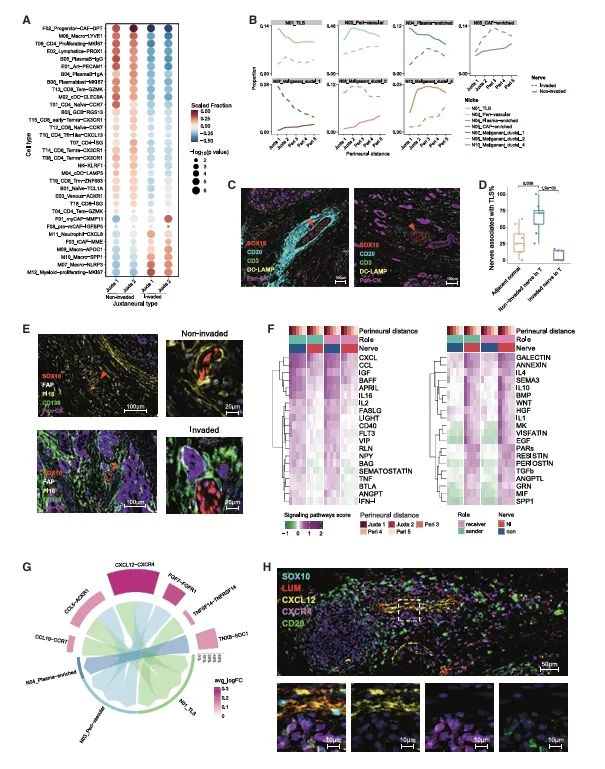
受侵神经和未受侵神经周围的微环境
(A)点图热图显示,在侵袭或未侵袭的神经旁微环境中存在显著富集的子簇。
(B)跨越从远离神经的最远点到紧邻神经的最近点的5个点的空间生态位比例。
(C)mIHC染色展示了代表未侵袭神经和代表侵袭神经的微环境。
(D)箱线图显示了在9对相邻的正常和肿瘤组织样本中,与TLSs相关联的未侵袭神经或侵袭神经的百分比。
(E)免疫组化染色显示,在低神经侵袭性胰腺导管腺癌肿瘤样本PA 72中,PI16阳性、FAP 阴性的癌旁成纤维细胞围绕着未受侵袭的神经;而在高神经侵袭性PDAC肿瘤样本PA#28中,CD138阳性、FAP高表达的癌旁成纤维细胞围绕着受侵袭的神经。
(F)热图展示了由COMMOT计算得出的信号通路得分。
(G)Circos图显示了非受侵神经产生的配体与2个像素范围内的空间生态位之间的配体-受体对。
(H)免疫组化染色显示,在PDAC肿瘤切片PA#47中,LUM+成纤维细胞表达CXCL12,并且CXCR4+CD20+B细胞围绕着未受侵袭的神经。
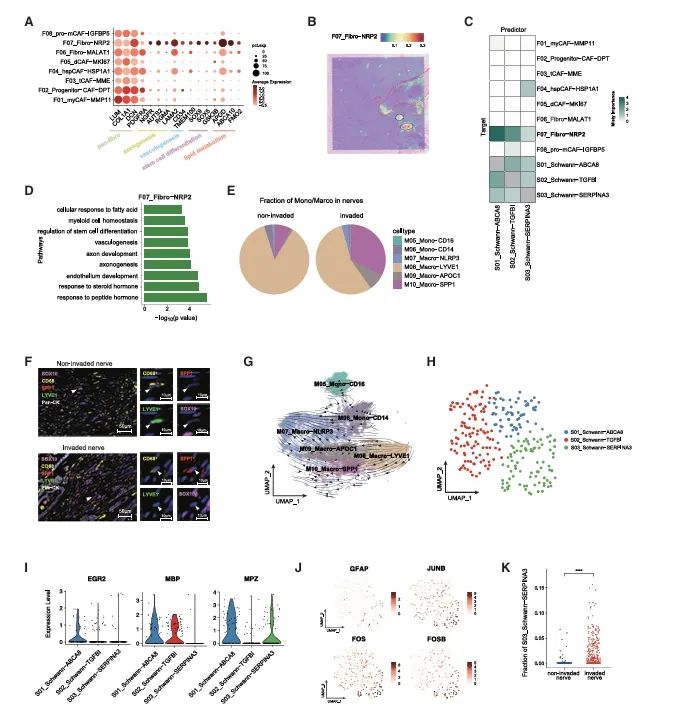
解析未受侵袭和已受侵袭神经内部的细胞构成情况
(A)显示F07_Fibro NRP2标志基因的气泡热图。
(B)在代表性样本PA#98中F07-Fibro-NRP2的定位及其比例。
(C)在半径5的范围内,细胞类型丰度对其他细胞类型丰度预测的平均重要性。
(D)通过GO密集分析富集在F07_Fibro NRP2中的通路。
(E)未受侵或受侵神经纤维中不同单核细胞和巨噬细胞子簇的分数。
(F)mIHC染色展示了代表性PDAC样本PA#51中未受侵神经中的CD68+LYVE1+SPP1巨噬细胞以及受侵神经中的CD68+LYVE1+SPP1+巨噬细胞。
(G)覆盖单核细胞和巨噬细胞的UMAP的RNA速度图。
(H)显示施万细胞子簇的UMAP图。
(I)小提琴图展示了EGR2、MBP和MPZ在3个施万细胞亚群中的表达情况。
(J)UMAP图展示了S03_Schwann SERPINA3这4个代表性特征基因在所有施万细胞中的表达水 平
(K)通过ST分析确定了未受侵袭和受侵袭神经斑中S03_Schwann-SERPINA3细胞的比例。
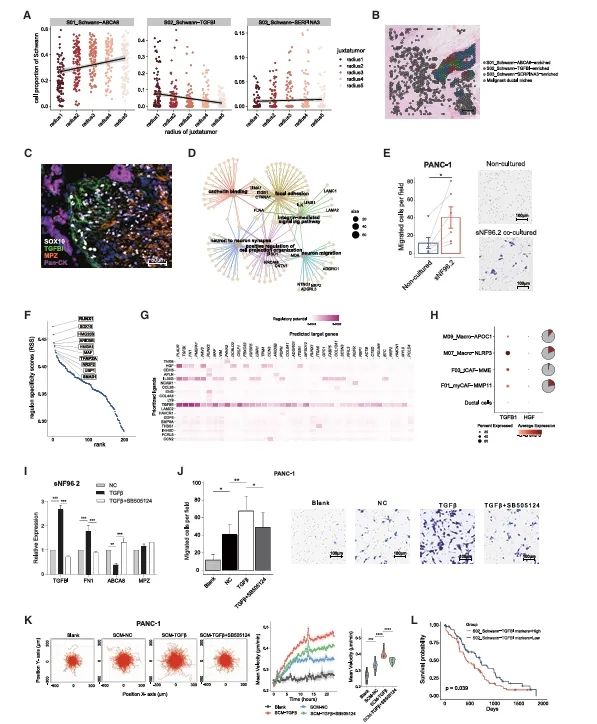
一种独特的、具有转变特性的施万细胞亚群,其参与了神经组织的侵袭过程
(A)描绘了三种施万细胞子簇在距离恶性导管微环境不同距离处的分布情况的散点图。
(B)在代表性的高NI样本PA#98中,三种施万细胞子簇的空间分布情况。
(C)免疫组织化学染色显示了TGFBI+SOX10+施万细胞在受侵神经的受侵边缘的定位。
(D)基因概念网络图展示了S02_Schwann-TGFBI中选定的GO富集通路和基因之间的关联。
(E)柱状图展示了迁移的PANC-1细胞数量。
(F)散点图显示了S02施万-TGFBI细胞的调控特异性得分。
(G)NicheNet配体-靶标矩阵热图表示来自TME的预测优先配体与S02施万-TGFBI中靶基因之间的调节潜力。
(H)气泡热图显示了在4个潜在的TME子簇和导管细胞中TGFB1和HGF的表达情况。
(I)通过qPCR量化了用20 ng/mL TGF-β或TGF-β与SB505124联合处理24小时的sNF96.2细胞 中TGFBI、FN1、ABCA8和MPZ的相对基因表达。
(K)PANC-1细胞经sNF96.2上清液处理后的随机迁移实验。
(L)Kaplan-Meier曲线展示了在已发表的队列研究中S02_Schwann TGFBI标志基因表达与预 后的关联。
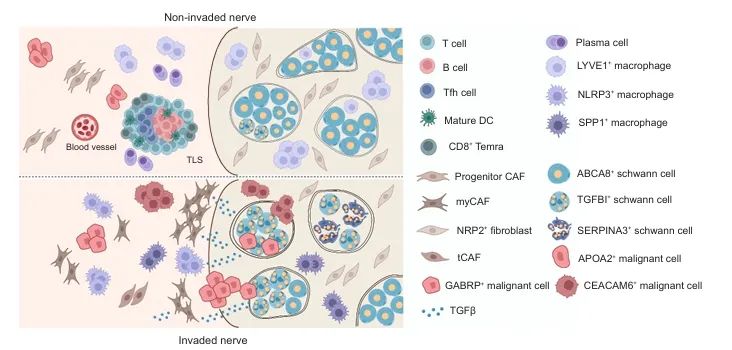
胰腺导管腺癌肿瘤中神经周围及内部细胞构成的概述
图形摘要展示了在胰腺导管腺癌中,未受侵袭和已受侵袭的神经周围及内部的免疫细胞、基质细胞、恶性细胞和施万细胞的子群体分布情况。
Reference
Chen MM, et al. Integrated single-cell and spatial transcriptomics uncover distinct cellular subtypes involved in neural invasion in pancreatic cancer. Cancer Cell. 2025 Jul 17:S1535-6108(25)00270-3. doi: 10.1016/j.ccell.2025.06.020. Epub ahead of print. PMID: 40680743.
























 2564
2564

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








