作者,Evil Genius
今天我们参考的文章来自Beyond genetics: driving cancer with the tumour microenvironment behind the wheel,2024年1月发表于NATURE REVIEWS CANCER。我们来看看肿瘤发生的内外驱动因素。
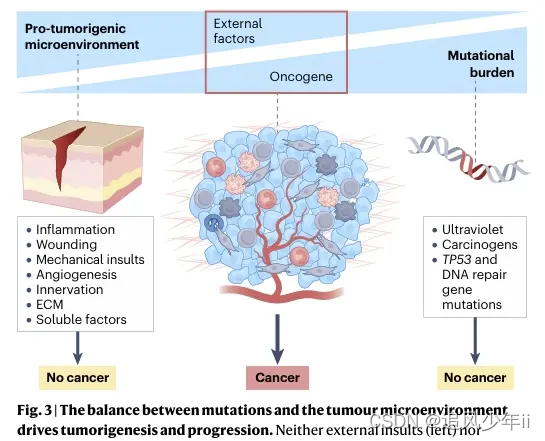
长期以来,癌症一直被视为一种累积突变的遗传疾病。有研究表明,衰老组织中经常充满了复杂致癌背景的克隆,它们与正常组织似乎和谐共存,这一观点得到了进一步证实。然而,同样令人困惑的是,当允许癌细胞在健康胚胎的范围内发育时,在某些情况下,仅表达一种或几种致癌基因的成人组织细胞可以产生具有许多恶性侵袭性癌症特征的肿瘤。这些完全不同的观察结果很难调和,除非援引环境线索来引发表观遗传变化,这些变化可以抑制或驱动恶性转化。
一个多世纪以来,癌症一直被描述为一种遗传性疾病。大多数人类癌症包含2-8个驱动突变,许多工作都集中在突变发生的顺序上。例如,在结直肠癌中,进展通常与APC、RAS、SMAD和TP53基因突变的顺序增加有关。这些研究导致了这样一种观点,即体细胞突变的时间积累达到致癌负荷的阈值是转移状态的开始和进展的基础。在老鼠身上的研究表明,即使是只携带一个或几个致癌突变的细胞也能发展成恶性肿瘤。同样,在人类中,儿科癌症的突变比成人癌症少得多,但同样具有侵略性,这表明少量突变与表观遗传变化相结合可以引发肿瘤的发展和进展。研究提供了进一步的证据,表明转移扩散到继发部位并不总是与更高的突变负担相关,甚至未转化的上皮细胞也可以自发地在远处器官中传播和存活。某些癌症表现出的器官亲和性也支持这样一种观点,即环境决定了肿瘤转移的形成,非遗传途径通常控制转移特征的获得。

受致癌突变影响的细胞是否会引发肿瘤或表现为正常行为取决于环境,在决策过程中调用其他因素,如组织微环境。在这个过程中包括癌症的高风险因素,包括肥胖、饮食、慢性炎症、污染、激素变化、损伤和许多其他影响有机体适应性的畸变,进而影响癌前组织干细胞的微环境。
在过去的十年中,研究人员专注于研究肿瘤微环境(TME)各组成部分的时空变化以及转化细胞在恶性、侵袭性和转移性癌症发展过程中的变化。这些研究导致了许多新发现的癌症驱动因素,包括一些遗传改变,如致癌组蛋白突变,以及许多非遗传改变,如组蛋白和DNA修饰以及肿瘤侧转录调控的改变,以及细胞外基质(ECM),组织结构和TME侧的物理力,所有这些都可以对恶性肿瘤产生深远的影响。此外,与正常组织相比,大多数癌症的TME是复杂的,由多种细胞和细胞网络组成,包括适应性和先天免疫细胞、成纤维细胞、血管、淋巴管、神经元和脂肪细胞。癌症干细胞(CSCs)是一种自我更新、维持和传播肿瘤生长的细胞,它作为一个细胞交换机,整合来自TME的各种输入信号,并传回新的信号,这些信号共同决定了癌症的预后。
鉴于这些复杂性,为适应癌症行为的多样性而量身定制TMEs也就不足为奇了。例如,在许多情况下,侵袭是由来自促肿瘤免疫细胞(如单核细胞来源的巨噬细胞)的活性TGFβ驱动的,这些细胞与血管周围生态位相关,并在附近的CSCs和癌活化的成纤维细胞(CAF)邻域中引起显著的转录变化。相比之下,肺腺癌表现出相对稳定的肿瘤免疫特征,在整个进展和浸润淋巴结和继发部位的过程中保持不变,强调免疫系统是抑制还是促进浸润取决于环境。
除了微环境,饮食影响也会影响肿瘤的形成和发展。例如,虽然肥胖的人患肿瘤的风险更高,但矛盾的是,他们对癌症治疗的反应更好,预后也更好。在这种情况下,由超重和肥胖引起的慢性炎症状态可能支持肿瘤发生,但在治疗时阻止顽固性病变。
总之,对肿瘤起始和转移的研究已经揭示了无数的非遗传因素在恶性肿瘤的形成和发展中是关键的,而且往往是主要的驱动因素。
恶性肿瘤的外在驱动因素
TME包括免疫细胞、CAFs、血液和淋巴血管和神经,以及细胞外成分,如ECM、基底膜、生长因子和代谢物,所有这些都已知会影响肿瘤发生和肿瘤进展。携带单一致癌突变的上皮细胞使得解开突变负担的多种影响和揭示影响早期肿瘤启动CSCs及其在肿瘤发生和进展中的作用的环境因素成为可能。
转化细胞与其normal“邻居”之间的竞争
哺乳动物上皮内的细胞竞争是组织形态发生过程中的自然生理过程。在果蝇的翅膀发育中首次描述了细胞竞争是由一种机制精心安排的,即适合的细胞识别并主动杀死不适合的邻居,然后将其驱逐出组织。通常被误解为简单的增殖优势,类似于经典细胞竞争的现象已经被描述为哺乳动物组织。因此,通过使用实时成像,研究人员已经观察到在毛囊和胰腺导管和腺泡区域内转化细胞与健康邻居的竞争。虽然缺乏对机制的了解,但这些研究强调了转化细胞需要胜过其健康邻居,以避免细胞死亡和挤压,并允许肿瘤形成。
最近在乳腺类器官中研究了人类癌症肿瘤发生中的细胞竞争,其中转化细胞只有在被转化的邻居包围时才能有效增殖。因此,为了使转化细胞的克隆出现,它们必须产生足够的旁分泌信号来阻止其健康邻居的竞争。事实上,在肠隐窝中,携带KRAS或PI3K突变的转化肠细胞会将骨形态发生蛋白配体分泌到邻近的健康隐窝中,从而抑制正常的干细胞活性并获得竞争优势。
总之,这些研究提供了令人信服的证据,证明从肿瘤发生的早期阶段开始,在没有基因突变积累的情况下,转化的上皮细胞可以(而且必须)改变其周围的上皮细胞,从而成功地进展为恶性肿瘤。在这方面,值得注意的是,也有一些特定突变,例如TP53和NOTCH1,可以在皮肤和食道中长时间异常积累,而不会进展为恶性肿瘤或被其邻居消除,这表明除了致癌突变外,肿瘤发生还需要生态位重塑。总的来说,克隆竞争可能既促进了肿瘤内的异质性,也促进了肿瘤的进化。

Crosstalk between transformed cells and the microenvironment induces the cancer stem cell state
炎症是肿瘤发生的加速器
炎症是癌症发生和跨组织发展的关键驱动因素。在最初的遗传损伤之前或之后,暴露于炎症刺激可以取代这种需要。尽管肿瘤环境可能会微调细胞之间的相互联系,但这种信号由肿瘤细胞传递并被邻近免疫细胞接收的结果似乎是癌症进展。尽管炎症能够加速癌性ras -表达细胞的肿瘤发生,但在某些情况下,癌性HRASG12V本身的表达可以在TME内触发一系列失调信号,随着时间的推移,这些信号会发展为具有侵袭性癌症特征的肿瘤.
间质成纤维细胞作为肿瘤发生的驱动因素
CAFs是肿瘤内具有亚型和亚特化异质性表型的TME细胞,在ECM沉积和重塑中起关键作用,也与癌细胞和浸润性白细胞广泛“交流”。在基因正常的成纤维细胞中也证实了CAFs对上皮肿瘤发生的强大作用。CAFs强烈响应TGFβ和yes相关蛋白(YAP)信号,诱导细胞类型特异性改变ECM的产生和免疫抑制能力。
局部机械力作为非遗传因素在肿瘤进展中的重要性也在使用更高突变负担的研究中进行了调查。例如,在一系列以不同模式和水凝胶硬度生长的小鼠和人类癌细胞系中,单独的几何线索被证明可以增强克隆类肿瘤的CSC特征,包括增殖、迁移、侵袭和存活。这一原理已经在体内由KrasG12D和Trp53缺失驱动的胰腺导管腺癌模型中得到证实,其中证明了早期病变的几何形状可以预测肿瘤的侵袭性。因此,胰腺肿瘤产生的导管直径决定了病变是生长到管腔内(内生)还是向外折叠(外生性)。外生性病变与TME密切相互作用,因此它们也会招募促肿瘤发生的CAFs,促进肿瘤进展
简而言之,当涉及到肿瘤细胞、它们的TME和TME内部的机械力时,环境很重要。此外,尽管来自外部环境的机械力可以影响肿瘤的结构和行为,但来自癌症本身的机械力在形成生长中的癌症的特性方面同样重要,在某些情况下更为重要。
血管生成、淋巴管生成和神经发生
TME对癌症的其他众所周知的影响是血管生成和淋巴管生成,这两者都是由csc的信号触发的。通过对小鼠皮肤肿瘤模型中编码血管内皮生长因子A (VEGFA)的基因进行基因消融,可以证明VEGFA是肿瘤相关血管生成的有效诱导剂。值得注意的是,Vegfa可由早期致瘤微环境中的多种因素诱导,包括综合应激反应、缺氧和tgf - β信号传导。脉管系统将营养物质、激素和免疫细胞运送到肿瘤的能力,使其成为位于肿瘤-基质界面的csc的重要生命线。脉管系统也可以产生肿瘤内异质性,驱动邻近CSCs的差异转录组学,并促进其治疗耐药性
在皮肤SCCs中,当TGFβ信号导致CSCs上调VEGFA和其他血管生成因子的表达时,血管系统急剧上升。TGFβ靶基因还包括那些编码上皮-间质转化蛋白和瘦素受体(LEPR)的基因。对于像SCCs这样没有直接接触脂肪组织(脂肪组织是瘦素产生的来源)的肿瘤,血管系统变得更加重要,因为循环必须提供瘦素来触发LEPR信号。这一途径的激活反过来又会提高PI3K-AKT-mTOR途径,并在肿瘤生长导致营养物质稀缺时维持能量平衡。由于LEPR信号还可以促进HRAS法尼基化所需的胆固醇生物合成,因此该途径也可能在增强RAS活性方面发挥作用。
尽管癌细胞转移通常始于癌细胞向淋巴结的迁移,但关于淋巴毛细血管在肿瘤发生中的作用知之甚少。虽然该领域仍在展开,但最近的研究表明,黑色素瘤细胞可能使用淋巴血管作为减少铁下垂死亡的首选手段。通过输送免疫细胞、调节流体压力和提供关键刺激生长因子的能力,淋巴管在调节正常组织干细胞行为方面发挥着关键作用。鉴于这些特征深刻地影响癌症特性,并且由于肿瘤生长而产生的干扰力可能反过来影响淋巴管,因此询问淋巴管在csc中的作用应该是有趣的。
总之,这些发现证明了远程和短程环境输入在协调肿瘤促进反应方面的作用,即使相关的CSCs具有低致突变负担。鉴于这些输入在CSCs中激活的各种途径在转移性癌症中经常发生突变,很容易推测,癌症中增加的突变负担可能反映了TME和CSCs之间已经建立的致癌途径的锁定。
癌症的细胞内在非基因驱动因素
TME和肿瘤细胞之间的交流形成了癌症表观基因组,其中包括DNA、组蛋白和其他染色质相关蛋白的翻译后修饰。这些改变会留下影响csc转录和翻译的持久标记。

Epigenetic changes drive tumorigenesis and progression
TME诱导的转录因子失调
由TME触发的致瘤前信号通常会导致转化细胞中的转录因子失调。MAPK通路被酪氨酸激酶受体如EGFR激活,进而激活RAS和/或RAF,改变转录因子如JUN、FOS、ELK、ETS、MYC、MSK102甚至是WNT信号的淋巴细胞增强结合因子(LEF1,也称为TCF1)辅助因子β-catenin的表达。虽然这条通路上的基因在癌症中经常发生突变,但这条通路可以被TME过度激活。
染色质动力学的影响
随着肿瘤的发生,外部因素和下游转导信号通路的复杂相互作用可以深刻地改变csc的染色质组织。最近的高通量技术进步使得染色质可接近区域的定位、转录因子的结合、染色质修饰和三级染色质动力学开始揭示染色质的非遗传变化如何促进肿瘤的发生和进化,例如对小鼠肺腺癌的研究。在癌变过程中,染色质失调会导致可塑性状态,从而促进癌症的转化、异质性和进化,这在结直肠癌中得到了证实。新生肿瘤及其微环境之间的动态串扰产生了选择性压力,触发了组织中通常不活跃的转录因子。其中一个例子是runt相关转录因子(RUNX),它经常引起参与肿瘤进展和转移的染色质重塑的表观基因组改变。
TME的代谢状态也会影响癌症表观基因组学。在这方面,值得注意的是,许多DNA和组蛋白去甲基化酶的活性依赖于α-酮戊二酸辅因子,因此受到TME中α-酮戊二酸与琥珀酸比值的影响。例如,当比例较低且去甲基化酶被抑制时,组蛋白3赖氨酸27三甲基化(H3K27me3)会积累,特别是当甲基化酶,即zeste同源物2的增强子(EZH2)过度活跃时,就像癌症中经常出现的那样。EZH2在干细胞(包括CSCs)中含量普遍较高,可以抑制分化并促进增殖。虽然在一些癌症中发现了EZH2激活突变或基因扩增,但EZH2也可以通过TME升高,研究表明EZH2水平可通过骨微环境升高,这足以诱导乳腺肿瘤转移。
癌症进展的转录后控制
在染色质结构和转录的下游,调节转录稳定性的机制和翻译也被认为是表观遗传学调节剂。在癌症中,TME的外部因素可以诱导劫持这些机制的途径,以促进转化、肿瘤发生和进展。
miRNAs
许多miRNA与癌症有关,它们的失调可以通过突变介导。miRNA改变癌症进程的一个有趣的例子是,它们能够抑制一种编码载脂蛋白E的特定变体的mRNA,这种变体自然存在于人群中,但如果缺失,则会增加对转移性黑色素瘤的易感性。
癌细胞环境在调控这些转录后调控因子的表达方面也起着关键作用。缺氧和EGFR信号——后者被突变过度激活,但也被TME细胞的生长因子分泌激活——调节argonaute 2 (AGO2)蛋白的磷酸化,从而调节miRNA的成熟。
翻译
癌细胞必须努力使其能够在压力条件下生存,同时抑制抗肿瘤免疫反应。敌对TME,如营养缺乏、氧气限制、高代谢需求和氧化应激,都会引发内质网(ER)应激的细胞状态。通过激活ER应激传感器和适应性应激反应,癌细胞可以抵御环境攻击,增强其转移和耐药性。这些反应的核心是转化机制。通过抑制全局翻译,同时允许翻译一些关键的应激反应mRNA,癌细胞可以更好地应对环境的应激。
鉴于TME的异质性及其对抗癌治疗的动态适应,靶向TME是具有挑战性的。保持健康的饮食、经常锻炼和低水平的压力已被证明可以改善治疗反应。





















 1988
1988

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








