2023年8月25日,浙江大学胡宝兰教授团队在Nature Communications上发表最新研究成果(Zhao et al., 2023, Nat Commun),用一个有趣的发现支持了微生物互作研究中的新观点:微生物互作关系受所处环境的影响,极端环境条件会促进微生物的合作。这一观点为国际微生物生态学中的一个关键问题提供了新的回答,这个关键问题是:在自然微生物群落中,微生物更偏爱合作还是竞争?
胡宝兰教授团队的研究在国内环境微生物领域引起了广泛讨论。基于可培养手段的微生物互作关系研究,虽然是国际上的热点问题,但在国内却相对小众。作为这一领域内的工作者,欣喜地发现国内已有许多学者关注这个领域的核心问题。于是迫不及待想和国内同行们分享一下,最近几年国际学界中围绕这个问题发生的一系列有趣的故事。
这篇博文将全程探讨上述关键问题的争论过程(包括一些文献综述和国际会议上学到的内容)、有趣的学术八卦,以及笔者的个人想法。由于个人水平有限,文中可能存在不成熟的思考,恳请读者批评指正。鉴于篇幅较长,建议收藏后分几次阅读。这篇博文的写作也受到北京航空航天大学杨军教授的鼓舞,在此特别感谢。

“恩怨”之始
恩怨的主角之一是牛津大学的Kevin Foster教授,他一直是微生物互作研究领域的焦点人物。在2012年发表在Current Biology的一篇论文中,他和帝国理工学院Thomas Bell首次实验探究了“微生物更偏爱合作还是竞争”的问题。他们从山毛榉的“树洞”中分离出72 株细菌,定量分析了这72株菌的两两互作关系。在180个实验探究的成对组合中,仅有2个组合表现出合作关系,而其他178个组合中,两菌的内卷导致整体生产力下降。由此,这篇文章给出了一个打破常规直觉的结论:竞争,而非合作,是可培养微生物物种之间的主要相互作用(Foster and Bell, 2012, Curr Biol)。
文章挑战了大多数微生物研究者的普遍直觉,即微生物之间广泛存在着合作关系,因此激起了微生物研究者们的讨论,一些学者对该研究方法提出了质疑,主要集中在两个方面:(1) 常规的分离方法会不可避免地富集快速生长、竞争力强的微生物,而忽略那些生长慢、依赖合作生长的微生物,使研究结果呈现对竞争关系的偏向性;(2) 微生物群落是作为动态整体,72株菌的互作可能仅代表了时间动态中的某一点。其实,这篇文章已经尽力避免了这些质疑。例如,研究以山毛榉树叶裂解液为培养基,更好地模拟了自然条件;这些“永久雨水池”在山毛榉树根部是相对稳定的环境。然而,要颠覆一个根深蒂固的直觉,这些设计显然还不足够。
此外,这篇文章还有一个重要贡献——建立了利用培养手段鉴定微生物互作的金标准。Kevin团队在2013年发表的一篇综述中对此进行了总结(Mitri and Foster, 2013, Annual Review of Genetics, Vol 47)。这个标准通过比较两株微生物在共培养和单独培养中表现出的生产力(通常用细胞数或生物量作为生产力指标,不过2012年的那篇研究是以CO2释放速率为表征),结果分为11种不同的情形,从而定义6种不同的互作关系(图1)。特别地,合作是指共培养中两菌的生产力都比各自在单独培养中高,而只要有一方在共培养中的生产力低于其在单独培养中,就定义为竞争。

图1 通过两株微生物两株微生物在共培养和单独培养实验定义其互作关系的“金标准”。图改编自(Mitri and Foster, 2013, Annual Review of Genetics, Vol 47)的图5A。
对微生物合作相关研究“疯狂开炮”
可能受2012年文章的启发,Kevin在随后的研究大都以“竞争”为主题,旨在质疑微生物合作的普适性。他的观点主要分为以下四类(图2左):
(1)合作可能会降低群落的生产力。在2014年发表于《PNAS》的一篇文章中,Kevin团队以Lotka-Volterra模型(研究互作关系的经典模型),引入了微生物进化生命周期的概念,并假设原本自主的微生物会发生基因丢失,从而与别的微生物形成合作互补关系(Oliveira et al., 2014, P Natl Acad Sci USA)。模拟结果表明,合作可能是一种糟糕的进化策略,原因包括基因丢失导致的微生物功能下降和合作团体生产力的下降,这不符合自然选择的逻辑。然而,笔者在2021年的一篇《ISME Journal》文章中,基于类似假设但不同的模型,得出了相反的结论(Wang et al., 2021, Isme J)。更严谨的数学描述是,Kevin团队研究发现,合作关系能稳定演化的参数域较小,而笔者的研究显示了较大的参数域,表明合作的演化并非那么困难。主要区别在于笔者关注了更细的生态学参数和更长的时间尺度。笔者的研究发现,在很多情形下,合作团体的生产力是提高的,因为每个个体付出了更少的整体代价且减少了资源的浪费。可见,研究假设和体系的选取,对于结论有着很重要的影响。
(2)合作种群之间的相互依赖,合作任一方的消失均会导致群落的崩溃,因此合作是一种高风险策略。上述PNAS文章中,合作不易演化的另一个重要原因是:合作使细胞依赖于可能不在附近的物种,一方的偶然消失可能导致整个种群的崩溃(Oliveira et al., 2014, P Natl Acad Sci USA)。不过在笔者的研究发现,在较长的时间尺度下,合作个体总能有缘与伙伴相遇,一旦相遇便能不离不弃,形成稳定主导群落的团体(Wang et al., 2021, Isme J)。更有影响力的一篇工作是Kevin团队2015年发表于Science的一篇文章。利用与上述PNAS文章十分相似的模型,Kevin团队探究了互作关系网络中的合作与竞争关系的占比对群落稳定性的影响(Coyte et al., 2015, Science)。研究结果指出,当群落中的互作关系以竞争为主时,群落的稳定性和多样性更高(“A high diversity of species is likely to coexist stably when the system is dominated by competitive, rather than cooperative, interactions”)。这是因为合作一方的丰度降低,往往会拉低其他合作方物种的丰度,从而破坏系统的稳定。因此,即便是增加群落内的合作有利于提高整体生产力,它也是以降低生态稳定性为代价的。
(3)“欺骗者”(Cheaters)导致合作崩溃。这是一个跨越百年的研究议题,是指合作群体中会出现不劳动但只利用群体“公共资源”的“欺骗者往往具有选择优势,终将导致合作群体崩溃。因为“生物之间广泛存在着合作关系”的整体直觉,大多数早期研究都关注合作关系如何避免被欺骗,这一方向的研究被称为“社会演化学”(Social evolution)。其实Kevin早期也在从事这方面的研究,利于微生物体系提出了一些观点(Mitri et al., 2011, P Natl Acad Sci USA; Xavier et al., 2011, Molecular Microbiology)。但在2012年后,他的研究主题更偏向竞争,可能因为他认为如果合作不普遍,这一问题的研究就失去了意义。一个八卦是,同在牛津的Stuart West是社会演化学的研究大牛,Kevin和他关系要好,他们都很相信亲缘选择学说(Kin-selection)。
(4)(也由于以上这些原因导致)合作在自然界中不是普遍的。Kevin团队最近的研究主要关注生物被膜(Biofilm)中的微生物竞争,所谓的“细菌战争”(Bacterial warfare)。生物被膜是指微生物通过分泌的聚合物基质结合在一起的表面附着或自由漂浮的微生物细胞群。生物被膜是微生物在自然环境中生存的主要形式。在2016年的一篇Nature Review Microbiology的综述中,Kevin团队提出,不同微生物种群如果在生物被膜中隔离分布,则个体周围都是它的“亲戚”,则自然选择通常有利于合作,因为个体分泌的有利物质会帮助亲属,即亲缘选择(Kin-selection)。然而,当不同物种在生物被膜内空间混合时,个体主要与其他基因型相互作用,此时种间竞争与拮抗会更普遍(Nadell et al., 2016, Nat Rev Microbiol)。这一观点隐含一个推论,因为自然环境中观察到的生物被膜大多都是多物种空间混合的,因此竞争是更普遍的。虽然文中没有直接提出这一观点,但Kevin经常在学术会议中提到这个推论,这个推论为他近期研究主题,“Bacterial warfare”,提供了重要支撑。这些研究中关注微生物个体如何用各种武器进攻别的个体,以及如何防御进攻,营造了一种微生物群落是“激烈战场”的氛围(一些典型文献:(Booth et al., 2023, bioRxiv; Booth et al., 2022, bioRxiv; Granato and Foster, 2020, Curr Biol; Granato et al., 2019, Curr Biol; Granato et al., 2023, Isme J; Niehus et al., 2021, Elife; Palmer and Foster, 2022, Proc Natl Acad Sci U S A; Smith et al., 2020, Plos Biology; Smith et al., 2023, Nat Rev Microbiol))。

图2“竞争派”与“合作派”两位大牛团队的主要观点
恩怨:捍卫“合作”,对“竞争”的反击
既然是恩怨,自然就会有对立面,Kevin的对面站着的是德国奥斯纳布吕克大学的Christian Kost教授,他是坚定的“合作”维护者。有趣地是,上述四个炮轰合作的观点并不是笔者总结的,而是来自Christian在2022年洛桑ISME18大会上的报告提纲(图3A)。在这次报告中,Christian通过对自己课题组多年研究的梳理,对Kevin提出的四个观点进行了详细的驳斥(图2右)。Christian团队的研究主要以大肠杆菌氨基酸缺陷突变株为模式,构建合成微生物群落:群落中通常包含两株不同的氨基酸缺陷株,形成相互依赖的专性合作关系(图3B)。
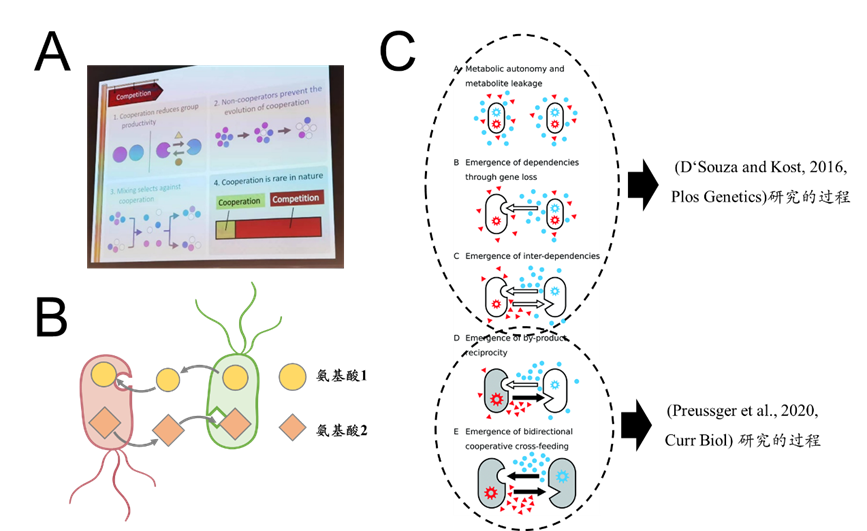
图3 Christian团队的观点和研究体系。(A)Christian在2022年洛桑ISME18大会上的报告提纲。(B)Christian团队研究的模式群落:大肠杆菌氨基酸合作互营合成群落。(C)微生物合作从功能自主个体演化而来的全过程概念图,改编自(D'Souza et al., 2018, Natural Product Reports) 的图7。
驳斥(1):通过适应性演化,合作可以增加群落的生产力。支持这一观点的两项比较重要研究是(D'Souza and Kost, 2016, Plos Genetics) 和(Preussger et al., 2020, Curr Biol)。研究1以自主型的大肠杆菌出发进行实验演化(Experimental evolution)研究,演化2000代以后,所有谱系均演化出了氨基酸缺陷性,这些缺陷性表现出比祖先菌株更强的适应性,呈现出一定的合作性质,暗示合作可以增加群落生产力。研究2以人工构建的氨基酸交换合作群落为起始,实验演化150代后,群落同样获得了比祖先更强的生产力水平;演化后的细胞提高自己能生产氨基酸的产量,合作伙伴还形成了空间聚团,这暗示了合作获得更高生产力的原因是个体更专一于自己负责的功能,且合作伙伴之间的联系变得更紧密了。这些发现被总结在2018年的一篇综述中(D'Souza et al., 2018, Natural Product Reports),文中提出了一个完整的概念模型,描述了微生物合作是如何从功能自主的个体演化而来,包括从自主个体形成相互依赖关系,进而发展为生产力更高的稳定合作关系。一个八卦:研究1和综述的一作Glen D'Souza与笔者目前同在一个课题组从事博士后研究,是个科研很牛又非常Social的大哥。很多恩怨轶事,笔者是从他那里听到的。
驳斥(2):合作是一种有利于群落稳定的策略。Kevin团队对于合作不利于稳定的论断是基于生态学模型,Christian团队也用一篇生态模型的文章进行了回应(Oña and Kost, 2022, Ecology Letters),研究发现,与Kevin的观点相悖,特定的网络拓扑和群落成员之间的合作交叉互养有利于群落对抗生态干扰。还是那句话,模型假设和体系的选取,对于结论有着很重要的影响——这篇文章对合作交叉互养的机制进行了很细致的假设。Christian也用实验结果对Kevin的观点进行正面回应:如果合作伙伴总是聚团生活在一起,合作就不容易单独消失而导致群落崩溃。在上面提到的实验演化研究中,合作群落演化出了聚团(aggregate)行为(Preussger et al., 2020, Curr Biol),在后续的研究中更发现了他们演化出了生活史特征(aggregate与disaggregate交替,数据未发表),这让合作伙伴能更好地生活在一起。
驳斥(3):空间结构可以有效抵制“欺骗者”对合作的破坏。Christian团队在Acinetobacter baylyi与Escherichia coli成了氨基酸互养的合作关系中,引入了两种氨基酸都不能生产的“欺骗者”(Pande et al., 2016, Isme J)。共培养实验表明,“欺骗者”在无空间结构的液体培养中会导致合作崩溃,但在空间结构化环境(琼脂表面)不会。模型和实验表明,在空间中合作者和“欺骗者”的自发进行了空间分离,从而稳定了合作关系。严格来讲,这篇工作是Wenying Shou老师(现在工作于伦敦大学学院,但这篇文章是在她在Fred Hutchinson癌症研究中心工作期间发表)2013年一个工作的重复(Momeni et al., 2013, Elife),不过Shou老师用的是酿酒酵母的类似体系。值得一提的是,在上面提到的实验演化研究中,Christian团队也在进化后聚团合作群体里加入了“欺骗者”,合作聚团也表现出了抵御“欺骗者”的特质。
驳斥(4):(也由于以上这些原因)合作在自然界中是普遍的。因为Christian团队主要基于人工合成的微生物合作群落开展研究,故其结论在自然环境中的普适性总被诟病。Christian团队的研究工作近期逐渐向自然微生物群落转变。已发表的两篇工作由其博士后Samir Giri主导(Giri et al., 2021, Curr Biol; Giri et al., 2022, ISME Communications)。这两项研究将4株基因敲除获得的氨基酸合成缺陷株,与环境中分离的25株代谢自主型细菌两两配对,观察它们是否能形成代谢交流关系。Current Biology的工作指出,63%的组合都能形成稳定的互作关系,且两菌系统发育关系差异越大,越有利于互作关系的形成;ISME Communications的工作指出,在40% 的配对中,营养缺陷型受体和代谢自主型供体在共培养中都获得了显著的生长优势,即“++”的互利关系。虽然严格来讲,这种单向的代谢交流不能定义为合作,但这些结果暗示基于代谢交流的合作在自然群落中其实是容易形成的。Christian团队的博士生Ghada Yousif在近期的国际会议中,还报告了他们正在进行土壤样品中的氨基酸合成缺陷株分离和配对研究,结果表明这类基于代谢交流的双向合作其实也是普遍的。
情仇:两个团队间的相爱相杀
讲了这么多学术,下面来讲一点八卦。
两个领域大牛在观点上如此对立,那当他们同时出现在一个国际会议中,要如何相处?事实上,Kevin和Christian从未在同一个学术会议上露面。会议的组织者也都知其中缘由,形成了一种默契:当邀请一位作Keynote Speaker时,就不会再邀请另一位。例如,Kevin作为Keynote参加了去年10月的Embo workshop: Molecular mechanisms in evolution and ecology和今年7月的GRC Microbial Population Biology,但Christian未出席这两个会;Christian参加了去掉8月的ISME18和今年7月的Bageco 2023,这两个会议也未邀请Kevin。有意思地是,笔者作为Oral Speaker分别参加了去年的Embo workshop和今年的Bageco 2023,且报告位次均在两位大牛之后,天选的恩怨调和剂?哈哈。
当然,两位大牛不碰面,不代表他们的团队成员不参会。以上提到这几个会上都有对方团队成员参加且作报告。这时,一方大牛向另一方团队成员提问往往成为会议的焦点,因为大多数人都知道双方的恩怨。然而,这些提问并不像期待的那样针锋相对,大牛们并不会质疑观点,而更侧重于对实验证据的严谨性提问,还会很友善地提出修改或补充实验的建议。
在同行评议过程中,双方保持这种态度。因为研究方向类似,双方团队经常互审稿件,但并不会因为观点不同而提出拒稿。相反,审稿意见更多地关注于研究本身的数据严谨性,提出实际的修改建议,有助于对方提升研究质量(若你问笔者怎么知道的,笔者在双方课题组都有线人,哈哈)。笔者认为,这正是同行评议应有的态度,不是以批判的心态,而以提升稿件呈现的最终质量为目标,注重研究动机的充分性、逻辑的严谨性和数据分析的可靠性。至于研究结论是不是有创新性(novelty)和流量(general interest),应由编辑去评判。如此这般,严谨的研究工作会越来越多,尽管观点可能会大相径庭,但百家争鸣才是学术发展的良性环境。
总之,两个大牛课题组的观点对立并没有导致学术资源的浪费,而是推动了更多高水平的研究,也培养了许多杰出的人才。许多大牛课题组出来的年轻学者也不一定继承原来老板的观点,有一些形成了自己新的观点,有一些之间还建立了很好的合作与私人关系。
从团队恩怨到国际大讨论
去年5月,Kevin团队在Science发表了一篇观点文章,题为“细菌很少一起工作”(“Bacterial species rarely work together”)(Palmer and Foster, 2022, Science)(小编注:原文翻译可直接浏览本公众号历史内容或https://mp.weixin.qq.com/s/D3UlImdV6d735FuDUupgNg)。这篇文章的观点主要基于6篇研究论文——这些论文均采用金标准实验方法,对来自6个不同环境中微生物进行分离培养和互作关系鉴定(Gould et al., 2018, P Natl Acad Sci USA; Kehe et al., 2021, Sci Adv; Ortiz et al., 2021, Isme J; Piccardi et al., 2019, P Natl Acad Sci USA; Venturelli et al., 2018, Molecular Systems Biology; Weiss et al., 2022, Isme J)(图4)。Kevin团队指出,和2012年那篇山毛榉的“树洞”的文章一样(Foster and Bell, 2012, Curr Biol),这些结果都显示竞争,而非合作,是微生物之间的主要互作关系。尽管Kevin团队一直以来对微生物合作的普适性持否定态度,但这是他们首次以如此直接的标题强调在自然界中微生物之间极少存在合作,迅速引爆了整个微生物生态学界。这篇文章的发表,首先催生了上文提到的Christian在ISME18(去年8月)在报告中,从四个角度强势回应Kevin的观点。不仅是Christian团队,领域内的许多知名学者也下场发声。在某特上,文章引起了极高的讨论度,以下是一些代表性观点的摘录。

图4(Palmer and Foster, 2022, Science) 中对于6篇研究论文中实验证据的总结,图片来自于文章原图。
强硬反对派:
Roland Hatzenpichler(蒙大拿州立大学):“研究设计无意义,结论不可避免地存在偏差。如果您在选择培养基上隔离培养微生物后尝试在共培养微生物,那么它们协同工作的可能性当然很小。令人惊讶的是这种明显的偏见没有被发现。为什么能发表在Science上?我的观点并非结论是错误的,而是得出结论的研究设计无法检验最初的问题。”
Glen D'Souza(苏黎世联邦理工,前面提到的同实验室大哥):“确实很有趣。但对‘证据’极为怀疑。此外,从选择性配对研究的角度看待相互作用是非常有偏见的。还有,我们需要对立地把一切都放在合作阵营还是竞争阵营吗?”
Alex Crits-Christoph(加州大学伯克利分校,Jill Banfield组):“‘然而,黄金标准是单独和一起培养物种,并直接测量它们对彼此的影响’。不:相反,根据定义,这是一种针对给定营养环境的技术,并且真的不能用来回答复杂环境的问题!”
Rachel L Harris(哈佛大学,Peter R. Girguis组):“这篇文章的标题不当。更合适的说法是‘细菌种类很少在富营养化环境中一起工作’。无数研究表明,贫营养环境(例如深层生物圈)中存在广泛的微生物代谢互养。”
柔和讨论派(几位大牛的评论,Christian在某特上没有出场):
Jonathan Friedman (希伯来大学,原麻省理工Jeff Gore组博士后,笔者很喜欢这个总结陈词!):“总而言之,我同意大多数负面的评论,并且应该更多地强调它们,特别是在高能见度的场所(指某社媒)。但是,为了了解哪些微生物在什么条件下会相互作用,我们不应该认为这种方法的发现是微不足道的、有偏见的。相反,我们应该将它们与具有互补优势和局限性的方法结合起来。辩论和批评是科学过程的一个组成部分。但无论微生物之间是否存在正向的相互作用,让我们尝试让这些辩论和批评在科学家中普遍存在,即使在某特上也如此。”
Alvaro Sanchez(原耶鲁大学,现马德里大学):“我认为,当我们谈论互作时,如果我们定义一下我们到底在谈论什么,将会很有帮助。在细胞/分子水平上,一个细胞释放一种被另一个细胞捕获的分子。或者一个细胞摄取了一种分子,这意味着第二个细胞也无法摄取它。由于无数这样的分子/细胞整合,我们得到了群体水平的影响(一个群体对另一个群体的涌现性的影响)。现在,还不太清楚这些是否是成对的,因为它们从成对的细胞内出现的方式很复杂。......我们应该谨慎对待如何将它们与分子/细胞机制联系起来。”
Seppe Kuehn(芝加哥大学):“关于相互作用非常有意义的讨论。谢谢Jacob和Kevin的写作!接着Jonathan Friedman和Alvaro Sanchez评论。Alvaro提到以更清晰的方式定义互作。我想补充一点,在选择定义时,明确定义一个目标是有用的:我们是否试图预测/控制丰度动态?代谢流?宿主反馈?根据我们的目标,我们的描述水平几乎肯定会很重要。在某些情况下,有效的相互作用可能会发挥作用,而在其他情况下,微观因素更重要。关于什么类型的互作最常见——考虑到可培养性、偏好性等许多总是,我不清楚我们如何知道我们何时成功回答了这个问题。这个估计中的分母是可变的。”
Sara Mitri(洛桑大学):“喜欢讨论并感觉有必要加入!这是我的🧵:首先,我认为人们过于关注我们看到正向与反向互作的出现频率,相反,我们应该问我们何时期望看到更多正向与反向互作!该论文中有一些答案:物种多样性应该增加反向互作,恶劣的环境促进正向相互互作。另一条经验法则来自(Kehe et al., 2021, Sci Adv):不能单独生长的物种很可能会受到能单独生长的物种的促进。这凸显了定量相互作用时的环境依赖性,当然,如果我们使用培养实验,我们必然会产生偏见,因为生长介质将决定哪些物种可以单独生长。”
笔者观点:这篇文章的证据存在两个值得商榷的地方。
第一,方法代表性。6个研究中有5个所探究的互作关系数在100个以下,有2个甚至只做了10个和6个,数据量太小,是否具有代表性?剩下的1个笔者认为是里程碑式的研究:使用麻省理工开发的高通量kchip方法(Kehe et al., 2019, Proc Natl Acad Sci U S A),探索了7600个可能的互作关系(Kehe et al., 2021, Sci Adv)。这篇文章的结论是“存在正向相互作用在可培养细菌之间是普遍的”(“Positive interactions are common among culturable bacteria”),仿佛是一个支持合作的结论。但文章的通讯作者Jonathan Friedman专门在某特上解释到他们发现的Positive interactions主要是指寄生(Parasitism,+-)和偏利共生(Commensalism,+0)关系, 而非可定义为合作的互利共生(Mutualism,++)。其实,这个结果中合作(“++”)和竞争(“--”)都没有主导,竞争只在数量上略胜一筹。
第二,环境依赖性。6个环境中有4个都是肠道。肠道微生物本身难培养,且通常被认为是富营养的环境,并不能代表其他环境,特别是像海洋、淡水这样的营养贫瘠环境中的情况。从给出的这6个结果来看,4个肠道环境和2个环境样品的互作情况已经显示出明显的差异。
恩怨何解?
在国际大讨论以后,果然更多国际学者都加入到了这个问题的研究之中。
关于“方法代表性”的问题,其实kChip和Jonathan的文章已经给出了很好的解决方案。kChip每天可以支持10万个微生物互作对的共培养实验,使高通量的微生物互作实验成为可能(Kehe et al., 2019, Proc Natl Acad Sci U S A)。此外,该方法的门槛不高,已经被在一些实验室引入和应用(笔者实验室也已经引进)。当然,另一方面是微生物可培养性的挑战,这是一个庞大的方法学难题,学界一直在致力于解决。新的方法如原位培养、droplet等也在不断涌现和发展中。然而,不过提高微生物可培养性不是快餐,仍需要长期的积累和努力。
这里的“环境依赖性”的问题,是指当我们在讨论互作关系条件时,应该考虑这些微生物身处的环境。这个观点来自洛桑大学Sara Mitri教授。Sara曾于2010-2014年间在Kevin实验室从事博士后研究,是Kevin最得意的博士后之一。她从2015回瑞士开展独立研究,核心研究体系是从工业冷却剂和润滑剂(Metal working fluids)中分离的微生物并构建合成群落。有意思地是,在她的2019年的第一篇奠基性工作中(Piccardi et al., 2019, P Natl Acad Sci USA),4株微生物以润滑剂为唯一碳源时体现更多的正向互作关系(图5A)。于是她在国际会议报告总会用这个打趣,说我是Kevin组的博后,但是却从事着微生物合作相关的工作。但当她在培养体系中增加了别的营养和解毒剂,4株菌的关系由协助(Facilitation)转变了竞争(Competition)。基于此,她提出困难的环境(Harsh environments)会促进微生物合作,而营养丰富的环境(Rich environments)中竞争更普遍(图5B-C)。这应该是首次基于实验数据提出这个观点。

图5(Piccardi et al., 2019, P Natl Acad Sci USA)中发现微生物互作的“环境依赖性”。困难的环境下(以润滑剂为唯一碳源,MWF),四株微生物主要呈现正向互作(A)。添加氨基酸(B)或直接以氨基酸为碳源(C)模拟营养丰富环境中,四株微生物呈现更多负向互作。图片来源于原文图3A-C。
浙江大学胡宝兰教授团队的文章为这个观点提供了更有力的证据(Zhao et al., 2023, Nat Commun)。该研究的核心发现是在高温和极端压力的条件下,细菌之间的互利共生关系会显著增强。这一观点经过严谨的实验验证,涵盖了3008个细菌成对的共培养实验,其中互利共生关系占比高达39.1%,而竞争关系只占13.9%(图6)。这个工作的重要创新性在于,其鉴定的互作不只是单向的正向互作关系(+),而是双向的正向关系(++),即互利共生(Mutualism),是毫无疑问的合作关系。相比之下,之前Jonathan的文章主要以单向的正向互作关系为主,所以只能使用“Positive interaction”这样折中的术语。所以,这其实是“困难的环境促进微生物合作”在更大尺度下的严谨实验证据。

图6(Zhao et al., 2023, Nat Commun) 通过3008个共培养实验鉴定的堆肥环境下微生物互作关系。(A)37 ℃条件下的互作关系类型,其中互利共生(++)占33.8%。(B)高温(50 ℃)条件下的互作关系类型,其中互利共生(++)相比于低温条件占比显著增加,至44.3%。图片来源于原文图4C-D。
以上这些进展似乎让未来变得明朗:我们只需要对针对不同环境样品,采用更高通量的分离方法和互作鉴定方法,探究“环境依赖”的互作关系种类。并且已经有了一个清晰的假设:困难的环境促进微生物合作,而轻松环境加剧微生物竞争(“共患难不能同富贵”)。
然而,天边仍有乌云,还有许多被忽视的因素。例如,以上主要关注了不同“环境”的横向差异,忽视了在时间尺度上,微生物自身对环境的改变。近期,笔者所在实验室利用一个巧妙的实验设计,表明在一次培养体系下(Batch culture),微生物互作是随时间动态改变(Daniels et al., 2023, Isme J)。在这个例子中,两株海洋细菌首先进行正向互作,但在培养后期又转变为竞争关系,是源于微生物分泌的代谢物对环境的改变。这也对互作关系鉴定的金标准提出了质疑——如果不考虑时间序列,或许我们只捕捉到一个片段或一个宏观的综合,并不能真正反映微生物复杂的微观互作机制(与Alvaro和Seppe的观点类似)。不仅是时间,空间微环境的差异也可能引起互作的差异。这种对时空动态的依赖性被称为“上下文依赖性”(Context-dependency)。近期Sara团队应用数学模型对这一性质进行定量描述,基于系统中潜在的代谢过程的假设,预测体系中相互作用的时间变化(Oliver and Sara, 2023, bioRxiv)。所以,随着研究的深入,旧的假设随时可能被推翻(例如,新的研究结果可能并不支持“共患难不能同富贵”的假设),会有新的假设和概念被提出,这正是科学研究令人着迷之处。
笔者观点:除十分赞同上述观点外,笔者认为微生物互作发生在个体水平上,但目前的金标准其实只评价了种群A中的所有个体和种群B中所有个体的互作关系的综合,不能反映微生物之间真实的互作状态。同微生物种群(同一基因型)中的个体差异已被大量观察到(经典综述,现在老板的成名作之一:(Ackermann, 2015, Nat Rev Microbiol)),这种差异可能是不同个体所处空间微环境导致,也可能由于个体间本身的表现型差异。因此,种群A中的a1和a2两个个体,可能与种群B中的b1和b2发生着不同的相互作用(图7A)。一个相关的证据来自笔者实验室在单细胞水平上的微生物互作研究(Dal Co et al., 2020, Nat Ecol Evol; Micali et al., 2023, Proceedings of the National Academy of Sciences):两个微生物种群的代谢合作可能只发生在两个种群的空间交界地带,大量处于种群内部的个体其实没有与外部种群发生合作(图7B)。笔者目前也在开展个体单细胞水平的微生物互作研究。

图7 微生物相互作用发生在个体水平上。(A)一个假设的情景:种群A中的a1和a2两个个体,与种群B中的b1和b2发生着不同的相互作用。(B)一个相关例子,代谢合作可能只发生处于种群的空间交界处的个体(图中颜色较亮的个体)。图改编自(Dal Co et al., 2020, Nat Ecol Evol)的图2。
微生物更偏爱合作还是竞争:为什么理解这个问题很重要?
写了这么多,终于到了结尾的时候。用这样一个标题来结尾,是想分享一下作为微生物互作研究者的感受,为什么要从事这个方向的研究,以及如何在工作中取得乐趣?
首先,这个问题的答案其实就在问题本身。探索未知的自然科学问题本身就是有意义的。就像人类最初认识到老虎只吃肉,牛羊只吃草,而人类什么都吃,我们也想知道人类偏爱什么食物?人类的食性受什么影响?(相信很多人和笔者一样,偏爱肉,哈哈哈)。类似地,我们也想知道,在微小的微生物世界中,它们偏爱内卷还是合作共赢?
其次,理解这个问题,可以帮助我们了解更深层次的问题。我们更想了解,微生物的社会是怎么组织的?一个微生物社会有多少物种?不同物种的“菌”口比例怎么分布?它们通过什么样的关系纽带生活在一起?这样的关系纽带如何支持这个社会的稳定发展?这些问题的专业术语为微生物群落如何构建(Community assembly)?是微生物生态学最根本的问题之一。近期,麻省理工学院的Jeff Gore团队在这个问题上取得了许多重要的进展,成为了领域“网红”。他们利用可培养的微生物群落提出了许多简洁的微生物群落构建理论(一些经典文献:(Friedman et al., 2017, Nat Ecol Evol; Hu et al., 2022, Science; Lee et al., 2023, Proceedings of the National Academy of Sciences; Ratzke et al., 2020, Nat Ecol Evol))。不过,在Jeff团队使用可培养群落中,所有可培养微生物都表现为竞争关系,符合Kevin的观点。但Jeff团队其实并不否认合作关系在群落构建中的重要性。例如,Jeff也是Jonathan那篇文章的重要作者;在最近的一篇《Science》文章中,尽管实验体系中没有合作关系,但在模型研究中,他们同样引入了正向互作关系,讨论了在不同互作网络体系下的鲁棒性(Hu et al., 2022, Science)。这表明对微生物群落构建问题的理解基于对微生物互作关系结构的认识,但对这一基础问题的认识仍然有待深化。
第三,说完科学,还得讲一点应用。从农业生产、食品发酵、环境保护到与直接影响人体健康,微生物在人类的生产生活中始终扮演重要角色。在所有这些应用场景下,微生物都不是独立存在的,它们以一个社会(微生物群落或微生物组)的形式发挥作用。通过改造甚至从头构建微生物群落,我们有可能使其更好地执行我们所期望的功能,例如发酵出更美味的食物、更好地保护我们的生存环境、促进作物更好地生长、协助治疗疾病甚至强健体魄。这种改造必须建立在对微生物社会的深入了解之上,形成描述微生物群落构建的理论体系。利用微生物群落构建原理改造微生物社会,是目前一个很热的研究方向,叫“微生物组工程”(microbiome engineering)。笔者去年与上海交通大学的许平、唐鸿志教授团队合作,从微生物组工程在环境保护方面应用的角度撰写了一篇综述,介绍了许多学术概念(Hu et al., 2022, mLife)。作为一篇博文,这里不再描述更多学术细节,只是想强调,对自然科学问题的解答有助于我们形成自然科学理论体系,理论又可以指导更好地利用自然资源,促进社会的可持续发展。
最后,也是最重要的,研究微生物互作很有趣。有趣在于,微生物社会的组织与人类社会组织高度相似。当我们抱怨压力过大、内卷现象严重时,或许没想到在我们已经认知的微小社会中,微生物也是以内卷为主。这激励我们去探索那些未知的微生物社会,看看那些没有内卷的微生物社会是如何架构的。我们的社会能否借鉴这种架构方式?另一方面,当我们共同面对困难时,人们是可以团结一致的,这与微生物社会类似,都体现了“共患难不能同富贵”的道理。适度的竞争可以激发更多的发展,但过度的竞争可能导致内卷和资源浪费,从而降低整体生产力;适度的合作可以实现共同利益,但过度的合作可能会带来懒惰的“欺骗者”,或因合作伙伴的不辞而别而导致整体崩溃。究竟怎样的社会关系组合更有利于社会的稳定和生产力的提高?微生物互作研究为我们提供了一些思考的线索。不能在人类社会中实验验证的一些假设,利用微生物群落可以(这么说好像缺乏对生命的敬畏,罪过罪过!)。反过来,也可以将人类社会中的原理应用于解释微生物社会中的现象。例如,笔者最近研究所关注代谢分工互作模式,即微生物也可以像工厂流水线一样,由不同种群间的分工来完成一条代谢途径。笔者发现,与人类社会一样,微生物分工流水线的稳定运行依赖于利益的均匀分配,所谓“不患寡而患不均”(Wang et al., 2022, Cell Reports)。也就是说,工资要与工作量相匹配,在这个研究案例中,“工资”指微生物可直接利用的营养,“工作量”是指它们所承受的代谢负担。总之,在研究微生物社会的问题时,我们既可以利用人类社会学的理论来帮助理解,又可以将新的实验发现和理论假设应用于思考整个人类社会的发展结构。这种双向的思考过程相当有趣!
微生物互作是一个既具有科学意义又具有广泛应用价值,同时又令人着迷的研究主题。欢迎您加入我们,共同探讨微生物社会和人类社会中所共有的问题!

作者简介:
王淼啸,瑞士苏黎世联邦理工学院(ETH Zürich)博士后研究员,工作于Martin Ackermann教授和Olga Schubert研究员所领导的课题组。主要研究方向包括:微生物间相互作用机制及其生态学意义,微生物群落组装及演化机制,合成微生物组的理性设计与构建原理。在Cell Systems、Cell Reports、ISME Journal、mLife等期刊上发表学术论文16篇,其中第一或通讯作者署名8篇(2023年前)。担任mLife杂志海外兼职编辑;iMeta青年编委;ISME Journal、eLife、ISME Communications等杂志审稿人。热爱山地徒步,是瑞士最大的华人户外徒步团体Crazy Hikers Zürich的领队之一。小红书徒步博主@一天成天旅行的科研🐶。
小编评论:
这篇文章无疑激发了读者的浓厚兴趣,并引发了自然的反驳欲。文章的一个主要问题是,似乎当前的讨论过于聚焦于细菌,而忽略了微生物世界的多样性,包括真菌、古菌和噬菌体等其他微生物。这些微生物之间的相互作用至今还缺乏系统性的探讨,目前的争论大多仅限于细菌的合作与竞争。
事实上,小编在《Current Biology》上发表的一篇文章(Ruan., et al, 2022, Curr Biol)就从生物物理的角度报道了真菌菌丝能够无视细菌间的互作关系,从而维持微生物的共存关系。这表明,仅仅探讨细菌间的竞争与合作关系是不足以全面解释微生物在环境中的生存策略的。我们需要更加全面和综合的研究,考虑到微生物世界的多样性和复杂性。

小编简介:
阮楚晋,瑞士联邦水科学与技术研究所(Eawag)和中国农业大学联合博士后研究员。工作于David R. Jonhson研究员王钢教授的课题组。主要研究方向包括:微生物群落组装及演化机制,微生物间相互作用机制及其生态学意义,微生物群落功能的调控机制。以第一作者在Cell子刊Current Biology、Nature子刊npj Biofilms and Microbiomes、ISME Communications等国际知名期刊发表学术论文7篇,在微生物学报、微生物学通报和土壤学报等国内知名学术期刊发表论文4篇,并以合作作者发表的论文8篇(2023年前)。《土壤学报》青年编委;ISME Journal审稿人。
参考文献
Ackermann, M. (2015). A functional perspective on phenotypic heterogeneity in microorganisms. Nat Rev Microbiol 13, 497-508. 10.1038/nrmicro3491.
Booth, S.C., Meacock, O.J., and Foster, K.R. (2023). Cell motility greatly empowers bacterial contact weapons. bioRxiv, 2023.2010.2010.561656. 10.1101/2023.10.10.561656.
Booth, S.C., Smith, W.P.J., and Foster, K.R. (2022). Bows and swords: why bacteria carry short and long-range weapons. bioRxiv, 2022.2010.2013.512033. 10.1101/2022.10.13.512033.
Coyte, K.Z., Schluter, J., and Foster, K.R. (2015). The ecology of the microbiome: Networks, competition, and stability. Science 350, 663-666. 10.1126/science.aad2602.
D'Souza, G., and Kost, C. (2016). Experimental Evolution of Metabolic Dependency in Bacteria. Plos Genetics 12. doi: ARTN e100636410.1371/journal.pgen.1006364.
D'Souza, G., Shitut, S., Preussger, D., Yousif, G., Waschina, S., and Kost, C. (2018). Ecology and evolution of metabolic cross-feeding interactions in bacteria. Natural Product Reports 35, 455-488. 10.1039/c8np00009c.
Dal Co, A., van Vliet, S., Kiviet, D.J., Schlegel, S., and Ackermann, M. (2020). Short-range interactions govern the dynamics and functions of microbial communities. Nat Ecol Evol 4, 366-375. 10.1038/s41559-019-1080-2.
Daniels, M., van Vliet, S., and Ackermann, M. (2023). Changes in interactions over ecological time scales influence single-cell growth dynamics in a metabolically coupled marine microbial community. Isme J 17, 406-416. 10.1038/s41396-022-01312-w.
Foster, K.R., and Bell, T. (2012). Competition, Not Cooperation, Dominates Interactions among Culturable Microbial Species. Curr Biol 22, 1845-1850. 10.1016/j.cub.2012.08.005.
Friedman, J., Higgins, L.M., and Gore, J. (2017). Community structure follows simple assembly rules in microbial microcosms. Nat Ecol Evol 1, 109. 10.1038/s41559-017-0109.
Giri, S., Ona, L., Waschina, S., Shitut, S., Yousif, G., Kaleta, C., and Kost, C. (2021). Metabolic dissimilarity determines the establishment of cross-feeding interactions in bacteria. Curr Biol 31, 5547-5557 e5546. 10.1016/j.cub.2021.10.019.
Giri, S., Yousif, G., Shitut, S., Oña, L., and Kost, C. (2022). Prevalent emergence of reciprocity among cross-feeding bacteria. ISME Communications2, 71. 10.1038/s43705-022-00155-y.
Gould, A.L., Zhang, V.V., Lamberti, L., Jones, E.W., Obadia, B., Korasidis, N., Gavryushkin, A., Carlson, J.M., Beerenwinkel, N., and Ludington, W.B. (2018). Microbiome interactions shape host fitness. P Natl Acad Sci USA 115, E11951-E11960. 10.1073/pnas.1809349115.
Granato, E.T., and Foster, K.R. (2020). The Evolution of Mass Cell Suicide in Bacterial Warfare. Curr Biol 30, 2836-2843 e2833. 10.1016/j.cub.2020.05.007.
Granato, E.T., Meiller-Legrand, T.A., and Foster, K.R. (2019). The Evolution and Ecology of Bacterial Warfare. Curr Biol 29, R521-R537. 10.1016/j.cub.2019.04.024.
Granato, E.T., Smith, W.P.J., and Foster, K.R. (2023). Collective protection against the type VI secretion system in bacteria. Isme J 17, 1052-1062. 10.1038/s41396-023-01401-4.
Hu, H., Wang, M., Huang, Y., Xu, Z., Xu, P., Nie, Y., and Tang, H. (2022). Guided by the principles of microbiome engineering: Accomplishments and perspectives for environmental use. mLife 1, 382-398. https://doi.org/10.1002/mlf2.12043.
Hu, J., Amor, D.R., Barbier, M., Bunin, G., and Gore, J. (2022). Emergent phases of ecological diversity and dynamics mapped in microcosms. Science378, 85-89. 10.1126/science.abm7841.
Kehe, J., Kulesa, A., Ortiz, A., Ackerman, C.M., Thakku, S.G., Sellers, D., Kuehn, S., Gore, J., Friedman, J., and Blainey, P.C. (2019). Massively parallel screening of synthetic microbial communities. Proc Natl Acad Sci U S A 116, 12804-12809. 10.1073/pnas.1900102116.
Kehe, J., Ortiz, A., Kulesa, A., Gore, J., Blainey, P.C., and Friedman, J. (2021). Positive interactions are common among culturable bacteria. Sci Adv7. doi: ARTN eabi715910.1126/sciadv.abi7159.
Lee, H., Bloxham, B., and Gore, J. (2023). Resource competition can explain simplicity in microbial community assembly. Proceedings of the National Academy of Sciences 120, e2212113120. doi:10.1073/pnas.2212113120.
Micali, G., Hockenberry, A.M., Dal Co, A., and Ackermann, M. (2023). Minorities drive growth resumption in cross-feeding microbial communities. Proceedings of the National Academy of Sciences 120, e2301398120. doi:10.1073/pnas.2301398120.
Mitri, S., and Foster, K.R. (2013). The Genotypic View of Social Interactions in Microbial Communities. Annual Review of Genetics, Vol 47 47, 247-273. 10.1146/annurev-genet-111212-133307.
Mitri, S., Xavier, J.B., and Foster, K.R. (2011). Social evolution in multispecies biofilms. P Natl Acad Sci USA 108, 10839-10846. 10.1073/pnas.1100292108.
Momeni, B., Waite, A.J., and Shou, W. (2013). Spatial self-organization favors heterotypic cooperation over cheating. Elife 2. doi: ARTN e00960/10.7554/eLife.00960.
Nadell, C.D., Drescher, K., and Foster, K.R. (2016). Spatial structure, cooperation and competition in biofilms. Nat Rev Microbiol 14, 589-600. 10.1038/nrmicro.2016.84.
Niehus, R., Oliveira, N.M., Li, A., Fletcher, A.G., and Foster, K.R. (2021). The evolution of strategy in bacterial warfare via the regulation of bacteriocins and antibiotics. Elife 10. 10.7554/eLife.69756.
Oliveira, N.M., Niehus, R., and Foster, K.R. (2014). Evolutionary limits to cooperation in microbial communities. P Natl Acad Sci USA 111, 17941-17946. 10.1073/pnas.1412673111.
Oliver, J.M., and Sara, M. (2023). Environment-organism feedbacks drive changes in ecological interactions. bioRxiv, 2023.2010.2031.565024. 10.1101/2023.10.31.565024.
Oña, L., and Kost, C. (2022). Cooperation increases robustness to ecological disturbance in microbial cross-feeding networks. Ecology Letters25, 1410-1420. 10.1111/ele.14006.
Ortiz, A., Vega, N.M., Ratzke, C., and Gore, J. (2021). Interspecies bacterial competition regulates community assembly in the intestine. Isme J 15, 2131-2145. 10.1038/s41396-021-00910-4.
Palmer, J.D., and Foster, K.R. (2022). Bacterial species rarely work together. Science 376, 581-582. 10.1126/science.abn5093.
Palmer, J.D., and Foster, K.R. (2022). The evolution of spectrum in antibiotics and bacteriocins. Proc Natl Acad Sci U S A 119, e2205407119. 10.1073/pnas.2205407119.
Pande, S., Kaftan, F., Lang, S., Svatos, A., Germerodt, S., and Kost, C. (2016). Privatization of cooperative benefits stabilizes mutualistic cross-feeding interactions in spatially structured environments. Isme J 10, 1413-1423. 10.1038/ismej.2015.212.
Piccardi, P., Vessman, B., and Mitri, S. (2019). Toxicity drives facilitation between 4 bacterial species. P Natl Acad Sci USA 116, 15979-15984. 10.1073/pnas.1906172116.
Preussger, D., Giri, S., Muhsal, L.K., Oña, L., and Kost, C. (2020). Reciprocal Fitness Feedbacks Promote the Evolution of Mutualistic Cooperation. Curr Biol 30, 3580-+. 10.1016/j.cub.2020.06.100.
Ratzke, C., Barrere, J., and Gore, J. (2020). Strength of species interactions determines biodiversity and stability in microbial communities. Nat Ecol Evol 4, 376-383. 10.1038/s41559-020-1099-4.
Smith, W.P.J., Vettiger, A., Winter, J., Ryser, T., Comstock, L.E., Basler, M., and Foster, K.R. (2020). The evolution of the type VI secretion system as a disintegration weapon. Plos Biology 18. doi: ARTN e3000720/10.1371/journal.pbio.3000720
Smith, W.P.J., Wucher, B.R., Nadell, C.D., and Foster, K.R. (2023). Bacterial defences: mechanisms, evolution and antimicrobial resistance. Nat Rev Microbiol 21, 519-534. 10.1038/s41579-023-00877-3.
Venturelli, O.S., Carr, A.V., Fisher, G., Hsu, R.H., Lau, R., Bowen, B.P., Hromada, S., Northen, T., and Arkin, A.P. (2018). Deciphering microbial interactions in synthetic human gut microbiome communities. Molecular Systems Biology 14. doi: ARTN e8157/10.15252/msb.20178157.
Wang, M.X., Chen, X.L., Liu, X.N., Fang, Y., Zheng, X., Huang, T., Tang, Y.Q., Ackermann, M., Nie, Y., and Wu, X.L. (2022). Even allocation of benefits stabilizes microbial community engaged in metabolic division of labor. Cell Reports40. ARTN 111410/10.1016/j.celrep.2022.111410.
Wang, M.X., Liu, X.N., Nie, Y., and Wu, X.L. (2021). Selfishness driving reductive evolution shapes interdependent patterns in spatially structured microbial communities. Isme J 15, 1387-1401. 10.1038/s41396-020-00858-x.
Weiss, A.S., Burrichter, A.G., Raj, A.C.D., von Strempel, A., Meng, C., Kleigrewe, K., Münch, P.C., Rössler, L., Huber, C., Eisenreich, W., et al.(2022). In vitro interaction network of a synthetic gut bacterial community. Isme J 16, 1095-1109. 10.1038/s41396-021-01153-z.
Xavier, J.B., Kim, W., and Foster, K.R. (2011). A molecular mechanism that stabilizes cooperative secretions in. Molecular Microbiology 79, 166-179. 10.1111/j.1365-2958.2010.07436.x.
Zhao, Y., Liu, Z., Zhang, B., Cai, J., Yao, X., Zhang, M., Deng, Y., and Hu, B. (2023). Inter-bacterial mutualism promoted by public goods in a system characterized by deterministic temperature variation. Nat Commun 14, 5394. 10.1038/s41467-023-41224-7.























 1775
1775

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








