点击蓝字 关注我们
肠道菌群在肺动脉高压中的神秘面纱

iMeta主页:http://www.imeta.science
综 述
● 原文链接DOI: https://doi.org/10.1002/imt2.159
● 2024年1月1日,北京协和医学院熊长明、杨跃进及北京大学心血管研究所郑乐民等团队在iMeta在线联合发表了题为 “Promising dawn in the management of pulmonary hypertension: The mystery veil of gut microbiota” 的文章。
● 本综述对肠道菌群与PH之间的联系进行了独特的探索性分析,旨在推动对肠肺轴的进一步研究。
● 第一作者:杨逸成、张瀚文、王瑶尧、许靖
● 通讯作者:郑乐民(zhengl@bjmu.edu.cn)、杨跃进(yangyjfw@126.com)、熊长明(xiongcmfw@163.com)
● 合作作者:舒松仁、汪沛志、丁曙思、黄源
● 主要单位:国家心血管病中心 中国医学科学院 北京协和医学院 阜外医院、北京大学医学部心血管疾病研究所、首都医科大学天坛医院
亮 点
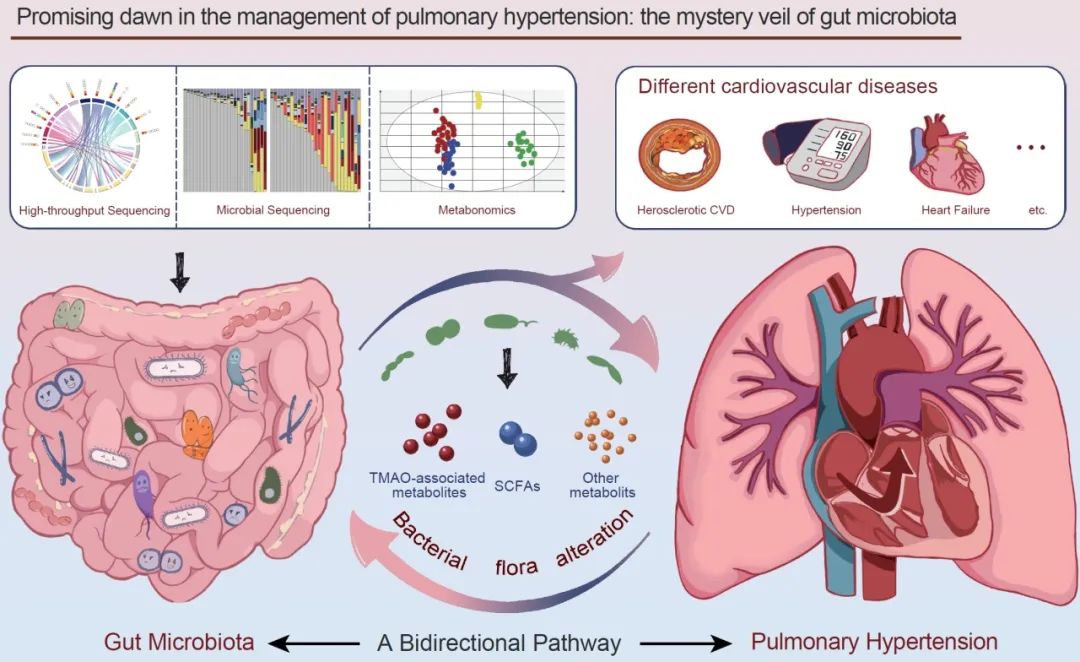
● 近年来,肠道菌群为肺动脉高压(PH)管理带来了前所未有的模式,这让研究人员和临床医生在精确的疾病控制方面感到欣喜;
● 肠肺轴是肠道和肺之间的双向相互作用,通过循环、神经系统和其他生理过程发生,最终影响肠道和肺的健康;
● 我们提供了肠道菌群及其代谢产物与肺动脉高压的全面概况,强调了微生物和宿主在调控肺动脉高压方面的相互作用;
● 随着肠道菌群宏基因组学和代谢组学等技术的快速发展,肠道菌群与人体的关联最终将被揭示,这将为PH患者的疾病治愈和预后改善带来曙光。
摘 要
肠道菌群是定居于肠道的复杂微生物群落,对人体健康起着至关重要的作用。它错综复杂地参与了新陈代谢,也影响着各种各样的生理过程。肠肺轴是胃肠道和肺部之间的双向通路。最近的研究表明,肠道菌群在肺免疫反应调节和肺部疾病发展中起着至关重要的作用。本文介绍了在肺动脉高压 (PH) 这样一种以肺血管压力和阻力升高为特征的致命性疾病中,肠道菌群和相关代谢产物是如何参与其发病机制。我们的研究团队探讨了肠道菌群代谢产物在心血管疾病中的作用,证实了腐胺、琥珀酸、三甲胺 (TMAO) 和三甲基-5-氨基戊酸等代谢物与疾病的相关性。此外,我们发现特异性代谢产物,如TMAO和甜菜碱,在PH中具有重要的临床价值,表明他们有潜力成为疾病管理过程中的生物标志物。在详细介绍肠道微生物及其代谢产物与PH之间的相互作用的同时,我们提出调控肠道菌群可以成为肺动脉高压的潜在治疗方法。最后,我们致力于减轻由PH引起的沉重社会经济负担。这篇综述对肠道菌群与PH之间的联系进行了独特的探索性分析,旨在推动对肠肺轴的进一步研究。
视频解读
Bilibili:https://www.bilibili.com/video/BV11u4m1A7cz/
Youtube:https://youtu.be/8jz6TABJDw8
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
肺动脉高压 (PH) 是多种致病因素共同作用所致的一种病理生理状态。根据 2022 年欧洲心脏病学会/欧洲呼吸学会指南,PH 的定义是静息时仰卧位右心漂浮导管测定平均肺动脉压大于20 mmHg。PH 是一种进行性疾病,可引起心力衰竭,最终导致死亡。随着疾病和医学检查技术的进步,作为心血管疾病 (CVD) 之一的PH在过去十年中备受关注。PH 患者可表现出非特异性体征和症状,包括疲劳、劳力性呼吸困难、胸痛、下肢或腹部水肿以及头晕。因此,大多数PH患者确诊时病情已错过了最佳治疗时机,恶化至晚期,导致该病生存时间短、预后差。根据发病原因和相关治疗进行分类,PH可分为5类,包括肺动脉高压 (PAH) 、与左心疾病相关的PH、与肺部疾病和/或缺氧相关的PH、与肺动脉栓塞相关的PH和机制不明确和/或多因素相关的PH。
PAH 是一种以肺血管压力和阻力升高为特征的疾病,是由肺小动脉的增殖、外源性和纤维化重塑引起的。虽然之前的观点将肺血管的异常归因于过度增殖的平滑肌细胞和功能失调的内皮细胞,但最近的研究已将焦点转向PAH中间质细胞和免疫炎症细胞的调节,以及代谢功能障碍 (Warburg效应) 。尽管目前我们对PAH有了深入的了解,但临床治疗仍然仅仅依赖于靶向药物,包括磷酸二酯酶5抑制剂、内皮素受体拮抗剂、可溶性鸟苷酸环化酶激活剂和前列腺素。然而令人失望的是,这些药物无法逆转肺血管重塑的发病机制,导致病情逐渐恶化,严重时需要进行肺移植。对于第4类慢性血栓栓塞性肺动脉高压 (CTEPH) ,球囊肺血管成形术和肺动脉内膜切除术等治疗方法被认为在临床上是有效的。然而,侵袭性损伤、操作的复杂性和耗时性阻碍了对该疾病的及时干预。尽管我们目前对PH的了解不断深入,但找到针对这个“癌症样”疾病的有效疗法仍然是一个巨大的挑战。进一步探究治疗方法对于实现 PH 的真正“治愈”至关重要。
近年来,肠道菌群的显著发展为疾病管理带来了前所未有的模式。肠道系统是人体最大的器官,它包含一个巨大的微生物群落,其中细菌、古细菌、真菌和病毒是主要组成部分,构成了每个人体独特的基因库。所有动物与微生物群落共同进化,包括人类。微生物在营养吸收、定植抗力和免疫过程中不断适应宿主的环境和生态。肠道菌群组成及其相关核酸和代谢物与人体功能以双向精调的方式相互作用,从而影响个体健康。随着高通量测序和宏基因组学的发展,我们可以获得人类肠道菌群动态变化的信息,从而帮助揭开肠道微生物的神秘面纱。在过去的十年中,人类肠道菌群引起了科研人员的持续关注,其与心血管疾病发病机制的关系逐渐阐明。例如,肠杆菌科 (Enterobacteriaceae) 和链球菌属 (Streptococcus spp.) 丰度的增加导致动脉粥样硬化性CVD的表型。与健康人群相比,高血压患者体内微生物丰富度和多样性下降,普雷沃氏菌 (Prevotella) 、克雷伯氏菌 (Klebsiella) 等细菌数量增加。此外,在心力衰竭患者中,包括毛螺菌科类 (Lachnospiraceae) 在内的微生物丰富度下降。虽然肠道菌群在其他CVD中研究更加深入,但在PH中也取得了一些小进展。在PAH 患者肠道菌群中,产生三甲胺 (TMA) /三甲胺 N-氧化物 (TMAO) 的细菌增加,但产生丁酸盐和丙酸盐的细菌减少,具体包括粪球菌 (Coprococcus) 、丁酸弧菌 (Butyrivibrio) 、真杆菌 (Eubacterium) 、阿克曼氏菌 (Akkermansia) 、拟杆菌 (Bacteroides) 和毛螺菌 (Lachnospiraceae) 。
然而,由于肠道菌群的个体间变异较为显著,揭示肠道菌群的实际组分变化及其在疾病发病机制中的准确作用仍是一个相当大的挑战。微生物组代谢物是了解微生物与疾病之间相互作用的一种方式,目前已有越来越多的证据证实 CVD 与代谢物之间的关联,包括三甲胺相关化合物、短链脂肪酸 (SCFA) 、胆汁酸和氨基酸。我们课题组也探究了肠道微生物组代谢物与 CVD 的关系,并证明了腐胺、琥珀酸盐、TMAO 和 N,N,N-三甲基-5-氨基戊酸 (TMAVA) 与 CVD 之间的关联。此外,我们发现TMAO和甜菜碱等代谢物是PH领域的潜在生物标志物,具有十分重要的临床价值。
随着肠道菌群宏基因组学、非靶向或靶向代谢组学等技术的快速发展,微生物与人体之间错综复杂的关系将随着时间的推移被破解,这将为肺动脉高压患者的疾病治愈和预后改善带来曙光。迄今为止,研究大多集中在公共卫生中的微生物群,以期改变现有仍有不足的治疗方式 (图1)。这篇综述全面介绍了肺动脉高压中肠道菌群及其相关代谢物的概况,强调了肠道菌群和宿主在肺动脉高压的相互作用。我们相信我们的工作可以推动肺动脉高压研究发展,最终减轻疾病负担。

图1. 肠道菌群与肺动脉高压之间的关系
随着宏基因组学和非靶向或靶向代谢组学等技术的快速发展,对肠道菌群及其相关代谢物的了解不断增长。肠道菌群功能失调与心血管疾病(心力衰竭、高血压和动脉粥样硬化性心脏病)密切相关。最近,有研究表明肠道菌群及其相关代谢物也参与到肺动脉高压的发病机制,肺动脉高压可能导致细菌菌群的改变。该图全面概括肺动脉高压中肠道菌群及其代谢产物,强调肠道菌群及其宿主在调节肺动脉高压方面的相互作用。CVD:心血管疾病;SCFA:短链脂肪酸;TMAO:氧化三甲胺。
肺肠轴
在环境因素、肠道菌群和代谢物的参与下,肠-肺轴构建了肠道和肺之间的双向作用通道。这种相互作用通过循环、神经系统和其他生理过程发生,最终影响肠道和肺部的健康。肠-肺轴概念最初由Turner Warwick于 1968 年提出,此后对肺与肠道疾病之间相关性的研究成为热点。1976 年,Kraft等人观察到患有严重炎症性肠病的患者慢性支气管肺疾病的发病率较高,提出肺损伤的原因可能是肠道损伤和脂多糖 (LPS) 易位到循环系统中,从CT结果中可观察到肠道损伤和肺部症状的严重程度之间具有相关性。此外,肺部疾病也被证明会增加肠道功能障碍发生风险,哮喘患者的肠易激综合症发病率是健康人的两倍。虽然肠-肺轴已在人类和小鼠模型中得到证实,但其发病机制仍不清楚,需要进一步的探究。
肺和肠的同源性
肺和肠之间的同源性是“肠-肺轴”的结构基础,肺、气管、呼吸道上皮和肠在胚胎发育中均起源于内胚层。最近的一项研究表明,改变转录因子的活性可以诱导胚胎肺祖细胞产生肠祖细胞,从而进一步产生各种类型的肠细胞。呼吸道和消化道粘膜属于粘膜免疫系统,可产生大量的分泌型免疫球蛋白A (sIgA) 。sIgA是各个器官粘膜免疫的共同分子基础,是反映“肺-肠轴”的重要物质。许多实验室已经证明sIgA可以阻止病原菌在宿主组织内传播,并可以与许多非病原菌或有益菌结合。这些发现意味着这种特殊抗体在调节微生物群落的组成方面具有重要作用。此外,研究人员发现,在肠道炎症患者的肠道组织中可以检测到肺功能蛋白肺表面活性蛋白A,嗜酸性粒细胞趋化因子的 mRNA 可在同时在肺和肠中表达。肠粘膜和肺粘膜在结构和免疫调节机制上的许多相似之处构成了肠-肺轴内双向作用的生物学基础。
免疫反应
呼吸道和消化道粘膜属于粘膜免疫系统,一个器官的炎症反应可影响另一个器官。粘液相关淋巴组织中的微皱褶细胞识别抗原并将其呈递给树突状细胞,树突状细胞迁移到淋巴结并在病原体存在的情况下激活T和B淋巴细胞介导的免疫反应。肺和肠道具有结构和功能上的相似性,使得它们具有共同的归巢受体,如CCR6、α4β7 和 CCR9。这些受体将T细胞招募到肠道,而CCR4 将T细胞引导到肺部。粘附分子 (特别是 VCAM-1 和 α4β1 整合素) 与 L-选择素和 PNAd 的相互作用对于促进免疫细胞归巢至肺部至关重要。当肠道发生炎症性改变时,T效应记忆细胞激活并表达L-选择素/CD62L,随后通过循环系统进入肺,与肺内皮上的 PNAd 配体结合。淋巴细胞依赖这些受体在外周器官之间移动。一项体外研究表明,肺树突状细胞能够诱导T细胞表达CCR9和α4β7,为肠肺轴提供了证据。当黏膜损伤发生时,它会引起免疫应答,可能通过黏膜免疫途径影响其他黏膜免疫应答。这可能导致不同黏膜部位的局部刺激引起不同程度的免疫应答。例如,肠道菌群有能力刺激2型和3型固有淋巴细胞的产生,它们通过淋巴和血液循环迁移到呼吸道,造成肺部损伤。
肠道菌群代谢产物
肠道菌群代谢物在肠肺轴中发挥重要作用,可通过循环系统在肺部和肠道之间进行双向调控。短链脂肪酸是肠道代谢物的重要组成之一,常见的短链脂肪酸包括丁酸盐、丙酸盐和乙酸盐。SCFA在粘膜免疫中发挥着重要作用,可促进杯状细胞的分化和粘蛋白的产生,增加肠道IgA的分泌,进而增强肠上皮屏障功能。SCFA可通过G蛋白偶联受体或通过抑制组蛋白脱乙酰酶 (HDAC) 的表观遗传修饰来诱导Treg激活,从而发挥抗炎作用。SCFA的微生物合成促进结肠中Treg细胞的生成。有趣的是,喂食高纤维的小鼠表现出更高的 SCFA 循环水平,并且对肺部过敏性炎症具有预防作用。相比之下,喂养低纤维的小鼠表现出较低的 SCFA 循环水平,并且对过敏性肺病的易感性较高。丁酸盐作为SCFA的代表,在肠道上皮细胞功能中发挥着重要作用,促进免疫细胞的分化和成熟,从而调节肠道免疫系统。值得注意的是,SCFA不仅调节胃肠道免疫系统,还影响胃肠道的细菌分布。丁酸盐诱导过氧化物酶体增殖物激活受体-γ,促进结肠上皮向β-氧化转变,维持了厌氧环境。相反,丁酸盐的缺乏会导致诱导型一氧化氮合酶表达升高和变形菌 (Proteobacteria) 的增多。丁酸盐通过影响胃肠道中的细菌分布来调节肺部疾病的发病机制。综上所述, SCFA可以跨膜进入外周血液系统,影响骨髓腔内免疫细胞的分化和成熟,通过接到免疫细胞进入肺部,调节肺部的免疫反应。
TMAO 是肠道菌群代谢产物之一,被认为是心血管疾病和其他慢性疾病 (包括肺部疾病) 的潜在危险因素。在十年前,TMAO浓度的升高就已被证实可以作为CVD患病风险的预测指标。近年来,其与肺部疾病的关联也逐渐被揭示。TMAO主要来源于胆碱,在红肉和鱼类中含量丰富。肠道菌群胆碱-TMA裂解酶可将其分解产生TMA,TMA经门静脉进入肝脏,被含黄素单加氧酶氧化,最终生成TMAO。在肝脏中合成后,TMAO 通过血流输送到体内的各个系统,包括肺和心脏。TMAO会激活炎症并对肺血管造成结构性损伤。研究表明,TMAO 血液浓度升高会损害内皮功能,并因氧化应激增加而引发血管炎症。TMAO 激活 TXNIP-NLRP3 炎症小体,抑制内皮一氧化氮合酶活性并减少一氧化氮的产生。这一过程会促进氧化应激反映的发生,提高IL-1β和IL-18的水平。在缺氧环境下,TMAO 会存进右心室成纤维细胞释放TGF-β/Smad,同时TGF-β/Smad激活成纤维细胞,从而刺激I型胶原蛋白的释放并最终导致心脏和肺纤维化。与TGF-β/p38/MAPK/Smad 通路相关的分子表达增加表明它们参与肺和右心室纤维化的发生。此外,其他肠道微生物相关代谢物被证实可参与肺部相关生理功能,这有助于进一步了解肠肺轴。
微生物组分
微生物组分也是一种可溶性物质,可通过循环系统促进肺部和肠道之间的相互作用。微生物成分包括微生物相关分子模式,它们与宿主模式识别受体 (如TLR或 NLR) 相互作用,在人体内产生免疫炎症效应。微生物相关的分子模式包括肽聚糖和脂多糖 (LPS) ,脂多糖是大多数革兰氏阴性细菌外膜的重要组成部分,在保护细菌免受环境压力、抗生素耐药性和共生影响方面发挥着关键作用。LPS 对人类健康至关重要,与其他免疫剂相比,它会激活不同的免疫机制,也是唯一通过TLR4激活肺部吞噬细胞的物质。TLR4激活后,NF-κB和MAPK通路也会被激活。这两条途径最终引起炎症反应,促进IL-1、IL-6、TNF-α和NO的释放,最终导致急性肺损伤。研究表明,TLR7信号通路受阻可引起免疫反应下调,某些T淋巴细胞亚群的免疫活性受损,导致流感病毒难以被清除。过多的活性氧产生也是LPS引起的急性肺损伤的一个重要因素。活性氧对肺细胞线粒体DNA的攻击导致细胞死亡和组织损伤。肺泡上皮细胞和毛细血管内皮细胞损伤会引起弥漫性间质性肺水肿和急性低氧性呼吸衰竭。
菌群失调
肺肠轴失衡的明显迹象是肠道菌群失调,与呼吸道疾病密切相关。人体肠道是一个庞大的微生物栖息地,内部栖息着数千种细菌,总数达到1014,几乎是成人细胞数量的10倍,是人体内编码基因数量的100倍。在人类结肠中,拟杆菌门 (Bacteroidetes) 、厚壁菌门 (Firmicutes) 、变形菌门 (Proteobacteria) 和放线菌门 (Actinobacteria) 占据主导地位。肠道菌群的成分和功能的改变可以通过粘膜免疫系统影响呼吸系统。肠道上皮细胞的粘蛋白分泌可阻止细菌迁移到上皮组织。一旦粘膜上皮受损,微生物就会发生移位,导致全身性炎症,进而引发脓毒症等严重疾病。此外,粘蛋白及其成分可以通过细菌的粘附、生长调控粘膜组织内部的微生物群组成。
肠肺轴的双向性质至关重要,COVID-19患者在整个住院期间肠道菌群表现出动态变化,其特点是产生 SCFA 的细菌 (如Faecalibacterium) 减少,而兼性厌氧细菌 (如Escherichia–Shigella) 增加。放线菌 (Eggerthella) 增加可能导致肠道通透性增加如腹泻等胃肠道症状。肠道通透性增加还会使肠道细菌移位,引发全身炎症,最终导致疾病恶化。除 COVID-19 外,其他疾病患者的粪便中还经常检测到特定细菌,例如在哮喘患者中可检测到拟杆菌属 (Bacteroides) 、粪杆菌属 (Faecalibacterium) 、琼脂杆菌属 (Agathobacter) 、经黏液真杆菌属 (Blautia A) 和罗氏菌属 (Roseburia) ;在慢性阻塞性肺疾病患者中可检测到普拉梭菌 (Faecalicatena) 、颤螺菌属 (Oscillibacter) 、阿沙梭菌 (Lawsonibacter) 、普氏梭杆菌 (Flavonifractor) 和链霉菌属 (Streptomyces) 。与对照组相比,结核分枝杆菌患者肠道菌群的α多样性降低,变形菌门丰度相对增加,拟杆菌丰度减少。慢性炎症引起的理化性质的变化可以促进微生物群落内特定物种的建立,将它们从暂住菌转变为常驻菌。许多呼吸系统疾病在胃肠道中都有表现,并影响肠道菌群的组成。流感病毒肺炎通过脂质载体蛋白-2和结肠粘蛋白Muc5ac表达增加诱发腹泻,表明发生轻度肠道炎症。多重耐药铜绿假单胞菌引起的细菌性肺炎可诱发胃肠道疾病,其机制可能是通过限制M期细胞周期来抑制胃肠道上皮细胞的增殖。CD4+T细胞与肠道菌群呈正相关,维持生态平衡。尽管一些研究人员提出肺部疾病可能对肠道菌群产生影响,但肺部对肠道菌群影响的确切分子机制仍知之甚少。氧稳态对于维持肠道菌群功能至关重要。胎儿肺部在低氧条件下发育,早产会使发育中的肺部暴露在高氧环境中。高氧环境可以直接抑制肠上皮细胞中抗菌肽的表达,还可以影响回肠微生物群的组成,特别是导致葡萄球菌丰度增加。抗菌肽在调节宿主肠道菌群的稳定性方面发挥着关键作用。高氧暴露对回肠上皮细胞的损伤与抗菌肽表达的下调有关。相反,慢性阻塞性肺病引起的缺氧导致胃肠道完整性受损,葡萄糖转运活性低下,蛋白质消化吸收减少,导致肠道菌群紊乱,SCFA合成减少,血清中乙酸浓度减少进而加重病情。免疫是另一个潜在因素。动物实验证实2型ILC (ILC2) 促进肠粘膜抗寄生虫防御和组织修复。这些细胞可以在 IL-33 刺激下从肺部迁徙到肠道,并通过肺肠轴成熟。过敏原诱导的肺ILC2过度激活可引起肠道ILC2炎症,而肺ILC2的发育缺陷可显著影响肠道ILC2的数量和功能。长链非编码RNA也可以影响肠肺轴。研究表明,miR-155 和 miR-21 在肺和肠粘膜损伤组织中均显着上调。MiR-155 靶向肺部的 SOCS1和肠道中的FOXO3a,进而发挥促炎作用,而 miR-21既可以通过肺部的5MAD7促进纤维化,并又可以通过RhoB降低肠道屏障功能。虽然表观遗传学并没有揭示肠道和肺部哪个是因、哪个是果,但它为探索它们之间的关系提供了一个新的方向。最近的研究证实呼吸道微生物组成的变化与肺动脉高压的发生有关。唾液链球菌会导致如右心室收缩压升高、右心室肥大和肺血管重塑等肺动脉高压的典型表现。
简而言之,肺和肠之间的同源性是肠肺轴的结构基础。免疫细胞及其相互作用在生理过程中发挥重要作用。肠道代谢物和微生物成分 (包括脂多糖) 是肠-肺轴中不可或缺的介质。此外,肠道菌群组成和功能变化可以通过粘膜免疫系统影响呼吸系统,而肺部疾病也会导致肠道功能障碍。图2简要概括肺肠轴的双向作用。

图2. 肠肺轴的双向调节
肠肺轴是肠道和肺之间的相互作用,受到环境因素、肠道菌群及其代谢物的影响。这种相互作用通过循环系统、神经系统和其他生理过程发生,并最终影响肠道和肺的健康。(1)肺和肠的同源性是肠肺轴的结构基础。(2) 粘液相关淋巴组织中的微皱褶细胞识别抗原并将其呈递给树突状细胞,树突状细胞迁移到淋巴结并在病原体存在的情况下激活T和B淋巴细胞介导的免疫反应。(3)肠道菌群产生的代谢产物(TMAO和SCFAs),通过血液系统循环,促进肺部和肠道之间的双向调控。(4) 脂多糖等微生物成分是可溶性物质,也可通过循环系统促进肺部和肠道之间的调节。(5)肠道菌群失调是肺肠轴失衡的具体表现,肠道菌群组成和功能的变化可以通过粘膜免疫系统影响呼吸系统。LPS:脂多糖;SCFA:短链脂肪酸;TMAO:氧化三甲胺。
肺动脉高压中肠道菌群概况
胃肠道内包含数百个种肠道菌群,它们紧密地参与机体的各项生理功能,在遗传、代谢和免疫学方面发挥着重要的作用。肠道菌群失调可见于心血管疾病、结肠癌、肥胖和类风湿性关节炎等多种疾病。近年来,许多研究也证实肠道菌群参与肺动脉高压的发病,在缺氧或野百合碱 (MCT) 诱导的 PH 患者和动物模型中可观察到肠道菌群的变化。我们总结了肺动脉高压中肠道菌群概况,为更深入地理解“肠道-PH”轴奠定了基础 (表1) 。
表 1 肺动脉高压中肠道菌群概况

CTEPH:慢性血栓栓塞性肺动脉高压;F/B ratio:厚壁菌/拟杆菌;HySu,缺氧/Sugen 5416;MCT:野百合碱;PAH:动脉性肺动脉高压;PH:肺动脉高压;SuHx:sugen 5416/缺氧;TMA:三甲胺。
PH病人
PAH病人
最近的一项研究表明,PAH患者具有独特的肠道菌群特征。与对照组相比,PAH 患者的α多样性、细菌丰富度和均匀度显着降低。双歧杆菌 (Bifidobacterium) 与TMA/TMAO和嘌呤代谢相关的细菌群落的增加,而产生丙酸盐的细菌 (Akkermansia, Bacteroide) 以及产生丁酸盐的细菌 (Butyrivibrio, Lachnospiraceae, Coprococcus, Eubacterium) 数量减少。此外,PAH患者中肠道菌群代谢产物的成分也发生改变,精氨酸、脯氨酸和鸟氨酸含量的增加。与健康对照者相比,PAH 患者还表现出促炎相关的菌群增加,例如多形拟杆菌 (Bacteroides thetaiotaomicron) 、狄氏副拟杆菌 (Parabacteroides distasonis) 和普通拟杆菌 (Bacteroides vulgatus) 。相反,某些具有抗炎特性的菌种在患者中的含量低于正常人组,例如普拉梭菌 (Faecalibacterium prausnitzii) 、直肠真杆菌 (Eubacterium rectale) 、布氏瘤胃球菌 (Ruminococcus bicirculans) 、罗斯伯利亚菌 (Roseburia sp.) 和青春双歧杆菌 (Bifidobacterium adolescentis) 。Jose等人的一项研究纳入了较高比例的特发性 PAH 患者,结果发现,与健康个体相比,患者体内肠道变形杆菌 (Amedibacterium intestinale) 、双环罗氏菌 (R. bicirculans) 、白色瘤胃球菌 (Ruminococcus albus) 和毛螺菌科细菌GAM79 (Lachnospiraceae bacteriu GAM79) 有所减少。
其他类型PH病人
一项研究重点关注 CTEPH的肠道菌群特征,通过宏基因组鸟枪法测序,探索11名CTEPH患者和 22 名健康对照者的肠道菌群的差异。与对照组相比,CTEPH患者的α-多样性显著下降。值得注意的是,具有抗炎特性的普拉梭菌属 (Faecalibacterium) 、罗斯氏菌属 (Roseburia) 和纺锤链杆属 (Fusicatenibacter) 在内的细菌的相对丰度降低,且与患者内毒素水平呈负相关。另外,最近的一项研究探究了平原地区和高原地区的肠道菌群与肺动脉高压的关系。与对照组相比,生活在平原地区的 PH 患者中,产生TMA的菌群数量较高,但菌群α多样性则降低;在高原地区PH患者中,肠道菌群并没有发生改变。这项工作平原地区和高原地区PH患者肠道微生物具有明显差异性,需要进一步研究以探究潜在的肠道菌群相关的发病机制。
动物模型
肠道菌群失调的特征是厚壁菌门与拟杆菌门 (F/B) 比例失衡,这个现象已在多种PH动物模型中得到证实,包括 MCT 诱导模型、Sugen 5416缺氧 (SuHx) 诱导模型、缺氧诱导模型、高海拔诱导模型和左肺动脉结扎诱导模型。
MCT诱导的PAH大鼠常用于转化研究,该模型中肠道菌群的变化也已被阐明。与健康对照相比,MCT 诱导的大鼠表现出 F/B 比值升高,并且包括梭状芽胞杆菌属 (Clostridium) 、血尿杆菌属 (Turicibacter) 和柔膜菌属 (Mollicutes) 在内的几种致病菌含量最多。放线菌门 (Actinobacteria) 、厚壁菌门 (Firmicutes) 、变形菌门 (Proteobacteria) 丰度增加,螺旋毛菌门 (Spirochaetota) 、拟杆菌门 (Bacteroidetes) 、不明细菌 (unidentified bacteria) 和疣微菌门 (Verrucomicrobi) 减少。
对SuHx大鼠进行的基于菌群分类学的分析显示,与对照组相比,F/B 比率增加了三倍。然而,这一比例的改变主要是由于拟杆菌门减少造成的,而厚壁菌门家族在统计学上没有显著的变化。在属水平上,与对照大鼠相比,SuHx大鼠中脱盐杆菌属 (Dehalobacterium) 、Marvinbryantia、肠球菌属 (Enterococcus) 、阿克曼氏菌属 (Akkermansia) 、拟杆菌属 (Bacteroides) 和拟杆菌属S24-7组 (Bacteroidetes S24-7 group) 未培养细菌的丰度较低,而聚义酸菌 (Acetitomaculum) 、双歧杆菌 (Bifidobacterium) 、普拉梭菌 (Faecalibaculum) 、Parvibacter、Allobaculum、Parsutterella、狄氏副拟杆菌 (Parabacteroides) 和罗斯氏菌 (Rothia) 。
同样,F/B 比率的增加会破坏hyp诱导的PH小鼠的肠道菌群稳态。研究观察到,有害菌群的丰度有所增加,包括海藻科 (Marinifilaceae) 、乳杆菌科 (Lactobacillaceae) 和螺杆菌科 (Helicobacteraceae) ,而有益的拟杆菌科 (Bacteroidaceae) 、坦纳菌科 (Tannerellaceae) 、普氏菌科 (Prevotellaceae) 和毛螺菌科 (Lachnospiraceae) 则显着减少。
高原肺动脉高压 (HAPH) 是一种特别影响生活在高原地区人群的疾病。该病的发病机制涉及肺血管的收缩和重塑,最终导致高原心脏病。一项研究表明,HAPH 大鼠模型的肠道菌群发生了变化。科水平上,乳杆菌科 (Lactobacillaceae) 和动球菌科 (Planococcaceae) 的丰度和F/B比值度增加,普雷沃氏菌科 (Prevotellaceae) 和脱硫弧菌科 (Desulfovibrionaceae) 的丰度下降。此外,在左肺动脉结扎诱导的PH大鼠模型中,研究人员发现孢子菌 (Sporobacteria) 的丰富度增加,而真杆菌科 (Eubacteriaceae) 、δ变形杆菌 (Deltaproteobacteria) 和脱硫弧菌 (Desulfovibrio) 的丰度反而下降。
这些证据表明肠道菌群的变化可能在 PAH 的早期发病机制中发挥致病作用,同时有必要进一步研究其影响。图3简要展示了与PH相关的不同肠道菌群概况。

图3. 肺动脉高压中肠道菌群概况
肺动脉高压的定义是静息时仰卧位右心漂浮导管测量平均肺动脉压大于20mmHg。与对照组相比,PAH患者的α多样性、细菌丰富度和均匀度显着降低。放线菌和具有促炎特性的微生物增加,而产生丙酸和丁酸的细菌减少。此外,CTEPH患者的α多样性和具有抗炎特性的细菌显著减少。与对照组相比,在生活在平原地区的PH患者中,肠道菌群的α多样性降低,产生TMA的菌群增多;而在高原PH患者中,肠道菌群没有发现明显的改变。肠道菌群失调可具体表现为厚壁菌门与拟杆菌门(F/B)比例失衡,这个现象已在多种PH动物模型中得到证实。因此,肠道菌群失调可能PH的发病机制之一。CTEPH:慢性血栓栓塞性肺动脉高压;HAPH:高原性肺动脉高压;LPAL,左肺动脉结扎;MCT:野百合碱;PAH:动脉性肺动脉高压;PH:肺动脉高压;SuHx:sugen 5416/缺氧;TMA:三甲胺。
PH领域中肠道菌群依赖的代谢物
肠道微生物群的组成和功能在PH中有所改变,其依赖的代谢物分子是关键的调节因素。在此,我们根据已发表的研究总结了 PH 中代谢物的相关知识,为临床上疾病的管理提供新的可探索性思路。
TMAO相关的代谢物
迄今为止,TMAO相关代谢物是在PH领域中探索最多的分子。TMAO在心血管疾病中的作用已得到充分研究。TMAO可引起心肌肥厚和纤维化,促进内皮细胞和血管炎症反应,诱发心脏线粒体功能障碍,激活血小板从而促进血栓形成,直接影响血管和心脏健康。我们团队之前的研究揭示了TMAO与血管损伤和心脑血管疾病包括慢性心力衰竭、认知障碍、卒中等的关系。我们还首次探讨了血浆TMAO对PH患者的影响,突出其在疾病管理中潜在的生物标志物价值。我们严格筛选了通过右心导管明确的PAH患者,通过严格的纳入和排除标准以及统计模型的构建减少偏倚后,探索了循环TMAO水平与患者病情严重程度和预后的关系。结果显示,高血浆TMAO水平患者病情重且预后不良,表现为心力衰竭和病情恶化风险的增加。我们后来的研究进一步证实了血浆TMAO 水平在各种PH亚型中的潜在生物标志物作用,包括特发性/遗传性PAH和先天性心脏病相关的PAH,但在CTEPH患者中未发现TMAO水平与预后相关。在动物实验中,一种名为 3,3-二甲基-1-丁醇(DMB)的TMAO抑制剂能够改善 MCT诱导的PH,改善平滑肌细胞的过度增殖和转化生长因子-β的表达水平,恢复内皮一氧化氮合酶的功能。Huang 等人揭示TMAO通过上调巨噬细胞中Kng1、Cxcl1、Cxcl2、Cxcl6和白细胞介素6等炎症因子的产生促进肺动脉平滑肌细胞的增殖和迁移,最终导致肺血管重塑,TMAO抑制剂DMB可以抑制巨噬细胞产生的趋化因子和细胞因子缓解 PH 的进展。然而,Videja等人的研究得出了相反的结论,他们指出TMAO在MCT诱导的大鼠模型中发挥保护作用,纠正异常的线粒体能量代谢。当前TMAO在PH发病机制中的真正作用还未能下定论,今后需要加强合作研究,围绕这一矛盾的实验结果开展更多探索性的工作,揭开TMAO在PH中的神秘面纱。
此外,其他TMAO通路相关的代谢物,包括左旋肉碱、胆碱、三甲基赖氨酸和甜菜碱等在PH中的价值也值得探讨。我们的研究发现,与TMAO在PH中的情况类似,高血浆甜菜碱水平与PH患者预后不良相关。然而,要揭示这种关联的具体机制还需要进一步研究。胆碱是TMAO的前体,参与多种生理过程。以往的研究表明,胆碱是心血管疾病中潜在的生物标志物。我们的团队首次研究了循环胆碱水平与PH患者预后之间的关联,并发现该代谢物在PH领域具有类似的生物标志物作用。此外,我们的团队还发现并定义了N,N,N-三甲基-5-氨基戊酸(TMAVA)为另一种 TMAO 相关的代谢物,其水平的升高与心衰患者死亡和移植风险的增加有关。它通过抑制肉碱合成和随后的脂肪酸氧化,加速了心肌肥厚的进展。目前,我们正在进一步探索TMAVA在PH领域的作用和价值,旨在确定新的发病机制靶点,以治愈疾病。
SCFAs
肠道微生物群可以通过释放代谢产物来调节宿主免疫系统,其中研究最多的产物是SCFAs。SCFAs的产生源于肠道环境中食物与肠道微生物群之间复杂的相互作用,这些分子是游离脂肪酸受体2和3的天然配体,在各种细胞类型(包括肠内分泌细胞和免疫细胞)中均有表达,在宿主和肠道微生物群之间发挥着重要的信号交流作用。
近十年来,人们一直在探索SCFAs与心血管疾病之间的关系。SCFAs作为宿主生理过程中关键的细菌代谢产物,对心血管疾病有多重影响,大多数SCFAs在心血管疾病包括房颤、高血压、动脉粥样硬化中发挥保护作用。丁酸盐能激活过氧化物酶体增殖体激活受体-γ,促进结肠上皮细胞向β-氧化方向发展并维持厌氧环境。相反,丁酸盐的缺乏会导致变形菌的扩增,造成肠道菌群紊乱。
值得注意的是,SCFAs在逆转PH中可能具有重要价值,在疾病管理和治疗方面大有可为。最近,Moutsoglou及其同事提供了大量证据支持PAH患者存在肠道菌群失调,揭示了PAH患者独特的肠道微生物特征,其特点是血浆中抗炎性SCFAs水平下降。在动物实验中,丁酸盐干预可减轻缺氧诱导的大鼠PH,表现为右心肥大缓解、右心室收缩压降低和肺血管重塑改善。此外,丁酸盐可减少肺泡和肺间质巨噬细胞的聚集,其能通过激活G蛋白偶联受体、促进表观遗传修饰和抑制巨噬细胞中的NF-κB通路,诱导T调节细胞分化,从而减轻炎症反应。此外,它还能促进白细胞介素-10等抗炎因子的产生。SCFAs在调节紧密连接蛋白的表达方面起着关键作用,因此,SCFAs的减少会削弱肠道屏障功能,促进氧化应激,增加肠道炎症和渗漏的可能性,这将会导致炎症因子释放到血液中,然后循环到肺部,引起肺血管重塑。SCFAs与PH的发病机制有关,但阐明其具体机制还需要今后的研究。此外,有必要进行临床队列研究,以确定 SCFAs循环水平与患者预后之间的关系,探索其作为PH患者生物标志物的潜力。
其他代谢物
苯乙酰谷氨酰胺是一种由肠道微生物群和宿主共同参与合成的代谢物。以往的研究表明,它与动脉粥样硬化性心血管疾病和主要不良心血管事件的发生有关,并通过促血栓形成作用增加脑卒中风险。苯乙酰谷氨酰胺是否参与PH的发病,尤其是与血栓形成相关的亚型值得探索。然而,目前该领域仍是空白,需要进一步的临床和基础的研究。此外,其他代谢物(包括胆汁酸、支链脂肪酸等)在PH中的价值也值得探索。图 4 展示了PH中肠道菌群相关代谢物的知识。

图4. 肺动脉高压中肠道菌群相关代谢物
TMAO是肺动脉高压中潜在的生物标志物。在我们先前的队列研究中,严格纳入了PAH患者并测量了血浆中TMAO的水平。血浆高TMAO水平与肺动脉高压患者预后不良相关。TMAO主要来源于红肉和鱼类中丰富的胆碱。肠道菌群可将其分解生成TMA,TMA通过门静脉进入肝脏,然后被FMO氧化成TMAO。研究表明TMAO通过上调巨噬细胞中促炎因子的产生来加重肺动脉高压,DMB可通过降低TMAO水平发挥对肺动脉高压的保护作用,DMB是否可用于临床值得进一步探讨。SCFAs的产生源于饮食与肠道微生物群之间复杂的相互作用。SCFAs具有抗炎作用,可减少肺泡和肺间质巨噬细胞的聚集。SCFAs的减少会激活NF-kB通路,抑制抗炎因子的产生,促进肺动脉高压。苯乙酰谷氨酰胺与动脉粥样硬化性心血管疾病、主要不良心血管事件的发生有关,并通过促血栓形成作用增加脑卒中风险。苯乙酰谷氨酰胺是否参与PH的发生发展,尤其是与血栓形成相关的PH亚型,还有待进一步研究。TMAO:氧化三甲胺;TMA:三甲胺;FMO:含黄素单氧化酶;DMB:3,3-二甲基-1-丁醇。
结 论
PH是一种复杂的疾病,其特点是肺动脉压力和血管阻力增加,导致右心衰竭和死亡。PH错综复杂的发病机制给疾病诊断和治疗带来了巨大挑战,因此,当前研究重点转向了潜在生物标志物和分子靶点的探索,以期能个性化管理和治疗PH,改善患者预后。
肠道菌群及其相关代谢物在PH中的重要作用不容忽视,我们之前的研究已经确定了其与PH之间的相关性。人工智能和机器学习等技术和方法的快速发展为我们彻底了解PH带来了巨大的帮助。通过这些先进技术,我们可以有效地处理和利用从肠道微生物组中获得的海量信息,以确定新的生物标志物、风险因素和治疗靶点。未来开展纵向研究以不断揭示肠道菌群在PH中的价值仍然至关重要。
肠道微生物群在调节宿主免疫、炎症和新陈代谢方面发挥着至关重要的作用。通过细菌成分和活性代谢物,肠道菌群与机体的适应性免疫系统相互作用,促进免疫平衡的建立和维持。代谢物是肠道微生物群影响局部和全身免疫反应的关键介质,在PH发病机制中的重要性不言而喻。
从这个角度来看,探索肠道菌群、代谢物和PH之间的关系可能会为开发针对PH患者的个性化治疗策略打开一扇新窗口。从"一刀切"的治疗模式转向以患者为中心的方法,有望实现更有效的干预。粪便移植、益生菌种植、工程微生物和饮食干预等,很大可能是今后治疗或者辅助治疗PH的关键手段。
诚然,这些研究成果到临床实践的转化是极具挑战性的。如何确保合适的微生物群改变、监测治疗反应和管理潜在的副作用都是重要的考量因素。根据个人独特的微生物组组成和临床需求来定制治疗方式,可能是未来成功应用的关键。图 5 概述了肠道菌群在今后PH患者管理中的潜在应用。

图5. 肺动脉高压管理和治疗的未来展望
利用粪便和血液样本进行宏基因组和非靶向或者靶向代谢物探索,以发现新的肺动脉高压生物标志物。评估疾病严重程度和预后的生物标志物开发出来后,与传统的评估方法(包括超声心动图、右心导管检查和心电图)相结合,促进对疾病状况的全面评估。除传统治疗方法外,通过饮食干预、益生菌或粪便微生物移植增加有益微生物群,通过抗生素或靶向药物减少有害微生物群有望是肺动脉高压有效的治疗策略。人工智能和机器学习等技术的快速发展能为我们解析更多疾病的信息,利用这些先进技术可以促进肠道微生物组、代谢物、临床信息和治疗靶点等复杂大数据的处理和应用,从而实现肺动脉高压的精准管理。
总的来说,探索肠肺轴的相关知识为PH的治疗和管理策略开辟了新的视野。它为新型生物标志物的发现、精准的风险预测、创新的治疗干预和更有效的预防措施提供了许多机会。然而,肠道菌群和肺部的信息交流还有很多东西需要深入探索,但毫无疑问,肠道菌群这一领域的发展势必会为PH患者带来新的治愈的希望!
引文格式:
Yicheng Yang, Hanwen Zhang, Yaoyao Wang, Jing Xu, Songren Shu, Peizhi Wang, Shusi Ding, Yuan Huang, Lemin Zheng, Yuejin Yang, Changming Xiong. 2024. Promising dawn in the management of pulmonary hypertension: The mystery veil of gut microbiota. iMeta e159. https://doi.org/10.1002/imt2.159
作者简介

杨逸成(第一作者)
● 北京协和医学院阜外医院博士研究生。
● 研究方向:肠道菌群相关代谢物和心血管疾病的临床和机制研究。以一作/共同一作发表SCI论文14篇,主持青年基金1项,获多项国家级和省部级荣誉。

张瀚文(第一作者)
● 北京协和医学院阜外医院硕士研究生。
● 研究方向:肠道菌群相关代谢物和心血管疾病的临床和机制研究。

王瑶尧(第一作者)
● 北京协和医学院阜外医院硕士研究生。
● 研究方向:心肾相关性疾病(心血管疾病患者的急性肾损伤、心肾综合征等)的临床研究。

许靖(第一作者)
● 北京协和医学院阜外医院博士研究生。
● 研究方向:基于多组学的冠心病临床预警及机制研究。

熊长明(通讯作者)
● 北京协和医学院阜外医院教授、博士生导师。
● 研究方向:肺动脉高压、肺栓塞、右心衰竭的临床和机制研究。发表SCI论文多篇,任中国循环杂志通讯编委,Lancet Respir Med, EHJ, Clinical Respiratory Journal, Life Sciences, 中华医学杂志等多种杂志特约审稿专家。主持和参与20多项国家级和省部级课题;获卫生部科技进步奖三等奖、教育部高等学校科学研究优秀成果奖一等奖、北京市科技进步奖三等奖等多项荣誉。

杨跃进(通讯作者)
● 主任医师,北京协和医学院长聘教授,博士生导师,卫生部有突出贡献中青年专家。
● 曾任中国医学科学院阜外医院副院长、国家心血管病中心副主任。北京医学会心血管病分会主任委员、海峡两岸医药卫生交流协会心血管专业委员会主任委员、中国老年医学会心血管病分会主任委员、美国心脏病学院委员(FACC)、欧洲心脏病学会专家委员(FESC)。已主持国家973、863、自然科学基金、教育部和卫生部等基金项目二十多项,发表论文380余篇,其中SCI文章160多篇,主编和参编著作多部。荣获国家科技进步一等奖、二等奖各1项,省部级科技进步奖10项,中国医学科学院科技进步奖、医疗成就奖、全国优秀论文奖多项;曾获美国赛克勒基金青年医师年度奖。

郑乐民(通讯作者)
● 北京大学心血管研究所副所长,研究员,博士生导师。
● 教育部重点实验室主任助理,基础医学院心脑血管和代谢学科群副主任;心血管代谢与蛋白质组学研究室主任。专业为病理生理学;现担任中华医学会心血管分会基础学组委员、中国心胸血管麻醉学会精准医学分会副秘书长、北京生理协会血管分会糖脂代谢组组长、中国药理学会心血管药理专业委员会委员、中国病理生理协会青年委员。获得国家自然基金委“优秀青年基金”;中组部“万人计划”青年拔尖人才基金;教育部“新世纪人才基金”。获中华医学奖与省部级奖两项,美国心脏协会“Pre-doctoral Fellowship Award”等。共发表SCI文章123篇,SCI引用超5300次(h-index 37)。
更多推荐
(▼ 点击跳转)
iMeta | 引用7000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 15)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、50万用户的社交媒体宣传等。2022年2月正式创刊发行!目前期刊已经被ESCI、Scopus等数据库收录。
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:office@imeta.science

































 4929
4929

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








