点击蓝字 关注我们
泛基因组研究揭示两个转座子插入是影响鸭体重和白羽性状的原因突变

iMeta主页:http://www.imeta.science
研究论文
● 原文链接DOI: https://doi.org/10.1002/imt2.154
● 2023年12月17日,河南农业大学康相涛、李文婷和广东省农业科学院水稻所胡海飞等团队在iMeta在线发表了题为 “Duck pan-genome reveals two transposon insertions caused bodyweight enlarging and white plumage phenotype formation during evolution” 的研究文章。
● 本文研究结果强调了采用泛基因组作为参考基因组在基因组学研究中的重要性,且揭示了转座子对鸭重要经济性状形成的影响。
● 第一作者:王克君、华国营、李竞一、杨宇
● 通讯作者:李文婷(liwenting_5959@hotmail.com)、胡海飞(huhaifei@gdaas.cn)、康相涛(xtkang2001@263.net)
● 合作作者:张晨曦、杨岚、胡晓玉、Armin Scheben、吴亚楠、龚萍、章双杰、樊艳凤、曾涛、卢立志、龚炎长、蒋瑞瑞、孙桂荣、田亚东
● 主要单位:河南农业大学、神农种业实验室、中国农业科学院深圳农业基因组研究所、华中农业大学、武汉市农业科学院、冷泉港实验室、江苏省家禽研究所、浙江省农业科学院、广东省农业科学院
亮 点
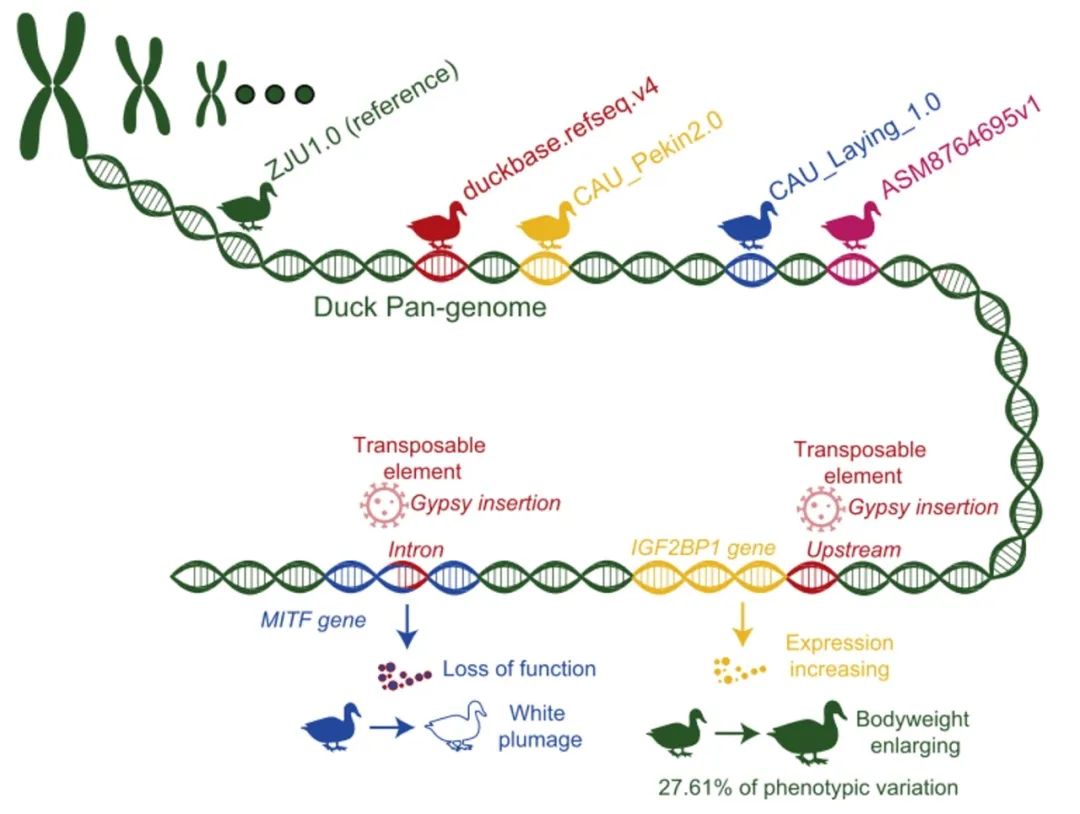
● 本研究基于5个基因组信息构建了鸭泛基因组,捕获到大约40.98 Mb参考基因组不包含的新序列;
● 我们发现很大一部分比例结构变异来源于转座子,其中很多定位在基因区和调控区,且与家鸭驯化和改良过程显著关联;
● 为清楚阐述转座子元件对表型变化的影响,我们选取两个代表性例子,解析了IGF2BP1和MITF分别对家鸭体重和白羽性状形成的遗传机制;
● 值得一提的是,据我们所知,从数量性状角度看,IGF2BP1基因启动子区Gypsy转座子插入解释了最大的禽类体重性状表型变异。
摘 要
结构变异(Structural Variations SVs)是影响驯化和改良性状形成的主要决定因素之一,本研究基于5个公开发表的基因组序列构建了首个鸭线性基因组,捕获了约40.8 Mb参考基因组不存在的序列。基于构建的泛基因组和高深度二代测序数据,共鉴定101,041 SVs, 分析发现其中很大一部分SVs来源于转座子元件。许多转座子来源的SVs 位于基因区和调控区,且与家鸭的驯化和改良过程显著关联。进一步通过整合数量遗传学和分子遗传学实验,我们首次解析了一个6,945 bp的Gypsy转座子插入是影响家鸭体重性状主效基因IGF2BP1的原因突变。据我们所知,从数量性状角度,该Gypsy转座子插入对体重性状的效应在已报道的鸟类研究中是最大的(表型变异的27.61%)。此外,我们也鉴定到另外一个6,634 bp的Gypsy插入在MITF基因的内含子区,形成一个新的嵌合转录本,导致白色羽毛性状的形成。我们的研究结果强调了采用泛基因组作为参考基因组在基因组学研究中的重要性,且揭示了转座子对鸭重要经济性状形成的影响。
视频解读
Bilibili:https://www.bilibili.com/video/BV1PW421K7ZP/
Youtube:https://youtu.be/pPc7LkkFeK4
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
鸭(Anas platyrhynchos)是人类食用肉类和蛋类的主要来源,也是绒羽的重要来源。家鸭大约于公元前 500 年的铁器时代在中国中部从野鸭(Anas platyrhynchos)和斑嘴鸭(Anas zonorhyncha)驯化而来。中国有 37 个本土鸭品种,主要分布在华东、华中、西南和华南地区,集中在长江和珠江流域。周正奎研究员等人研究表明,野鸭大约经过 500-800 代驯化成家鸭(地方鸭),而地方鸭大约经过 700-1000 代的高强度遗传改良形成商品高产北京鸭。北京鸭促成了樱桃谷鸭的和克里莫鸭的培育。驯化和遗传改良导致了家鸭在体型外貌、生产力和行为等方面发生显著的变化。
已有研究报道了一些关于鸭表型形成的遗传基础,例如,位于MC1R基因调控区的两个SNP与野鸭ⅹ北京鸭的F2资源群的黑羽有关。TAS2R40基因的 5'UTR 上的SNP突变导致了鸭凤头性状的形成。此外,位于ABCG2基因上游的两个顺式调控SNP与金定鸭的绿蛋壳显著有关。尽管如此,许多具有经济意义的性状仍未解析。例如,位于 IGF2BP1基因上游许多SNP与鸭体重显著相关,但其原因突变仍未明确。
近年来的研究表明,结构变异(SVs)在物种进化和性状形成中发挥重要的作用,如影响鸡毛腿性状、凤头和体型等表型。相比于SNP的效应,SVs 可对顺式调控区产生更大作用,导致基因表达量改变或产生新的转录本,从而产生不同的表型。先前的证据也表明,在基因组进化过程中SV 的产生与转座元件(TE)介导的宿主基因组序列的不精确复制、插入、删除和重组有关。此外,TE 衍生的 SV 还通过提供启动子或增强子序列影响转录调控,或者改变调控宿主基因表达的三维染色质结构,导致新基因的形成,从而促成脊椎动物的表型变异,例如鸡羽色性状、水牛毛色性状等。然而,基于单一参考基因组对SVs鉴定不全面或不准确,导致驯化和育种改良过程中对表型影响很大的SVs未被捕获。而泛基因组通过整合来自多个基因组组装的泛序列来捕获一个物种的完整遗传变异,并利用群体测序数据绘制SV全景图谱,从而更好地了解SV的特征并解析其对表型变异的影响。
本研究利用5个公开发表的基因组构建了首个鸭线性泛基因组,利用高深度测序数据绘制了SV全景图谱,并证明了SV的形成与TE插入显著相关。为了证明这些由TE 衍生出的SV的重要性,我们将这些SV与驯化和改良中性状形成联系起来。研究结果表明这些SV是数量性状(体重性状)IGF2BP1基因和质量性状(羽色性状)MITF基因的原因突变。本研究工作拓展了对泛基因组重要性的认识,并强调了TE衍生的SV对表型形成的重要作用。
结 果
鸭泛基因组构建
我们整合 Psvcp和 PPsPCP工具方法,基于5已发表的鸭基因组构建了首个鸭泛基因组,其中包括3个北京鸭基因组(商业品种)、1个绍兴鸭基因组(本土品种)和野鸭基因组(野生近缘种)。我们构建鸭泛基因组的方法如图 1A 所示。鸭泛基因组发现了参考基因组(ZJU1.0)中不存的约40.98 Mb的序列,编码了329个具有完整编码区的高置信度基因。
研究进一步获得了131个高深度测序数据(3个商业鸭、7个地方鸭和2个野鸭品种),平均深度高达46.5 ×。根据鸭泛基因组中基因在所有鸭品种中的 PAV(存在/不存在变异)频率对基因进行了分类。131个体共有15,906个(97.67%)核心基因,380个(2.33%)可变基因,包括98个softcore基因和282个cloud基因,其频率分别超过99%和1-99%(图1D)。与人类(96.88%)、鸡(76.32%)和贻贝(69.2%)相比,鸭泛基因组的核心基因含量比例更高。基因功能富集分析表明,可变基因主要富集在免疫反应、嗅觉感知和 G 蛋白偶联受体信号通路等功能模块中。泛基因组modelling分析揭示鸭泛基因组为一个closed泛基因组,估计有15,959个基因(不包括性染色体上的基因,图1E),这表明目前组装的泛基因组包含了鸭子几乎完整的遗传多样性。

图1. 鸭泛基因组
(A)鸭泛基因组构建策略示意图。(B)基于Psvcp流程鉴定到的新鉴定序列统计情况。(C)基于PPsPCP流程鉴定到新序列的长度分布情况。(D)泛基因组鉴定基因分类。(E)泛基因组基因数量建模。(F)基于SV信息采用GTR模型构建的进化树。
群体水平遗传变异鉴定
本研究采用了四种常用于动物和植物的不同的 SV 检测工具:LUMPY、Delly、GRIDSS和Manta。基于131个高深度测序数据(平均46.5 ×),在至少两种 SV 检测工具的支持下基于泛基因组,共鉴定到101,041个SV,同时基于PCR基因分型验证了4个SV基因分型的一致性,平均准确率为 87.4%。与单一参考基因组 ZJU1.0 相比,使用泛基因组作为参考,可以额外鉴定出27,533 个常染色体SV和3,155,258个小遗传变异,其中包括2,912,903个SNP和242,335 个indels。基于SV的系统发生树、主成分分析和种群结构表明,131个个体聚类为三大类:野生、地方鸭和商业鸭品种(图1F)。
家鸭驯化和改良对SV频率的变化影响
为了揭示野鸭驯化和育种改良过程中SV出现频率的变化,我们进行了驯化过程(野鸭和地方鸭品种)(图2A,C)以及遗传改良过程(地方鸭品种和商品鸭品种)的比较(图2B,D)。结果显示999个SV的出现频率在驯化过程存在显著差异(图2E-F),显著富集在与神经元发育、解剖结构形态发生、细胞形态发生、对细菌免疫过程的响应等相关功能通路中(图2G-H);在遗传改良过程中检测到 518 个 SV 的频率增加和 435 个SV的频率减少(图2E-F),这些SV临近的基因主要集中在细胞粘附、繁殖、精子发生、肽基酪氨酸去磷酸化等方面(图 2I)。有趣的是,在改良过程中,发现两个分别与产量和外貌性状的基因与显著的频率变化SV相邻(图 2B),一个是位于IGF2BP1上游区域的 ~7.0 kb 基因缺失(ID:DEL00154411)在地方鸭中出现频率(0.89)较高,而在商品鸭中出现频率(0.012)极低(FDR-adjusted p = 5.54e-34 和 FST = 0.86)。另一个 ~6.6 kb 的缺失(ID:DEL00130156)位于 MITF 基因的内含子,在地方鸭中出现的频率(0.93)明显高于在商业品种中出现的频率(FDR-adjusted p = 4.55e-39 和FST = 0.92)。

图2. 鉴定驯化和改良过程受选择的SV
(A)散点图展示比较野鸭和地方鸭的SV出现频率。(B)散点图展示比较地方鸭和商品鸭的SV出现频率。(C)比较地方鸭和野鸭之间的分化指数FST。(D)比较地方鸭和商品鸭种之间的分化指数FST。(E)Venn图展示Fisher’s exact和分化指数FST显著SV的交集。(F)进化过程中显著SV的分类。(G-H)驯化过程频率上调的和下调的SV在GO富集结果。(I)改良过程中下调SV的富集结果。
转座子来源的SV与驯化和改良性状相关
利用从头预测和序列相似性方法,鉴定约24.37%的新序列被注释为转座子(TEs),而整个鸭泛基因组序列中只有9.49%序列被鉴定为TEs。我们进一步研究了泛基因组中TEs的分类、丰度和长度(图3A),并使用不同窗口大小的滑动窗口法估算了TEs和SVs之间的存在相关性(图3B),结果均在所有测试的窗口大小中,都观察到SV与TE之间存在显著的相关性(图3B),发现有59.2%大于100 bp SV至少对应一个TE,其中58.7%的已鉴定SV至少有一半序列与TE重叠(高TE重叠SV)(图3C),有392个SVs与TE匹配度超过95%。随后,我们以IGF2BP1和MITF中的SV为例,解读了TE衍生的SV是如何驱动鸭表型性状形成的。

图3. 基于泛基因组的转座子注释和与SV形成的相关性
(A)泛基因组SV和TE的分布。(B)SV和TE相关性分析。(C)SV与TE匹配的比例及分布。(D)高含量TE来源的SV的基因组分布特征。
IGF2BP1启动子区6,945 bp Gypsy转座子插入通过上调IGF2BP1表达水平增加家鸭的体重
周正奎研究员发现IGF2BP1 mRNA表达量与鸭的体重有关,然而,导致IGF2BP1表达量发生变化的原因突变仍不清楚。我们利用泛基因组结合PCR Sanger测序发现,在IGF2BP1启动子区域有一个6,945 bp的基因组序列插入,它的插入和非插入分别被定义为该基因的H(重)和L(轻)等位基因(图4A-B),H等位基因在商业品种中几乎是固定的,,而L等位基因在本地和野生品种中是优势等位基因型(图4C-D),这与改良过程中该SV频率的增加是一致的(图2)。
利用连城白鸭◊凯亚鸭F2群体进行的单标记关联分析表明,该SV与8个体重和胴体重性状显著相关(图4F)。与LL基因型相比,HH基因型总是与更高的生产性能相关。其中,与全净膛重(p = 2.57e-27)和半净膛重性状(p = 6.06e-27)的关联最为显著,该基因位点分别占表型变异的27.61%和27.28%。为了验证该TE对IGF2BP1转录活性的影响,构建了两个重组质粒pGL3-H和pGL3-L,双荧光实验表明pGL3-H的转录活性明显高于pGL3-L(图4G)。根据上述证据,我们得出结论,在IGF2BP1启动子区域插入6,945bp的Gypsy元件可能会通过提供额外的增强子元件来增加IGF2BP1的表达,从而增加鸭的体重。

图4 Gypsy转座子调控IGF2BP1表达且与体重性状显著相关
(A)Gypsy转座子插入IGF2BP1启动子区基因组结构图。(B)PCR分型和等位基因特异性PCR分型电泳图(C)。(D)IGF2BP1启动子区插入等位基因频率分布。(E)SNP-based 选择信号分析。(F)IGF2BP1启动子区单标记关联分析。(G)比较pGL3-H 和pGL3-L重组质粒的转录活性分析。(H)比较IGF2BP1在HH型和LL型个体间的mRNA表达量。
MITF基因内含子中插入6,634 bp的Gypsy转座子可通过诱导产生一个嵌合转录本导致鸭的白羽表型形成
我们的研究发现MITF基因内含子区存在6,634 bp Gypsy转座子插入,分别被定义为W(白色)和C(彩色)等位基因(图5A),WW基因型在有色羽鸭中完全不存在,而在商品白羽鸭(北京鸭、YTG鸭和AB鸭)中则完全固定(图5B),表明WW基因型与白色羽毛性状相关,而WC杂合子和CC 等位基因呈现有色羽毛(图5C)。
在MITF CC基因型的SM鸭中,我们发现了三种MITF转录本,包括A、E 和MITF-M(图5A,D),而在WW基因型中鉴定到的是 A、E 和一个新的嵌合转录本(MITF-novel)。相比之下,WW基因型中未检测到MITF-M转录本。MITF-M转录本只在黑色素细胞系中表达,调节黑色素生成途径中许多色素基因的表达,并负责黑色素细胞的分化。我们进一步分析了 MITF 基因在黑色素生成途径中的调控作用,MITF-M 过表达组转录本的细胞中TYR、TYRP1和MLANA基因显著高于MITF-novel过表达组。此外,TYR、TYRP1、MLANA和OCA2在北京鸭(白色羽毛)的皮肤组织中也几乎没有表达,但在Heiwu鸭(有色羽)中却有显著较高的表达量(图 S7F)。以上证据表明,Gypsy元件的插入诱导了MITF-novel转录本的形成和MITF-M的破坏,阻断了黑色素生成途径,从而导致WW 基因型鸭的白羽表型。

图5. Gypsy插入诱导MITF产生新嵌合转录本致使白羽性状形成
(A)Gpysy转座子在MITF内含子插入的基因组结构。(B)MITF内含子插入的基因型分布。(C)SNP-based 选择信号分析。(D)转录本PCR扩增验证电泳图。(E)MITF-novel转录本的编码能力预测分析。(F)MITF-M和MITF-novelde 蛋白结构图。(G)MITF-M和MITF-novel氨基酸结合特点。(H)过表达MITF-M和MITF-novel对黑色素形成通路基因的表达效应。
Gypsy转座子进化关系分析
我们也对Gypsy转座子进行了进化分析,发现鸭Gypsy转座子相比对于鸡发生过明显扩张,且形成3个分支,IGF2BP1上游的Gypsy转座子和MITF内含子插入的转座子较为古老,发生在3.88百万年和0.6百万年前。

图6. LTR Gpysy转座子超家族进化分析
(A)Gypsy转座子在鸭、鸡、人、鼠基因组的进化分析。(B)鸭泛基因组上Gpysy超家族编码区的进化分析。
结 论
本研究构建了首个鸭泛基因组,并绘制了鸭SV全景图谱,发现其中大量SV与驯化和改良相关的性状有关。重要的是,我们解析了位于IGF2BP1启动子区的一个Gypsy转座子通过促进IGF2BP1基因的表达来增加鸭的体重;位于MITF内含子的Gypsy转座子通过产生新的转录本促进了白羽性状的形成。我们的研究结果突显了转座子元件对性状形成的重要影响,也为了解转座子元件如何塑造动物表型的形成提供了启示。
引文格式:
Kejun Wang, Guoying Hua, Jingyi Li, Yu Yang, Chenxi Zhang, Lan Yang, Xiaoyu Hu, Armin Scheben, Yanan Wu, Ping Gong, Shuangjie Zhang, Yanfeng Fan, Tao Zeng, Lizhi Lu, Yanzhang Gong, Ruirui Jiang, Guirong Sun, Yadong Tian, Xiangtao Kang, Haifei Hu, Wenting Li. 2024. Duck pan-genome reveals two transposon insertions caused bodyweight enlarging and white plumage phenotype formation during evolution. iMeta e154. https://doi.org/10.1002/imt2.154
作者简介

王克君(第一作者)
● 河南农业大学特聘教授,博导。
● 目前研究方向为畜禽遗传资源保护与种质特性解析,在iMeta、Molecular Biology and Evolution等期刊发表论文23篇,获得河南省畜禽种业发展突出贡献个人奖、吴常信动物遗传育种科技成果奖、河南省科技进步一等奖、河南省教育厅成果奖和河南省教育厅优秀科技论文一等奖各1项。

华国营(第一作者)
● 博士毕业于中国农业大学。
● 研究方向为动物遗传学和功能基因组学,已在iMeta, Animal Genetics, Poultry Science, JASB, Biology等期刊发表学术论文6篇。

李竞一(第一作者)
● 博士,华中农业大学动物科技学院副研究员,硕士生导师。
● 主要研究领域为家鸡抗逆性状以及外观性状的遗传解析与分子育种方面的应用。以第一作者身份在Molecular Biology & Evolution,PNAS等杂志上发表SCI论文5篇。主持重点研发青年科学家、国自然青年基金项目等3项。

杨宇(第一作者)
● 武汉市农业科学院高级畜牧师,硕士生导师。
● 研究方向为家禽遗传育种与健康养殖,已在Frontiers in Genetics、 Journal of Animal Science、sexual development等期刊发表学术论文20余篇,主持湖北省自然科学基金、湖北省种业高质量发展项目多项,获湖北省科技进步三等奖1项。

李文婷(通讯作者)
● 博士,河南农业大学副教授,中国科学技术协会青年托举人才。
● 长期致力于家禽泛基因组研究,解析了鸡生长性状主效基因IGF2BP1的原因突变。先后主持国家自然基金生物育种青年专项、面上项目、河南省优秀青年基金等12项,发表Molecular Biology and Evolution等文章40余篇,获全国博士后创新创业大赛金奖,吴常信动物遗传育种科技成果奖、河南省畜禽种业发展突出贡献个人奖等5项。

胡海飞(通讯作者)
● 博士,广东省农业科学院水稻所青年技术骨干,JGG、Agriculture communications青年编委。
● 研究方向包括(1)泛基因组构建和分析技术的创制和集成;(2)利用泛基因组技术,探究广东籼稻的优质化育种的遗传和演化规律。参与发表SCI论文30余篇,其中一作/通讯作者发表SCI论文10篇,其中包括Plant Biotechnology Journal, iMeta, New phytologist, Genome Biology, Molecular Biology and Evolution等国际国内领域主流期刊。

康相涛(通讯作者)
● 中国工程院院士,河南农业大学教授。
● 长期致力于地方鸡种质资源保护利用研究,先后主持国家“863”计划、国家自然科学基金、河南省重大科技专项等科研课题。育成国审新品种2个,以第一发明人获得授权发明专利36项。主持完成“中国地方鸡种质资源优异性状发掘创新与应用”研究于2008年获得国家技术发明奖二等奖,“地方鸡保护利用技术体系创建与应用”研究于2018年获得国家科学技术进步奖二等奖。
更多推荐
(▼ 点击跳转)
iMeta | 引用7000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 15)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、50万用户的社交媒体宣传等。2022年2月正式创刊发行!目前期刊已经被ESCI、Scopus等数据库收录。
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:office@imeta.science


































 1752
1752

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








