阿司匹林(Aspirin)具有镇痛、抗血小板和潜在的抗肿瘤等作用,已成为心血管疾病治疗常用药。有报告表明,超过90%的服用阿司匹林的患者出现肠道毒性,但是它如何影响肠道内稳态仍不清楚,2024年2月14日在Cell Host&Microbe上发表了题为A gut microbiota-bile acid axis promotes intestinal homeostasis upon aspirin-mediated damage的研究论文。该研究揭示了口服阿司匹林通过消耗肠道中的古氏副拟杆菌(Parabacteroides goldsteinii)来降低7-酮基石胆酸(7-keto-LCA)水平进而影响肠道干细胞的肠道损伤机制,并且提出了预防肠道损伤的潜在方法。

研究方法
组学研究方法:宏基因组测序,16S测序,胆汁酸靶向代谢组检测,非靶向代谢组检测,转录组测序,细菌全基因组测序;
其他研究方法:菌群移植(FMT),菌株培养,免疫共沉淀(Co-IP),LPS检测等;

研究结果
1. 阿司匹林使用者有明显的肠道菌群失调,导致肠道损伤
收集23名健康志愿者口服阿司匹林前(BA)和口服阿司匹林后(AA)的粪便样本,分别进行宏基因组测序分析(图1A),阿司匹林治疗后Simpson指数下降(图1B),且PCA分析结果显示肠道菌群组成发生了很大的改变,根据VIP和LDA值分析显示副拟杆菌(Parabacteroides)是导致群体分离的主要肠道菌群(图1C)。物种丰度分析显示古氏副拟杆菌(Parabacteroides goldsteinii)、粪副拟杆菌(Parabacteroides merdae)、 和迪氏副拟杆菌(Parabacteroides distasonis)的丰度均减少(图1G)。在动物模型中进一步验证了阿司匹林对肠道微生物群的影响,PLS-DA数据显示口服阿司匹林会改变肠道微生物群组成(图1H)。同样,古氏副拟杆菌的a-多样性(图1I)和丰度也呈时间依赖性下降(图1J和图1I)。总之,这些数据表明阿司匹林在人类和小鼠中引起肠道生态失调,其特征是古氏副拟杆菌丰度降低。

■ ■ ■ ■ ■
图1. 阿司匹林在人类和小鼠中引起肠道失调
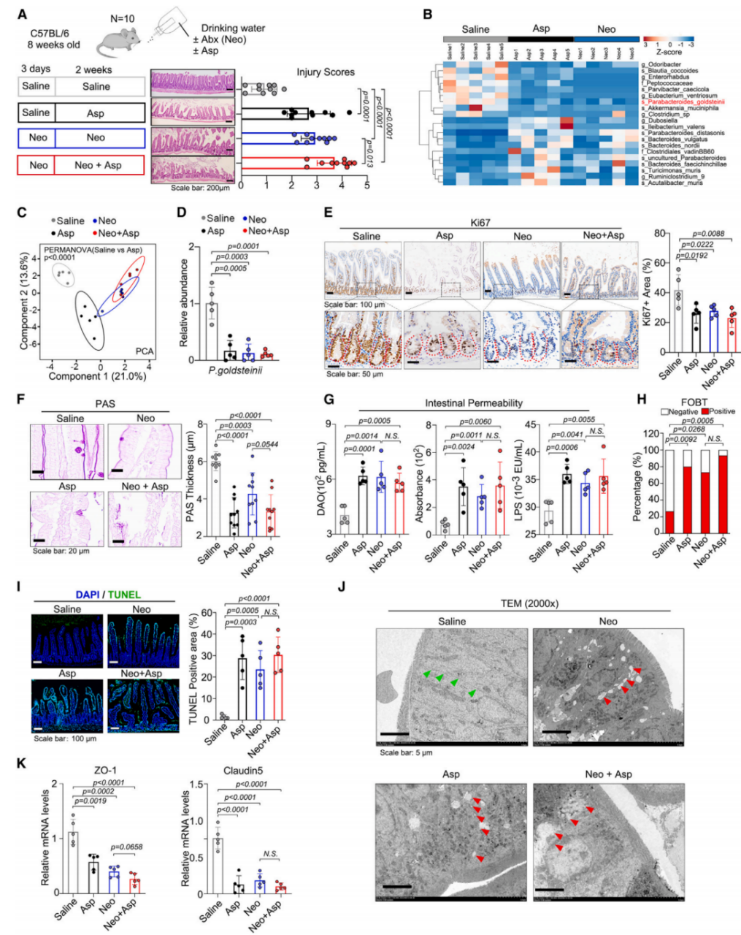
对阿司匹林治疗小鼠的肠道损伤进行评分,研究发现古氏副拟杆菌的丰度与肠道损伤严重程度呈负相关。肠道内容物中微生物组成的热图和PCA分析表明,与生理盐水组相比,阿司匹林和新霉素组小鼠的肠道微生物群有差异(图2B和2C)。阿司匹林和新霉素都降低了肠道微生物群的多样性,抑制了特异性无病原体(SPF)小鼠中的古氏副拟杆菌(图2D)。此外,阿司匹林治疗后肠黏膜变薄,新霉素治疗小鼠的情况类似(图2F)。阿司匹林或新霉素可增加肠通透性(图2G),肠道出血发生率升高(图2H),阿司匹林和抗生素治疗可驱动细胞凋亡(图2I),阿司匹林治疗后肠道屏障受损(图2J)。更有趣的是,共生菌群的粪便菌群移植(FMT)改善了在阿司匹林治疗小鼠中观察到的异常表型,而已经服用阿司匹林的小鼠的FMT则没有影响。
基于粪便样本16S测序的PCA分析结果也显示了肠道微生物群的不同组成。与上述结果类似,在新霉素和阿司匹林处理的小鼠中,古氏副拟杆菌的相对丰度也降低了。粪便和肠道中古氏副拟杆菌的组成呈正相关。综上所述,这些数据表明阿司匹林可能通过诱导肠道生态失调和抑制古氏副拟杆菌而损害肠道屏障功能。
■ ■ ■ ■ ■
图2. 阿司匹林会损害肠道屏障功能,导致肠道损伤
2.被阿司匹林耗尽的古氏副拟杆菌减轻了与阿司匹林相关的肠道屏障破坏
阿司匹林对古氏副拟杆菌的生长抑制呈剂量依赖性(图3A),非靶向代谢组学分析显示,阿司匹林相关代谢物主要富集氨基酸代谢相关的化合物。其中,L-谷氨酰胺、瓜氨酸和L-脯氨酸是网络互作分析中的核心成分(图3B)。补充L-谷氨酰胺和瓜氨酸恢复了阿司匹林对古氏副拟杆菌生长的抑制(图3C),表明阿司匹林可能通过干扰两种代谢物的生物合成来影响古氏副拟杆菌。非靶向代谢组学检测显示阿司匹林治疗后肠道胆汁酸池减少(图3D);通过古氏副拟杆菌移植得到恢复(图3E)。阿司匹林显著降低了牛磺α/β-鼠胆酸(Tα/βMCA)、熊去氧胆酸(UDCA)和7酮基石胆酸(7-keto-LCA)的肠道浓度,而古氏副拟杆菌移植保存了它们(图3F)。古氏副拟杆菌的丰度与BAs(胆汁酸)呈正相关(图3G)。上述BA-AA组的粪便代谢物谱(见图1A)也显示出类似的变化和相关性(图3H和3I)。上述结果表明,古氏副拟杆菌在调节胆汁酸模式方面具有生物活性作用。
对BA-AA队列的宏基因组数据进行了进一步分析。阿司匹林治疗后,hdhA基因(编码7-α-HSDH)拷贝数显著减少(图3J)。由于已有研究表明hdhA编码的7-a-HSDH能够在体内和体外将CDCA转化为7-keto-LCA和UDCA,以及在小鼠中转化为βMCA,因此研究人员预测了胆汁酸代谢的合成途径(图3K)。在副拟杆菌中鉴定出与hdhA同源的序列,包括古氏副拟杆菌、粪副拟杆菌、 和迪氏副拟杆菌(图3L)。研究还发现古氏副拟杆菌在体外产生7-keto-LCA,但不产生UDCA(图3M)。肠道内容物中胆汁酸浓度与粪便样品之间存在良好的相关性。据报道,副拟杆菌通过胆盐水解酶(BSH)降低牛磺酸结合的胆汁酸,该研究数据表明古氏副拟杆菌增加牛磺β-鼠胆酸浓度。这可能是由于胆汁酸池中总鼠胆酸池的扩大,而BSH活性没有变化(图S5M)。总之,这些结果表明阿司匹林消耗的古氏副拟杆菌恢复肠道胆汁酸谱的稳态。

■ ■ ■ ■ ■
图3. 阿司匹林耗尽的古氏副拟杆菌恢复肠道微生物群和胆汁酸代谢谱
3.古氏副拟杆菌及其代谢物7-keto-LCA维持肠道内稳态
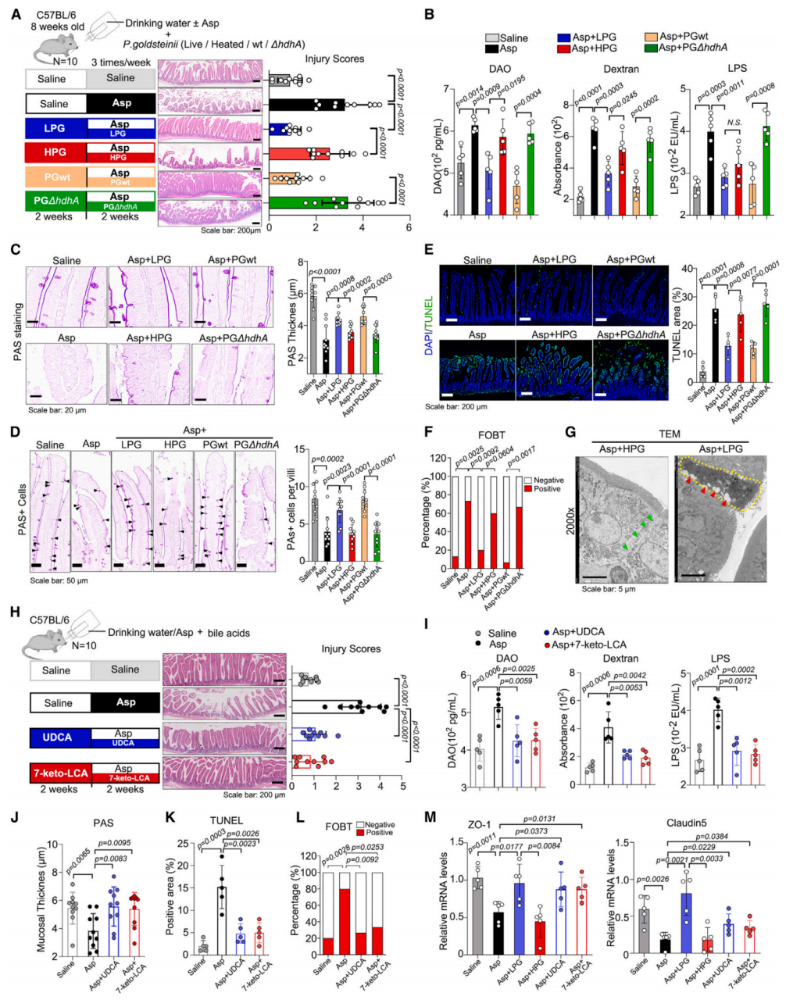
敲除hdhA基因构建了hdhA缺陷突变株(PG∆hdhA),且证明突变株不能将CDCA转化为7-keto-LCA,hdhA对古氏副拟杆菌的生长没有影响,粪便样本的qPCR结果显示,敲除古氏副拟杆菌的hdhA并不影响其在宿主上的定植。然后用阿司匹林治疗SPF小鼠,同时移植古氏副拟杆菌。LPG(活的古氏副拟杆菌)和PGwt(野生型古氏副拟杆菌)改善了损伤评分,而不是HPG(加热灭活的古氏副拟杆菌)或PG∆hdhA,(图4A)。与HPG或PG∆hdhA相比,LPG和PGwt恢复了肠道通透性(图4B)。PAS染色进一步显示,LPG和PGwt而非HPG或PG∆hdhA逆转了阿司匹林对肠道粘液屏障的损伤(图4C),并对保存杯状细胞有积极作用(图4D)。TUNEL和FOBT实验显示的其他异常表型表明LPG和PGwt保护肠上皮细胞(图4E和4F)。LPG组肠道屏障显示出坚固的紧密连接,这些紧密连接在HPG组中被破坏,与阿司匹林组相似(图4G),PCoA分析显示LPG移植可能有助于恢复阿司匹林诱导的肠道生态失调。通过16S测序和RT-qPCR验证了阿斯匹林处理小鼠LPG移植后古氏副拟杆菌的定植。大肠杆菌hdhA功能模型实验说明hdhA参与了7-keto-LCA的生成。UDCA和7-keto-LCA对阿司匹林诱导的肠上皮损伤均有保护作用(图4H)。肠通透性分析显示UDCA和7-ketoLCA对阿司匹林的作用相反(图4I),PAS染色进一步支持了这些BAs在维持肠道粘液屏障(图4J)和保存杯状细胞方面的保护作用。两种BAs均对阿司匹林诱导的损伤(图4K、4L)和隐窝细胞增殖具有保护作用。UDCA和7-keto-LCA有助于维持紧密连接。LPG移植和UDCA和7-keto-LCA饲喂后,紧密连接标志物mRNA水平升高(图4M)。这些数据表明,古氏副拟杆菌以及它通过hdhA产生的胆汁酸可以防止阿司匹林引起的肠道损伤。
■ ■ ■ ■ ■
图4. 古氏副拟杆菌通过hdhA改善阿司匹林诱导的肠道损伤
4.FXR拮抗剂7-Keto-LCA促进Wnt信号传导和干细胞增殖
FXR是一种胆汁酸受体,在肠干细胞扩增和肠道屏障中起关键作用。研究人员建立了肠道特异性敲除FXR的小鼠模型。用阿司匹林治疗Fxr-floxed小鼠(Fxrfl/fl)和肠道特异性Fxr-null小鼠(Fxr∆IE),结果显示阿司匹林引起的肠道损伤(图5A)、肠道屏障破坏(图5B)、生长抑制(图5C)、细胞凋亡(图5D)、粘膜厚度(图5E)、杯状细胞减少和FOBT率减轻。更有趣的是,阿司匹林治疗后,具有β-catenin和Olfm4核分布的隐窝细胞数量减少,这是通过敲除肠道FXR而减弱的(图5F)。此外,在阿司匹林作用下敲除肠道FXR后,杯状细胞和Paneth细胞数量均增加(图5G)。通过16S测序分析了肠道内容物,阿司匹林改变了Fxrfl/fl和Fxr∆IE小鼠微生物群的主要组成。在这些小鼠中,古氏副拟杆菌的相对丰度都降低了,表明古氏副拟杆菌的抑制是由阿司匹林直接诱导的,而不是肠道损伤的结果。综上所述,这些数据表明FXR部分介导了阿司匹林对肠道的影响。通过肠道类器官培养实验发现,古氏副拟杆菌及其胆汁酸代谢产物有助于在肠道自我修复过程中维持肠道干细胞功能。

■ ■ ■ ■ ■
图5. 肠道特异性敲除FXR可减轻阿司匹林引起的肠道损伤
UDCA和TβMCA都是被证实的肠道FXR拮抗剂,研究人员测试了7-keto-LCA对FXR的作用。发现7-keto-LCA和UDCA都是FXR拮抗剂(图6B)。经BAs处理的肠道类器官进行RNA测序,发现UDCA和7-keto-LCA都促进了干细胞特征(Lgr5-Ascl2)的表达(图6E)。相应的PCA显示对照组和CDCA组之间存在分离(图6F)。此外,7-keto-LCA治疗抵消了观察到的许多基因的抑制,最明显的是那些参与Wnt信号传导和增殖相关途径,但不参与凋亡途径的基因(图6G)。这些发现为FXR拮抗剂如何保持干细胞扩增提供了可能的机制见解。这一结果与PCR结果一致,在类器官中FXR靶基因mRNA表达减少,干细胞标记mRNA表达增加(图6H)。此外,在7-keto-LCA处理的细胞系和类器官中,β-catenin的核易位增加。体内实验结果还显示,7-keto-LCA和古氏副拟杆菌移植均消除了阿司匹林对肠隐窝β-catenin活性的抑制(图6I)。一种可能的解释是,BAs调节了FXR与β-catenin的物理结合,因为共免疫沉淀(coIP)显示,UDCA和7-keto-LCA处理后,FXR-β-catenin相互作用水平增加。这些数据表明Fxr拮抗剂7-keto-LCA促进Wnt信号传导以保持肠隐窝细胞的干性。

■ ■ ■ ■ ■
图6. 7-Keto-LCA是一种FXR拮抗剂,促进Wnt信号传导
研究结论
综上所述,该研究表明,肠道微生物群与BAs之间的相互作用对维持肠道干细胞功能和肠道屏障至关重要,它们通过酶介导对未偶联BAs进行修饰。这些发现表明,由于阿司匹林诱导代谢BA的肠道共生微生物减少,基于微生物的治疗可能潜在地改变BA模式。肠道屏障功能受损的后续表型和胃肠道疾病的干性可能通过补充BAs和肠道共生菌而可逆。

胆汁酸检测
迈维代谢通过自建数据库,一次性对65种胆汁酸进行绝对定量检测,包括游离态胆汁酸和结合态胆汁酸,初级胆汁酸和次级胆汁酸。内标+外标双重验证的绝对定量方法,覆盖广、定量准,适合各类胆汁酸相关疾病以及肠道微生物与宿主互作研究。
往期分享

系统生物学研究内容主要包括“基因-蛋白-代谢-表型”等多个层次,越来越多研究表明,多组学已成为生命科学和医学研究的重要工具。“基因组反应了可能发生的变化,蛋白组和代谢组反应了正在或者已经发生的变化”,迈维代谢持续创新质谱技术,创新性的开发出了广泛靶向代谢组检测技术 TM,建立了行业领先的植物代谢数据库和医学代谢物数据库 MWDB,真正实现了“高通量、超灵敏、广覆盖”尽可能多的检测样本中所有的小分子化合物。

与此同时,迈维代谢和赛默飞达成战略合作,详情请点击:拓展组学研究的边界 | 迈维代谢携手赛默飞共建战略合作实验室。在引进新一代质谱平台 Orbitrap™Astral™并同步配置 Orbitrap Exploris 120 质谱仪后,双方进一步深入技术联合开发,携手努力打造为世界领先的创新蛋白质组和代谢组研发中心。加快和深化对拓展蛋白质组学及多组学领域的探究,更好地服务于生命科学和医学健康研究领域,助力精准医学高质量发展!


客服微信:metware888
咨询电话:027-62433042
邮箱:support@metware.cn
网址:www.metware.cn
我就知道你“在看”



























 1406
1406

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








