中风严重影响生活质量,但在个体层面上,中风后的长期认知变化难以预测。因此,迫切需要基于急性期临床神经影像学数据更准确地预测长期症状。先前研究已证实白质连接中断位置与临床症状密切相关。然而,若能全面观察所有可能的连接中断-功能缺损关联,将有助于在个体层面上系统地关联脑连接中断与认知行为表现。
本研究提出了一个全面的框架——白质连接中断的复合形态空间(断连组),用于预测中风后一年的神经心理学评分。将潜在断连组形态空间与神经心理学结果相关联,我们获得了生物学洞见,并创建了首个涵盖86项评分的全面断连组-功能缺损关系图谱——神经心理学白质图谱。我们创新的预测框架"断连组症状发现器"在预测性能上优于其他六种模型,包括功能断连、病灶拓扑和体积建模。基于该图谱的样本外预测平均绝对误差低于20%,并可实现个性化的神经心理学预测。对外部群组的预测显示,语义流畅性的R²达0.201。此外,在两个外部群组中重复训练和测试,视空间表现的R²达0.18。
该框架以交互式网络应用程序(http://disconnectomestudio.bcblab.com)形式呈现,为中风认知建模提供了新的实用方法。我们希望这个图谱和网络应用能帮助减轻认知缺陷对患者、家庭和社会的负担,同时有助于制定未来的个性化治疗方案并发现新的治疗靶点。我们预计,通过未来更多研究者和临床医生的参与和贡献,我们框架的评估范围和预测能力将进一步提高。本文发表在BRAIN杂志。
引言
病灶-缺损模型的准确性不仅取决于数据质量,还取决于基础理论框架。它们共同建立了脑损伤位置与临床症状之间关系的证据,如视空间忽视、失语症、失用症或运动性病识感缺失等。解剖学白质网络与临床表现之间的关联表明,结构和临床表现之间并非一一对应关系,因为不同的病灶可能导致相同的功能障碍。例如,大脑中动脉或后动脉的中风可能导致视空间忽视,就像不同的岛周白质断开可能导致失语症。尽管这一点很重要,但目前的方法并不能系统地捕捉脑特征与临床表现之间的潜在重叠,也不能捕捉它们神经基质的分布特性。因此,为了实现准确可靠的精准医疗,需要一个全面的框架来系统地关联脑连接断开与认知行为评估。
我们假设,量化脑连接将提供更准确的长期脑功能预测因子。这一假设基于先前的中风恢复研究,以及我们的大脑作为一个相互连接的网络而非独立实体工作的理念。
在表面复杂性之下,可能存在一个可以在紧凑的表征空间中描述的更简单的规律。具体来说,在成像空间中由数千个解剖回路的损伤存在或缺失描述的解剖学病灶可以简化为二维笛卡尔空间。在这种情况下,患者的坐标概括了周围白质束的病灶负荷。因此,降维算法允许定义可以嵌入多变量数据的低维空间。在嵌入空间(也称为形态空间)中,具有相似断开模式的患者将聚集在一起,而不同的断开模式则会相距较远。形态空间使病灶-缺损关系更容易观察,允许基于患者的嵌入坐标进行相关性分析。因此,特定的大脑特征可以在形态空间内定义区域,并帮助预测症状和脑病理,类似于典型的机器学习方法。
人工智能(AI)最近在建模症状严重程度与医学成像模式之间的关联方面取得了进展,例如在肿瘤组织表征方面达到了高精度和敏感性。然而,AI模型需要通过更广泛的临床实用终点(包括神经心理学测量)进行改进。下一个挑战将是使AI以患者为中心,以便更有效地部署到临床常规中,并可能改善患者的生活质量。
为了推动这一挑战,我们提出了一种使用形态空间来预测最常见神经系统疾病之一——中风的神经心理学评估的建模方法。我们首先绘制了1333例中风脑断开模式的分布图——断连组形态空间。第二个数据集(训练集)包含中风后一年丰富的神经心理学测量,被导入这个断连组形态空间。这第二个数据集通过86项神经心理学评估获得的临床症状丰富了形态空间。一个样本外验证集(具有相同的神经心理学数据)用于评估预测准确性。这个称为断连组症状发现器(DSD)的程序可靠地预测了患者的表现,平均绝对误差低于20%。为了使DSD工具能够立即供临床-学术界使用,并促进其转化和纳入临床实践,我们提供了一个开放访问的网络应用程序(http://disconnectomestudio.bcblab.com),可以上传个体断开模式以预测预期的1年神经心理学评分。我们还通过包括三个外部队列来证明DSD模型的普遍性。该网络应用程序将通过未来的众包进行交互式更新,用任何新可用的数据集来为DSD模型提供信息。
材料和方法
Bash和Python编程语言被用于自动化图1中总结的所有处理步骤,更多细节见补充图1。
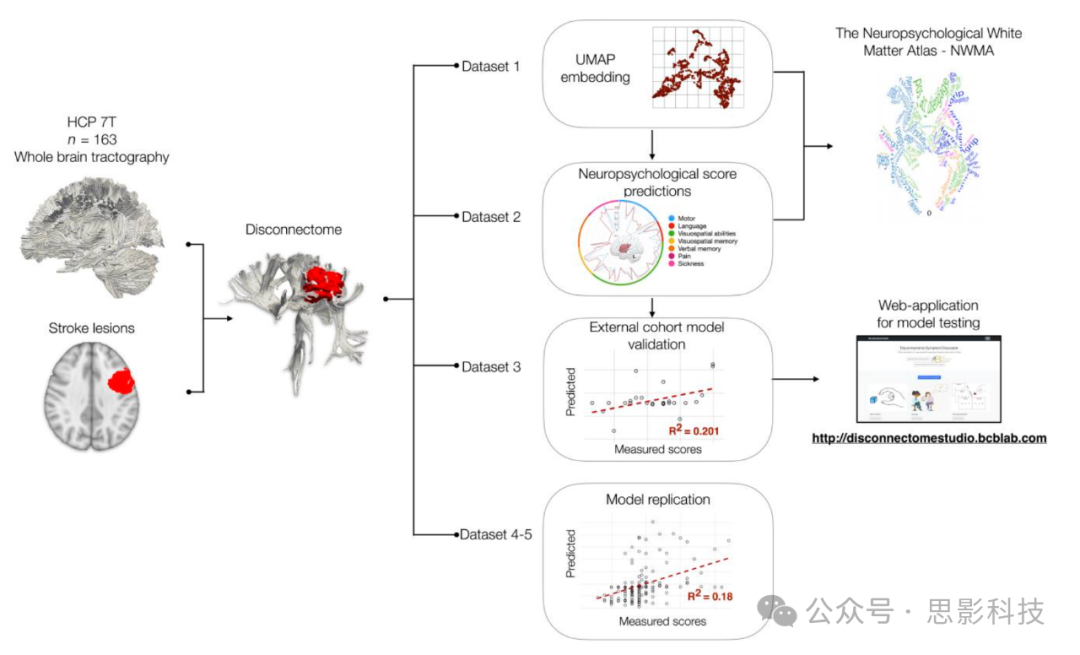
图1 分析工作流程的图形摘要
正常断连图是从人类连接组计划(HCP)参与者和患者的病变位置得出的。数据集1定义了断连形态空间(两个维度的潜在空间)。数据集2被导入数据集1的形态空间,以捕获神经心理学分数的变异性及其与体素的相关性——断连组症状发现器(DSD)。这项分析扩展到86个神经心理学分数,使我们能够创建神经心理学白质图谱(NWMA)。数据集3作为DSD预测的样本外验证。作为外部队列的模型复制,数据集4作为DSD方法的训练集,数据集5作为外部验证。为了进行更广泛的模型测试,DSD计算被整合到一个开放访问的交互式网络应用程序中(http://disconnectomestudio.bcblab.com)。完整细节见补充图1和补充材料。
中风病灶
表1总结了数据集的信息。数值以平均值 ± 标准差(范围)表示。NA = 不适用;UMAP = 统一流形近似和投影方法。
表1 人口统计信息
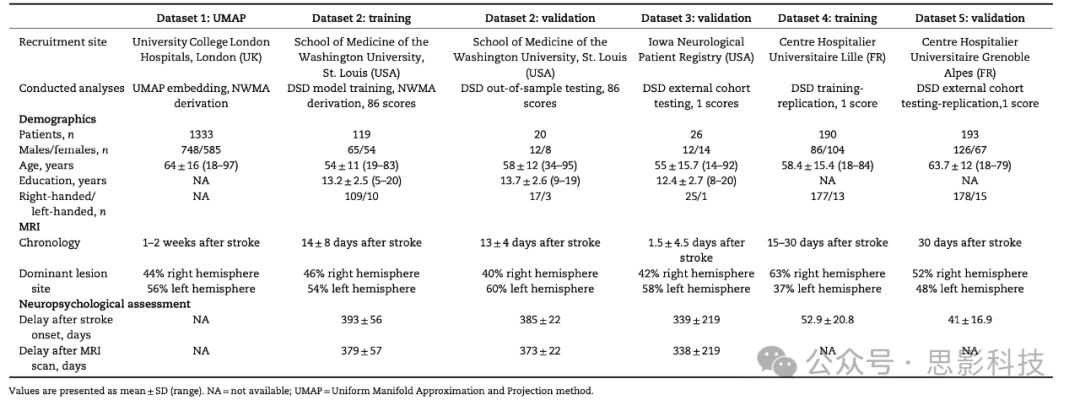
病灶数据来自五个不同的国际中心(数据集1-5)。在所有五个数据集中,急性MRI数据均在中风发作后2周内获得。数据集1:(n = 1333名参与者)MRI扫描在伦敦大学学院医院获得。MRI扫描(1.5 T和3 T)在患者常规临床护理过程中通过几台扫描仪获得。患者平均年龄为64 ± 16岁(年龄范围:18-97岁),56%为男性。这个队列是作为一项经西伦敦和GTAC研究伦理委员会批准的研究的一部分招募的。数据集2在圣路易斯华盛顿大学医学院招募,包括MRI和神经心理学评估。MRI临床扫描采用标准化的3 T协议进行。数据集2的神经心理学评估平均在中风发作后1年进行(更多信息见表1)。所有数据集2的参与者都按照《赫尔辛基宣言》(2013年)和圣路易斯华盛顿大学机构审查委员会制定的程序提供了知情同意。
数据集2被分为两个独立的子组:数据集2-训练和数据集2-验证。从数据集2中随机选择了一组患者(数据集2-验证),并限制该子组的病灶变异性图在大脑半球和血管区域之间平衡(补充图2),且数据集2-验证的性别和年龄分布与数据集2-训练相当。因此,数据集2-验证被用作代表性外部数据集。对于数据集2-训练(n = 119名参与者),患者平均年龄为54 ± 11岁(年龄范围:19-83岁),54.6%为男性。平均教育水平为13 ± 2.5年,91.6%为右利手。对于数据集2-验证(n = 20名参与者),平均年龄为58 ± 12岁(年龄范围:34-95岁),60%为男性;平均教育水平为14 ± 2.6年,85%为右利手。
数据集3包含26名中风患者[平均年龄55 ± 15.7岁(年龄范围:14-92岁),46%为男性,平均教育水平为12.4 ± 2.7年,96%为右利手],这些患者从爱荷华神经病患者登记处(美国)选择。
数据集4包含190名中风患者(平均年龄58.4 ± 15.4岁[年龄范围:8-84岁],45%为男性,93%为右利手),这些患者从里尔大学医院(法国)招募。
数据集5包含193名中风患者(平均年龄63.7 ± 12岁[年龄范围:18-79岁],65%为男性,92%为右利手),这些患者从格勒诺布尔阿尔卑斯大学医院(法国)招募。MRI临床扫描在中风发作后15-30天内使用标准化的1.5 T协议进行。在这些数据集中,贝尔测试在中风发作后30-90天内进行。每个队列都得到了当地机构审查委员会的批准
神经心理学评分
数据集2共有86个神经心理学评分。每项神经心理学评估(评分、测试电池、管理)的详细信息在补充材料C节中报告。简而言之,运动能力(C.1节)评估了上肢抓握、握力、捏力、握力强度、钉子更换、肩部屈曲运动、手腕伸展以及下肢行走。语言能力(C.2节)使用图片命名、非词重复、指令、句子阅读、句子理解和语义流畅性进行评估。视空间能力(C.3节)使用辨别准确性、反应时间、替代、行为不注意和非结构化符号消除进行测试。视空间记忆(C.4节)使用抽象图形检索分数进行评估,语言记忆(C.5节)使用列表单词识别分数进行评估。记录了MRI扫描期间的疼痛量表(C.6节),并进行了中风病态问卷调查,调查日常身体和心理社会病态(C.7节)。尽管一些评分存在共线性,尤其是视空间能力,我们选择使用单一评分措施而不是组合评分指数,以保持数据驱动并与个体患者的测量结果临床兼容。
语义流畅性(动物)是数据集2和数据集3之间唯一可比较的测试,因此被选择用于预测模型的外部验证。平均而言,中风后评估时间为11.1 ± 7.2个月(3.7-29.4个月)。
对于数据集4和5,选择贝尔测试(一种消除测试)来验证外部训练和样本外预测。在这个测试中,要求参与者在280个干扰物中圈出35个铃铛。
所有参与者都以书面形式同意参与研究,研究已得到各自机构审查委员会的批准。
断连组分析
患者的弥散加权数据并不需要用于断连分析。相反,白质断连图是从一个标准化的弥散加权数据集中得出的,该数据集由176名健康参与者组成,其中45%为男性,使用7T MRI进行弥散加权扫描(HCP)。全脑纤维束追踪是使用Thiebaut de Schotten等人报告的相同程序重建的。简而言之,默认的HCP预处理管道(v3.19.0),包括TOPUP和EDDY校正(https://fsl.fmrib.ox.ac.uk),被应用于参与者的弥散加权图像,选择65个均匀分布的梯度方向体积,b值为2000 s/mm2(1.05 mm等向体素,131个近轴向切片,加速因子为3,回波时间=71.2 ms,弛豫时间=7000 ms,相位编码方向配对前后和反向)。确定性纤维束追踪是在原始弥散MRI空间中使用StartTrack软件(版本ST_20170905)执行的。对于阻尼Richardson-Lucy算法,设置固定纤维响应因子α = 1.5 × 10-3 mm2/s,几何阻尼参数为8,200次迭代。对于球面纤维方向分布,设置绝对阈值为灰质等向体素的3倍,相对阈值为其最大幅度的8%。全脑纤维束追踪流线传播是使用改进的欧拉算法进行的(角度阈值35°,步长0.5 mm,最小流线长度15 mm)。
随后,首先将受试者纤维束追踪转换为流线密度体积,其中强度对应于穿过每个体素的流线数量。其次,使用Advanced Normalization Tools(ANTs)库分发的Greedy对称微分同胚标准化(GreedySyN)管道生成了流线密度体积的研究特定模板。然后将模板协配到MNI152空间(2 mm分辨率)。第三,将单个流线密度体积配准到MNI152空间中的流线密度模板,并使用软件包Tract Querier中分发的trackmath工具和ANTs GreedySyN将相同的变换应用于单个全脑流线纤维束追踪。此步骤在标准MNI152空间中生成了全脑流线纤维束追踪。
脑卒中病灶在MRI扫描中手动描绘,随后使用BCBtoolki中的对映标准化工具标准化到MNI152空间(2 mm分辨率)。相应地,在将患者的T1加权图像配准到MNI152之前,病变区域被对侧健康组织替代以计算标准化变换。然后,使用BCBtoolkit处理断连组图谱。HCP纤维束追踪经过过滤,只考虑通过每个脑卒中病灶的流线。为了获得标准化人群组统计,每个过滤后的纤维束追踪都被二值化。因此,如果至少有一条流线通过一个体素,该体素的值将为1。这一步骤允许创建一个总结百分比(%)图。即,对于每个脑卒中患者,根据报告该体素中存在流线断连的HCP参与者数量,得到一个范围从0到1的图。
断连组形态空间
患者断连组的降维是使用均匀流形近似和投影(UMAP)方法获得的,这是一种非线性嵌入方法,沿主轴分布数据变异性。具体来说,UMAP将数据投影到新构建的流形中,同时在全局距离上保留输入数据结构之间的原始成对距离。获得的UMAP流形将遵循黎曼几何和代数拓扑的理论框架。因此,具有相似断连图谱的患者在UMAP形态空间中聚集在一起,而具有不同断连图谱的患者则位于较远处。对于数据集1,三维断连组图被向量化并作为嵌入方法的特征导入。UMAP参数设置为默认参数(即15个近邻的近似值和最小0.1欧几里得距离,以获得数据集1的二维嵌入)。选择二维潜变量配置是为了提供更直观的空间,便于临床上有意义的解释,这是一个局部连接的黎曼流形空间,我们在论文中称之为断连组形态空间。UMAP嵌入变换使用Pickle库存储为Python对象,以便在导入新患者到模型时应用相同的低维变换。随后,坐标尺度被移动,只有正坐标,原点为零。
断连组症状发现器
进行了患者在断连组形态空间中的定位与神经心理学评分之间的统计相关性分析。在多元回归公式之前,UMAP坐标被转换为2D nifti图像(260 × 260矩阵,0.05 mm像素大小),并应用了1 mm的高斯核空间平滑(使用FSL库https://fsl.fmrib.ox.ac.uk/fsl/fslwiki/)。我们使用高分辨率(0.05 mm)以避免嵌入坐标之间的重叠;随后,选择20像素的空间平滑(即高斯核sigma 1 mm)以确保覆盖整个形态空间。这一步骤旨在模拟UMAP坐标的不确定性,并获得患者在断连组形态空间中定位的空间分布。使用Python中的迭代循环进行了患者定位概率与神经心理学评分之间的逐像素Pearson相关性分析。只有中等效应大小的相关结果被认为是有信息的(R > |0.2|)。随后,由于多个体素簇超过了阈值,进行了主成分分析(PCA)以压缩患者坐标分布变异性。考虑了三个主要主成分。主成分数量的选择考虑了解释的方差量(始终高于80%)和存活|R| > 0.2阈值的形态空间簇数量,这些簇包括患者的UMAP投影数据点(不超过三个)。随后,患者的主成分作为因变量输入多元回归模型(Python sklearn.linear_model.LinearRegression)以预测神经心理学评分:
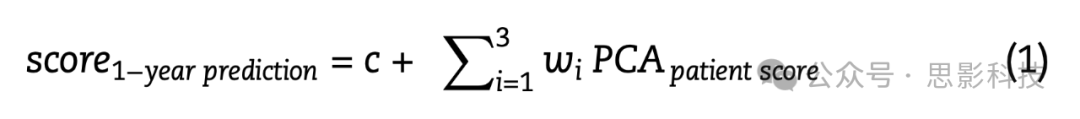
其中c是线性回归模型的截距,wi是模型权重,PCApatient score是模型变量,通过患者定位分布与PCA成分的内积获得。
多元回归公式使用数据集2-训练断连组进行训练,并使用样本外的数据集2-验证和数据集3患者进行验证,同时独立地使用数据集4进行训练并用数据集5进行测试。
预测的准确性被评估为平均绝对误差(MAE),并通过神经心理学评估中获得的最高分数进行标准化(MAE %):

这种标准化允许比较不同临床量表的预测准确性,并为个别分数的误差测量提供了直观的解释 - 误差百分比(MAE%)。
为了评估我们的模型DSD与群体观察的拟合程度,我们报告了预测的拟合优度R2。只有当包含的受试者数量超过20时才计算这个指标。因此,除了数据集2-验证外,所有数据集都提供了R2,在数据集2-验证中报告了个别MAE%测量值。
断连组症状发现器与病变和功能连接模型的比较
我们统计比较了DSD的R2与其他六种常用预测模型。这些模型包括:
(i)基于体素的断连组方法(D-VB);
(ii)病变数据的症状发现器(SD)嵌入(L-SD);
(iii)基于体素的病变症状映射(L-VB);
(iv)基于体素的功能断连症状映射(f-VB);
(v)病变体积和年龄SD(VolAge-SD);
(vi)群体平均值。
D-VB方法允许将DSD的预测能力与经典的基于体素的断连方法进行比较。病变数据的UMAP嵌入(L-SD)与DSD使用相同的复杂框架,直接应用于患者的病变数据,以在可比较的框架中测试DSD断连对病变拓扑的附加预测价值。L-VB允许将DSD的预测能力与经典的病变方法进行比较。第四个模型利用功能失连图在体素水平上与临床症状关联。第五个模型将DSD与考虑两个常被认为是中风后恢复的主要决定因素(即病变大小和年龄)的预测进行比较,第六个模型仅考虑神经心理学分数的平均值。
按照Boes等人的程序分析了功能失连图。我们处理了相同的HCP队列(n=176,7T)来估计病变区域与大脑其余部分的同步活动。随后,类似于断连组图的程序(参见"断连组"部分),在MNI空间中计算了HCP组平均值,以生成功能断连图,其中每个体素的范围在-1和1之间。负值和正值对应于病变与大脑其他区域之间的皮尔逊相关。
对于使用训练集进行多重回归的SD方法(DSD、L-SD和VolAge-SD),通过在每次迭代中随机分配华盛顿圣路易斯队列(数据集2)的70%作为训练集(n=100)来评估k-fold验证。对于基于体素(VB)的方法(D-VB、L-VB、f-VB),我们运行了5000次置换,并估计了最显著体素(98百分位)的模型拟合优度(R2)。。VB相关性包括所有华盛顿圣路易斯患者(数据集2)。最后,我们使用双尾配对t检验比较了DSD R2结果与其他方法,并应用Bonferroni校正进行多重比较。
断连组症状发现器网络应用
DSD网络应用(http://disconnectomestudio.bcblab.com)使用Django框架(https://www.djangoproject.com)构建。这个Web框架允许数据库操作,并且基于Python。DSD前端是用标准JavaScript和css模板创建的,而后端托管在DigitalOcean Web服务器(https://www.digitalocean.com)上。
神经心理学白质图谱
为了创建评估的神经心理学评估的白质图谱,将白质断连组(数据集1)与患者的PCA分数相关联,通过在数据集1上运行预测模型来评估。断连组数据用于定义UMAP空间,而DSD模型权重作为多重回归模型的变量,用于预测长期神经心理学症状。使用randomise(FSL库)运行了广义体素线性回归模型,以断连组图为自变量,PCA分数为因变量。为了解决结果的可重复性问题,这个程序重复了两次,将数据集1分成两半,每一半n=666个受试者。
获得的randomise T图用于计算相应的效应量图。对于每个神经心理学分数,评估了从DSD模型获得的三个PCA分数,并考虑了各组分之间的最大效应量。随后,在NWMA总结图中报告了神经心理学评估中的最高效应量(FSL库find_the_biggest函数)。通过两个数据集1总结图之间的皮尔逊相关来量化NWMA的可重复性。
结果
断连组形态空间
潜在断连组配置是基于1333名中风患者(见表1中的数据集1)定义的,因为其超过1000名中风患者的数量允许对临床转化的病变变异性进行生态学描述。
处理数据集1的中风病变以获得断连组图。断连组图量化了每个病变基于健康人群高分辨率纤维束追踪所中断的白质连接模式。随后,使用UMAP方法嵌入断连复杂性。得到了断连组图的潜在二维配置。随后,将外部患者群导入数据集1的潜在配置中,以训练(数据集2-训练和4)和测试(数据集2-验证、3和5)形态空间预测中风1年后神经心理学表现的能力。
患者断连组谱分布基于皮质病变位置和常见断连的白质束。左或右半球主要断连的患者分别嵌入形态空间的右半部和左半部。同样,后部或前部断连的患者位于嵌入空间的顶部或底部。例如,右侧下额枕束(IFOF)明显断连的患者位于形态空间的左上极端。相比之下,左侧皮质脊髓束(CST)和弓状束(AF)的断连则相对更靠近中心,位于形态空间的右下方(图2)。不同数据集的导入显示了断连模式分布的一致性。这些结果表明,形态空间适当地区分了不同的断连模式(更多细节见补充图3)。
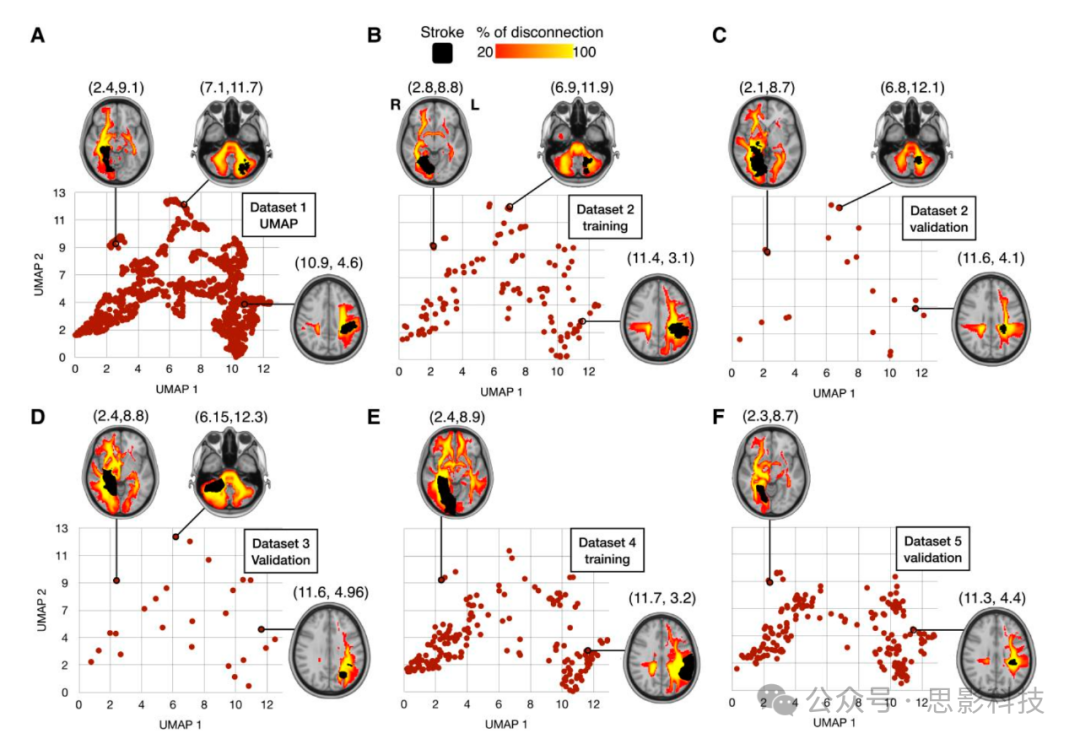
图2 断连组形态空间
使用UMAP方法嵌入1333个中风断连组(数据集1)(A)。
外部队列在断连组形态空间中的投影,用于数据集2-训练(B)
数据集2-验证(C);数据集3-验证(D),数据集4-训练(E)和数据集5-验证(F)。
复合形态空间
目前尚不清楚断连组形态空间在多大程度上可以预测不同的神经心理学表现。为了回答这个问题,我们利用了第二个独立的中风患者数据集(n=119;见表1中的数据集2),这些患者接受了广泛的标准神经心理学评估(n=86,补充表1)。对于第二个数据集的每个患者,计算了断连组图并使用UMAP定义的转换导入断连组形态空间。为了解决嵌入不确定性,患者在形态空间中的坐标进行了空间平滑(见"材料和方法"部分)。这样,每个患者在断连组形态空间中的坐标被转换为定位概率。然后使用皮尔逊相关方法来估计形态空间中每个坐标与神经心理学表现之间的关联(更多细节见补充图1)。图3表明,断连组形态空间中的区域与神经心理学分数之间存在中等到大的效应量关联(所有|R|>0.2)[图3A(i)-C(i)]。重要的是,对于某些分数,断连组形态空间中对应不同断连谱的多个簇显然导致了相同的神经心理学损害。这证实了病变结构与临床障碍之间不存在一一对应关系,同样,不同的脑损伤位置可能导致相同的功能损害。我们没有简单地进行形态空间坐标尺度与神经心理学分数之间的线性关联。然而,为了广泛捕捉形态空间中的数据方差,对患者在显著簇内的定位概率进行了主成分分析(PCA)建模(后面称为空间PCA)。对于每个患者,空间PCA的前三个成分输入多重回归分析,以预测发病1年后单个患者的神经心理学分数。多重回归创建了方程,模拟每个患者在断连组形态空间中的潜在定位(即由空间PCA的前三个成分定义)与其神经心理学分数之间的关系。这样,我们获得了一个复合形态空间,它利用了两个数据集的联合优势。复合形态空间准确(具有中等到大的效应量)且可靠地预测了86个神经心理学分数中的70个(补充表2)。
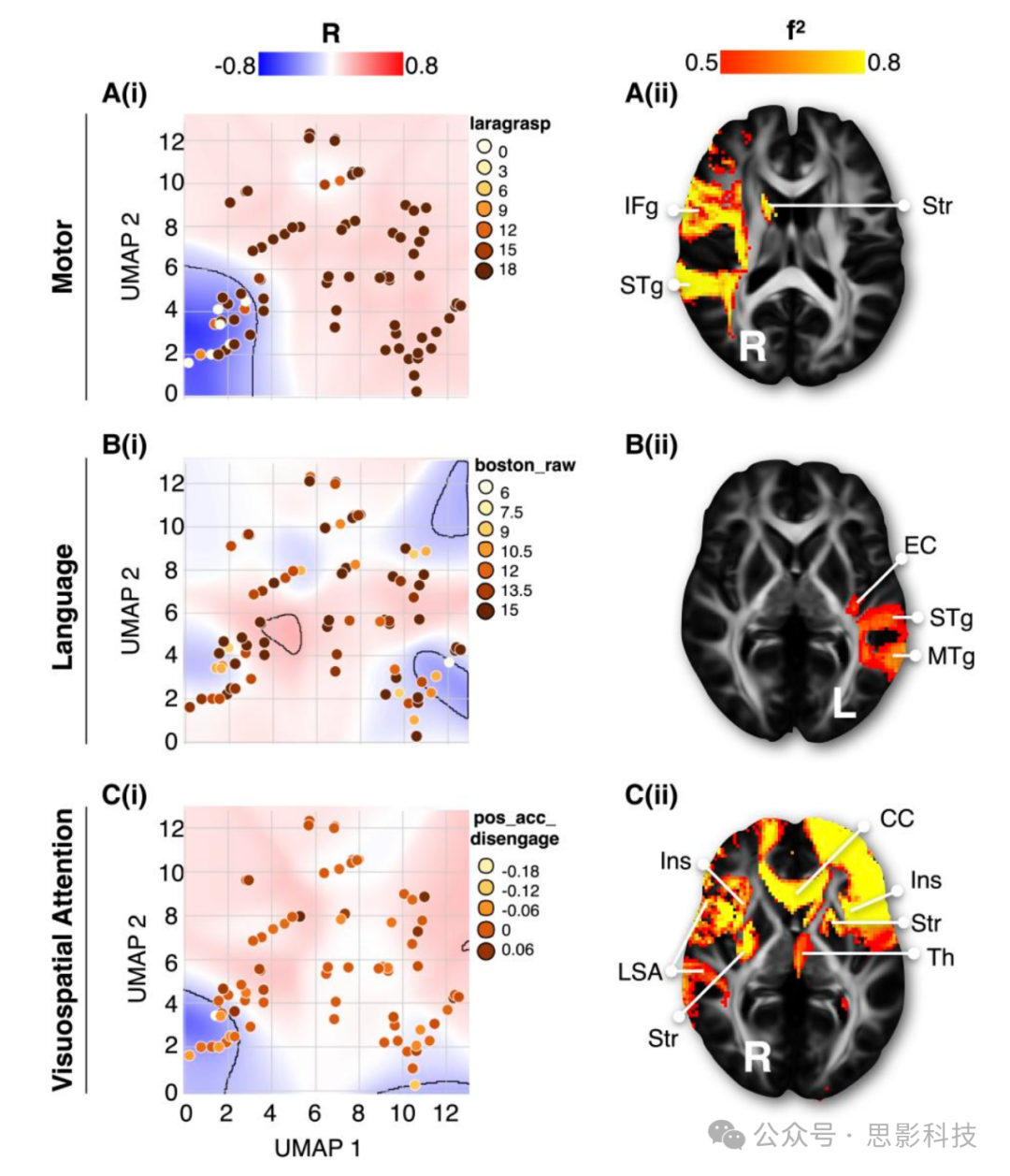
图3 复合形态空间
复合形态空间对应于统计组合了个体神经心理学分数的断连组形态空间,A(i)-C(i)是三个不同神经心理学分数与形态空间区域关联的例子,与[A(ii)-C(ii)]其原型断连谱一起呈现。在形态空间背景中,显示了与神经心理学分数的皮尔逊相关(R)位置;已经勾画出中等效应量区域(|R > 0.2|)。所有神经心理学评估和图都在补充材料(C部分)中报告。
f2 = 效应量;laragrasp = 左侧抓握动作研究手臂测试;boston_raw = 波士顿命名测试;pos_acc_disengage = Posner定向任务中的准确性;CC = 胼胝体;EC = 外囊/极囊;IFg = 下额回;Ins = 岛叶;LSA = 弓状束长段;MTg = 中颞回;STg = 上颞回;Str = 纹状体;Th = 丘脑。
断连组形态空间成分映射
在下一级,我们将分数预测结果带回神经影像空间,以探索导致症状的神经解剖模式。第一个数据集被平分(2 × 666断连组图)以评估可重复性。预测的神经心理学表现的潜在模式与第一个数据集两半的脑断连图使用体素水平的线性回归进行了统计关联。这样我们为每个神经心理学分数获得了两组脑断连图[见图3A(ii)-C(ii)的例子,所有图及其完整讨论见补充材料C部分]。我们能够制作一个与神经心理学分数相关的脑断连综合图谱,两组图的统计比较表明具有优秀的可重复性水平(Pearson R = 0.82)。图4A总结了从中等(0.15 > f2> 0.35)到高效应量(0.35 > f2)的最高统计关联,旨在提供一个白质图谱来构建新的NWMA(神经心理学白质图谱)。最高效应量在左半球,特别是额叶连接,表明这些断连与神经心理学分数之间存在最强的关联(图4B)。一些区域也可能与多个神经心理学分数相关。为了总结这些信息,我们计算了一个多功能图,表明每单位白质体积可以用大效应量预测多少个神经心理学分数(图4C)。多功能图揭示了左右半球之间的明显不对称。右半球较低的效应量和较高的多功能性表明,需要更多工作来精细测量和区分神经心理学中的右半球功能。
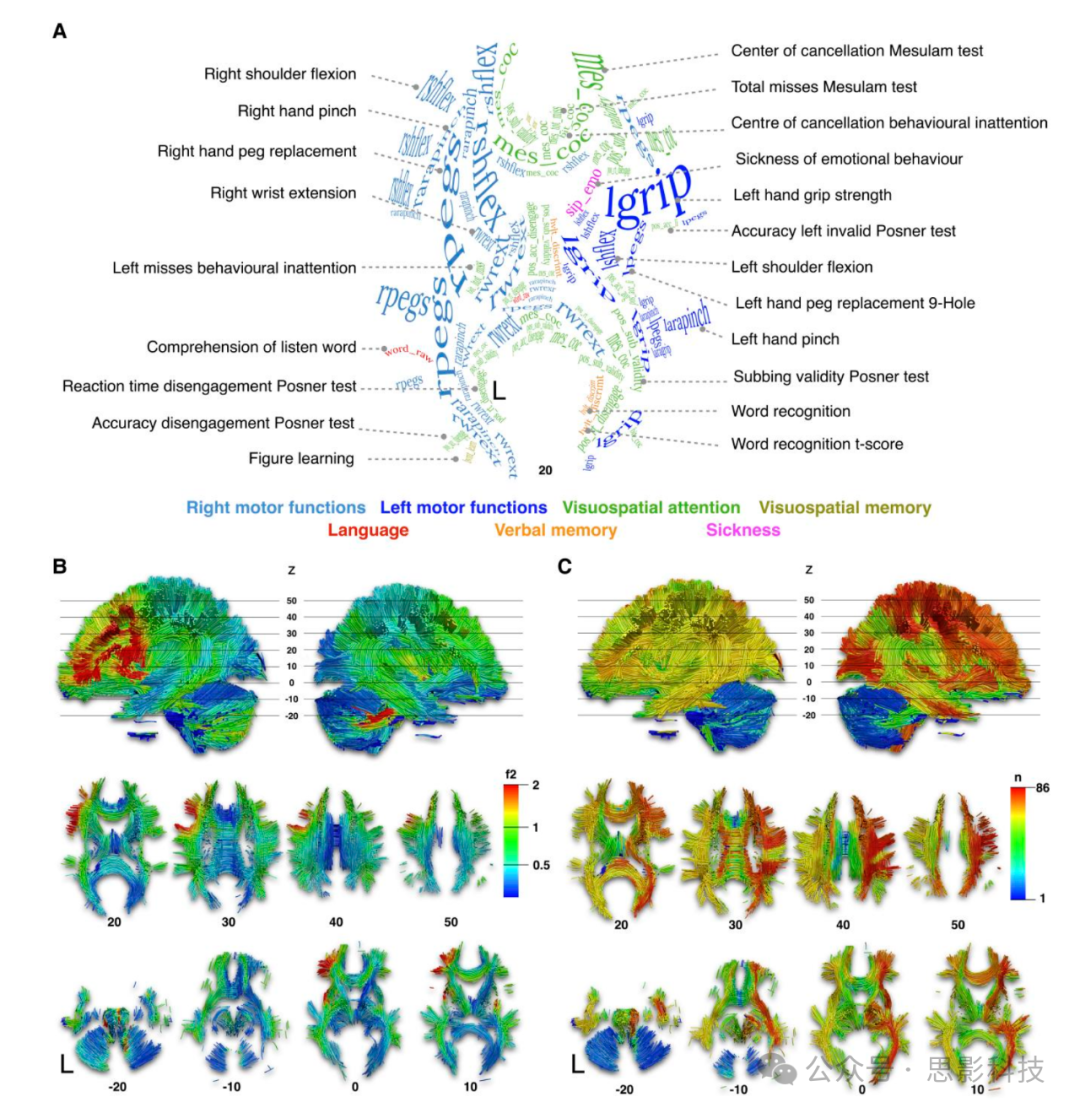
图4 神经心理学白质图谱(NWMA)
(A) 神经心理学分数标记的轴向投影对应于最强的白质关联。访问https://neurovault.org/collections/11260/或补充材料C节查看单个神经心理学白质图。标记文本的字体大小和曲率是手动设置的,以适应显著簇的大小并跟随白质的方向(参见补充材料D节获取高分辨率图像)。
(B) 颜色图对应于神经心理学分数中最高的效应量分数(f2)。
(C) 颜色图对应于神经心理学分数效应量分布图重叠的数量(n)。这种重叠将被称为通用性图。每个轴向切片下方报告了MNI152参考Z坐标。
外部队列模型验证
为评估预测的准确性,将来自第三个独立数据集25的数据(从原始数据集2中保留的20名中风患者;见表1中的数据集2-验证)投射到形态空间中。从那里,应用从复合形态空间得出的方程来预测个体神经心理学分数。使用MAE评估单个神经心理学分数的预测准确性,MAE反映了观察到的分数与预测分数之间的差异,并通过最大分数进行归一化(MAE%;图5)。MAE是评估机器学习准确性的标准指标(https://scikit-learn.org/stable/modules/model_evaluation.html),它提供了一个具有临床意义的测量。个体分数的预测平均MAE为16.1 ± 7(范围4.4, 39.2)%。在这个第三个独立数据集中,超过四分之三(n = 65)的可用分数(n = 83)预测的MAE < 20%(参见补充表3获取全面统计数据)。
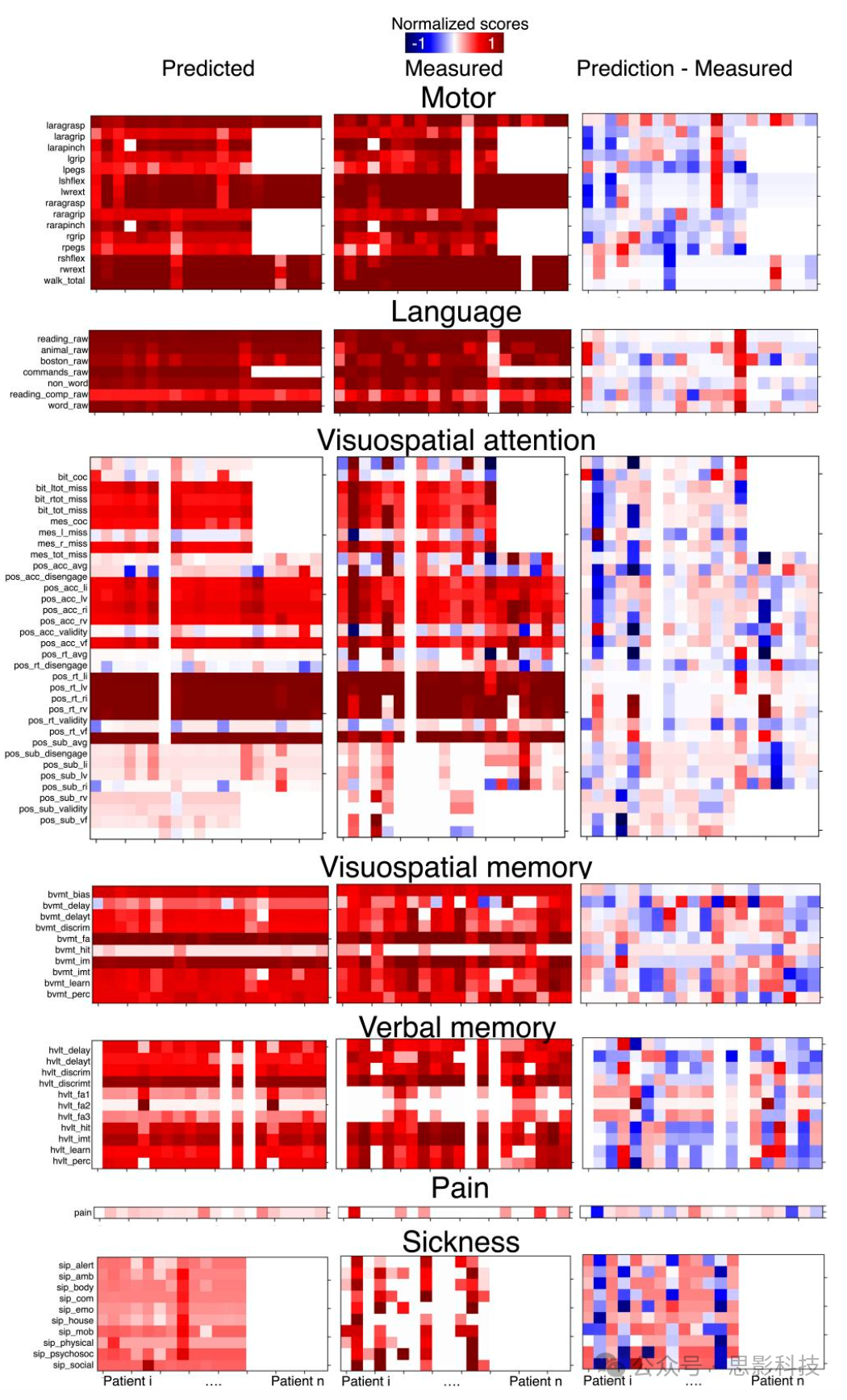
图5 神经心理学分数的准确性
左图:根据复合断连形态空间建模预测的神经心理学分数。
中图:中风发作1年后测量的神经心理学分数。
右图:预测分数与测量分数之差的归一化误差。列对应单个患者的神经心理学特征。行对应不同的神经心理学分数。为了视觉效果,分数相对于最大量表分数进行了归一化。参见补充图4获取来自训练集的相同图像。分数缩写的全称可在补充表1和http://disconnectomestudio.bcblab.com查看。
从个体化临床角度来看,这20名患者的神经心理学特征是通过比较每个患者的测量分数和预测分数来评估的。图5展示了数据集2-验证的预测分数和测量分数的彩色图。
此外,图6展示了从数据集2-验证中得出的三个代表性患者。雷达图展示了DSD模型预测与测量分数的对应关系。DSD预测与患者记录的表现的一致性已在补充材料F部分(补充图58-77)中报告和讨论。
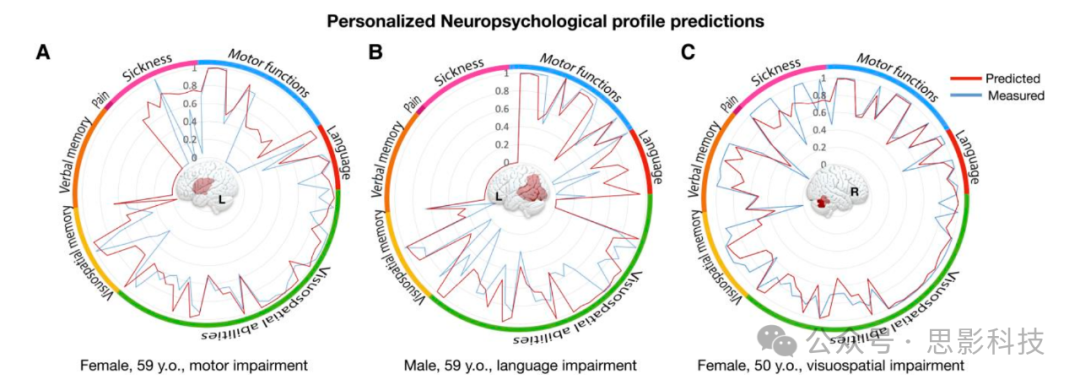
图6 个体化神经心理学特征预测。报告了数据集2-验证中三个代表性患者的神经心理学特征预测。对于每个特征,外圈表示与神经心理学领域的对应关系。注意,为了便于阅读,一些分数的极性被反转,因此更高的分数始终表示更好的表现。A-C分别展示了左下额叶病变伴慢性运动障碍的患者(A);左颞顶叶病变伴慢性语言障碍的患者(B);以及右侧小脑中风伴视空间和语言记忆过程慢性缺陷的患者(C)。数据集2-验证的所有雷达图都在补充图58-77中报告。
DSD(断连组症状发现器)模型在第三个外部队列(数据集3,见表1人口统计学特征)中进行了进一步测试,测试项目为语义流畅性(动物类别)分数,这是他们不同神经心理学常规评估中唯一可比较的测试。DSD模型对数据集3的预测达到R²= 0.201和MAE% 13.71%(图7B)。
此外,我们通过在两个不同的队列(数据集4和5)中训练和验证DSD模型,证明了其通用性。我们在数据集4(一个包含190名参与者的法国中风患者队列)上训练DSD模型,并在外部队列数据集5(193名参与者)上测试训练好的DSD模型。对于Bells测试分数预测,在训练阶段达到R²= 0.2985和MAE 16%,在外部验证中达到R²= 0.1797和MAE% 13.69%(图7C)。
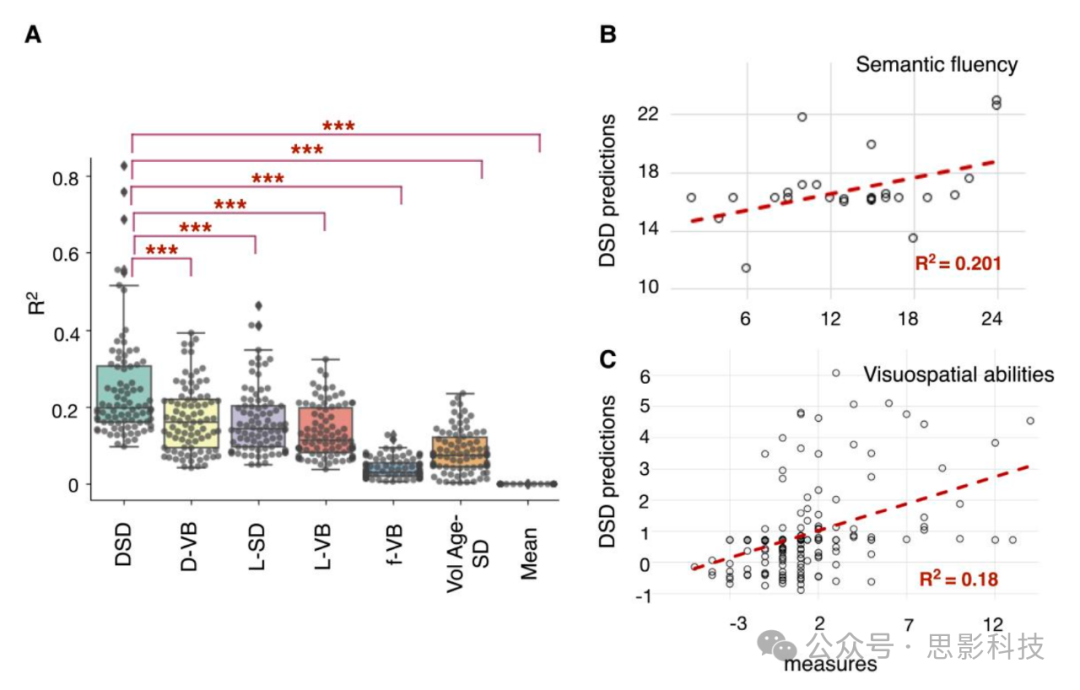
图7 DSD R²与其他预测模型的比较
(A)箱线图报告了通过回归测量分数和预测分数获得的所有神经心理学分数(数据集2)的R²,DSD(断连组症状发现器)与其他六个模型进行了比较:断连图体素基础(VB)相关(D-VB),病变数据的症状发现者(SD)UMAP嵌入(L-SD),病变VB映射(L-VB),功能失连VB(f-VB),带病变体积和年龄变量的SD(VolAge-SD)以及组平均。箱体显示四分位数,须线延伸到分布的其余部分,不包括四分位距离外的异常值。箱体内的线表示中位数R²:DSD为R²= 0.20,D-VB为R²= 0.16,L-SD为R²= 0.14,L-VB为R²= 0.11,f-VB为R²= 0.03,以病变大小和年龄为预测因子的为R²= 0.07,组平均为R²= 0。星号对应于配对t检验获得的P值(双尾,Bonferroni校正多重比较):***P < 0.001。
(B)DSD对语义流畅性测试(动物类别)的样本外预测,n = 26名中风患者(数据集3)。
(C)DSD复制和视空间能力的样本外预测,Bell分数,n = 193名中风患者(数据集5)。
R²与其他预测模型的比较
通过回归测量分数和预测分数来评估所提出的预测模型解释的神经心理学方差,计算了拟合优度(R²)。在模型训练阶段(数据集2-训练),达到的平均R²为0.19 ± 0.09(范围0.05,0.67)。每个神经心理学分数的预测R²见补充表2。此外,为了评估模型稳定性,我们在DSD模型训练和验证中随机分配患者,进行100次置换k折交叉验证(所有数据集2-训练和验证)。训练集R²在置换中的分布见补充图4C。平均而言,迭代中达到的中位数R²为0.20 ± 0.14(范围0.10,0.83)。
在图7C中,每个模型获得的个体R²的箱线图显示,DSD模型解释的方差显著高于所有六种比较方法。
讨论
通过应用最先进的数据嵌入方法,我们成功地结合了互补的中风患者数据库。我们产生了一个与脑断连相关的神经心理学分数的新图谱——NWMA(神经心理学白质图谱)。该图谱与一个公开可用的网络应用程序DSD相关联,该应用程序利用我们的方法,为研究人员和临床医生提供了认知症状的新解剖见解。DSD模型的样本外验证(数据集2-验证)准确预测了65个神经心理学分数,预测误差小于20%。
我们的中风队列中相似的断连模式在嵌入空间中紧密分布,这与其他研究领域使用UMAP方法进行数据聚类的目的相似,例如单细胞遗传转录组。这种嵌入信息使我们能够将中风1年后的单个患者神经心理学特征与形态空间中的区域和断连模式联系起来。因此,断连形态空间作为一个参考,用于导入和总结新的中风断连。
通过系统探索白质相关性,我们创建了一个与脑部断连相关的神经心理学评分的综合图谱。我们的研究评估了单一评分指标。这种方法使我们能够讨论个体评分的白质相关性的异同,并创建一个白质神经心理学图谱(NWMA;见补充材料C部分)。此外,在评估外部个体患者时,单一评分具有可与其他队列比较的优势。研究确认了一些经典的功能关联,如运动功能的侧化、左侧围绕语言网络、额顶注意网络或右侧岛叶与病感。此外,还报告了关于脑功能和断连的新见解,如与视觉忽视相关的胼胝体连接、视空间记忆的小脑枢纽和语言记忆的舌回(个别结果和讨论见补充材料C部分)。值得注意的是,左右运动功能障碍的解剖预测因素是不同的。广泛且双侧的白质贡献,包括左侧皮质脊髓束,与中风后1年的右侧运动功能障碍有关。然而,长期左侧运动功能障碍与右侧额颞叶和岛叶连接的断开有关(图3和补充材料C.1部分)。这些发现与总体运动指数的初步报告一致,并暗示运动功能可能存在不对称的神经基础。
总体而言,NWMA(神经心理学白质图谱)在左半球的最大效应大小突出了左额叶作为运动和语言功能的关键枢纽(图4B)。相反,右侧功能重叠的最高数量主要是由于疼痛和病感的NWMA图谱在右侧额顶叶和岛叶连接中广泛重叠(补充图39-49)。只有一半的视空间评分显示了对右半球的独特参与,例如,Mesulam消除测试呈现左侧化或双侧分布(补充图23)。
我们提供的NWMA允许利用急性MRI扫描来预测长期中风症状的严重程度。这些结果表明,断连图模型适用于预测广泛的认知行为表现,并识别完整的个性化、个体患者特征。这些信息将成为临床环境中的宝贵资源,例如用于制定个性化治疗和康复策略。与许多仅具有诊断目的的先前中风AI方法相比,这是一步进步。DSD模型具有基于跨模态数据(神经影像输入-神经心理学结果预测)的预后价值。
然而,不同功能的预测准确度并不相同(补充表3)。三个因素可能解释这些差异。首先,一些神经心理学评分在评估表现方面比其他评分更可靠。其次,可塑性和个体间差异可能与恢复相互作用。第三,断连图模型可能无法捕捉脑损伤的所有变异。事实上,目前尚未考虑到低灌注和低代谢等因素以及急性影像学变化(如假性正常化)。此外,我们出于实用和直观目的,任意选择使用两个嵌入维度创建断连图形态空间。虽然这被证明是描述潜在数据结构和预测症状的可靠方法,但未来的研究可能会探索形态空间的更高维度(数据和代码可应要求从作者处获得)。最后,我们使用了可用的最大且最全面探索的中风数据集之一,就神经心理学评分而言。然而,由于验证组仅占训练组的约20%,其适度的数量限制了验证步骤的统计能力。为了克服这一潜在限制,DSD网络应用程序允许通过众包和添加新数据集进行更广泛的验证。
在图7A中,我们将DSD与使用不同预测框架的其他六个模型进行了比较。利用结构失连的DSD UMAP模型优于病变和功能失连预测器。统计比较是针对数据集2记录的86个神经心理学评分进行的。DSD在运动评分上达到了最高的R²(补充图4C),这与Bowren等人最近报告的结构失连结果一致。相比之下,Bowren等人指出功能连接是语言评分的最佳预测因子。我们的结构连接模型,通过UMAP方法丰富,在语言评分方面优于f-VB结果。这表明白质断连的降维改善了语言网络变异性的估计及其与语言障碍的统计关联。我们通过预测Bowren等人队列的语义流畅性(动物)评分进一步证明了这一点;样本外预测达到R²= 0.201(图7B)。总的来说,这些证据表明,断连预测器可能是中风后1年神经心理学评分的最佳策略。
作为概念验证,我们通过在两个完全不同的队列(数据集4和5)中进行训练和测试,测试了DSD模型的通用性。图7C表明,DSD模型外部队列预测与实际测量结果一致,效应量中等(拟合优度R²= 0.18,Bell评分)。此外,用UMAP建模的断连图和病变数据优于基于体素的方法(图7A)。这一结果验证了我们最初的观察,即结构与临床表现之间不存在一对一的关系,而是需要高阶建模来准确描述整合的脑功能。
在当前工作中,我们旨在提出一个新的框架,利用MRI数据预测患者的长期临床/认知评分。通过高度协作的研究网络,我们获得了五个独立中风队列的访问权限。数据集1包括MRI,在1000多名患者中获得,为UMAP方法提供了中风后白质损伤变异性的信息。通过数据集2,我们训练了一个回归模型来预测86个神经心理学评分。其中之一,语义流畅性测试,在独立队列数据集3中进行了测试。数据集4和5用于训练和测试与数据集2和3相同的视空间能力模型,并证明了所提出框架对外部队列的通用性。临床评估在各中心的共性决定了具体评分的选择。然而,为了促进未来的模型测试和全球协作研究,我们开发了DSD网络应用程序,这是一个免费且用户友好的网络浏览器工具,只需要互联网连接和病变断连数据。即时软件访问和自动更新使得万维网成为临床转化的理想媒介。DSD方法的应用可能有助于个性化预后评估。开发的网络应用程序已发布,以促进更广泛的模型验证,这对未来全球验证DSD可靠性至关重要。只有在这个不可或缺的验证步骤之后,DSD网络应用程序才应考虑用于临床试验测试。因此,DSD旨在同时造福研究人员对脑功能的理解和患者的治疗。





















 775
775

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








