自闭症谱系障碍(ASD)中表型异质性的机制尚不清楚。利用一个大型神经影像数据集,我们确定了三个功能性脑网络连接的潜在维度,这些维度能够预测ASD行为的个体差异,并在交叉验证中保持稳定。沿着这三个维度进行聚类,揭示了四个可重复的ASD子群,这些子群在ASD相关网络的功能连接变化和临床症状特征上具有显著不同,并且在独立样本中得到了重复验证。通过将神经影像数据与来自两个独立转录组图谱的规范基因表达数据整合,我们发现,在每个子群中,ASD相关的功能连接可以通过不同ASD相关基因集表达的区域差异来解释。这些基因集与涉及免疫和突触功能、G蛋白偶联受体信号传导、蛋白质合成及其他过程的不同分子信号通路有差异性关联。总体而言,我们的研究结果描绘了不同形式ASD背后的非典型连接模式,这些模式涉及不同的分子信号机制。本文发表在Nature Neuroscience杂志。
主要内容
患有自闭症谱系障碍(ASD)的个体在社交互动和沟通方面存在一系列困难,表现为重复和仪式性行为、不同程度的智力障碍以及各种医学共病。ASD并不是一个统一的实体。不同形式的ASD可能由不同的病理生理过程所驱动,并可能从不同类型的治疗干预中受益。因此,表型异质性是定义病理生理机制和发现新治疗方法的主要障碍。
功能性磁共振成像(fMRI)研究发现,ASD中社会认知和语言处理受损与丘脑、视觉区域和突显网络的异常活动相关,而重复和仪式性行为则与抑制控制和前纹状体回路功能的异常相关。大规模、多中心的静息态fMRI(rsfMRI)数据集在群体水平上识别出ASD中皮质纹状体和前顶叶网络功能连接的稳健且可重复的差异。最近,神经影像学研究调查了ASD中表型异质性的神经生物学基础,显示解剖学定义的亚群可以提高ASD症状严重度的预测能力;功能连接可以区分ASD个体与典型对照;以及在不同ASD个体子集内发现了多种功能连接模式。然而,异常连接是否以及如何影响ASD中症状和行为的个体差异尚不清楚。
家族外显子测序研究估计有超过1,000种遗传变异增加了ASD的风险,其表现出不同的外显性,大规模的全基因组关联研究已识别出超过500种常见变异,这些变异与广泛的生物学特性相关。在大多数情况下,ASD的风险被认为是许多常见变异累积影响的结果,这使得建模它们在大脑功能、发展和行为中的作用变得复杂。ASD还与特定脑区的转录差异相关,最近的研究表明,基因表达的区域差异可能调节健康人脑的网络功能,以及ASD和精神分裂症中的结构异常。这些观察结果使我们假设,不同的遗传通路可能在某些个体子集中发挥重要作用,并可能通过调节ASD相关脑网络中的功能连接来赋予特定症状的风险。
为了检验这一假设,我们使用正则化典型相关分析(RCCA)和优化以减少过拟合并提高泛化能力的重采样方法,在两个大规模的rsfMRI数据集(自闭症脑影像数据交换(ABIDE)I和II)中识别出解释ASD表型异质性的三个潜在脑-行为维度。这三个维度描述了能够预测个体在(1)语言能力,(2)社交情感和(3)重复行为和受限兴趣方面差异的功能连接模式,这些模式在训练样本中估计并使用保留数据进行了验证。沿着这三个维度的层次聚类识别出四个不同的ASD个体子群,这些子群在保留数据中具有可重复性,并与不同的功能连接和行为模式相关。最后,通过将rsfMRI数据与来自两个转录组脑图谱的规范基因表达数据整合,我们发现ASD相关基因表达的区域差异可以预测哪些网络在ASD中表现出异常连接,并在每个ASD子群中涉及不同的生物过程和分子信号机制。
结果
我们首先测试了ASD相关脑网络中的功能连接是否解释了ASD症状的个体差异,使用了一个大型、经过广泛验证且研究透彻的神经影像样本(ABIDE I和ABIDE II),该样本包括432名具有语言智商和ADOS-2校准严重度评分(CSS)的ASD个体以及来自36个研究地点的1,106名神经典型对照。由于头部运动和其他伪影可能干扰多中心神经影像数据集的分析,我们实施了一项严格的协议来控制运动伪影和数据质量,遵循或超过了已建立的指南(补充图1和方法)。使用一个经过广泛验证的功能分割图谱,我们为每位参与者估计了全脑静息态功能连接(RSFC)图。排除了不符合我们数据质量纳入标准的数据(约21.5%的参与者;方法),所有后续分析集中在299名ASD参与者和907名神经典型对照上。
三个脑-行为维度解释自闭症谱系障碍中的个体差异
我们使用RCCA识别了解释ASD相关三个领域个体差异的潜在脑-行为维度:社交情感症状、受限和重复行为(RRBs)以及语言智商(图1a–c)。为了减少过拟合,我们首先使用重采样特征选择(1,000个训练集,基于95%的数据子采样)来识别与一个或多个ASD行为可靠相关的功能连接特征子集。接下来,我们在1,000个训练集/测试集重复中使用交叉验证的RCCA,其中测试数据(5%)在特征选择和RCCA过程中被保留(补充图2和方法)。RCCA识别出了三个潜在的脑-行为维度(图1d–f)。第一个维度预测了个体在语言智商方面的差异,并与社交情感和RRB(重复行为)症状(通过ADOS-2 CSS测量)呈适度负相关(图1d)。第二个维度预测了个体在社交情感CSS方面的差异(图1e)。第三个维度与个体在RRB症状方面的差异强相关,并与语言智商呈中等相关(图1f)。基于考虑重复之间相关性的校正(且保守)的方差估计器,交叉验证测试集中的典型相关在所有三个脑-行为维度上均具有统计学显著性(补充图3a–c;1:r = 0.269,P < 0.0001,d = 1.119;2:r = 0.180,P = 0.0005,d = 0.771;3:r = 0.115,P = 0.0185,d = 0.484)。尽管所有三个典型相关在保留数据中都是显著的,但训练集中的较高典型相关性相对于测试集的结果毫不奇怪地表明了一些过拟合(这是交叉验证中的常见发现)并且表明在保留的测试数据上可能仍有进一步改进的空间,例如,采用更复杂的正则化程序。
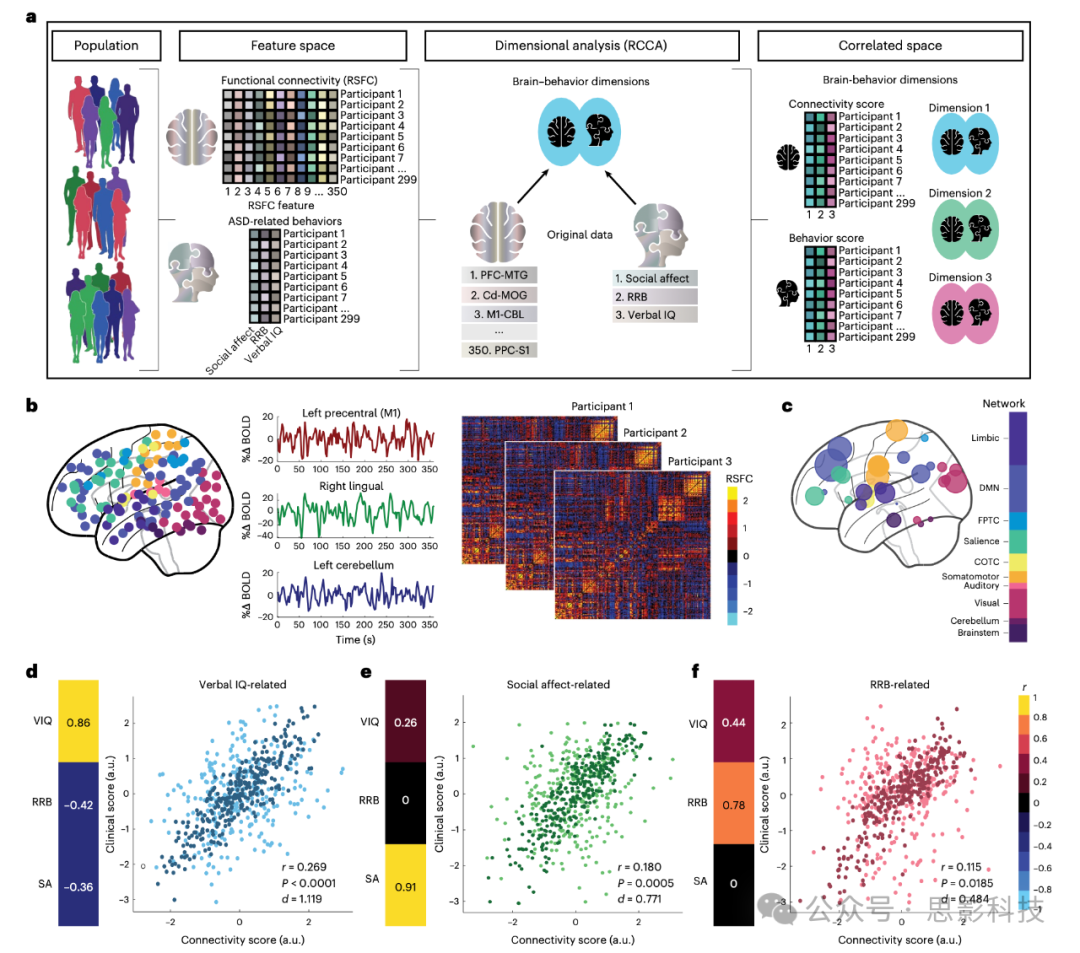
图1:三个脑-行为维度解释自闭症谱系障碍中的个体差异
a、示意图总结了在299名ASD参与者和907名神经典型对照中稳定化特征选择和RCCA的过程。
b、玻璃脑图(左)展示了覆盖大脑半球、脑干和小脑的功能分区(按功能网络着色)。从三个代表性ROI提取的BOLD信号时间序列(中)以及每个参与者每个ROI与其他所有ROI之间的相关性(功能连接矩阵,右)。
c、玻璃脑图展示了在一个代表性训练集中,与一个或多个ASD行为相关的功能连接特征的神经解剖分布(按功能网络着色,大小按相关性表示)。
d–f、RCCA揭示了三个维度,预测个体在语言智商(d)、社交情感(e)和重复/受限行为(RRB,f)症状方面的差异。散点图描绘了每个RCCA维度的连接得分与行为得分之间的关联。保留数据上计算的平均得分为浅色,而训练集数据上计算的平均得分为深色。热图(左)展示了每个维度的行为得分与每个临床症状之间在训练集上的平均相关性(Fisher z转换的斯皮尔曼相关系数)。所有三个维度的典型相关系数(r)在保留数据中均具有统计学显著性(插图中也显示了Cohen’s d),与经验零分布(保留测试集数据的洗牌;每个1000个训练/测试集中进行1000次洗牌)相比。(变量1:r = 0.269,P < 0.0001,d = 1.119;变量2:r = 0.180,P = 0.0005,d = 0.771;变量3:r = 0.115,P = 0.0185,d = 0.484;r表示测试集的平均典型相关,P表示P值,d表示Cohen’s d)。
a.u.,任意单位;BOLD,血氧依赖信号;CBL,小脑;Cd,尾状核;COTC,小脑-枕叶任务控制;DMN,默认模式网络;FPTC,前顶叶任务控制;M1,初级运动皮层;MOG,内侧眶回;MTG,中颞回;PFC,前额叶皮层;PPC,后顶叶皮层;r,典型相关;RCCA,正则化典型相关;S1,初级躯体感觉皮层;SA,社交情感。
为了更好地理解特定区域和网络中异常功能连接如何导致ASD症状的个体差异,我们首先检查了每个潜在脑-行为维度的RSFC相关(连接得分载荷)。我们发现每个脑-行为维度描述了不同的功能连接模式(图2a–c及扩展数据图1)。具体来说,我们发现与语言智商相关的维度与已知对语言处理和阅读能力重要的大脑区域之间的连接相关,包括皮质丘脑、视觉网络和纹状体连接(图2a),这与先前的研究一致,这些研究表明阅读能力与丘脑同步化以及涉及这些区域的功能连接呈负相关。与社交情感相关的维度与已知对社会情感处理重要的大脑区域之间的连接相关,包括突显网络、视觉网络和纹状体区域之间的连接(图2b)。这些结果与先前的研究一致,显示ASD中突显网络在静息状态下过度活跃;突显网络连接与对无关刺激的感觉过度反应和社交互动缺陷相关;皮质纹状体过度连接是ASD的一个常见且可重复的特征,可能有助于社会相关刺激的异常门控。与RRB(重复行为)相关的维度与已知对认知控制、反应抑制和行动选择重要的大脑区域之间的连接相关,包括与初级运动区域和前顶叶任务控制网络的皮质纹状体连接(图2c)。这些结果与先前的研究一致,显示严重RRB(重复行为)症状与皮质纹状体、前顶叶和运动皮层连接相关,以及RRB(重复行为)与执行功能相关。此外,这三个脑-行为维度在不同ASD参与者子集中的计算结果稳健且稳定(补充图3和4)。进一步地,我们在一个包含更窄年龄范围(8–18岁)的数据子集中以及在第二个脑分区中复制了关键的脑-行为关联发现(补充图5和6)。总体而言,这些结果描绘了解释个体在语言智商、社交情感和RRB症状方面差异的不同功能连接特征集,并与先前研究的汇聚性发现一致,增强了结果的可信度。
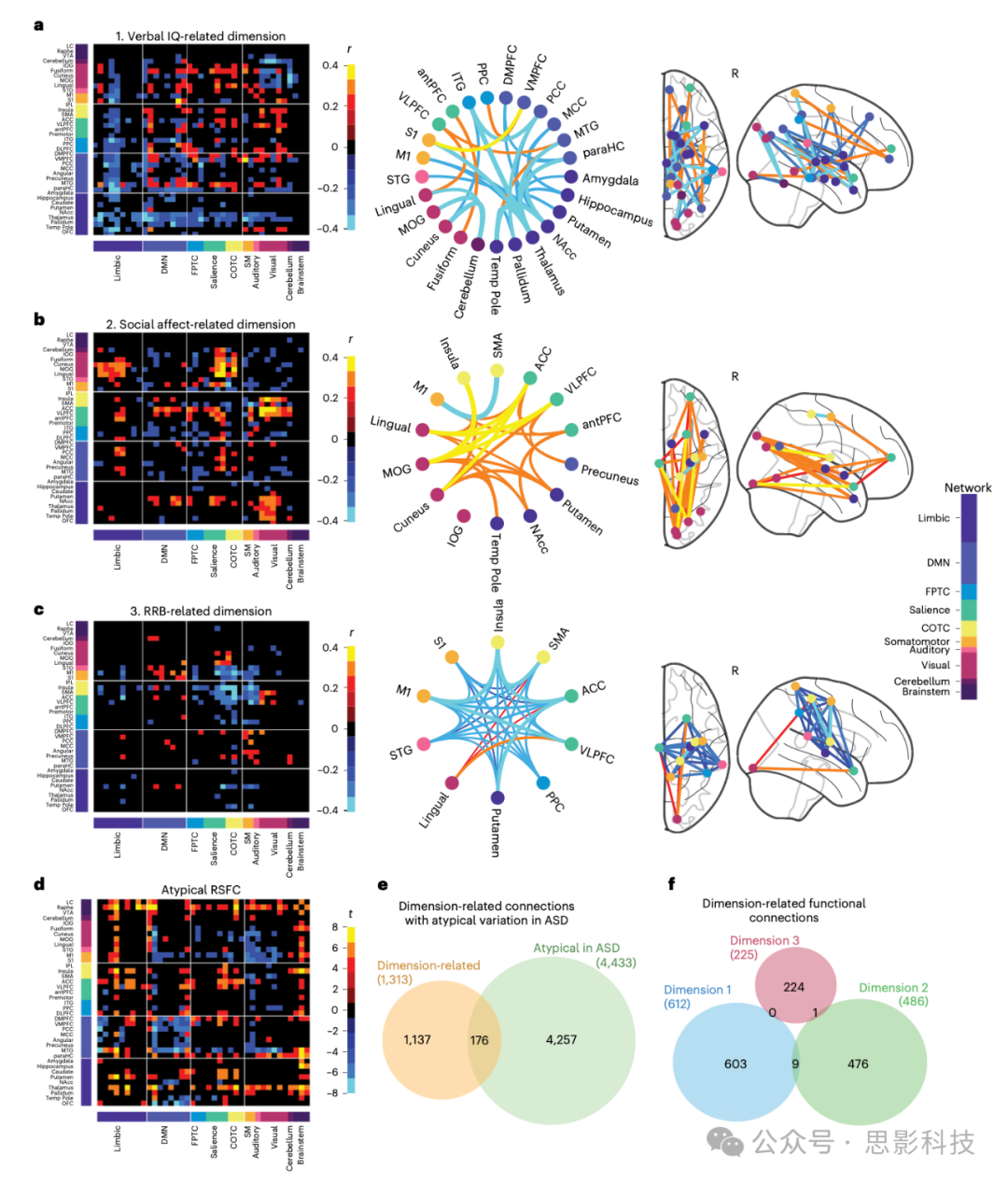
图2:自闭症谱系障碍症状的功能连接相关性
a.与语言智商相关维度的RSFC特征与行为得分之间的平均相关性(在交叉验证(CV)训练折叠中)。热图(左)以脑区(x轴)和RSFC网络(y轴)标注,显示了对维度有强载荷的RSFC特征子集(最大RSFC与维度相关性;FDR < 0.05;247个ROI映射到37个脑区,跨半球合并)。和弦图(中)描绘了最重要的RSFC特征的连接得分相关性(超过1个连接,FDR < 0.001)。玻璃脑图(右)展示了和弦图中RSFC特征的神经解剖分布。
b.与社交情感相关维度的RSFC特征与行为得分之间的平均相关性(在CV训练折叠中)。
c.与RRB(重复行为)相关维度的RSFC特征与行为得分之间的平均相关性(在CV训练折叠中)。
d.299名ASD个体与907名神经典型对照组之间的异常连接热图(双侧Welch’s t检验;FDR < 0.001),显示了每个37个脑区组内ROI之间的最大异常连接统计量。全脑(247 × 247个ROI)结果见扩展数据图1。
e、韦恩图显示与a-c维度相关但非异常的RSFC特征数量(黄色;nRSFC = 1,137;FDR < 0.05)以及与任何维度不相关但异常的RSFC特征数量(绿色;nRSFC = 4,257;FDR < 0.05)。只有13.4%的症状预测RSFC特征(重叠部分;nRSFC = 176/1,313;FDR < 0.05)也是异常的。
f、韦恩图显示与每个维度显著相关(FDR < 0.05)的RSFC特征数量(共247 × 247个)。每个RSFC维度得分与一组大多唯一的RSFC特征相关联。
ACC,前扣带皮层;antPFC,前额前皮层;DLPFC,背外侧前额叶皮层;IOG,眶下回;IPL,顶下小叶;ITG,颞下回;MCC,内侧扣带皮层;NAcc,伏隔核;OFC,眶额皮层;paraHC,海马旁回;PCC,后扣带皮层;SM,躯体运动;SMA,辅助运动区;STG,颞上回;Temp Pole,颞极;VLPFC,腹外侧前额叶皮层;VMPFC,腹内侧前额叶皮层。
为了更好地理解不同脑网络中独特与重叠的RSFC特征在多大程度上与个体在语言智商、社交情感和重复行为症状方面的差异相关,我们测试了每个潜在脑-行为维度中最重要的RSFC特征之间的重叠情况。我们发现有1,313个RSFC特征与至少一个维度的症状得分相关(假发现率(FDR)校正后P < 0.05),且大多数特征特定于一个维度,因此仅有十个特征(仅占全脑所有RSFC特征的0.03%)与多个维度相关(见图2f)。
最后,我们检查了ASD症状的个体差异是否主要由相对于神经典型对照异常的RSFC特征解释,还是由处于正常范围内的RSFC变异解释。ASD与广泛的连接异常相关,这些异常跨越各种皮质和皮质下区域(FDR校正后P < 0.05;见图2d及扩展数据图1d),涉及4,433个RSFC特征,约占全脑所有RSFC特征的14.6%。出乎意料的是,只有少数(13.4%)最重要的症状预测RSFC特征也相对于对照组表现出异常(见图2e)。当将此分析限制在年龄匹配的对照组(N = 868名5–35岁神经典型对照)时,结果高度相似(见补充图7)。这些结果表明,虽然一些异常的RSFC特征是症状的预测因子,但大多数不是;相反,ASD症状的个体差异主要由处于正常范围内的RSFC变异解释,只有当这些变异与涉及默认模式网络(尤其是中颞回)、丘脑、初级感觉运动区域、脑干(尤其是背侧缰核)及其他区域的一组独特异常RSFC特征同时存在时,才与ASD症状相关。
脑-行为维度定义了四个自闭症谱系障碍子群
尽管许多研究已经识别出ASD中一致且可重复的异常连接模式,但尚不清楚不同的回路功能障碍模式是否在某些ASD个体子群中起作用而在其他子群中不起作用。在识别出解释ASD个体差异的三个脑-行为维度后,我们测试了ASD个体是否倾向于在这个三维空间中聚类成相对同质的子群。沿着这三个维度的层次聚类确定了一个最佳的四聚类解决方案(见图3a),基于三次样本内和三次样本外的拟合优度评估(见补充图8和9、扩展数据图2及方法部分)。在一个次要的探索性分析中,我们未观察到聚类之间的性别差异(见补充图8h);然而,此分析的一个限制是ABIDE ASD数据集中只有15.4%的ASD参与者为女性(Nfemale = 46名女性,N = 299名ASD参与者)。在随后的分析中,我们使用参与者的模式聚类分配作为跨1,000个子样本的集成估计(方法部分)。
图3:基于脑-行为维度得分的层次聚类揭示了四个自闭症谱系障碍子群
a.热图和树状图展示了对所有 299 名 ASD 个体(行)沿三个维度(列)的层次聚类,使用 ASD 参与者对之间连接得分的余弦相似度(热图);树状图显示了余弦相似度的层次聚类(虚线表示最大余弦距离的 80%)。
b–e.盒须图显示了社交情感(SA)(b)、重复刻板行为(RRB)(c)、语言智商(VIQ)(d)和总严重度(e)的临床症状 z 分数分布(叠加的条形图表示中位数);分别对应于子群 1–4 的 N = 69、N = 87、N = 67 和 N = 76 名 ASD 参与者(颜色表示子群)。所有四个测量指标——社交情感、重复刻板行为、语言智商和总严重度——在子群之间存在差异(子群间的 Kruskal–Wallis 检验显示每个症状的子群间差异显著:社交情感,X² (3, N = 299) = 115.86,P = 6.02 × 10^−25;RRB:X² (3, N = 299) = 124.52,P = 8.18 × 10^−27;VIQ:X² (3, N = 299) = 138.28,P = 8.88 × 10^−30;总严重度:X² (3, N = 299) = 115.22,P = 8.25 × 10^−25)。注意,更高的社交情感、重复刻板行为和总严重度得分以及较低的语言智商表示更严重的损害。
f–h.参与者在两个维度上的连接得分的核密度估计图(最低等比例水平 = 0.25)。盒须图表示子群在单一维度上的连接得分分布(分别对应于子群 1–4 的 N = 69、N = 87、N = 67 和 N = 76 名 ASD 参与者)。对于 b–h,盒子的边界表示第 25 和 75 百分位数;中间线表示中位数;须对应于 ±2.7σ 和 99.3% 的数据;异常值显示为圆圈。b–h 的分析使用了正文和方法部分中描述的聚类分配。
接下来,我们测试了四个子群在ASD症状和异常功能连接方面的差异,发现两个领域中均存在子群差异。四个子群在临床症状特征上存在显著差异(图3b–e)。每个子群还与ASD相关网络中不同的异常RSFC模式相关,特别是边缘系统区域(子群2和3)、默认模式网络(子群4)和感觉运动区域(子群1)等(扩展数据图3)。当我们在1,000个子样本(包含95%的ASD参与者;扩展数据图4a–d)中评估子群的临床症状分布以及在1,000个子样本中评估异常功能连接的平均值和标准差(扩展数据图4e–l及方法部分)时,这些结果依然稳定。
对特定子群中异常连接、与维度相关的连接以及临床症状特征之间关系的更详细成对比较揭示了关联,表明每个子群中个体差异背后存在不同的网络级机制(图3b–h和图4)。子群1具有高于平均水平的语言智商(图3d),在与语言智商相关的维度1中具有较高的连接得分(图3f,g),并且与神经典型对照相比,在与智商相关的语言处理区域中表现出异常低的RSFC(图4a)。相反,子群2具有低于平均水平的语言智商(图3d),在与语言智商相关的维度1中具有较低的连接得分(图3f,g),并且在相同的语言处理区域以及多个其他预测语言智商个体差异的连接中表现出异常升高的RSFC(图4b)——这是其他子群中未观察到的发现。这些结果显示,与语言智商相关网络中异常升高的连接特异于ASD个体的一个子群,并且表明在其他ASD个体中,异常连接的相反方向(异常降低)可能会补偿其他异常,从而即使在其他领域存在症状的情况下也能保持语言智商。

图4:自闭症谱系障碍子群在与维度相关的RSFC特征中具有不同的异常连接模式
图4a–l针对图2a–c中识别的最重要的与维度相关的RSFC特征,展示了异常连接的和弦图(每个子群的ASD参与者的RSFC与907名神经典型对照进行双侧Welch’s t检验,N = 69、N = 87、N = 67和N = 76名ASD参与者;FDR < 0.05)。蓝色框突出显示了正文中讨论的发现。
-
图4a–d:子群在与语言智商相关的RSFC(维度1)中的异常连接。
-
图4e–h:子群在与社交情感相关的RSFC(维度2)中的异常连接。
-
图4i–l:子群在与RRB相关的RSFC(维度3)中的异常连接。
图4b:子群2具有与维度1相关的异常连接,预测较低的语言智商。
图4g:子群3具有与维度2相关的异常连接,预测高社交情感症状和低RRB症状。
图4h:子群4具有与维度2相关但方向相反的异常连接,预测低社交情感症状和高RRB(重复刻板行为)症状。
图4i:子群1具有与维度3相关的异常连接,预测高RRB症状和高语言智商。
图4k:子群3具有与维度3相关但方向相反的异常连接,预测低RRB症状。
右侧的色条表示异常连接的方向和连接强度(暖色表示相对于神经典型对照增加,冷色表示减少)以及功能网络(节点颜色)。分析使用了正文和方法部分中描述的汇总聚类分配。
同样,子群3具有高社交情感症状(图3b)、低RRB症状(图3c)并且与神经典型对照相比,在与社交情感相关的维度2中表现出异常升高的连接(图4g),包括突显网络的前扣带和腹外侧前额叶区域等。相反,子群4具有低社交情感症状(图3b)、高RRB症状(图3c)并且在相同区域中以相反的方向表现出异常连接,与维度2相关的连接异常降低(图4h)。对子群3(低RRB症状、认知控制区域、纹状体和初级运动皮层之间的过度连接;图4k)和子群1(高RRB症状、相同区域的异常低连接;图4i)进行更详细的成对比较,也揭示了与减少RRB症状相关的潜在补偿性连接差异。这些结果共同定义了沿三个脑-行为维度的四个ASD子群,这些子群在ASD症状特征和功能网络组织方面均存在差异。它们也与假设一致,即不同和对比的连接模式可能有助于ASD的临床异质性,并且相似的ASD症状可能与不同的网络级基础相关联。
作为比较,我们直接基于标准化的临床症状评分(量表值的z-score;即,使用余弦距离和平均连接进行层次聚类,并在图3中以四个聚类为切分点,但仅基于临床症状)进行了聚类。我们发现,N = 226名ABIDE参与者(占N = 299的75.6%)被分配到与使用脑功能连接(连接得分)时相同的聚类中(见补充图10)。我们将这一结果解释为聚类结果在某种程度上具有相似性;然而,基于脑-行为维度的聚类整合了额外的信息,这些信息在最终的聚类分配中起到了重要影响。
为了进一步验证,我们确认了各子群的连接得分对RCCA参数的小变化不敏感,并且是稳定的(补充图3、4和11)。在一个限制为年龄匹配对照组(N = 868名5–35岁神经典型对照)的次要分析中,子群结果也保持一致(补充图12)。接下来,我们在一个更窄年龄范围的样本(8–18岁)和第二个脑分区中复制了ASD子群的关键发现49(扩展数据图5和6及补充图13–16)。此外,我们评估了年龄对这些ASD子群的影响,未发现ASD子群脑-行为关联中存在发育异质性的证据(补充图17–20及补充表1和2)。
最后,我们测试了在ABIDE中定义的ASD子群是否可在来自国家精神卫生研究所(NIMH)数据档案(NDA;N = 85名ASD参与者)的独立样本外数据集中复制(扩展数据图7、补充图21及方法部分)。总结我们的方法,总共有N = 113名参与者,其中NNDA = 85名参与者(8–39岁;58名男性,27名女性)根据本研究使用的质量控制标准具有可用的fMRI数据。我们完全按照在ABIDE数据集中实施的分析步骤重复了这些分析,包括特征选择、RCCA和聚类。尽管样本量相对较小,我们还是识别出了四个ASD子群,其行为特征和异常连接模式与在ABIDE ASD子群中观察到的极为相似(扩展数据图7及补充图21;NDA子群规模为NNDA_1 = 20,NNDA_2 = 21;NNDA_3 = 27;NNDA_4 = 17)。
子群特异性连接的转录组相关性
接下来,我们假设常见的ASD风险变异可能通过影响ASD相关脑网络的静息态连接来调节ASD的病理生理学,并且不同的遗传通路可能在某些个体子集中发挥重要作用。为了检验这一假设,我们首先研究了规范基因表达模式的区域差异是否解释了图3和4中识别出的四个ASD子群的异常连接的空间模式。我们将Allen人类脑图谱(AHBA)中10,438个微阵列探针的规范区域基因表达谱(包括来自6名健康成年人的3,702个样本的基因表达数据,N = 5男性,N = 1女性,年龄24–57岁)映射到上述使用的功能分区(图1b),并按照最佳实践预处理了AHBA微阵列表达数据集(方法部分)。接下来,我们使用偏最小二乘(PLS)回归测试与每个ASD子群中异常RSFC的空间分布协变的加权基因表达探针组合(图5a)。PLS回归确认,基因表达的区域差异预测了所有四个子群中异常连接的神经解剖分布,在简单的置换检验和更严格的空间置换(“旋转”)检验中均达到统计显著性(补充表3及方法部分)。为了确定不同子群中不同基因集的参与程度,我们使用排名偏重叠(RBO)计算了子群前1,000个排名基因权重之间的排名相似性,RBO是一种用于非共同列表的排名相似性度量。RBO相似性分数表明,每个子群优先考虑了不同的基因候选集(RBO = 0.36–0.59;1表示完全相似;图5b)。
图5:自闭症谱系障碍子群中异常连接模式的转录组相关性
图5a.转录组学分析示意图,用于测试基因表达是否解释了每个子群中的异常连接。首先,我们计算了每个脑区(ROI)的基因表达和每个子群中跨ROIs汇总的异常连接(RSFC)。其次,我们对每个子群执行了偏最小二乘(PLS)回归,并使用空间置换(“旋转”)检验来估计每个PLS模型的显著性。所有四个子群的PLS模型均具有显著性(子群1:P = 0.014;子群2:P < 0.001;子群3:P < 0.001;子群4:P < 0.001;所有统计数据见补充表3)。第三,我们根据每个模型中的PLS基因权重对基因进行了排名。
图5b.子群基因排名列表之间相似性的热图(子群之间前1,000个正向排名基因的RBO平均值和前1,000个负向排名基因的RBO平均值)。每个子群与一组独特的基因相关联(RBO = 0.36–0.59,1表示完全相似)。
图5c–e每个子群的排名基因权重的基因集富集热图,涵盖ASD相关基因集(c)、非精神疾病相关基因集(d)、精神障碍相关基因集(e)、突触信号基因集(f)、免疫信号基因集(g)和蛋白质翻译基因集(h)。完整的GSEA结果见补充表4。所有子群均富集了ASD相关基因集,但未富集无关疾病的基因集。颜色表示归一化富集分数的负对数转换FDR的强度,乘以基因权重的符号(+1或−1)。
ADHD,注意缺陷多动障碍;CNS,中枢神经系统;GAD,广泛性焦虑障碍;GPCR,G蛋白偶联受体;ID,智力障碍;MDD,重度抑郁障碍;MSA,多系统萎缩;PD,个性障碍;RDNV,罕见的新发变异。
接下来,我们测试了ASD风险变异是否会成为这些基因集中特异性异常RSFC的重要预测因子,使用加权快速基因集富集分析(fGSEA)来评估子群基因权重是否富集了与ASD相关的基因集。所有四个子群的PLS模型均富集了多个ASD相关基因集(图5c)。值得注意的是,PLS模型中负权重的基因(与异常RSFC呈负相关)富集了在ASD中转录下调的基因,而正权重的基因富集了在ASD中上调的基因(图5c),进一步支持了基因表达与异常功能连接之间具有生物学意义的关联。
为了确立这些发现的特异性,我们还测试了与其他疾病表型相关的已发表基因集的富集情况。重要的是,对于多系统萎缩、痴呆、心脏病或银屑病相关的基因没有富集,这些基因不应与ASD具有遗传风险重叠(图5d)。然而,子群1和子群4中负权重的基因——这些子群具有相对严重的RRB(重复刻板行为)症状——富集了与妥瑞症和注意缺陷多动障碍(ADHD)相关的基因(图5e)。所有四个子群中正权重的基因富集了已知与ASD共病的免疫相关疾病的基因(图5d)。我们还发现,具有平均到高于平均语言智商的子群1、3和4的基因集富集了与语音学习相关的基因(图5e)。总体而言,这些结果表明,基因表达的区域差异预测了图3和4中识别的四个ASD子群中异常连接的空间分布,并且这些基因富集了ASD风险变异,但未富集与其他无关疾病相关的基因。
尽管解释异常连接的基因集在所有四个子群中均富集了ASD相关风险变异,图5b的结果表明,不同子群中这些基因的组合各不相同。为了进一步理解每个子群是否涉及不同的生物学途径,我们使用fGSEA和基因本体(Gene Ontology)分析测试了与特定细胞组分、分子功能和生物过程以及细胞类型相关的基因的富集情况(图5f–h,补充表4和补充图22及23)。有三种模式显著突出。首先,解释异常连接的基因集在突触信号基因集中有所富集,但程度不同。与子群2连接模式相关的基因仅富集了11个突触信号基因集中2个,而子群1、3和4分别富集了11、8和11个突触信号基因集。其次,解释异常连接的基因集也在免疫信号基因集中有所富集,但程度不同。与子群3连接模式相关的基因富集了所有12个免疫信号基因集,而子群1、2和4分别仅富集了6、8和6个免疫信号基因集。这表明,免疫信号在ASD中的既定作用在特定子群中可能更为重要,至少在其对脑网络连接的影响方面。第三,解释异常连接的基因集仅在子群1中富集了蛋白质翻译基因集,包括与ASD相关的核糖体基因集。重要的是,我们还发现,交叉验证分析中的基因集富集结果与全数据集分析的结果高度相似(补充图24),进一步增强了这些发现的可信度。
为了进一步验证,我们在一个独立的基因表达数据集——BrainSpan发育中人类大脑图谱(N = 13名个体(7名男性),年龄8–40岁;方法部分)中重复了PLS和GSEA分析。总体而言,我们在两个基因表达数据集中的结果高度相似(扩展数据图8),提供了证据表明我们针对ASD聚类的基因集富集结果在再现我们的神经影像样本的发育年龄范围内具有泛化性。最后,为了更好地理解异常连接、基因表达与ASD症状之间的关系,我们使用来自ASD样本其余部分的数据进行了二次分析,即由于行为评估不完整而被排除在主要分析之外但具有可用fMRI数据的参与者。我们测试并发现了与上述四个子群中观察到的相似的语言智商、社交情感和RRB症状之间的关联(扩展数据图9)。这些分析共同为异常连接、ASD症状域和特定基因集之间的关联提供了汇聚性证据。
子群特异性蛋白质-蛋白质相互作用与自闭症谱系障碍行为的关联
为了总结,我们研究了图5中的PLS回归模型所识别的基因集与图3和图4中识别的子群特异性症状特征之间的关系,以进一步验证结果。我们假设,如果每个子群特异性基因集中排名靠前的基因在调节病理生理连接和ASD相关行为中发挥重要作用,那么从每个基因集中衍生的蛋白质-蛋白质相互作用(PPIs)分析将揭示在每个子群中特别相关的分子信号通路;这些通路富集了ASD风险基因;并且在之前的研究中已与子群特异性的ASD相关行为相关联。
为了测试这些假设,我们首先识别了与每个子群中异常连接至少有中等相关性的高排名基因(P < 0.01),并区分了所有四个子群共享的基因与仅与一个或两个子群特异性相关的基因(见图6和方法部分)。接下来,我们使用STRING PPI数据库进行了基于图的网络分析,识别了每个子群的零阶PPI(种子连接相关基因之间的全连接图)(图6b–e,补充表5和方法部分),以及子群之间的重叠部分(扩展数据图10)。每个子群的连接相关PPI识别了众多枢纽基因和功能模块(图6b–e)。值得注意的是,子群1的PPI结果仅包含一个与蛋白质合成相关的模块和多个核糖体基因(图6b)。子群2–4的结果包含多个显著的功能模块(图6c–e),这些模块与G蛋白偶联受体信号传导(子群2–4)、钾通道(子群2)、突触功能和信号转导(子群3)以及胃泌素–CREB信号传导(子群2和4)等相关。值得注意的是,结果还包括多个已知在ASD中转录水平改变的枢纽基因,以及众多通过GWAS确认的ASD风险基因,进一步增强了结果的可信度。
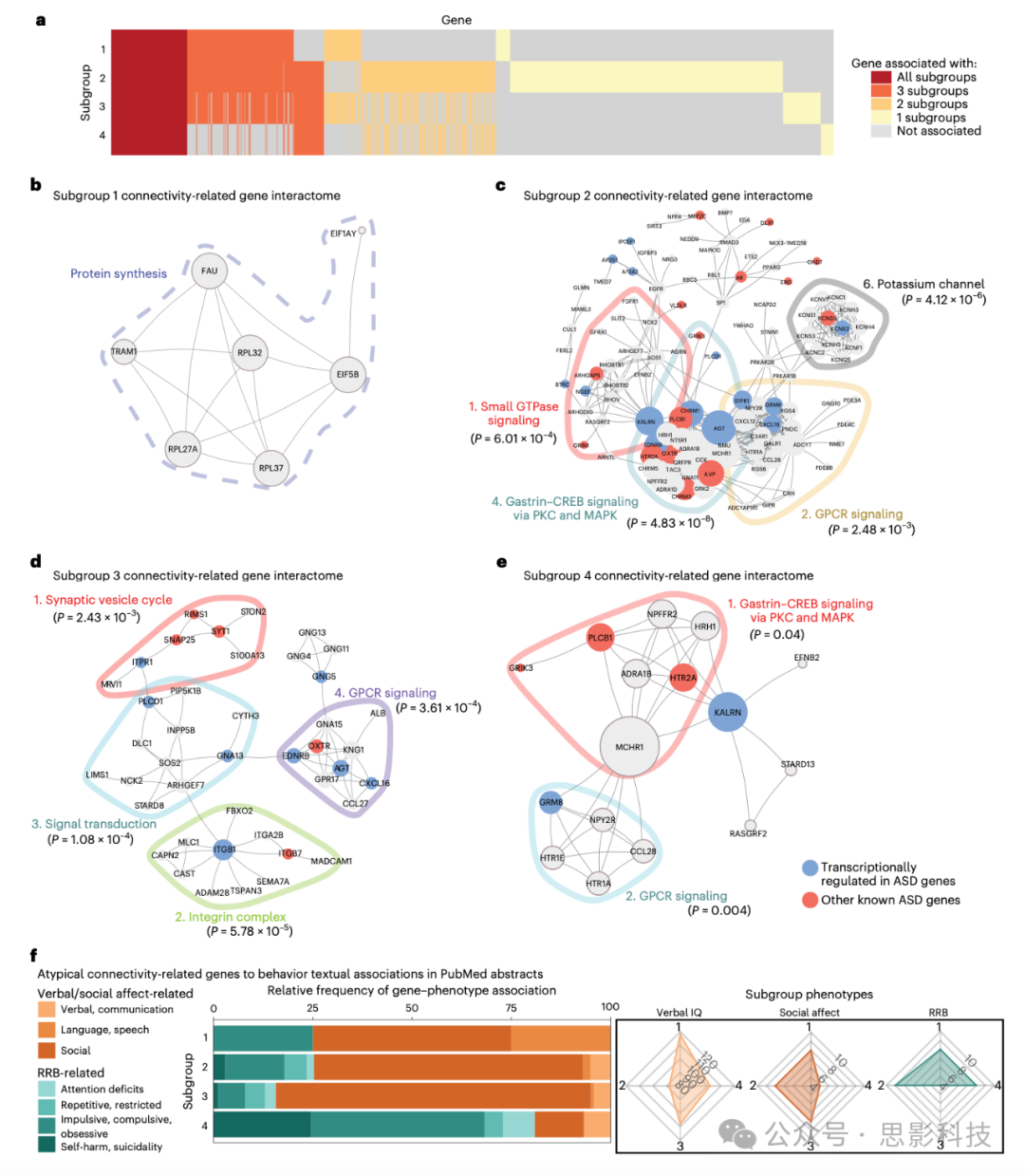
图6:蛋白质-蛋白质相互作用网络揭示了与自闭症谱系障碍相关行为有文本关联的不同连接相关基因
a,热图显示了与每个子群的异常连接显著相关的基因(P < 0.01;方法部分)之间的重叠(y轴)。一些基因与所有四个子群显著相关(红色),而其他基因仅与一个、两个或三个子群相关(黄色、淡橙色或橙色)。
b–e,与每个子群相关且不超过一个其他子群的基因的零阶PPI网络(STRING数据库;方法部分)。
-
b,子群1的互作组与蛋白质合成相关基因相关(基因周围的虚线)。
-
c–e,子群2–4具有多个显著的功能模块,由Walktrap算法确定(补充表5),通过每个模块周围的彩色线条描绘,涉及G蛋白偶联受体信号传导(子群2–4)、转化生长因子-β(TGF-β)信号传导(子群2)、突触功能和信号转导(子群3)以及胃泌素–CREB信号传导(子群4)等。
每个PPI模块的显著性是通过模块内度数与模块间度数的两样本Wilcoxon秩和检验(非配对,双侧)确定的(未对模块的多重比较进行调整)。对于模块中的每个基因,模块内度数是指该模块内连接基因的数量,模块间度数是指该模块外连接基因的数量。
f,嵌套条形图显示了每个子群特异性枢纽基因(每个子群PPI中前十个连接度最高的基因)与行为关键词之间的PubMed摘要关联的相对频率(对于每个子群,关键词相关摘要的数量除以摘要总数)。右侧的雷达图显示了子群之间临床症状严重程度的相对分布(图3b–e)。子群4(严重RRB(重复刻板行为),轻度社交情感)连接相关的枢纽基因与RRB相关关键词的关联最强(子群4的RRB相关术语占80.85%)。子群1–3显示了相反的关系(社交情感相关术语分别为子群1 = 75.00%,子群2 = 74.71%,子群3 = 84.35%)。关键词定义见补充表6。
在g中,‘*免疫反应信号传导’是‘免疫反应激活的信号传导’基因集的缩写;在h中,‘*核糖体结构’是‘核糖体的结构成分’基因集的缩写。
最后,为了对子群特异性 PPI 网络与每个子群相关的 ASD 症状和行为之间的关联进行更为确定和无偏的验证,我们对 PubMed/MEDLINE 数据库中的生物医学摘要进行了文本挖掘分析。我们测试了每个 PPI 网络中最具连接性的基因(“枢纽基因”)与与社交情感和 RRB 症状域相关的行为关键词之间的关联(参见补充图 25、补充表 6 和方法部分中的示意图)。我们发现,对于与子群 4 相关的基因,其 RRB(重复刻板行为) 相关关键词相对于社交情感相关关键词的频率要高得多(80.85%),该子群具有严重的 RRB 症状和最小的社交情感损害(图 6f)。相反,对于与子群 3 相关的基因,我们发现了相反的关系(84.35%),该子群具有最小的 RRB 症状和严重的社交情感损害,为这种将功能连接、基因和行为联系起来的方法提供了重要的无偏验证。
总之,这些分析揭示了多个可测试的假设,涉及 ASD 相关遗传通路在调节特定脑网络和行为的功能组织中的作用——这些假设在现有文献的背景下是合理的,并且涉及特定个体子集中的特定通路。它们还进一步验证了图 3–5 中识别的 ASD 子群代表了与不同生物过程相关的不同形式的 ASD。
讨论
我们识别并交叉验证了ASD的低维描述,该描述可以区分个体在功能连接模式和临床行为上的差异,并识别出具有临床意义的子群。这些脑-行为维度及其相关的ASD子群在不同的参与者子集间保持稳定,在保留的测试数据中具有可重复性,并在来自NDA(国家精神卫生研究所(NIMH)数据档案)的样本外ASD参与者中得到了复制(见扩展数据图7和补充图21),展示了潜在的ASD模型的稳健性和子群的普适性。这些假定的ASD亚型与不同的基因表达模式和生物过程相关,许多这些过程在群体水平上之前已被暗示与ASD相关。
我们对ASD异质性的神经基础理解有限,这阻碍了治疗干预的发展。我们对ASD个体进行亚型划分的方法提出了可测试的假设,关于不同的生化、遗传和细胞过程如何塑造不同的临床表型和ASD中的功能连接。有趣的是,两个子群(1和2)主要沿着一个连接相关维度(即与语言智商(VIQ)相关的维度1)分离。虽然这两个子群在核心ASD症状上都高度受损,但它们在语言智力能力、异常连接和基因表达关联上有所不同。高VIQ的子群1与皮质小脑-视觉网络区域的异常连接减少和躯体运动-前额叶网络ROI的异常连接减少相关,我们的分析强调了这一子群中与蛋白质翻译相关的基因集与异常连接之间的相关性。相比之下,低VIQ的子群2显示出视觉网络和皮质丘脑连接的异常增强,并且与蛋白质翻译基因集无相关性。这些结果提出了一个可测试的假设,即至少在某些个体中,这些网络中的连接减少和蛋白质翻译基因的异常表达可能是ASD症状的神经生物学基础,而在低VIQ个体中则不然。这些结果与将小脑连接与语言智商相关联的发现一致;将前额叶网络与语义处理相关联;将皮质丘脑连接与ASD中的视觉-听觉预测编码损伤相关联;将ASD风险因素之一的早产儿中皮质丘脑连接异常增强与言语认知受损(ASD的一个风险因素)相关联的发现一致;以及将核糖体基因与ASD中的智力障碍相关联的发现一致。
其他子群(3和4)具有平均的语言智力能力,但在两个核心ASD症状——社交情感和RRB(重复刻板行为)症状的损伤比例上有所不同,这与一些ASD个体在这两个领域症状严重度不平衡的报告一致。在子群3(社交情感 > RRB症状)中,我们观察到视觉网络与突显网络之间的连接异常增强,并且我们的分析涉及了免疫相关基因集——这与之前报告中将这些区域与ASD中的奖励处理相关联的发现一致。相反,在子群4(RRB > 社交情感症状)中,我们观察到这些网络之间的连接异常减弱,并且我们的分析涉及了5-羟色胺枢纽基因——这与已知的5-羟色胺与ASD中RRB的关联一致。这些结果支持了这样的假设:至少在一些个体中,视觉到突显网络的异常连接、免疫相关基因集和5-羟色胺基因可能是支撑社交情感和RRB症状的ASD症状的神经生物学基础(在重叠网络中存在异常连接,但连接变化方向相反定义了不同的子群)。
与子群特异性异常连接模式相关的枢纽基因的文本挖掘分析为这些关联提供了额外的支持。这是有用的,因为我们的基因组和蛋白质组分析仅使用子群的异常连接来识别与子群相关的基因,因此并未直接测量子群相关基因与行为之间的关联。因此,我们的文本挖掘分析作为基因到行为推断的桥梁。例如,子群3的连接预测基因在已发表的生物医学摘要中经常与社交情感相关的关键词相关联(84.35%,相对于RRB相关的关键词)。相反,子群4的连接预测基因则经常与RRB相关的关键词相关联(80.85%,相对于社交情感相关的关键词)。
这里识别的ASD子群为可能调节导致ASD行为的大脑功能变化的生物机制提供了见解,并确定了多个可在未来研究中探索的可测试假设。例如,在子群4(高RRB和低社交情感)中,异常连接与HTR1A表达的降低相关,HTR1A是一种编码与严重重复行为和受限兴趣相关的5-羟色胺受体的基因。已知HTR1A表达在ASD中下调,并且与压力和焦虑相关,功能失调的5-羟色胺信号传导已被暗示与ASD中奖励处理的改变以及在发育过程中导致RRB的感觉运动障碍相关。值得注意的是,与典型对照组相比,异常功能连接与更高的RRB(重复刻板行为)评分相关,并且针对5-羟色胺信号传导的药物可能有助于减少某些ASD个体的RRB。在ASD的Shank3小鼠模型中,坦多司琼减少了重复性的自我梳理和学习缺陷。
局限性:
我们的研究存在几个限制。首先,受限于可用的数据集。ABIDE I和II队列在36个研究地点收集,这些地点使用了不同的MRI扫描仪和扫描协议。临床表型数据,包括语言智商和ADOS-2量表评分,仅限于部分ASD参与者,且公开可用的ABIDE数据集中无法访问参与者级别的基因型数据。为了解决这些潜在的混杂因素,我们实施了严格的协议,以根据最佳实践去除头部运动和扫描仪相关的伪影,并通过对每个个体的功能连接矩阵进行四分位数标准化来控制站点效应。至少有一份最近的报告表明,考虑个体在功能拓扑上的差异可能进一步增强我们模型的性能。
第二,我们发现出乎意料的是,NDA(国家精神卫生研究所(NIMH)数据档案)中相对较小的样本量足以实施特征选择、RCCA和聚类,并产生类似的聚类结果。然而,这样的样本量不足以识别与每个子群相关的异常连接模式(每个子群仅有17到27名参与者),特别是在全脑分析中。相反,在我们与神经典型对照参与者比较异常连接的分析中,我们能够通过以下方式识别出与ABIDE样本结果的相似性:(1)利用非常大的神经典型对照样本进行对比(N = 907名参与者);(2)通过聚焦于在ABIDE样本中显示显著改变的RSFC特征来识别定性趋同;以及(3)确认与NDA子群相关的异常连接模式比随机期望更显著地与ABIDE子群相似。我们还指出,NDA样本中的特征选择、RCCA和聚类结果完全独立地复制了ABIDE样本中的相应分析,但NDA子群与神经典型对照组的RSFC比较并非完全独立,因为它们都依赖于相同的神经典型对照样本。
第三,尽管我们未发现子群内或子群间的发育差异证据,但应注意该数据集由于多种原因并不适合评估发育差异,包括在该ABIDE数据集中语言智商与年龄呈负相关,因此如果观察到差异,解析结果将具有挑战性。此外,我们观察到特定功能连接特征中没有可测量的发育异质性,这些特征解释了ASD症状的个体差异,但这并不排除在我们分析中不重要的其他功能连接特征中存在发育变化的可能性。相反,大量开创性研究已经描述了ASD和典型发育人群中功能连接的发育效应。
第四,我们使用的AHBA微阵列数据集包含来自仅六名健康成年人的死后大脑的脑区样本的全脑基因表达测量。尽管存在这一限制,本研究中将功能连接差异与基因表达关联的统计方法已被证明具有统计稳健性。本研究中的GSEA发现,基因表达预测异常连接模式的基因富集于ASD基因集,但未富集于无关疾病,并且分子富集在四个组之间有所不同。虽然空间自相关可能是空间转录组富集分析中的一个问题,我们在排名基因之前对脑区进行PLS基因权重的自举,并实施了加权版本的GSEA。基因集富集模式的明显子群差异表明空间自相关在富集发现中并不是一个主要因素(因为空间自相关在各子群之间应类似)。此外,我们使用来自BrainSpan发育中人类大脑图谱的发育转录组重复了我们的发现,该图谱包含来自42名个体(年龄8周受孕后到40岁)的26个脑区的基因表达测量(尽管这些个体/脑区样本中约52%的数据缺失)。进一步增强我们结果的可信度的是,富集发现在人群交叉验证分析中得到了重复,并且对PubMed摘要的分析支持了子群之间的表型差异,这些共同增强了这些关联不是人为伪造的信心。
最后,本研究使用的数据集年龄范围较大(5–65岁,尽管>72%的参与者集中在8–16岁,>81%集中在8–18岁)。在限制于8–18岁样本的较小样本中重复关键分析显示了与主要分析一致的结果(见补充图5、13和14及扩展数据图5)。为了最小化年龄相关异质性的影响,我们将ADOS-2评分转换为CSS,这控制了年龄效应和语言能力差异。我们选择不回归年龄对RSFC的影响,因为年龄效应与ASD相关的功能连接之间可能存在多重性,因此回归年龄可能会去除与ASD相关的生物学信息。重要的是,我们识别的子群在年龄上没有显著差异(中位年龄差异不超过2年;见补充图8g),表明年龄不是观察到的子群差异的驱动因素。
总结
我们在自闭症谱系中识别了四个子群,这些子群可能代表不同的功能连接组型,其中基因型表现为异常脑功能的中间表型,从而导致自闭症行为表现的临床异质性。我们的维度和子群结果提供了可在动物模型和未来临床研究中评估的可测试假设。它们表明了大脑功能的不同改变,可以通过基于回路的神经调制进行靶向干预,并预测了可以帮助指导针对每种ASD表型特定的药物治疗靶点研究的不同生物学通路。未来测试这些假设的努力将受益于包含更大ASD个体和神经典型对照组、具有更深表型和相关基因组数据的前瞻性样本。























 3205
3205

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








